

2. 南京中医药大学医学院·整合医学学院,江苏 南京 210023
2. School of Medicine-College of Integrative Medicine, Nanjing University of Chinese Medicine, Nanjing 210023, China
上世纪初,研究人员在中枢神经早期发育和特定病理条件下的大脑中发现小胶质细胞的存在[1-2]。在中枢神经的发育早期,小胶质细胞以“变形虫样”形态存在,随着发育成熟,小胶质细胞逐渐转化为“分支或静息”形态。在一系列内源性和外源性因素刺激下,包括病原相关分子模式(pathogen-associated molecular pattern,PAMP)、损伤相关分子模式(damage-associated molecular pattern,DAMP),小胶质细胞被激活,形态逐渐向变形虫表型转化,释放多种因子,如炎性细胞因子、活性氧及酶,可导致神经元和胶质细胞损伤。事实上,在几乎所有神经退行性疾病或障碍中,包括阿尔茨海默病(Alzheimer′s disease,AD)、帕金森病(Parkinson′s disease,PD)、亨廷顿舞蹈病和肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)、额颞痴呆(frontotemporal dementia,FTD)以及多发性硬化症(multiple sclerosis,MS)等炎症性病变中,都存在大量激活的小胶质细胞,该现象也出现在脑血管性疾病和精神系统疾病中。小胶质细胞的激活正逐渐成为脑损伤和病理学的标志,被视为“病理传感器”。因此,小胶质细胞在各种神经损伤病理条件下的作用一直是广泛研究的焦点。随着新技术的发展,在经典的致炎和抗炎表型的基础上,科学家发现了更多的与特定脑区、病理条件和微环境相关的具有特异性标志物和专属功能的小胶质细胞表型,进一步丰富了小胶质细胞的谱系结构。
1 小胶质细胞的传统表型在正常生理状态下, 小胶质细胞一般处于静息状态(M0), 呈现胞体较小、突起较长的分枝状形态。它们不断地伸展和收缩其突起以监测中枢神经系统组织。小胶质细胞对外界刺激十分敏感, 在大脑损伤条件下小胶质细胞即可被激活。激活后的小胶质细胞形态由静止的分枝状变成活化的阿米巴状,发挥损伤后突触修剪、吞噬凋亡和受损伤的细胞、炎症反应以及组织修复等功能。小胶质细胞激活后对中枢神经系统损伤具有双重作用,长期以来研究人员在小胶质细胞的研究中使用巨噬细胞的极化术语,将小胶质细胞分为M1和M2表型。M1型小胶质细胞具有强大的吞噬作用,主要分泌促炎因子,发挥促炎功能,引起细胞凋亡及继发损伤,过度活化的M1型小胶质细胞具有明显的神经毒性作用。M1小胶质细胞标志物包括CD86、CD16、CD32、MHC-Ⅱ、iNOS、IL-1β、IL-6、TNF-α、CCL-3、CCL-5。M2型小胶质细胞又分为M2a、M2b、M2c 3种亚型,可分泌抗炎细胞因子,在血管生成、促进炎症修复方面起重要作用。M2小胶质细胞标志物有Arg-1、Fizz-1、IL-10、YM1/2和CD206、TREM2、TGF-β、CCL22[3-7]。M1/M2的定义源自于将分离的细胞暴露于体外纯化的刺激物(凋亡细胞、脂多糖、炎性细胞因子或聚集蛋白等),在这个范例中,小胶质细胞确实分泌极化巨噬细胞的典型因子,但根据最近研究的发现,M1和M2状态在体内不能作为孤立的现象出现。近年来单细胞组学、时空组学、高精度分子成像技术的应用大大拓宽了科研人员的视野,使得人们能够深入了解组织中细胞构成的多样性和基因表达状态。这些新技术的应用揭示了小胶质细胞的不同状态。
2 新发现的特定小胶质细胞亚型小胶质细胞是中枢神经系统的常驻免疫细胞,它的亚型是由微环境以时间和区域依赖的方式不断塑造的[8-9],并不构成定型的细胞群;它们的形态、分子结构甚至超微结构在不同的细胞亚型中都有很大的不同。实际上小胶质细胞在中枢神经系统发育、应激和疾病的不同阶段分化为多种表型[10]。已经发现了许多小胶质细胞亚型,如CD11c+小胶质细胞、暗小胶质细胞(dark microglia,DM)、疾病相关小胶质细胞(disease-associated microglia,DAM)、白质相关小胶质细胞(white matter-associated microglia,WAMs)等。
2.1 CD11c+小胶质细胞大脑中存在出生前吞噬凋亡神经元形成的CD11c+的小胶质细胞亚群,是一个稳定的亚群。小胶质细胞在吞噬凋亡细胞时会促使其由CD11c-转变成CD11c+,小胶质细胞受体与凋亡神经元之间的作用增强。CD11c+小胶质细胞在胚胎晚期出现,然后在年轻成鼠中下降到几乎无法检测到的水平。然而,CD11c+小胶质细胞在年龄较大(6~9月龄)的小鼠中又重新出现。这表明CD11c+小胶质细胞不是一种简单的、短暂的激活型小胶质细胞表型,而是一类稳定的小胶质细胞。小胶质细胞CD11c+的稳定表达需要骨桥蛋白(osteopontin,OPN)的共表达[11]。OPN是一种分泌性细胞外基质糖蛋白,在正常脑组织的神经元和小胶质细胞中表达较低,但在许多神经系统疾病中过度表达(如AD、ALS、PD等)[12-13]。CD11c+小胶质细胞是中枢神经系统中唯一可以产生OPN的小胶质细胞。OPN对CD11+亚群的稳定性以及吞噬和促炎症反应的执行是必需的,OPN促进CD11c+小胶质细胞对突触的吞噬及增殖能力[14]。CD11c+OPN+亚群在稳定状态下表现出稳定的表型,并表达独立于小胶质细胞激活的核心遗传程序。产生OPN的CD11c+小胶质细胞定义为一个功能亚群而非瞬时激活表型,可以深入了解小胶质细胞分化对大脑发育的贡献。
将产生OPN的CD11c+小胶质细胞定义为功能性小胶质细胞亚群,有助于深入了解健康和疾病中的小胶质细胞分化,而CD11c+ OPN+小胶质细胞在脑内的空间分布、与神经退行性疾病间的关系还有待进一步研究。
2.2 DM利用高空间分辨率电镜,发现大脑中存在另一种类型的小胶质细胞。与正常的小胶质细胞相比,这一类型细胞的超微结构具有一些独特的特征。这些细胞总是表现出氧化应激的迹象,呈现浓缩的电子密集的细胞质和核质,伴有细胞质收缩、高尔基体和内质网扩张,以及线粒体改变。电镜下,这一类型的小胶质细胞几乎与线粒体一样暗,被命名为DM[15]。
DM很少在健康个体中被发现,它与衰老、慢性应激和AD等退行性过程有关。这种表型在正常稳态条件下很少出现,但在慢性应激、衰老、分形信号缺乏(Cx3cr1敲除小鼠)和AD病理学(APP-PS1小鼠)期间增多。最近在大鼠和人类中也发现了DM[16-18]。免疫染色结果显示DM表达4D4、CD11b和TREM2,而不表达Cx3cr1、Iba1和P2RY12。DM具有较高的吞噬活性,广泛吞噬树突棘、轴突终末和整个突触。目前DM只能通过电镜来识别,对它们的研究重要的是寻找能够精确识别DM的选择性标志物。
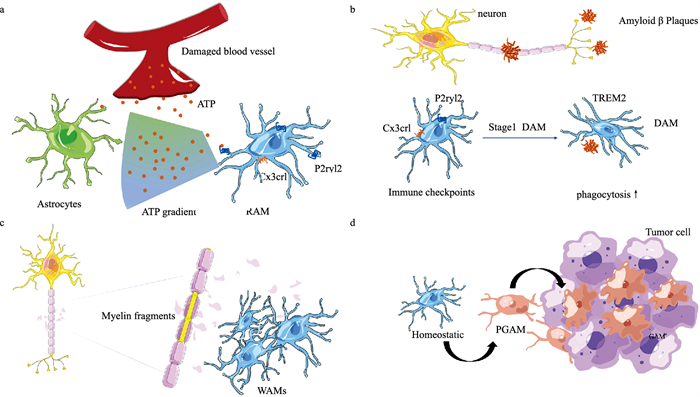
2.3 促血管生成修复相关小胶质细胞在脑血管损伤后重塑过程中,一个独特的小胶质细胞亚群促血管生成,将CD45lo、Cx3cr1+、P2RY12+、CD24+定义为修复相关小胶质细胞(repair-associated microglia,RAM)。借助活体显微镜,在Cx3cr1GFP/+小鼠中观察到小胶质细胞在脑血管损伤后立即向损伤血管投射突起,形成“玫瑰花结”样完全包裹住血管的管状结构。小胶质细胞包住受损或凝结的血管,使纤维蛋白局限于小灶簇而不是分布在整个损伤的脑实质,限制了渗漏到实质的程度,从而提供了脑血管损伤后的第一线保护。研究表明[19],小胶质细胞花环结构形成和抑制血脑屏障泄漏是星形胶质细胞ATP释放和随后的P2RY12信号传导调控的(Fig 1a)。抑制P2RY12受体或CX43半通道可使小胶质细胞花环结构减少。
|
| Fig 1 New subtypes of microglia a: After cerebrovascular injury, the release of injury-associated ATP triggers a gradient of astrocytes to secrete ATP, which is then sensed by microglia P2Y purinergic receptor 12 (P2RY12), controlling the movement of microglia towards the site of injury, with rapid projectile protrusions extending to cover it.b: A neurodegenerative disease-associated plaque within the AD brain near the novel microglia need to be activated in a two-step process. The first activation step is initiated in a TREM2-independent manner, down-regulating the microglia checkpoint, followed by activation of a TREM2-dependent program with enhanced phagocytosis. c: Within the white matter, microglia tend to accumulate in nodules containing myelin debris, and such microglia have important functions in myelin debris degradation. d: Steady-state microglia to glioma microglia for chemotactic prediction. |
RAM在脑血管损伤过程中,通过形成“玫瑰花环”结构限制损伤程度,又发挥着促进血管生成作用。在急性出血性血管损伤的情况下,小胶质细胞的这些作用,超过了其吞噬状态或释放促炎分子的能力所产生的负面作用。
2.4 DAM在5XFAD(AD转基因小鼠)模型分析鉴别出一种与AD相关的小胶质细胞称为DAM。首先从5XFAD小鼠的大脑中筛选了所有(CD45+)免疫细胞,然后进行单细胞RNA测序(single-cell RNA sequencing, scRNA-seq)分析。对6只野生型和AD模型小鼠的8 016个单细胞进行了分类,创建了10个转录差异最大的亚群的详细谱系。分析确定两个小群体的细胞,即集群Ⅱ和Ⅲ,代表AD中观察到的独特小胶质细胞状态,将这种状态定义为DAM。DAM位于不可溶性淀粉样蛋白β斑块(amyloid β plaques,Aβ)附近,在中枢神经系统的其他区域不存在。但DAM不仅存在于AD中,在髓鞘碎片堆积的情况下,也存在于脱髓鞘和ALS,多发性硬化症,中风等其他神经退行性疾病中。
DAM的形成通过TREM2依赖和TREM2非依赖路径进行。小胶质细胞在接收到AD病理学、衰老和ALS病理学相关信号后,会导致TREM2独立的DAM中间状态(阶段1),阶段1主要涉及体内平衡小胶质细胞检查点基因(Cx3cr1和P2ry12/P2ry13)表达的减少和B2m等基因的上调。这种中间DAM阶段可被TREM2依赖的二级激活信号进一步激活(阶段2),阶段2涉及吞噬细胞和脂质代谢基因的上调(Fig 1b)。但是,在没有TREM2独立阶段的情况下,没有观察到具有TREM2依赖阶段的细胞,这表明DAM激活是一种机械耦合的时间事件,必须首先在TREM2独立途径中启动,然后激活TREM2依赖程序。DAM的基因表达发生显著变化,脂质代谢途径和吞噬相关基因升高[20](Tab 1),对应于AD中斑块清除的需要,DAM是保存在小鼠和人类中的AD相关吞噬细胞。DAM积极参与淀粉样斑块的分解和消化,在AD中起积极作用,是一种新的保护性小胶质细胞亚型。
| Subtype of microglia | Localization | Changes in gene expression | Features and functions | Disease type | References |
| CD11c+microglia | Unclear | Itgax, CD209a, CD209f, CD36, CD11C and OPN↑ | Synaptic phagocytosis, proliferation, pro-inflammation | Brain development, aging and the different stages of AD, ALS, PD | [11-14] |
| dark microglia (DM) | Hippocampus, cerebral cortex, amygdala and hypothalamus | 4D4, CD11b and TREM2↑,Cx3cr1, IBA1 and P2RY12↓ | Cytoplasmic and nucleoplasmic, cytoplasmic contraction, Golgi apparatus and endoplasmic reticulum expansion, with high phagocytosis | Aging, chronic stress and AD | [15-18] |
| repair-associated microglia (RAM) | Cerebrovascular injury perivascular | Cx3cr1, P2RY12, CD24↑, CD45↓ | Formation of a “rosette” structure to limit vascular damage and promote angiogenesis | Cerebrovascular injury | [19] |
| Disease-associated microglia (DAM) | Aβ plaques | Iba1, Cst3, Hexb, P2RY12, P2RY13, Cx3cr1, CD33, Tmem119↓, ApoE, Ctsd, Lpl, Tyrobp and TREM2↑ | Enhanced lipid metabolic pathways and phagocytosis, phagocytosis of Aβ plaques | AD, ALS, MS,Stroke | [20] |
| plaque-associated microglia (PAM) | Aβ plaques | Iba1, CD11b↑, CD45, CD11a↓ | High inflammatory markers, low mobility and phagocytic activity, inability to phagocytically clear Aβ plaques | AD | [21-23] |
| white matter-associated microglia (WAMs) | White matter containing myelin fragments within the nodules | P2RY12 and P2RY13, Csfr1r, Cx3cr1, Hexb and Tmem119↓, ApoE, Cst7, Bm2, Lyz2, Cd63, CLEC7A, Ctsb, Ctss, CTSZ, H2-D1, H2-K1↑ | Enhanced lipid metabolic pathways and phagocytosis, phagocytosis of myelin debris | Aging, demyelination | [24-25] |
| glioma-associated myeloid (GAM) peritumoral GAM (PGAM) | Glioma | Cx3cr1 and SELPLG↓, CD163, ApoE, LPL, IFI27 and IFITM3↑ | Promotes glioma progression | Glioblastoma | [26-28] |
| lipid-droplet-accumulating microglia (LDAM) | Senile plaques in the hippocampus | AXL,CD74,CLEC7A and CYBB↓;CD63,ATP6V1A,ATP6V1C1,ATP6V1G1,TUBA1,RAB5B,RAB7,CD22,CAT,KL,PPP1CB,JAK,RAP1B,PLIN3 and ACLY↑ | Defects in phagocytosis, produce increased ROS and proinflammatory cytokines | Aging,AD,ALS and FTD | [29-30] |
另一种与AD相关的小胶质细胞称为PAM。在AD大脑中,PAM聚集在Aβ斑块周围,在健康的大脑中,小胶质细胞和巨噬细胞很容易区分。在神经炎症期间,如在AD中,活化的小胶质细胞和外周巨噬细胞改变了它们各自的形态和标记表达模式,混淆了它们的区别。CD11a在包括巨噬细胞在内的外周免疫细胞上高度表达,但在小鼠小胶质细胞上不表达。CD11a可用作区分小鼠小胶质细胞和浸润性外周免疫细胞的标志物。利用CD11a阴性标志物,表明AD转基因小鼠大脑中的PAM细胞完全由小胶质细胞组成[21]。Aβ斑块吸引小胶质细胞迁移到附近,斑块周围的小胶质细胞形成功能和形态学改变的独特小胶质细胞群。PAM在其基因表达中表现出进行性变化(Tab 1)。小胶质细胞从“稳态”状态转化为“DAM”或“小胶质神经变性”表型[22-23]。
AD大脑中,PAM与DAM同样聚集在Aβ斑块周围,但PAM与DAM不同,PAM具有更高的转录性,流动性和吞噬活性低,不能通过吞噬作用有效清除Aβ,所以对此类小胶质细胞功能进行调节可能是治疗AD的突破。
2.6 白质相关小胶质细胞年龄是最常见的神经退行性疾病的主要风险因素,衰老会导致灰质和白质变性。基因表达研究表明,衰老的小胶质细胞在白质中发展出更具炎症的表型。利用飞行时间质谱(time of flight mass spectrometer,CyTOF)分析不同脑区的小胶质细胞表型,比较了灰质和白质之间不同小胶质细胞免疫标志物的表达,此方法在蛋白质水平上证实了scRNA-seq检测到的人白质和灰质小胶质细胞的区别,白质小胶质细胞表达的HLA-DR、CD68、ApoE和EMR1水平高于灰质小胶质细胞[24]。利用单细胞RNA测序和UMAP分析将老化的白质与老化的灰质小胶质细胞分离。白质小胶质细胞特异性簇由特定基因特征定义。利用白质小胶质细胞基因特征,区分了两个白质特异性簇,称之为WAMs和激活的小胶质细胞。WAMs的特征是体内平衡基因的下调,和检查点基因以及DAM相关基因的上调(Tab 1)。激活的小胶质细胞以编码许多代谢基因的上调为标志,主要是核糖体亚基和线粒体基因,其中许多是小胶质细胞对衰老反应的一部分。将激活的小胶质细胞与WAMs进行比较,WAMs中最丰富的途径是缺氧诱导因子信号、溶酶体和胆固醇途径[25]。WAMs标记基因随着白质老化而增加,在白质内,小胶质细胞多聚集在含有髓鞘碎片的结节内,这些结节负责清除白质中的髓鞘碎片(Fig 1c)。WAMs在髓鞘碎片降解中具有重要功能。WAMs参与清除退化的髓鞘。因此,WAMs可能代表清除白质老化和疾病期间积累的变性髓磷脂所需的潜在保护性反应。
WAMs与DAM的形成都依赖于髓样细胞2 (TREM2)信号上表达的触发受体,但WAMs似乎代表一种小胶质细胞状态,显示DAM基因特征的部分激活,WAMs和DAM状态可能是连续的细胞身份,可以相互融合。在衰老中,小胶质细胞的激活似乎向WAMs状态转移,而在AD中,则向DAM状态转移。在老年小鼠中,WAMs似乎是通过ApoE非依赖性途径产生的,而在AD模型中,具有DAM和WAMs基因特征的小胶质细胞的产生需要ApoE功能。并且WAMs具有一个主要特征:参与白质髓鞘碎片清除。
2.7 胶质瘤相关小胶质细胞和胶质瘤瘤周相关小胶质细胞在恶性胶质瘤中,局部小胶质细胞和循环单核细胞迁移到肿瘤微环境并分化为肿瘤支持细胞,胶质瘤中髓样细胞亚群的细胞异质性和功能表型仍不清楚。使用scRNA-seq和CyTOF技术对来自对照大脑和脑肿瘤的人类小胶质细胞的基因和蛋白表达进行联合评估。发现人类胶质瘤中存在相关的小胶质细胞簇(glioma-associated myeloid,GAM)。胶质瘤相关簇的差异基因表达分析显示,小胶质细胞核心基因的表达较低,而代谢、炎症和干扰素相关基因的表达更高(Tab 1)。GAM的mRNA表达谱显示促炎性M1和抗炎性M2极化标志物因子的上调。该证据表明,人类胶质母细胞瘤含有混合的M1/M2样极化GAM[26](Fig 1d)。在肿瘤周围组织样本中还确定了一个离散的髓样细胞簇,将瘤周GAM(peritumoral GAM,PGAM)确定为GAM的一个独特亚群。PGAM富含趋化性和促炎性程序,CCL2、CCL3、CCL4、CCL3L1、CXCL12、CSF1、TNF-α和IL-1β的表达相对较高。PGAM表现出促炎症和趋化表型,与外周血单核细胞募集相关,并降低总体存活率[27]。PGAM和GAM可用P2RY12区分,P2RY12仅在肿瘤-基质界面标记小胶质细胞。
GAM促进胶质母细胞瘤细胞的生存、增殖、代谢、迁移和自我更新,还可以通过刺激血管生成等间接方式促进胶质母细胞瘤进展[28]。PGAM可能是肿瘤微环境的细胞靶点。
2.8 脂滴蓄积小胶质细胞(lipid-droplet-accumulating microglia,LDAM)通过联合透射电镜、相干反斯托克斯拉曼散射(coherent anti-stokes raman scattering,CARS)和流式细胞分析技术,研究者比较3月龄和20月龄鼠小胶质细胞的胞浆内容物,发现20月龄鼠小胶质细胞出现明显的脂滴蓄积,约是3月龄的4倍,主要存在于海马脑区,并以PLIN3和Iba1联合标识鉴定出新的小胶质细胞表型-LDAM。LDAM中脂滴构成主要是中性脂质TAGs、DAGs、MAGs和CEs。进一步的高脂滴和低脂滴小胶质细胞转录组比较发现,LDAM高表达的基因,主要富集在吞噬功能负调控途径,促ROS生成、致炎因子生成和β氧化等通路[29]。
LDAM是少有的以代谢变化为主要特征的小胶质细胞亚型。代谢重编程是髓系细胞系调控自身功能的典型生化过程。借鉴于外周的巨噬细胞吞噬脂质在动脉粥样硬化中的作用和变态炎性反应中的嗜酸性粒细胞,脂滴蓄积被认为是一种炎性标记和细胞器结构,LDAM被认为是一类致炎细胞,参与衰老和神经退行性疾病的发生和进展。同时,转录组分析发现,在LDAM下调的基因如AXL、CD74、CLEC7A和CYBB,在另一类依赖TREM2激活的DAM亚型则上调,而DAM被认为是有利于改善AD病理过程。从代谢调控的角度,干预脂滴蓄积是对LDAM亚型功能修复的潜在措施[30]。
3 结语与展望我们现在知道,大脑中存在小胶质细胞的不同亚群,即小胶质细胞在脑内空间分布上表现出细胞密度、基因和蛋白表达、功能的不同和形态上的差异。在有害刺激存在下会改变单个亚群,并诱导新亚群的出现[31]。了解其形态、转录和空间异质性是发现其在神经退行性病变中作用的关键。组学的应用能够对更多小胶质细胞亚型进行详细描述,越来越多的功能特异性小胶质细胞亚群通过表达一个或两个独特的特征基因进行鉴定。明确区分小胶质细胞细胞亚群将加速确定治疗药物靶点和优化药物输送方法。短暂的小胶质细胞耗竭后再重新填充小胶质细胞的独特表型以及其他有利表型,揭示了治疗神经疾病的新机会。另一方面,我们对小胶质细胞的研究越来越深入,面临的亚型区分和功能标识也就越复杂。最初的M1/M2极化概念确实是有用的,虽然特异性标记物发现的越来越多,但是特定亚型细胞功能仍旧围绕早期的定义,采用这种模式是为了简化数据解释,将研究重点放在小胶质细胞转变为有益的表型上。表征特定小胶质细胞表型的功能具有挑战性,但对于将科学发现转化为临床应用至关重要。新的研究可以针对性地分析特定大脑区域而不是整个大脑的基因表达。
目前小胶质细胞亚型的分类主要来源于人和小鼠,但CD11c+细胞亚型的分类主要来源于小鼠。人类和小鼠之间的物种差异限制了我们对人类小胶质细胞的功能探索。最新研究证明胎儿小胶质细胞的动态静息/活动状态转换在人类和小鼠之间非常相似,但在人类和小鼠的小胶质细胞发育过程中存在分子差异。该研究将为人体小胶质细胞的研究奠定坚实有力的基础、为小鼠小胶质细胞研究结果向人体医疗转化提供了理论依据[32]。
| [1] |
Andriezen W L. The neuroglia elements in the human brain[J]. Br Med J, 1893, 2(1700): 227-30. doi:10.1136/bmj.2.1700.227 |
| [2] |
Robertson, Ford. A microscopic demonstration of the normal and pathological histology of mesoglia cells[J]. J Ment Sci, 1900, 46(195): 724. doi:10.1192/bjp.46.195.724 |
| [3] |
Ganbold T, Bao Q, Zandan J, Hasi A, et al. Modulation of microglia polarization through silencing of NF-κB p65 by functionalized curdlan nanoparticle-mediated RNAi[J]. ACS Appl Mater Interfaces, 2020, 12(10): 11363-74. doi:10.1021/acsami.9b23004 |
| [4] |
Wu H, Zheng J, Xu S, et al. Mer regulates microglial/macrophage M1/M2 polarization and alleviates neuroinflammation following traumatic brain injury[J]. J Neuroinflammation, 2021, 18(1): 2. doi:10.1186/s12974-020-02041-7 |
| [5] |
Xu Y, Cui K, Li J, et al. Melatonin attenuates choroidal neovascularization by regulating macrophage/microglia polarization via inhibition of RhoA/ROCK signaling pathway[J]. J Pineal Res, 2020, 69(1): e12660. doi:10.1111/jpi.12660 |
| [6] |
Young K F, Gardner R, Sariana V, et al. Can quantifying morphology and TMEM119 expression distinguish between microglia and infiltrating macrophages after ischemic stroke and reperfusion in male and female mice?[J]. J Neuroinflammation, 2021, 18(1): 58. doi:10.1186/s12974-021-02105-2 |
| [7] |
张秀丽, 雷昌, 刘洋, 等. MCAO大鼠皮质小胶质细胞极化的研究及脑泰方Ⅱ号的干预[J]. 中国药理学通报, 2020, 36(9): 1298-303. Zhang X L, Lei C, Liu Y, et al. Polarization of microglia in cortex of MCAO rats and intervention of Naotaifang Ⅱ[J]. Chin Pharmacol Bull, 2020, 36(9): 1298-303. doi:10.3969/j.issn.1001-1978.2020.09.021 |
| [8] |
Jordão M J C, Sankowski R, Brendecke S M, et al. Single-cell profiling identifies myeloid cell subsets with distinct fates during neuroinflammation[J]. Science, 2019, 363(6425): eaat7554. doi:10.1126/science.aat7554 |
| [9] |
Hammond T R, Dufort C, Dissing-Olesen L, et al. Single-cell RNA sequencing of microglia throughout the mouse lifespan and in the injured brain reveals complex cell-state changes[J]. Immunity, 2019, 50(1): 253-71. doi:10.1016/j.immuni.2018.11.004 |
| [10] |
Masuda T, Sankowski R, Staszewski O, et al. Spatial and temporal heterogeneity of mouse and human microglia at single-cell resolution[J]. Nature, 2019, 566(7744): 388-92. doi:10.1038/s41586-019-0924-x |
| [11] |
Shen X, Qiu Y, Wight A E, et al. Definition of a mouse microglial subset that regulates neuronal development and proinflammatory responses in the brain[J]. Proc Natl Acad Sci U S A, 2022, 119(8): e2116241119. doi:10.1073/pnas.2116241119 |
| [12] |
Lin Y, Zhou M, Dai W, et al. Bone-derived factors as potential biomarkers for parkinson's disease[J]. Front Aging Neurosci, 2021, 13: 634213. doi:10.3389/fnagi.2021.634213 |
| [13] |
Chai Y L, Chong J R, Raquib A R, et al. Plasma osteopontin as a biomarker of Alzheimer's disease and vascular cognitive impairment[J]. Sci Rep, 2021, 11(1): 4010. doi:10.1038/s41598-021-83601-6 |
| [14] |
Dashdulam D, Kim I D, Lee H, et al. Osteopontin heptamer peptide containing the RGD motif enhances the phagocytic function of microglia[J]. Biochem Biophys Res Commun, 2020, 524(2): 371-7. doi:10.1016/j.bbrc.2020.01.100 |
| [15] |
Bisht K, Sharma K P, Lecours C, et al. Dark microglia: a new phenotype predominantly associated with pathological states[J]. Glia, 2016, 64(5): 826-39. doi:10.1002/glia.22966 |
| [16] |
Elgayar S A M, Abdel-Hafez A A M, Gomaa A M S, et al. Vulnerability of glia and vessels of rat substantia nigra in rotenone Parkinson model[J]. Ultrastruct Pathol, 2018, 42(2): 181-92. doi:10.1080/01913123.2017.1422066 |
| [17] |
Calì C, Agus M, Kare K, et al. 3D cellular reconstruction of cortical glia and parenchymal morphometric analysis from serial block-face electron microscopy of juvenile rat[J]. Prog Neurobiol, 2019, 183: 101696. doi:10.1016/j.pneurobio.2019.101696 |
| [18] |
Uranova N A, Vikhreva O V, Rakhmanova V I, et al. Ultrastructural pathology of oligodendrocytes adjacent to microglia in prefrontal white matter in schizophrenia[J]. NPJ Schizophr, 2018, 4(1): 26. doi:10.1038/s41537-018-0068-2 |
| [19] |
Mastorakos P, Mihelson N, Luby M, et al. Temporally distinct myeloid cell responses mediate damage and repair after cerebrovascular injury[J]. Nat Neurosci, 2021, 24(2): 245-58. doi:10.1038/s41593-020-00773-6 |
| [20] |
Keren-Shaul H, Spinrad A, Weiner A, et al. A unique microglia type associated with restricting development of alzheimer's disease[J]. Cell, 2017, 169(7): 1276-90. doi:10.1016/j.cell.2017.05.018 |
| [21] |
Reed-Geaghan E G, Croxford A L, Becher B, et al. Plaque-associated myeloid cells derive from resident microglia in an Alzheimer's disease model[J]. J Exp Med, 2020, 217(4): e20191374. doi:10.1084/jem.20191374 |
| [22] |
Bennett F C, Bennett M L, Yaqoob F, et al. A combination of ontogeny and CNS environment establishes microglial identity[J]. Neuron, 2018, 98(6): 1170-83. doi:10.1016/j.neuron.2018.05.014 |
| [23] |
Shukla A K, McIntyre L L, Marsh S E, et al. CD11a expression distinguishes infiltrating myeloid cells from plaque-associated microglia in Alzheimer's disease[J]. Glia, 2019, 67(5): 844-56. doi:10.1002/glia.23575 |
| [24] |
Sankowski R, Böttcher C, Masuda T, et al. Mapping microglia states in the human brain through the integration of high-dimensional techniques[J]. Nat Neurosci, 2019, 22(12): 2098-110. doi:10.1038/s41593-019-0532-y |
| [25] |
Safaiyan S, Besson-Girard S, Kaya T, et al. White matter aging drives microglial diversity[J]. Neuron, 2021, 109(7): 1100-17. doi:10.1016/j.neuron.2021.01.027 |
| [26] |
Calero-Pérez P, Wu S, Arús C, et al. Immune system-related changes in preclinical GL261 glioblastoma under TMZ treatment: explaining MRSI-based nosological imaging findings with RT-PCR analyses[J]. Cancers (Basel), 2021, 13(11): 2663. doi:10.3390/cancers13112663 |
| [27] |
Caponegro M D, Oh K, Madeira M M, et al. A distinct microglial subset at the tumor-stroma interface of glioma[J]. Glia, 2021, 69(7): 1767-81. doi:10.1002/glia.23991 |
| [28] |
Su Y T, Butler M, Zhang M, et al. MerTK inhibition decreases immune suppressive glioblastoma-associated macrophages and neoangiogenesis in glioblastoma microenvironment[J]. Neurooncol Adv, 2020, 2(1): vdaa065. |
| [29] |
Marschallinger J, Iram T, Zardeneta M, et al. Lipid-droplet-accumulating microglia represent a dysfunctional and proinflammatory state in the aging brain[J]. Nat Neurosci, 2020, 23(2): 194-208. doi:10.1038/s41593-019-0566-1 |
| [30] |
Jung E S, Mook-Jung I. New microglia on the block[J]. Cell Metab, 2020, 31(4): 664-6. doi:10.1016/j.cmet.2020.03.015 |
| [31] |
De Biase LM, Bonci A. Region-specific phenotypes of microglia: the role of local regulatory cues[J]. Neuroscientist, 2019, 25(4): 314-33. doi:10.1177/1073858418800996 |
| [32] |
Li Y, Li Z, Yang M, et al. Decoding the temporal and regional specification of microglia in the developing human brain[J]. Cell Stem Cell, 2022, 29(4): 620-34. doi:10.1016/j.stem.2022.02.004 |

