

2. 青岛海洋科学与技术国家实验室-海洋药物与生物制品实验室, 山东 青岛 266237
2. Qingdao National Laboratory for Marine Science and Technology-Marine Medicines and Biologics Laboratory, Qingdao Shandong 266237, China
小细胞肺癌(small cell lung cancer,SCLC)是一种高度转移和顽固性的癌症,具有进展迅速、早期转移,易复发等特征[1]。目前,SCLC临床治疗以化疗为主,一线标准治疗为EP方案:顺铂(cisplatin, CDDP)或卡铂和依托泊苷(etoposide, VP-16)联合使用或IP方案(铂类药物与伊立替康联合使用)。大多数患者虽然在一线标准治疗方案后,产生较高的响应率,然而,高达75%的局部晚期SCLC患者和90%以上的转移性疾病患者在2年内表现出进展性疾病,并最终产生化疗耐药[2]。二线拓扑异构酶I抑制剂治疗的应答率显著降低,总体低于20%[3],SCLC患者的中位生存期在诊断后仅为7~12个月。
耐药性仍然是SCLC有效和准确治疗的挑战[4-5],然而SCLC确切的耐药机制仍不清楚,因此建立与临床治疗相一致的SCLC耐药细胞对于研究SCLC的耐药机制及药物治疗具有重要意义。在本研究中,我们模拟SCLC的临床一线治疗方案,通过体内长期给药诱导耐药,进而获得耐药细胞,对其生物学特征及多药耐药性进行了鉴定。
1 材料与方法 1.1 材料NCI-H446细胞购自中国科学院上海细胞库;胎牛血清,Roswell Park Memorial Institute(RPMI)1640购自美国Gibco公司;CDDP、VP-16购自美国TargetMol;阿霉素(doxorubicin, DOX)、7-乙基-10-羟基喜树碱(7-Ethyl-10-hydroxycamptothecin, SN38) 购自美国MedChemExpress;细胞计数试剂盒-8 (Cell Counting Kit-8, CCK-8)购自中国翌圣生物科技(上海)股份有限公司;GAPDH、P-gp、ABCG2购自中国杭州华安生物技术有限公司;动物实验所用BALB/C nu-nu小鼠购于济南朋悦实验动物繁育有限公司,均为雄性,4周龄,体质量为14 g~16 g,实验动物合格证号:SCXK(鲁)2022 0006。
1.2 方法 1.2.1 细胞培养NCI-H446/NC和NCI-H446/EP在添加10%胎牛血清、100 mg·L-1青霉素和100 mg·L-1链霉素的RPMI 1640培养基中,37 ℃,5% CO2,饱和湿度的培养箱中培养。
1.2.2 动物饲养BALB/C-nude小鼠全程于EVC鼠笼中饲养,每日12 h照明,恒定温度24±2 ℃,恒定湿度40%~60%。
1.2.3 SCLC耐药细胞株的建立扩增培养SCLC NCI-H446细胞,以3×106个/只皮下接种至BALB/C-nude雄性裸鼠右前肢腋下,瘤体积长至约100 mm3时开始给予药物处理。成瘤裸鼠随机分为NCI-H446/EP给药组(腹腔注射CDDP 3 mg·kg-1,一周1次;腹腔注射VP-16 4 mg·kg-1,一周3次),溶媒对照组(腹腔注射等体积溶剂,由10% DMSO、40% PEG300、5% Tween 80、45%生理盐水组成),每组5只。持续给药,每周3次测量肿瘤体积和小鼠体质量,给药组瘤体积长至1 000 mm3时处死裸鼠,剥取皮下肿瘤组织,研磨提取细胞,接种至培养瓶中,37 ℃,5% CO2条件下静置30 min,收集上层未贴壁细胞继续培养,经多次分离后获得亲本肿瘤细胞和耐药肿瘤细胞,分别命名为NCI-H446/NC、NCI-H446/EP,扩增培养用于后续实验研究。
1.2.4 细胞形态观察NCI-H446/NC、NCI-H446/EP细胞,倒置显微镜下观察细胞形态并拍照。
1.2.5 SRB法检测细胞活力收获指数生长期的NCI-H446/NC、NCI-H446/EP细胞,以5×103 /孔的数量种于96孔板中。加入相应药物作用72 h后,用预冷的10%的TCA对细胞进行固定1 h以上,0.4% SRB染液避光染色15~30 min。1%的冰醋酸溶液冲洗后室温晾干。Tris-base溶液加入后充分振荡混匀,515 nm波长,读取96孔板A515值。计算50%细胞存活的药物浓度(IC50),耐药指数(re-sistaneeindex, RI)(NCI-H446/EP细胞的IC50与NCI-H446/NC细胞的IC50比值)。
1.2.6 CCK-8法检测生长曲线与倍增时间(Td)将NCI-H446/NC、NCI-H446/EP细胞分别接种于96孔板中,每孔1 000个细胞,37 ℃,5% CO2培养箱中培养0、24、48、72、96 h后,采用CCK-8法检测A值,绘制细胞生长曲线。计算细胞倍增时间(doubling time,Td):Td = Δt×lg2/(lgAt-lgA0),其中N0是开始的A值,Nt是结束的A值,Δt是从A0到At的时间。
1.2.7 流式细胞术检测细胞周期收集生长对数期的NCI-H446/NC和NCI-H446/EP细胞,PBS清洗后,加入预冷的75%冷乙醇,-20 ℃固定过夜,冷PBS清洗,加入50 g·L-1碘化丙啶和1.0 g·L-1 RNase-A,4 ℃避光孵育30 min,流式细胞仪检测细胞周期分布情况。
1.2.8 RT-PCR检测MDR1基因表达收获对数生长期NCI-H446/NC、NCI-H446/EP细胞,用TRIzol试剂盒分离提取细胞中总RNA。互补DNA (cDNA)通过5 μg总RNA的逆转录获得,保证细胞间cDNA含量一致。每个cDNA样本用ExTaq进行扩增。使用Tab 1中的正向和反向引物对指示基因进行PCR反应。循环条件:94 ℃变性5 min,55 ℃退火60 s,72 ℃延伸60 s,总PCR循环30次,最终在72 ℃延伸10 min。每个扩增的PCR产物在1%琼脂糖凝胶上电泳测定。PCR结果在分子成像仪ChemiDoc XRS系统下观察并拍照记录。
| Gene | Primers |
| Forward | 5′-GAATCTGGAGGAAGACATGACC-3′ |
| Reverse | 5′-TCCAATTTTGTCACCAATTCC-3′ |
收集细胞,PBS清洗,加入Loading buffer于冰上裂解细胞。细胞裂解液经电泳后转印至硝酸纤维素膜上,1×蛋白封闭液中室温下封闭15 min,加入相应的一抗4 ℃下孵育过夜。清洗后,用辣根过氧化物酶偶联二抗室温孵育1 h,电化学发光显影。使用ImageJ软件统计灰度值。以靶蛋白/磷酸甘油醛脱氢酶(GAPDH)的比值来显示靶蛋白的相对表达量。
1.2.10 耐药细胞株体内耐药性将NCI-H446/EP细胞以3×106个/只接种至Balb/c-nude裸鼠腋下,在肿瘤体积达到100 mm3时随机分为NCI-H446/EP给药组(腹腔注射,CDDP,3 mg·kg-1,一周1次;腹腔注射,VP-16,4 mg·kg-1,一周3次),对照组(等体积溶剂:10% DMSO、40% PEG300、5% Tween 80、45%生理盐水),每组5只。每周3次测量肿瘤体积,记录小鼠体质量。对照组肿瘤体积达到1 000 mm3时,结束实验,处死小鼠,剥取瘤组织称质量。
1.2.11 统计学处理数据以x±s表示,并通过SPSS进行分析。组间差异采用单因素方差分析(ANOVA)检验,两组间采用独立样本t检验。P < 0.05时,差异被认为是有统计学意义。
2 结果 2.1 NCI-H446裸鼠移植瘤产生体内耐药将SCLC NCI-H446皮下接种至裸鼠体内,构建人源性组织异种移植(patient-derivedxenografts, PDX)模型,按照SCLC临床EP治疗方案给予治疗,给药3周内,肿瘤对化疗药物敏感,瘤体积明显减小。第4周后,肿瘤开始逐渐恢复生长,生长速度加快,呈现与对照组相同的生长趋势(Fig 1),提示药物敏感性降低。给药组瘤体积长至1 000 mm3时处死裸鼠,剥取皮下肿瘤组织,研磨获得细胞悬液,经多次分离后获得肿瘤细胞,命名为NCI-H446/EP,扩增培养用于后续实验研究。
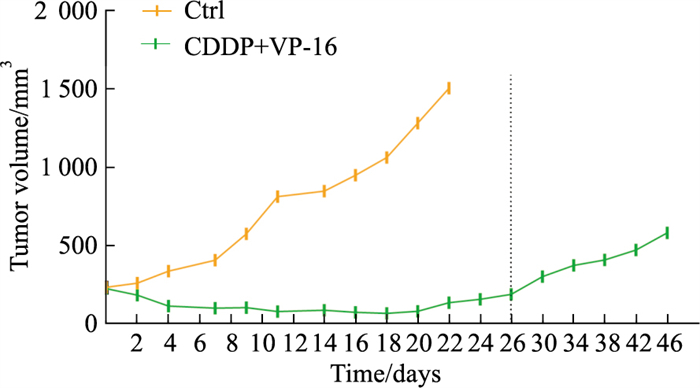
|
| Fig 1 Establishment of chemoresistant SCLC xenograft mouse models (x±s, n=5) |
倒置显微镜下观察NCI-H446/NC细胞大小均匀,呈铺路石样,胞浆核仁清晰。NCI-H446/EP细胞相较亲本细胞,体积大小不一,形状扁平,多有突起,细胞核和细胞质明显增大,核仁多(Fig 2)。
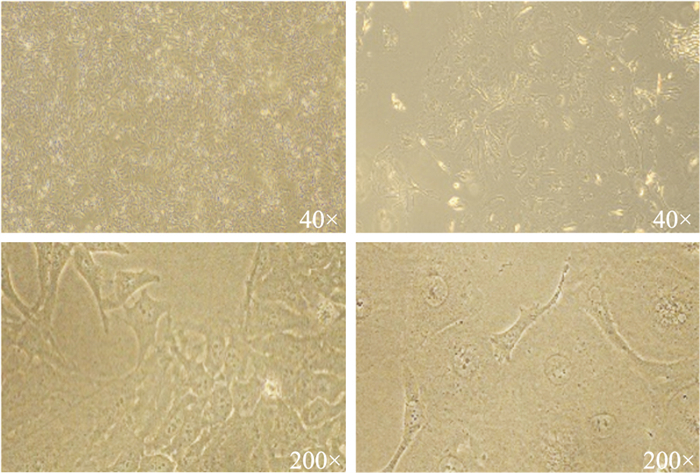
|
| Fig 2 Morphology of NCI-H446/NC and NCI-H446/EP cells in exponential growth phase |
SRB法检测CDDP、VP-16以及肺癌常用化疗药物SN-38和DOX对NCI-H446/NC、NCI-H446/EP的细胞毒性,计算IC50值和RI(Tab 2)。结果表明,NCI-H446/EP对CDDP、VP-16产生了较强的耐药性,同时对SN-38、DOX也产生了交叉耐药性。
| Drug (μmol·L-1) |
IC50 | RI | |
| NCI-H446/NC | NCI-H446/EP | ||
| CDDP | 4.17±0.18 | 50.19±1.45 | 12.01 |
| VP-16 | 0.47±0.09 | 10.65±2.46 | 18.36 |
| SN38 | 0.10±0.01 | 6.87±1.95 | 65.40 |
| DOX | 0.58±0.03 | 5.98±0.37 | 10.12 |
采用CCK-8法检测NCI-H446/NC、NCI-H446/EP细胞活性,以培养时间为x轴,以OD450值为y轴。绘制细胞生长曲线(Fig 3)。计算NCI-H446/NC和NCI-H446/EP细胞的Td分别为31.71±0.75 h和42.67±0.05 h,NCI-H446/EP细胞生长速度明显低于其亲本细胞(P<0.01)。
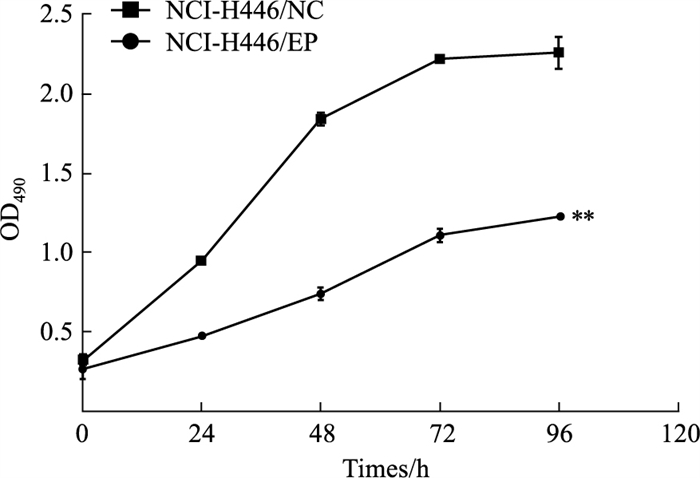
|
| Fig 3 Growth curves of NCI-H446/NC and NCI-H446/EP cell (x±s, n=3) **P < 0.01, NCI-H446/EP vs NCI-H446/NC |
流式细胞术检测NCI-H446/NC、NCI-H446/EP细胞周期分布。如Fig 4所示,与NCI-H446/NC细胞相比,NCI-H446/EP细胞G0/G1期比例增加,G2/M期细胞减少。
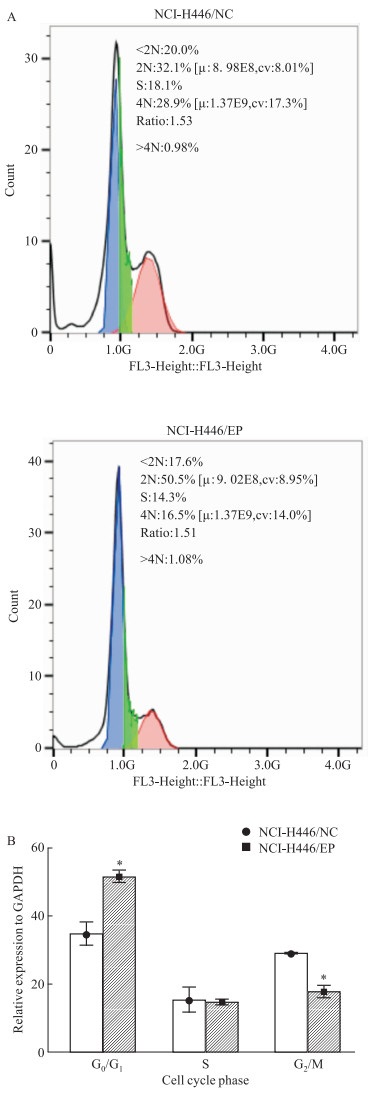
|
| Fig 4 Cell cycle distribution and statistical analysis (x±s, n=3) *P < 0.05, NCI-H446/EP vs NCI-H446/NC. |
RT-PCR检测表明,多药耐药细胞NCI-H446/EP中MDR1的mRNA水平明显高于NCI-H446/NC细胞(Fig 5、6)。Western blot结果表明,ABC转运蛋白家族P-gp在NCI-H446/EP细胞高表达,与RT-PCR结果一致,而ABCG2表达没有明显升高。
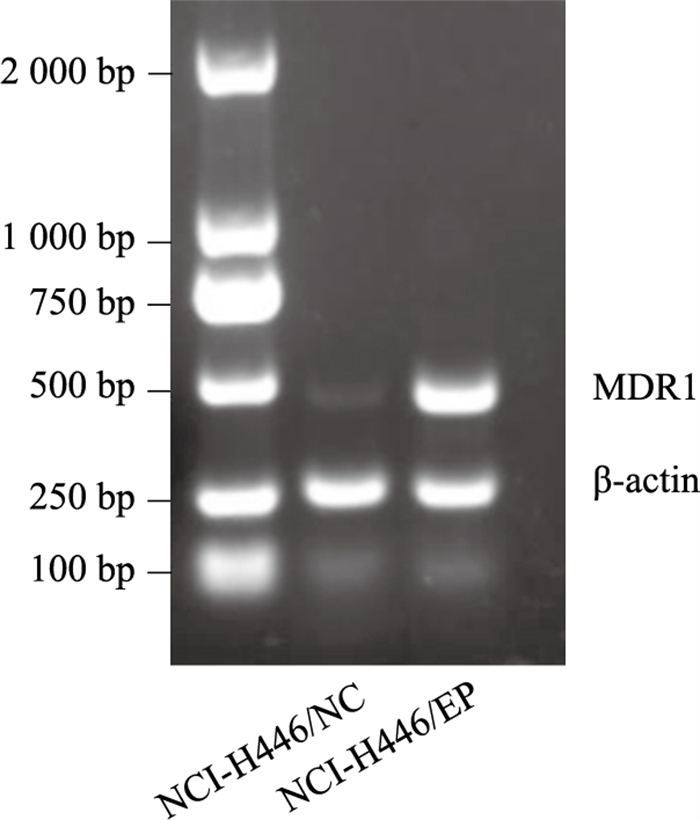
|
| Fig 5 RT-PCR analysis of NCI-H446/NC and NCI-H446/EP cells |
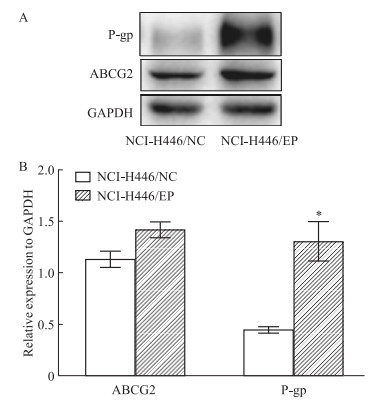
|
| Fig 6 Diffe rential expression of drug-resistant proteins and statistical analysis (x±s, n=3) *P < 0.05, NCI-H446/EP vs NCI-H446/NC. |
为评价所构建耐药细胞在动物体内是否也具有耐药性,进一步构建了NCI-H446/EP体内移植瘤模型,给予EP方案治疗。给药两周内,给药组小鼠肿瘤体积、肿瘤质量与对照组相比均无差异(P>0.05),此外,给药组小鼠体质量与对照组相比也无差异(P>0.05)(Fig 7),说明H446/EP体内移植瘤对CDDP、VP-16具有耐药性,进而验证耐药细胞构建成功。
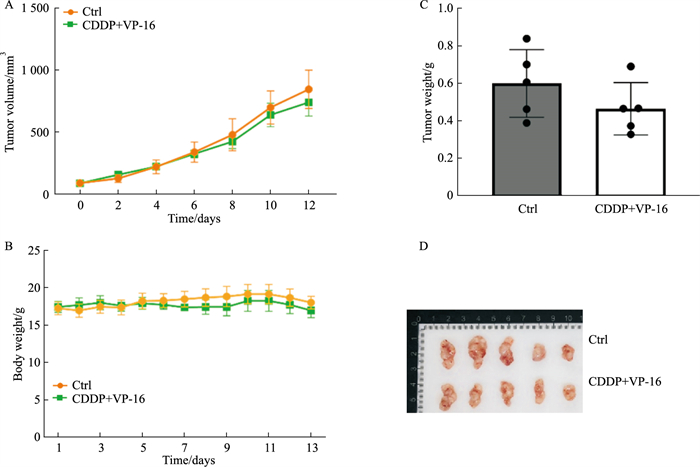
|
| Fig 7 Tumor growth kinetics of SCLC chemoresistant xenograft models in response to E/P treatment (x±s, n=5) 1:Ctrl; 2:CDDP (ip, 3 mg·kg-1, once/week) +VP-16(ip, 4 mg·kg-1, third/week); A, B: Tumor growth (A) and mice weight (B) in NCI-H446 tumor-bearing mice treated with EP; C, D: Tumor weight (C) and subcutaneous NCI-H446EP tumors from mice treated with EP. *P < 0.05, **P < 0.01, CDDP (ip, 3 mg·kg-1, once/week) +VP-16(ip, 4 mg·kg-1, third/week) vs Ctrl |
近30年来,SCLC的治疗进展缓慢,鲜有突破,面临“药荒”的尴尬局面。近年来一些靶向治疗或免疫疗法应用于SCLC[6],虽然取得了一些进展,但是SCLC的治疗选择和总体生存率在近三十年来几乎保持不变。目前认为MDR是导致SCLC对化疗产生耐药的主要原因[7-8],但是SCLC的确切耐药机制尚不明确,因此,耐药细胞模型的建立对于耐药机制及抗耐药治疗策略的研究具有重要意义。传统耐药细胞模型多采用体外大剂量反复间歇诱导联合逐级增加剂量法,但无法达到体内外百分百转化,细胞可能在动物体内无法成瘤,或者体内耐药性差,与临床用药不完全相符,不能模拟实际的体内耐药产生过程。为更真实模拟临床实际,本研究采用临床标准治疗方案给予小鼠CDDP和VP-16处理,经多次给药诱导SCLC产生耐药,再分离获得耐药细胞NCI-H446/EP。该方法获得的耐药细胞对CDDP、VP-16、SN-38、DOX均有一定的程度的耐药。将该细胞接种至裸鼠体内,所形成的的皮下移植瘤也对CDDP、VP-16产生耐药性。该细胞系与亲本细胞相比体积变大,形状扁平,多有突起,具有间充质细胞的特征,这与获得性耐药背景下诱导的谱系可塑性一致[9]。此外,所获得的NCI-H446/EP增殖速度变慢,细胞周期分布比例发生明细变化,符合具有多药耐药特征。
有研究表明,MRP1和P-gp是两种ABC外排转运蛋白,与多药耐药(MDR)密切相关[10-11]。本研究中,耐药细胞NCI-H446/EP的MDR1在mRNA和蛋白水平均明显高于亲本细胞,同时,耐药细胞P-gp表达也明显升高。其中,P-gp作为一种跨膜蛋白,导致化疗药物从癌细胞中的外排增加,化疗药物疗效降低,无法正常抑制耐药细胞生长。
总之,本研究建立了NCI-H446/EP耐药SCLC细胞系,在体内体外均具有多药耐药性,为后续深入探究SCLC耐药机制以及抗SCLC药物研发提供了实验模型。
| [1] |
黎骊, 陆国寿, 王丽, 等. 消瘤藤总香豆素通过诱导铁死亡抑制小细胞肺癌H1688细胞增殖[J]. 中国药理学通报, 2023, 39(6): 1115-21. Li L, Lu G S, Wang L, et al. Total coumarins in Pileostegia tomentella inhibits proliferation of small cell lung cancer H1688 cells by inducing ferroptosis[J]. Chin Pharmacol Bull, 2023, 39(6): 1115-21. |
| [2] |
Guo C, Wan R, He Y, et al. Therapeutic targeting of the mevalonate-geranylgeranyl diphosphate pathway with statins overcomes chemotherapy resistance in small cell lung cancer[J]. Nat Cancer, 2022, 3(5): 614-28. doi:10.1038/s43018-022-00358-1 |
| [3] |
Horita N, Yamamoto M, Sato T, et al. Topotecan for relapsed small-cell lung cancer: systematic review and meta-analysis of 1347 patients[J]. Sci Rep, 2015, 5(15437): 1-8. |
| [4] |
Chen Y T, Feng B, Chen L B. Update of research on drug resistance in small cell lung cancer chemotherapy[J]. Asian Pac J Cancer Prev, 2012, 13(8): 3577-81. doi:10.7314/APJCP.2012.13.8.3577 |
| [5] |
Stewart CA, Gay CM, Xi Y, et al. Single-cell analyses reveal increased intratumoral heterogeneity after the onset of therapy resistance in small-cell lung cancer[J]. Nat Cancer, 2020, 1: 423-36. doi:10.1038/s43018-019-0020-z |
| [6] |
Centanni M, Moes DJAR, Trocóniz I F, et al. Clinical pharmacokinetics and pharmacodynamics of immune checkpoint inhibitors[J]. Clin Pharmacokinet, 2019, 58(7): 835-57. |
| [7] |
Paz-Ares L, Dvorkin M, Chen Y, et al. Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial[J]. Lancet, 2019, 394(10212): 1929-39. doi:10.1016/S0140-6736(19)32222-6 |
| [8] |
Giovannetti E, Toffalorio F, De Pas T, et al. Pharmacogenetics of conventional chemotherapy in non-small-cell lung cancer: a changing landscape?[J]. Pharmacogenomics, 2012, 13(9): 1073-86. |
| [9] |
Brambilla E, Moro D, Gazzeri S, et al. Cytotoxic chemotherapy induces cell differentiation in small-cell lung carcinoma[J]. J Clin Oncol, 1991, 9(1): 50-61. |
| [10] |
Trock BJ, Leonessa F, Clarke R. Multidrug resistance in breast cancer: a meta-analysis of MDR1/gp170 expression and its possible functional significance[J]. J Natl Cancer Inst, 1997, 89(13): 917-31. |
| [11] |
Young L C, Campling B G, Cole S P, et al. Multidrug resistance proteins MRP3, MRP1, and MRP2 in lung cancer: correlation of protein levels with drug response and messenger RNA levels[J]. Clin Cancer Res, 2001, 7(6): 1798-804. |

