

2. 内蒙古人类遗传病研究自治区高等学校重点实验室 内蒙古 赤峰 024000;
3. 赤峰学院附属医院神经内科, 内蒙古 赤峰 024005;
4. 天津医科大学肿瘤医院、天津医科大学肿瘤研究所、国家癌症临床医学研究中心、天津市肿瘤防治重点实验室、天津市恶性肿瘤临床医学研究中心, 天津 300060
王洪权(1979-), 男, 博士,教授、副主任医师,研究方向: 神经药理学,通信作者,E-mail:whongquan@alu.fudan.edu.cn
2. Key Laboratory of Research on Human Genetic Diseases at University of Inner Mongolia Autonomous Region, Chifeng Inner Mongolia 024000, China;
3. Dept of Neurology, the Affiliated Hospital of Chifeng University, Chifeng Inner Mongolia 024005, China;
4. Tianjin Medical University Cancer Institute and Hospital, National Clinical Research Center for Cancer, Key Laboratory of Cancer Prevention and Therapy, Tianjin's Clinical Research Center for Cancer, Tianjin 300060, China
阿尔茨海默病(Alzheimer’s disease,AD) 是最常见的痴呆神经变性病,表现为记忆、认知、语言和行为障碍以及人格改变等[1]。AD的典型病理特征为老年斑(senile plaques,SPs)和神经原纤维缠结(neurofibrillary tangles,NFTs)。SPs由β-淀粉样蛋白(β-amyloid, Aβ)细胞外沉积形成,而NFTs由tau蛋白过度磷酸化在细胞内聚集引起。AD目前尚缺乏缓解疾病进展的有效治疗方法,给社会和家庭带来了沉重负担。大脑的区域性铁负荷增加和体内铁平衡失调、氧化应激、脂质氧化参与AD发病机制。铁死亡(ferroptosis)是一种新发现的铁依赖性、脂质过氧化(lipid peroxidation,LPO)驱动的调节性细胞死亡(regulated cell death,RCD),近几年研究显示铁死亡参与AD的病理过程和发病机制,引起学者的日益热切关注[2]。药物靶向抑制铁死亡可以缓解实验性AD相关的病理改变,并在AD患者中显示出潜在的临床益处。本文系统总结了铁死亡在AD发病过程中的作用机制进展,重点介绍了以药物靶向抑制铁死亡治疗AD的最新进展,为未来靶向抑制铁死亡防治AD提供有价值的信息。
1 铁死亡铁死亡是一种由细胞膜中含有磷脂的多不饱和脂肪酸(polyunsaturated-fatty-acid-containing phospholipids,PL-PUFA) 的过氧化损伤驱动的、铁依赖性的RCD方式,主要包括铁的聚集,铁依赖的活性氧(reactive oxygen species,ROS)产生和LPO 3个过程[3]。这种特殊形式的细胞死亡不会被caspase依赖性凋亡、自噬以及其他细胞死亡形式的抑制剂所阻断,而能够被铁螯合剂、亲脂性抗氧化剂以及LPO抑制剂等显著抑制。形态上铁死亡的典型特征是线粒体固缩,嵴消失,双层膜密度增加。生物化学上,细胞内谷胱甘肽(glutathione,GSH)的耗竭和谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)的失活导致细胞铁死亡。铁死亡过程中的过氧化底物是多不饱和脂肪酸磷脂(polyunsaturated fatty acid-containing phospholipids,PL-PUFA),酰基辅酶A合成酶长链家族成员4(acyl coenzyme A synthetase long-chain family member 4,ACSL4)和溶血卵磷脂酰基转移酶(lysophosphatidylcholine acyltransferase 3,LPCAT3)促进PUFA与磷脂结合,形成PL-PUFA。一旦PL-PUFA被整合到膜环境中,铁依赖性的酶和动态铁(labile iron)利用分子氧(O2)对PL-PUFA进行过氧化反应,生成PL-PUFA-OOH。能驱动铁死亡、依赖铁的酶包括脂氧合酶(lipoxygenases,ALOX)和细胞色素P450氧化还原酶(cytochrome P450 oxidoreductase,POR)[4]。以上过程导致脂质过氧化物的积累,脂质过氧化物或其次级产物(如4-HNE和MDA)直接或间接诱导细胞膜上的孔隙形成,进而启动铁死亡,最终引发细胞死亡。
目前研究显示,铁死亡的发生与以下3个因素密切相关[5-6](Fig 1):(1) 细胞内二价铁离子(Fe2+)的升高:铁在铁死亡中起着核心作用。与运输和结合铁相关的转铁蛋白受体1(transferrin receptor 1,TfR1)的增加以及铁蛋白和铁转运蛋白(transferrin,Tf)的减少均会导致Fe2+的增加从而诱发铁死亡。(2) 脂质过氧化物的过度产生:Fe2+又可以与NADPH氧化酶激活产生的过氧化氢通过芬顿反应产生脂质过氧化物的前体羟自由基。(3) LPO损伤修复机制的抑制:GPX4和胱氨酸/谷氨酸逆向转运体(system Xc-)对铁死亡过程中LPO损伤的修复具有重要的作用。system Xc-是细胞膜上的一种氨基酸转运体,由SLC7A11(又叫xCT)和SLC3A22组成,它负责细胞胱氨酸的输入和谷氨酸的输出,导致GSH的合成。xCT可将细胞外的胱氨酸转运到细胞内与谷氨酸合成GSH,进而GPX4利用产生的GSH将脂质过氧化物还原为相应的醇或水,对抗细胞的氧化应激完成LPO的修复。铁死亡激活剂erastin或RSL3可以通过抑制xCT中GPX4活性,最终导致细胞铁死亡。
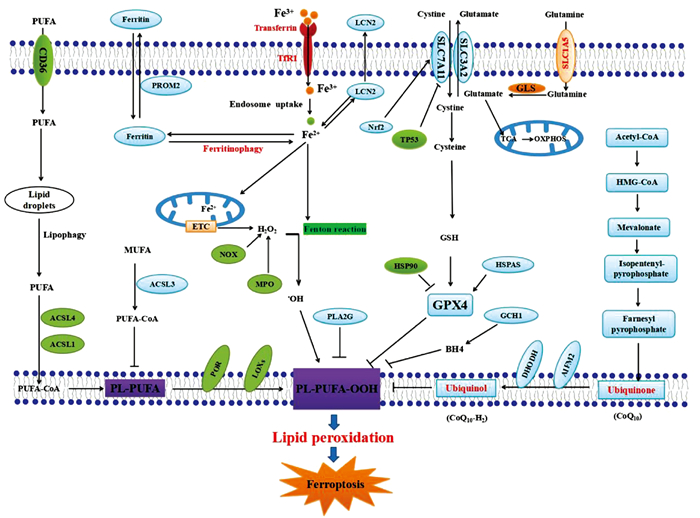
|
| Fig 1 Molecular mechanisms of ferroptosis |
在AD大脑中出现铁稳态失调、氧化还原稳态(redox homeostasis)失衡和LPO途径增强,这表明铁死亡参与AD发病机制[7]。
2.1 铁代谢稳态失衡导致AD发病机制20世纪60年代早期证实了大脑皮层铁聚集与AD存在关联。此后研究证实了游离铁、氧化应激、LPO与神经元细胞死亡之间具有直接联系性,AD患者脑内铁的含量明显增加,并与患者认知功能障碍正相关[7]。铁与AD患者脑内Aβ斑块和NFT病理相关。淀粉样蛋白前体蛋白(amyloid-β precursor protein,APP)剪切生成Aβ。在APP/PS1转基因小鼠模型,大脑皮质区Aβ斑块形成后,游离铁和铁蛋白的聚集增加[8]。铁沉积参与Aβ斑块和NFT的错误折叠过程,而tau蛋白的过度磷酸化和聚集反过来导致具有神经毒性的铁进一步聚集,从而形成恶性循环[9]。在高铁饮食的大鼠中,Aβ沉积和tau过度磷酸化增加,铁螯合剂能够有效地减弱Aβ负荷和tau的聚集[10]。而tau缺失会损害APP介导的铁输出,而铁螯合剂氯碘羟喹可以抑制这种改变,铁同时能够调控APP的表达和剪切过程,而APP可与细胞膜上的跨膜通道膜铁转运蛋白(ferroportin,FPN)结合促进铁外流[11],因此APP基因敲除后脑内铁转运蛋白下调和铁含量增加[12]。另外,脑内铁能够通过促进淀粉样蛋白生成途径功能增加,这一作用是通过促进BACE-1活性增加,进而使Aβ1-42产生增加实现的[13]。综上所述,这些研究表明,铁失调在AD中起着有害作用,靶向铁代谢途径可能是控制AD铁死亡的有效方法。
2.2 氧化还原稳态失衡参与AD发病机制氧化还原稳态维持体内氧化还原反应平衡,是维持机体生理稳态的重要组成部分。GSH是主要的细胞抗氧化剂,它是谷氨酸、半胱氨酸和甘氨酸在谷氨酸半胱氨酸连接酶(glutamate-cysteine ligase,GCL)和谷胱甘肽合成酶(glutathione synthetase,GS)催化下反应形成的一种重要的细胞内非酶抗氧化剂,它是硒蛋白GPX4的主要底物。研究表明,GSH含量的改变损害了氧化还原稳态,并与AD铁死亡的发生有关[14]。Aβ导致培养的神经元中GSH的消耗,相反给予GSH前体γ-谷氨酰半胱氨酸乙酯(γ-glutamyl-L-cysteinyl-glycine 3-ethyl ester,GCEE)可增加细胞内GSH水平,进而抑制Aβ介导神经毒性损伤,在AD发病和进展期间GSH水平降低,这些发现表明GSH内稳态的破坏参与AD发病机制[14]。除了GSH水平的改变,GSH相关的抗氧化酶谷胱甘肽S-转移酶(glutathione S-transferases,GST)在AD中也发生了改变,GST催化GSH和4-HNE之间的反应,因此恢复GSH水平是减缓AD进展的有效途径。在AD的动物模型和尸检标本中也存在GSH水平降低[15]。与正常小鼠相比,AD小鼠的GPX4水平也降低[16]。GPX4的过度表达抑制LPO,从而抑制Aβ诱导皮层神经元损伤[17]。GPX4基因敲除后会导致小鼠海马区神经元丢失,并伴有星形胶质细胞活化,这表明GPX4在神经退行性疾病中发挥神经保护作用。条件性神经元特异性GPX4基因敲除小鼠表现出认知障碍,出现海马神经元变性和铁死亡的特征,而铁死亡抑制剂liproxstatin-1(Lip-1)可以改善这些病理改变[14]。在5×FAD转基因小鼠中GPX4过表达改善学习和记忆功能,降低神经变性、LPO水平和Aβ产生[18]。综上所述,氧化还原稳态失衡参与AD发病机制。
2.3 LPO途径增强与AD决定LPO程度的PUFA丰度和定位对AD患者铁死亡的发生至关重要。由于脑内存在大量PUFA,神经元可能更容易受到ROS攻击,导致LPO发生,而后者反过来又促进产生更多ROS,形成恶性循环。在AD患者含有丰富SPs和NFT的特定脑区内膜磷脂和脂肪酸显著减少,与LPO的发生相关。LPO产物与Aβ斑块在AD患者大脑中具有共定位关系[19],Aβ导致LPO,而LPO产物促进APP剪切,从而产生更多的Aβ[20]。值得注意的是,催化PUFA脱氧的ALOX、环氧化酶(cyclooxygenases,COX)和POR这三类脂质氧化酶,在AD中发生了改变[21]。AD患者大脑中12/15脂氧合酶(12/15-LOX)的酶活性显著增加,而其蛋白水平影响模型小鼠的记忆和学习能力,而12/15-LOX抑制剂可以逆转这种AD表型[22]。包括丙二醛(malondialdehyde,MDA)、羟基壬醛(4-hydroxynonenal,4-HNE)和丙烯醛(acrolein)在内的LPO产物在AD大脑中水平明显升高[23]。氘化PUFA(D-PUFA)饮食可防止LPO产物的形成,并降低APP/PS1转基因小鼠中有毒Aβ的浓度[24]。综上所述,LPO参与AD发病机制,而LPO也是铁死亡途径中的主要调节因子,因此,抑制AD LPO的抗铁死亡治疗能够成为治疗AD的潜在靶点。
3 靶向抑制铁死亡与AD治疗研究表明,铁死亡抑制剂对实验性AD具有防治作用,靶向干预铁死亡是AD的潜在治疗靶点。具有抑制铁死亡抗AD药物总结见Tab 1。目前研究表明,靶向抑制铁死亡的化合物主要通过抑制LPO/激活GPX4、单纯抑制LPO和调控铁代谢发挥对AD的治疗作用。
| Compound | Experimental model | Mode of action | Findings |
| TSG | APP/PS1 mice | ↑GPX4;↑Nrf2;↓ LPO | ↓Oxidative stress; ↓lipid peroxidation; ↓DMT1, ACSL4 and NCOA4;↑SOD, FTH1, CD98 and xCT |
| Ginkgolide B | SAMP8 mices | ↑GPX4; ↑Nrf2;↓LPO | ↓cognitive dysfunction; ↑GPX4;↑FTH1; ↑Nrf2;↓TFR1;↓NCOA4;↑SOD and GSH; ↓MDA and ROS |
| γ-GC | APP/PS1 mice | ↑GPX4;↓ LPO | ↑Spatial memory; ↓LPO, protein carbonyls; ↑GSH and GSH/GSSG ratio; ↑GPX4;↑SOD |
| N2L | HT22 cells/RSL3 | ↑GPX4;↑Nrf2/HO-1; ↓LPO | ↓LPOand ROS; ↑GPX4;↓ACSL4 and COX2;↑FTH1; |
| Selenium (Se) | 3× Tg-AD mice | ↑GPX4 | Improved cognitive impairment and AD-related pathological symptoms in mice |
| Eriodictyol | APP/PS1 mice | ↓Iron; ↑GPX4;↓LPO | ↓ cognitive deficits;↓Aβ aggregation, phosphorylated Tau; ↑GPX4;↑Fpn1;↓FTH1;↓TfR1; |
| Eriodictyol | HT-22 cells/Aβ1-42 | ↓Iron; ↑GPX4;↓LPO | ↓Fe2+ content; ↑GPX4;↑Fpn1;↓FTH1;↓TfR1;↓ROS; ↓MDA |
| Clioquinol | ↓Iron | Clioquinol prevented Tau defificiency impaired iron export | |
| GW7647 | APP/PS1 mice | ↓Iron; ↓LPO | ↓Aβ burden; ↓cognitive defect; ↓lipid peroxidation; ↓Fe2+ content; |
| LA | P301S Tau TG mice | ↓Iron; ↑GPX4;↓LPO | ↓Iron overload, lipid peroxidation, and inflammation; ↑Fpn1; ↓TfR1; ↑GPX4;↑SOD1;↑xCT |
| OABL | 5×FAD Mice | ↓LPO | ↓impairments in cognitive function; ↓Aβ plaques, the Aβ expression, the phosphorylation of Tau protein, and the expression of BACE1 in AD mice brain;↓MDA; ↑GSH; |
| CMS121 | APPswe/PS1ΔE9- transgenic mice | ↓LPO | ↓Cognitive dysfunction; ↓4HNE; ↓15LOX2 |
| Fer-1 | Primary neurons/Aβ | ↓LPO | Fer-1/Lip-1 effectively ameliorate Aβ induced neuronal death and memory loss |
| Lip-1 | Mouse mode | ↓LPO | Fer-1/Lip-1 effectively ameliorate Aβ induced neuronal death and memory loss |
| CoQ10 | APP/PS1 mice | ↓LPO | Improved AD-Type behavioral and pathological symptoms; ↓circulating Aβ; ↓Aβ plaque formation |
| 7, 8-DHF | STZ rat | ↓LPO | ↑GSH, catalase, SOD, GPX; ↓LPO, |
| DHMDC | STZ mice | ↓LPO | ↑GSH activity; ↓LPO; ↓oxidative stress |
| Kojic acid | Aβ1-42/mice | ↓LPO | ↓Aβ and BACE-1;↑ Nrf2 and HO-1;↓LPO and ROS |
| Crocin | Aβ1-42/rat | ↓LPO | ↓LPOand ROS |
| Celecoxib | Aβ/SH-SY5Y | ↓LPO | ↓LPO and ROS; ↑ HO-1 |
| Allicin | ALCl3/rats | ↓LPO | ↓LPO and ROS; ↑ GSH |
| Centella asiatica | ALCl3/rats | ↓LPO | ↓LPO and ROS; ↑ SOD |
| Ellagic acid | ALCl3/rats | ↓LPO | ↓LPO; ↑ catalase; ↑GSH |
| Selenium | STZ rat | ↓LPO | ↓LPO; ↑ catalase; ↑GSH; ↑ SOD |
| ACSL4, long-chain acyl-CoA synthetase 4;Q10, Coenzyme Q10; DHMDC, 2', 6'-dihydroxy-4'-methoxy dihydrochalcone;DMT1, iron importer divalent metal transporter 1; FPN1, ferroportin(iron efflux transporter); FSP1, ferroptosis suppressor protein 1; FTH1, ferritin Heavy Chain 1; N2L, a novel lipoic acid-niacin dimer; OABL, 1, 6-O, O-diacetylbritannilactone; TSG, tetrahydroxy stilbene glycoside; TFR2, iron uptake transporter; γ-GC, γ-glutamylcysteine; LA, α-lipoic acid; 7, 8-DHF, 7, 8-dihydroxyflavone; Lip-1, liproxstatin-1;Fer-1, ferrostatin-1 | |||
在APP/PS1双转基因AD小鼠中,二苯乙烯苷(tetrahydroxy stilbene glycoside,TSG)可通过抑制铁死亡改善AD症状,TSG上调GPX4、SOD、FTH1、CD98和xCT,下调二价金属离子转运体(DMT1)、ACSL4和NCOA4,这表明TSG可以通过xCT/GPX4通路、ACSL4通路和铁代谢通路发挥抗LPO和铁死亡的作用[25]。在AD的SAMP8快速老化小鼠中,银杏内酯(ginkgolide B)通过上调GPX4、SOD和GSH、激活Nrf2、上调FTH1、下调TFR1和NCOA4,降低MDA和ROS生成,进而改善小鼠认知功能障碍[26]。γ-GC、新型硫辛酸烟酸二聚体N2L、北美圣草素(friodictyol)和补充硒(selenium)均能通过抑制LPO和调控GPX4通路在AD中具有保护作用(见Tab 1)。
3.2 调控铁与AD治疗AD脑内存在铁代谢异常的发现远远早于铁死亡参与AD的发病机制,早期研究显示调控脑内铁代谢异常对AD具有治疗作用。随着铁死亡概念的提出,近年来使抑制铁毒性、进而抑制铁死亡在AD中的治疗作用再次兴起。目前研究显示,降低脑内铁含量,进而抑制铁死亡在AD中具有治疗作用(见Tab 1)。这些化合物包括北美圣草素、氯碘羟喹、PPARα激动剂GW7647和α-硫辛酸,它们通过降低铁含量进而抑制铁死亡改善AD,但是它们具体机制目前仍研究不透彻,有待进一步深入研究。
3.3 抑制LPO与AD治疗AD的氧化应激学说自从1997年提出后,针对抑制氧化应激损伤治疗AD的研究如雨后春笋般出现。在AD中同时存在LPO损伤的增强,而铁死亡的特点是LPO以来的细胞死亡,因此2012年铁死亡概念提出之前的在AD中针对抑制LPO进而抑制AD发生的化合物,按照铁死亡的概念可将它们归类于通过抑制铁死亡发挥对AD的治疗作用。目前研究显示,通过抗LPO进而抑制铁死亡治疗AD的这一类化合物最为多见,近3年来通过这一机制发挥对AD治疗的化合物总结见Tab 1。目前这一类化合物发挥抗铁死亡的机制更为研究得不透彻,目前的研究仅限于对LPO产物减少方面体现对铁死亡的抑制作用,它们是否调控铁代谢通路、GPX4通路、ACSL4通路等目前均不是很清楚,值得学者深入探索,以期阐明各个化合物是否通过多通路发挥抑制铁死亡的作用机制。
4 结语综上所述,铁死亡参与AD发病机制,通过药物靶向抑制铁死亡对AD中具有治疗作用。但是目前关于铁死亡在AD中的致病作用研究尚处于初级阶段,对铁死亡的各个通路在AD中的病理机制仍有待深入研究。另外,AD相关致病蛋白对铁死亡的调控作用目前尚不清楚。在针对抑制铁死亡对AD治疗作用方面目前处于起步阶段,而且大多数研究只是通过细胞模型或动物模型简单探讨抑制铁死亡的效应观察,缺乏足够深度的机制探讨。激活Nrf2通路能够抑制铁死亡,因此,探索Nrf2通路激活剂在AD中是否通过抑制铁死亡也是未来研究方向。未来需继续深入研究铁死亡在AD中的作用机制和筛选针对抗铁死亡治疗AD的药物,以期为AD患者提供治疗新靶点。
| [1] |
谢林江, 邓婷, 徐颖, 等. 阿尔茨海默病信号通路研究进展及对策研究[J]. 中国药理学通报, 2021, 37(2): 165-70. Xie LJ, Deng T, Xu Y, et al. Research progress and Alzheimer's disease countermeasures of signaling pathways[J]. Chin Pharmacol Bull, 2021, 37(2): 165-70. doi:10.3969/j.issn.1001-1978.2021.02.004 |
| [2] |
姜懿纳, 阳松威, 张欣, 等. 铁死亡的机制及其在神经疾病中的作用[J]. 中国药理学通报, 2018, 34(2): 166-70. Jiang Y N, Yang S W, Zhang X, et al. Mechanism of ferroptosis and its role in neurological diseases[J]. Chin Pharmacol Bull, 2018, 34(2): 166-70. doi:10.3969/j.issn.1001-1978.2018.02.005 |
| [3] |
Dixon S J, Lemberg K M, Lamprecht M R, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-72. doi:10.1016/j.cell.2012.03.042 |
| [4] |
Zou Y, Li H, Graham E T, et al. Cytochrome P450 oxidoreductase contributes to phospholipid peroxidation in ferroptosis[J]. Nat Chem Biol, 2020, 16(3): 302-9. doi:10.1038/s41589-020-0472-6 |
| [5] |
Yu Y, Yan Y, Niu F, et al. Ferroptosis: a cell death connecting oxidative stress, inflammation and cardiovascular diseases[J]. Cell Death Discov, 2021, 7(1): 193. doi:10.1038/s41420-021-00579-w |
| [6] |
Zheng K, Dong Y, Yang R, et al. Regulation of ferroptosis by bioactive phytochemicals: Implications for medical nutritional therapy[J]. Pharmacol Res, 2021, 168: 105580. doi:10.1016/j.phrs.2021.105580 |
| [7] |
Ashraf A, Jeandriens J, Parkes H G, et al. Iron dyshomeostasis, lipid peroxidation and perturbed expression of cystine/glutamate antiporter in Alzheimer's disease: evidence of ferroptosis[J]. Redox Biol, 2020, 32: 101494. doi:10.1016/j.redox.2020.101494 |
| [8] |
Svobodová H, Kosná D, Balázsiová Z, et al. Elevated age-related cortical iron, ferritin and amyloid plaques in APP(swe)/PS1(deltaE9) transgenic mouse model of Alzheimer's disease[J]. Physiol Res, 2019, 68(Suppl 4): S445-51. |
| [9] |
Yan N, Zhang J. Iron metabolism, ferroptosis, and the links with Alzheimer's disease[J]. Front Neurosci, 2019, 13: 1443. |
| [10] |
Sripetchwandee J, Pipatpiboon N, Chattipakorn N, et al. Combined therapy of iron chelator and antioxidant completely restores brain dysfunction induced by iron toxicity[J]. PLoS One, 2014, 9(1): e85115. doi:10.1371/journal.pone.0085115 |
| [11] |
Tsatsanis A, Wong B X, Gunn A P, et al. Amyloidogenic processing of Alzheimer's disease β-amyloid precursor protein induces cellular iron retention[J]. Mol Psychiatry, 2020, 25(9): 1958-66. doi:10.1038/s41380-020-0762-0 |
| [12] |
Belaidi A A, Gunn A P, Wong B X, et al. Marked age-related changes in brain iron homeostasis in amyloid protein precursor knockout mice[J]. Neurotherapeutics, 2018, 15(4): 1055-62. doi:10.1007/s13311-018-0656-x |
| [13] |
Gong L, Tian X, Zhou J, et al. Iron dyshomeostasis induces binding of APP to BACE1 for amyloid pathology, and impairs APP/Fpn1 complex in microglia: implication in pathogenesis of cerebral microbleeds[J]. Cell Transplant, 2019, 28(8): 1009-17. doi:10.1177/0963689719831707 |
| [14] |
Hambright W S, Fonseca R S, Chen L, et al. Ablation of ferroptosis regulator glutathione peroxidase 4 in forebrain neurons promotes cognitive impairment and neurodegeneration[J]. Redox Biol, 2017, 12: 8-17. doi:10.1016/j.redox.2017.01.021 |
| [15] |
Aquilano K, Baldelli S, Ciriolo M R. Glutathione: new roles in redox signaling for an old antioxidant[J]. Front Pharmacol, 2014, 5: 196. |
| [16] |
Yoo M H, Gu X, Xu X M, et al. Delineating the role of glutathione peroxidase 4 in protecting cells against lipid hydroperoxide damage and in Alzheimer's disease[J]. Antioxid Redox Signal, 2010, 12(7): 819-27. doi:10.1089/ars.2009.2891 |
| [17] |
Ran Q, Gu M, van Remmen H, et al. Glutathione peroxidase 4 protects cortical neurons from oxidative injury and amyloid toxicity[J]. J Neurosci Res, 2006, 84(1): 202-8. doi:10.1002/jnr.20868 |
| [18] |
Chen L, Dar N J, Na R, et al. Enhanced defense against ferroptosis ameliorates cognitive impairment and reduces neurodegeneration in 5xFAD mice[J]. Free Radic Biol Med, 2022, 180: 1-12. doi:10.1016/j.freeradbiomed.2022.01.002 |
| [19] |
Butterfield D A, Boyd-Kimball D. Oxidative stress, amyloid-β peptide, and altered key molecular pathways in the pathogenesis and progression of Alzheimer's disease[J]. J Alzheimers Dis, 2018, 62(3): 1345-67. doi:10.3233/JAD-170543 |
| [20] |
Butterfield D A. Brain lipid peroxidation and alzheimer disease: synergy between the butterfield and mattson laboratories[J]. Ageing Res Rev, 2020, 64: 101049. doi:10.1016/j.arr.2020.101049 |
| [21] |
Wu J R, Tuo Q Z, Lei P. Ferroptosis, a recent defined form of critical cell death in neurological disorders[J]. J Mol Neurosci, 2018, 66(2): 197-206. doi:10.1007/s12031-018-1155-6 |
| [22] |
Di Meco A, Li J G, Blass B E, et al. 12/15-lipoxygenase inhibition reverses cognitive impairment, brain amyloidosis, and tau pathology by stimulating autophagy in aged triple transgenic mice[J]. Biol Psychiatry, 2017, 81(2): 92-100. doi:10.1016/j.biopsych.2016.05.023 |
| [23] |
Zhang G, Zhang Y, Shen Y, et al. The potential role of ferroptosis in Alzheimer's disease[J]. J Alzheimers Dis, 2021, 80(3): 907-25. |
| [24] |
Raefsky S M, Furman R, Milne G, et al. Deuterated polyunsaturated fatty acids reduce brain lipid peroxidation and hippocampal amyloid β-peptide levels, without discernable behavioral effects in an APP/PS1 mutant transgenic mouse model of Alzheimer's disease[J]. Neurobiol Aging, 2018, 66: 165-76. |
| [25] |
Gao Y, Li J, Wu Q, et al. Tetrahydroxy stilbene glycoside ameliorates Alzheimer's disease in APP/PS1 mice via glutathione peroxidase related ferroptosis[J]. Int Immunopharmacol, 2021, 99: 108002. doi:10.1016/j.intimp.2021.108002 |
| [26] |
Shao L, Dong C, Geng D, et al. Ginkgolide B protects against cognitive impairment in senescence-accelerated P8 mice by mitigating oxidative stress, inflammation and ferroptosis[J]. Biochem Biophys Res Commun, 2021, 572: 7-14. |

