

2. 兰州大学第二医院心胸外科,甘肃 兰州 730000
2. Dept of Cardiothoracic Surgery, the Second Hospital of Lanzhou University, Lanzhou 730000, China
蛋白质翻译后修饰通过调节蛋白质的活性、稳定性和定位来调节复杂的生物学过程。泛素化是蛋白质的一种翻译后修饰,在哺乳动物细胞中可以检测到的数万个泛素化位点说明了泛素化的普遍性。泛素化通过一系列复杂的酶的级联反应,将一个高度保守的多肽分子—泛素(ubiquitin,Ub)附加到靶蛋白上编码独特的生物信息,涉及的酶主要为E1泛素激活酶、E2泛素结合酶以及E3泛素连接酶。Parkin属于E3泛素连接酶家族,E3泛素连接酶Prkn编码Parkin蛋白,Parkin在线粒体质量控制、线粒体自噬和其他多种功能中起着重要作用[1]。线粒体除产生ATP外,还具有血红素生物和活性氧(reactive oxygen species,ROS)合成、钙稳态调节及参与调节信号转导通路等功能[2]。因此生理状态下,保持线粒体的正常功能对机体活动非常重要。值得注意的是线粒体的稳态受到线粒体动力学(包括线粒体融合与分裂)和线粒体自噬的泛素化的调节,当线粒体稳态失衡时,心肌细胞生物活动发生障碍,可导致高血压、冠心病、心力衰竭和心肌病等心血管疾病。
1 Parkin泛素化在线粒体稳态中调控的作用 1.1 Parkin泛素化与线粒体动力学线粒体通过不断地裂变和融合的循环来维持其正常的形态、分布和功能。心肌细胞中富含线粒体,为心脏正常活动提供能量保障,因此线粒体裂变和融合之间的动态平衡对维持细胞稳态尤为关键。动力相关蛋白1(dynamin-related protein 1,Drp1)是主要的裂变蛋白,Parkin靶向Drp1泛素化发生降解。敲除或突变Parkin基因,线粒体中Drp1增多,线粒体分裂过度,产生的ROS显著增加,促进细胞凋亡[3]。研究发现Drp1的缺失使线粒体增大,说明线粒体裂变功能受损可导致介导线粒体融合的三个动力蛋白相关的GTP酶失活,它们分别为外膜线粒体融合蛋白1(mitofusin1,Mfn1)和线粒体融合蛋白2(mitofusin 2,Mfn2)以及内膜视神经萎缩蛋白1(optic atrophy gene 1,OPA1)[4]。线粒体泛素化主要作用于线粒体外膜蛋白,泛素化和去泛素化调控着这些蛋白的活性,如wMITOL使线粒体Mfn2泛素化,PINK1会选择性地调节Mfn1和Mfn2以适应线粒体大小的增加,但并不调节OPA1[5]。
1.2 Parkin泛素化与线粒体自噬线粒体自噬是清除功能障碍或受损线粒体的一种选择性调节形式,是一个线粒体自我降解的过程,线粒体自噬通过溶酶体识别和降解泛素靶向标记的受损线粒体。线粒体自噬能力受损,线粒体功能发生障碍,导致有缺陷的细胞器进行性积累从而造成细胞损伤。
线粒体受损蛋白被泛素化修饰并降解,无法修复的不可逆受损线粒体可能被线粒体自噬消除。线粒体自噬降解受损细胞器主要有两条基本途径(Fig 1):(1)依赖Pink1-Parkin的线粒体自噬:当线粒体受损时,线粒体膜发生去极化,Pink1稳定在线粒体外膜(outer mitochondrial membrane,OMM)上并被激活,使Mfn2和泛素分子发生磷酸化,从而招募Parkin到受损线粒体的膜上,Pink1使Parkin发生磷酸化并与磷酸化泛素结合,激活Parkin,Mfn2是Parkin的受体,两者相互作用促进OMM上的多个线粒体相关蛋白泛素化,形成多聚泛素链,磷酸化的多泛素链与线粒体自噬接头蛋白(如p62[4]、NDP52、OPTN、NBR1、TAX1BP1)相互识别并结合,其泛素结合区域LIRs与自噬标志物LC-3连接,从而介导线粒体自噬清除受损线粒体[6]。(2)非依赖Parkin的线粒体自噬(受体介导的线粒体自噬):是由某些线粒体蛋白(如FKBP8、BNIP1、BNIP3、FUNIP3和NIX)介导的,它们通过LIRs基序直接与自噬体膜上的LC-3B相互作用,并不通过泛素化作用[7]。
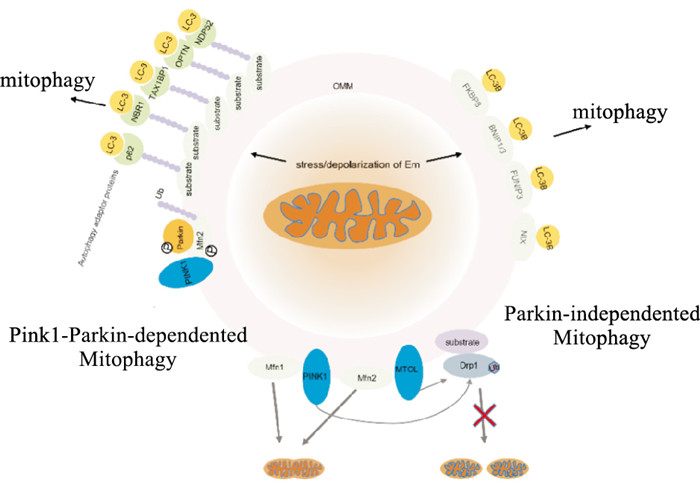
|
| Fig 1 Parkin protein regulates mitochondrial homeostasis through ubiquitination Ubiquitination of Parkin and MITOL regulates the fission protein Drp1, causing Drp1 degradation and mitochondrial fission disorder, and ubiquitination of the fusion protein Mfn1/2 to, thereby regulating mitochondrial size. Mitochondrial stress or membrane potential depolarization causes mitochondrial dysfunction, and induces mitochondrial autophagy to clear the damaged mitochondria: ①Pink1-parkin-dependent mitochondrial autophagy; ②Parkin-independent mitochondrial autophagy. |
线粒体动力学紊乱通常与线粒体自噬协同作用,在小鼠特异性敲除Drp1实验中发现线粒体自噬减少;使用BNIP3/NIX双敲除和Drp1缺失的细胞系证实了通过依赖Drp1线粒体片段化和BNIP3/NIX介导的依赖Pink1线粒体自噬清除受损线粒体[8]。以上证据说明,泛素化和线粒体自噬通路高度协调,相互补充,在应激条件下维持线粒体稳态,从而保证细胞进行正常的生理活动。
2 Parkin泛素化调节线粒体稳态在心血管疾病中的作用心脏是具有高能量需求的器官,若线粒体功能障碍或者数量减少,ATP产生水平降低,氧化应激增加,将会导致细胞功能障碍和细胞凋亡(Tab 1)。以下逐一展开分析线粒体功能障碍在各种心血管疾病中的作用机制。
| Disease | Condition | Mechanism | Parkin-mediatedmitophagy | Consequence | Ref |
| Hypertension | Astaxanthin | Drp↓,PINK,Parkin,TFAM,PGC-1α↑ | activate | Protecting vascular smooth muscle cells; alleviating hypertension | [9] |
| IGF-IIR | Mitochondrial fission and dysfunction,ROS↑ | activate | Reducing mitochondrial content; cardiomyocyte death | [10] | |
| Coronary heart disease | IL-6 | Parkin↑,Mitochondrial dysfunction | activate | Exacerbating atherosclerosis | [11] |
| WDR26 | Parkin accumulates in the mitochondrial outer membrane and promotes ubiquitination of mitochondrial outer membrane proteins | activate | Improving heart dysfunction | [12] | |
| RIPK3 | AMPK is inhibited and mPTP is opened | negative | Cardiomyocyte necrosis | [14] | |
| MitoQ | ROS↓,PINK1/Parkin↑ | activate | Increasing cell viability; decreasing cell apoptosis | [16] | |
| Apelin | Drp↑,Mfn1,Mfn2,OPA1↓ | activate | Activating p-AMPKα; promoting the proliferation of vascular smooth muscle cells; aggravating atherosclerosis | [17] | |
| Raloxifene | ROS↓,mitochondrial membrane potential changes,AIP↑,SOD↑,PINK1,Parkin,Bnip↑ | activate | Relieving inflammation; ventricular remodeling; cardiac dysfunction | [19] | |
| FOXO3a | Parkin↑ | activate | Inhibiting myocardial hypertrophy | [20] | |
| Samm50 | It interacts with Pink1 | activate | Exacerbating cardiac hypertrophy | [21] | |
| ALDH2 | PINK1,Parkin和Bcl-2↑ | activate | Inhibiting apoptosis; ameliorating heart failure | [22] |
心血管重构是高血压发病机制中的一个中心特征,它意味着细胞的功能和结构的改变并伴随着能量代谢的紊乱。细胞能量产生的改变为靶器官功能障碍或损伤提供了额外的基础。代谢底物利用改变、ROS产生增加以及线粒体动力学的紊乱与线粒体能量产生减少相关。病变细胞中线粒体动力学的变化会对细胞活力和凋亡产生影响,并介导生物能学适应。线粒体受损发生线粒体动力学融合或裂变的失衡,细胞内有害成分积累增加,诱导细胞功能障碍或死亡。
有研究报道,PINK1/Parkin途径参与细胞增殖过程,氧化应激可加重线粒体损伤,加速血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的增殖,这是高血压血管重塑的重要机制。虾青素通过降低Drp1的磷酸化来抑制线粒体分裂,通过增加PINK、Parkin、线粒体转录因子A(mitochondrial transcription factor A,TFAM)和PGC-1α的表达来增强线粒体自噬和生物合成过程,从而保护血管平滑肌细胞免受氧化应激诱导的线粒体功能障碍,减轻高血压疾病的血管重塑[9]。胰岛素样生长因子Ⅱ(insulin like growth factor Ⅱ,IGF-Ⅱ)及其受体IGF-ⅡR也在高血压期间发展成心力衰竭中起着重要作用,研究显示IGF-Ⅱ触发IGF-ⅡR受体激活,导致线粒体断裂,线粒体功能障碍,通过Parkin依赖性线粒体自噬导致线粒体含量降低,ROS增加,最终心肌细胞死亡[10]。烟酰胺腺嘌呤二核苷酸依赖性去乙酰化酶Sirtuin 3通过减轻有缺陷的线粒体自噬引起的线粒体功能障碍来促进血管生成,改善心肌纤维化[10]。高血压导致的心肌肥厚是对负荷增加的一种代偿性反应,持续的心脏压力负荷过大会导致心脏功能恶化和心力衰竭。自发性高血压大鼠的线粒体分裂蛋白Drp1减少,而融合蛋白OPA1增加,分别介导线粒体自噬和生物发生的Parkin和SIRT1/AMPK-PGC1α信号转导减少。这些研究结果表明,自发性高血压大鼠左心室线粒体功能障碍可能是线粒体动力学、自噬和生物发生受损的结果。在肺动脉高压的生理病理机制中研究发现缺氧条件可以激活PINK1/Parkin介导的线粒体自噬途径,诱导肺动脉平滑肌细胞过度增殖,导致肺血管重塑和肺动脉高压。
2.2 Parkin泛素化调节线粒体稳态在冠心病中的作用冠心病主要由于冠状动脉发生动脉粥样硬化,血管狭窄或堵塞,导致心肌缺血缺氧或坏死而引起的心脏病。众所周知,年龄是动脉粥样硬化发生发展的独立危险因素,有研究报道,在高脂饮食的老龄小鼠中观察到,在主动脉老化中,可通过增加白细胞介素-6(interleukin-6,IL-6)导致线粒体功能发生障碍,加重主动脉粥样硬化,同时Parkin水平增加,线粒体自噬也增加,对主动脉病变起代偿作用[11]。Parkin通过调节线粒体自噬,起到保护心肌细胞作用。缺乏Parkin基因的小鼠线粒体网紊乱,线粒体明显变小,对心肌梗死更加敏感,表现在Parkin-/-小鼠线粒体自噬障碍,受损线粒体累积,心肌梗死面积增加,小鼠死亡率增高。在细胞水平,Parkin基因在离体的心肌细胞中过度表达显著减少缺氧导致的细胞死亡现象。另外,在缺氧的H9C2细胞中发现WDR26通过促进Parkin聚集在线粒体从而增加线粒体外膜蛋白泛素化,调节线粒体自噬,小鼠心脏缺血后引起WDR26升高,对心脏起保护作用[12]。
对小鼠造模心肌梗死后给予胰高血糖素样肽-1受体激动剂DMB观察到小鼠左心室重塑和心功能下降得到显著改善,这是由于DMB增强了Parkin介导的线粒体自噬[13]。受体相互作用蛋白3 (receptor-interacting protein 3,RIPK3)在梗死组织中高表达,RIPK3表达的升高抑制了腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)AMPK通路和Parkin介导的自噬,线粒体通透性过渡孔开放增加,最终导致心肌细胞坏死[14]。由此可见心肌梗死后增强Parkin相关的线粒体自噬和线粒体生物发生是缓解心脏不良重塑的一个潜在可行性靶点。ROS可诱导内皮细胞凋亡[15],线粒体靶向抗氧化剂MitoQ可通过减少心肌细胞凋亡和ROS产生、增加细胞活力、线粒体膜电位水平和PINK1/Parkin表达来证明通过上调线粒体自噬对缺血/再灌注损伤具有保护作用[16]。
VSMCs的异常增殖是动脉粥样硬化发病机制的关键因素之一。线粒体自噬通过诱导人类VSMCs凋亡,对抗动脉粥样硬化形成,是一种保护机制。因此线粒体自噬是动脉粥样硬化斑块的潜在靶点。Apelin是G蛋白偶联受体APJ的内源性配体,APJ是一种与血管紧张素Ⅱ 1型受体非常相似的受体,Apelin-13不仅增加了Drp1的表达,还减少了Mfn1、Mfn2和OPA1的表达,Apelin-13通过PINK1/Parkin介导的线粒体自噬激活p-AMPKα,进而促进人主动脉VSMCs增殖,并加剧动脉粥样硬化病变的进展[17]。
2.3 Parkin泛素化调节线粒体稳态在心力衰竭中的作用心力衰竭时心脏不能充分泵出足够的血液来满足机体对营养和氧气的需求,因此,能量代谢的改变是心脏衰竭的特征。线粒体功能障碍,ATP产生减少,加速ROS的产生和细胞色素c的释放,促进心肌细胞损伤和死亡。另外心衰患者会发生线粒体解偶联,这种解偶联可能会减少ROS的产生,对心脏起保护作用。双特异性酪氨酸调节激酶1B(dual specificity tyrosine phosphorylation regulated kinase 1B,DYRK1B)通过损害线粒体生物能,导致线粒体功能发生障碍,促进心肌肥厚和心力衰竭的发生发展[18]。
当细胞能量代谢发生变化时,AMPK能够通过PINK1磷酸化激活PINK1/Parkin介导的线粒体自噬,进而延缓心力衰竭的发展。在TAC诱导或AngⅡ诱导的小鼠心脏重塑过程中发现PINK1和Parkin均下调,抑制线粒体泛素化,加剧心功能障碍。而一些中药活性成分如黄连素、人参皂苷Rg1等通过上调Parkin蛋白表达,增强线粒体自噬,抑制心肌肥厚和心室重塑,改善心功能。沉默信息调节2同源物1 (silent information regulator 2 homolog 1,SIRT1) 在心肌细胞中较多,SIRT1促进线粒体自噬,有助于改善线粒体功能障碍,因此,SIRT1可能是治疗心力衰竭的靶点。持续刺激IL-6会导致ROS增加,线粒体膜电位改变,细胞内产生ATP减少,超氧化物歧化酶SOD活性降低,同时线粒体自噬相关蛋白PINK1、Parkin和Bnip蛋白表达增加,而雷洛昔芬会抑制IL-6,进而使IL-6介导的效应消失,缓解炎症作用、心脏重塑以及心功能障碍[19]。叉头转录因子家族成员叉头盒O3a (forkhead box O3a,FOXO3a)蛋白通过转录激活Parkin蛋白进而促进线粒体自噬作用,抑制心肌肥厚[20]。Samm50是线粒体外膜蛋白,在心肌肥大模型中直接与PINK1相互作用,通过抑制线粒体自噬发生促进心肌肥大[21]。醛脱氢酶2(aldehyde dehydrogenase 2,ALDH2)可通过激活PINK1/Parkin信号通路抑制心肌细胞凋亡,有利于心力衰竭的恢复[22]。应激诱导蛋白IGF-ⅡRα引起内质网应激,当内质网发生应激,大量钙离子释放,线粒体摄取过量钙离子,而线粒体的钙超载是已知的导致细胞凋亡的重要因素;同时IGF-ⅡRα导致Parkin蛋白显著降低,促进细胞凋亡,心肌细胞损伤,加剧心力衰竭发生[23]。
2.4 Parkin泛素化调节线粒体稳态在心肌病中的作用心肌病是由不同病因引起心脏机械和电活动异常的一组异质性疾病,严重心肌病会引起心血管性死亡或进展性心力衰竭,是年轻人心脏性猝死的主要病因。其中,扩张型心肌病(dilated cardiomyopathy,DCM)常容易导致心力衰竭,而肌联蛋白截断变异(titin-truncating variants,TTNtv)是导致DCM最常见的遗传因素。在TTNtv性心脏中发现线粒体功能障碍,主要表现为心肌细胞耗氧率降低、ROS水平升高和线粒体蛋白泛素化[24]。线粒体通过产生ATP维持心肌细胞的能量需求,而线粒体功能障碍与线粒体形态改变将导致受损线粒体积累,进而可通过促进氧化应激、钙稳态失调、代谢重编程、细胞内信号异常和心肌细胞线粒体凋亡来诱导或加重糖尿病心肌病(diabetic cardiomyopathy,DC)。动物实验与细胞实验均证明,Mfn1与Mfn2是Parkin泛素化的底物,在DC中,Parkin使Mfn1泛素化并降解Mfn1,从而抑制线粒体融合。Parkin缺失加重了糖尿病介导的心肌损害,反之,Parkin过表达则对心肌细胞具有保护作用。
引起糖尿病心肌病的主要病理机制之一是血管内皮细胞(endothelial cells,ECs)功能障碍,有研究表明,ROS对去泛素化酶起负调控作用,线粒体功能障碍产生ROS增多,导致线粒体功能障碍相关蛋白质泛素化减少,阻止蛋白质降解。在2型糖尿病小鼠冠状动脉ECs内观察到增强抗氧化酶SOD2蛋白的泛素化使冠状动脉ECs中线粒体ROS浓度增加,同时冠状动脉血管松弛度减弱[25]。另外有研究报道泛素特异性蛋白酶USP12 (ubiquitin-specific protease 12)属于去泛素化酶,作用于促凋亡蛋白Bax的K63位点连接的多聚泛素链,但是USP12对Bax的介导作用还未可知,需要进一步探索。
线粒体作为细胞主要的供能场所,线粒体稳态对于维持心肌细胞正常功能和心脏正常收缩与舒张至关重要。线粒体稳态主要受到线粒体动力学(包括线粒体融合与分裂)、线粒体自噬、线粒体生物合成以及线粒体DNA的调节。而泛素化参与线粒体动力学、线粒体自噬的调节,若线粒体稳态失衡,导致心肌细胞死亡和心肌肥厚,引起心室重构,将诱发一系列心血管疾病。
3 结语与展望线粒体是细胞的一个完整的组成部分,它们的作用无疑与细胞活动有关。而线粒体稳态失衡是导致心肌细胞死亡和心肌肥厚的关键病理环节,其中泛素化调节线粒体形态改变以及线粒体自噬对心肌细胞的数量和质量至关重要。因此,需要对线粒体稳态调控机制深入研究,进一步探索更有效的潜在特异性靶向线粒体失衡的治疗策略,从而为心血管疾病提供有效的预防和治疗措施。
| [1] |
Patel J, Panicker N, Dawson V L, et al. Cell biology of parkin: clues to the development of new therapeutics for Parkinson's disease[J]. CNS Drugs, 2022, 36(12): 1249-67. doi:10.1007/s40263-022-00973-7 |
| [2] |
Wu S, Zhao X, Wu M, et al. Low expression of mitofusin 1 gene leads to mitochondrial dysfunction and embryonic genome activation failure in ovine-bovine inter-species cloned embryos[J]. Int J Mol Sci, 2022, 23(17): 10145. doi:10.3390/ijms231710145 |
| [3] |
Qi Z, Huang Z, Xie F, et al. Dynamin-related protein 1:a critical protein in the pathogenesis of neural system dysfunctions and neurodegenerative diseases[J]. J Cell Physiol, 2019, 234(7): 10032-46. doi:10.1002/jcp.27866 |
| [4] |
Yamada T, Dawson T M, Yanagawa T, et al. SQSTM1/p62 promotes mitochondrial ubiquitination independently of PINK1 and PRKN/parkin in mitophagy[J]. Autophagy, 2019, 15(11): 2012-8. doi:10.1080/15548627.2019.1643185 |
| [5] |
Nagashima S, Tokuyama T, Yonashiro R, et al. Roles of mitochondrial ubiquitin ligase MITOL/MARCH5 in mitochondrial dynamics and diseases[J]. J Biochem, 2014, 155(5): 273-9. doi:10.1093/jb/mvu016 |
| [6] |
Ordureau A, Paulo J A, Zhang J, et al. Global landscape and dynamics of parkin and usp30-dependent ubiquitylomes in ineurons during mitophagic signaling[J]. Mol Cell, 2020, 77(5): 1124-42. doi:10.1016/j.molcel.2019.11.013 |
| [7] |
Lazarou M, Sliter D A, Kane L A, et al. The ubiquitin kinase PINK1 recruits autophagy receptors to induce mitophagy[J]. Nature, 2015, 524(7565): 309-14. doi:10.1038/nature14893 |
| [8] |
Sulkshane P, Ram J, Thakur A, et al. Ubiquitination and receptor-mediated mitophagy converge to eliminate oxidation-damaged mitochondria during hypoxia[J]. Redox Biol, 2021, 45: 102047. doi:10.1016/j.redox.2021.102047 |
| [9] |
Huang C Y, Kuo W W, Ho T J, et al. Rab9-dependent autophagy is required for the IGF-ⅡR triggering mitophagy to eliminate damaged mitochondria[J]. J Cell Physiol, 2018, 233(9): 7080-91. doi:10.1002/jcp.26346 |
| [10] |
Wei T, Huang G, Gao J, et al. Sirtuin 3 deficiency accelerates hypertensive cardiac remodeling by impairing angiogenesis[J]. J Am Heart Assoc, 2017, 6(8): e006114. doi:10.1161/JAHA.117.006114 |
| [11] |
Tyrrell D J, Blin M G, Song J, et al. Age-associated mitochondrial dysfunction accelerates atherogenesis[J]. Circ Res, 2020, 126(3): 298-314. doi:10.1161/CIRCRESAHA.119.315644 |
| [12] |
Turkieh A, El Masri Y, Pinet F, et al. Mitophagy regulation following myocardial infarction[J]. Cells, 2022, 11(2): 199. doi:10.3390/cells11020199 |
| [13] |
Germano J F, Huang C, Sin J, et al. Intermittent use of a short-course glucagon-like peptide-1 receptor agonist therapy limits adverse cardiac remodeling via parkin-dependent mitochondrial turnover[J]. Sci Rep, 2020, 10(1): 8284. doi:10.1038/s41598-020-64924-2 |
| [14] |
Zhu P, Wan K, Yin M, et al. RIPK3 induces cardiomyocyte necroptosis via inhibition of ampk-parkin-mitophagy in cardiac remodelling after myocardial infarction[J]. Oxid Med Cell Longev, 2021, 2021: 6635955. |
| [15] |
许文虎, 金春子, 王晓龙, 等. 线粒体凋亡通路在棕榈酸诱导的血管内皮细胞凋亡中的作用[J]. 中国药理学通报, 2019, 35(2): 224-8. Xu W H, Jin C Z, Wang X L, et al. The role of mitochondrial apoptosis pathway in vascular endothelial cell apoptosis induced by palmitic acid[J]. Chin Pharmacol Bull, 2019, 35(2): 224-8. doi:10.3969/j.issn.1001-1978.2019.02.016 |
| [16] |
Ji Y, Leng Y, Lei S, et al. The mitochondria-targeted antioxidant MitoQ ameliorates myocardial ischemia-reperfusion injury by enhancing PINK1/Parkin-mediated mitophagy in type 2 diabetic rats[J]. Cell Stress Chaperones, 2022, 27(4): 353-67. doi:10.1007/s12192-022-01273-1 |
| [17] |
He L, Zhou Q, Huang Z, et al. PINK1/Parkin-mediated mitophagy promotes apelin-13-induced vascular smooth muscle cell proliferation by AMPKα and exacerbates atherosclerotic lesions[J]. J Cell Physiol, 2019, 234(6): 8668-82. doi:10.1002/jcp.27527 |
| [18] |
Zhuang L, Jia K, Chen C, et al. DYRK1B-STAT3 drives cardiac hypertrophy and heart failure by impairing mitochondrial bioenergetics[J]. Circulation, 2022, 145(11): 829-46. doi:10.1161/CIRCULATIONAHA.121.055727 |
| [19] |
Huo S, Shi W, Ma H, et al. Alleviation of inflammation and oxidative stress in pressure overload-induced cardiac remodeling and heart failure via il-6/stat3 inhibition by raloxifene[J]. Oxid Med Cell Longev, 2021, 2021: 6699054. |
| [20] |
Sun T, Han Y, Li J L, et al. FOXO3a-dependent PARKIN negatively regulates cardiac hypertrophy by restoring mitophagy[J]. Cell Biosci, 2022, 12(1): 204. doi:10.1186/s13578-022-00935-y |
| [21] |
Xu R, Kang L, Wei S, et al. Samm50 promotes hypertrophy by regulating pink1-dependent mitophagy signaling in neonatal cardiomyocytes[J]. Front Cardiovasc Med, 2021, 8: 748156. doi:10.3389/fcvm.2021.748156 |
| [22] |
Abudureyimu M, Zhao L, Luo X, et al. Influences of ALDH2 on cardiomyocyte apoptosis in heart failure rats through regulating pink1-parkin signaling pathway-mediated mitophagy[J]. Cell Mol Biol (Noisy-le-grand), 2022, 68(2): 94-102. doi:10.14715/cmb/2022.68.2.14 |
| [23] |
Pandey S, Kuo C H, Chen W S, et al. Perturbed ER homeostasis by IGF-ⅡRα promotes cardiac damage under stresses[J]. Mol Cell Biochem, 2022, 477(1): 143-52. doi:10.1007/s11010-021-04261-8 |
| [24] |
Zhou J, Ng B, Ko N S J, et al. Titin truncations lead to impaired cardiomyocyte autophagy and mitochondrial function in vivo[J]. Hum Mol Genet, 2019, 28(12): 1971-81. |
| [25] |
Cho Y E, Basu A, Dai A, et al. Coronary endothelial dysfunction and mitochondrial reactive oxygen species in type 2 diabetic mice[J]. Am J Physiol Cell Physiol, 2013, 305(10): C1033-40. |

