

类风湿关节炎(rheumatoid arthritis,RA)是一种自身免疫性疾病,以持续的炎症和关节损伤为特征[1]。主要的病理变化是滑膜细胞的增生和骨的破坏;对软骨、骨和其他邻近组织的损害往往是不可逆的,并且在疾病的后期阶段会造成残疾[2]。引起RA的原因很复杂,包括遗传因素、吸烟、微生物感染、激素、寒冷刺激和饮食等[3]。炎性细胞因子在RA的免疫病理中起着重要作用,如白细胞介素6(IL-6)、白细胞介素1β(IL-1β)和肿瘤坏死因子-α(TNF-α)等水平升高,可诱导炎症细胞浸润和滑膜细胞增生。目前没有药物可完全治愈RA,临床上常用的药物有非甾体类抗炎药(NSAIDs)和糖皮质激素(GCs)类等。但这些药物的生物利用度低,频繁、长期使用会导致一些副作用,包括免疫缺陷和体液紊乱[4]。近年来,中草药已被广泛用于替代抗炎药物,研究表明用中药治疗RA的疗效更好,副作用更少[5]。
雷公藤在中医上广泛用于治疗RA,在《中华本草》中描述称“祛风除湿,消肿止痛,活血通络,清热解毒”[6]。半萜类、二萜类化学成分是雷公藤所含的主要成分,这些药效对肝脏、肾脏、心脏、生殖系统、血液系统等都存在很大的毒副作用,这使得雷公藤及其制剂在治疗RA过程中有一定限制[7]。雷公藤多苷(tripterygium glycosides,TG)是从雷公藤根部提取的有效成分,中国最早研究和使用的抗炎和免疫调节中药之一,被称为“中国首创植物新药”,不仅保留了雷公藤的免疫抑制作用,而且还消除了其许多有毒成分,没有其他中药可以替代它在RA治疗中的主要作用[8-9]。但研究发现随着日用剂量加大、用药时间延长,使用雷公藤多苷治疗RA毒副作用的发生风险也会随之增加,对肝、肾会造成一定程度的损伤[10]。因此,我们需要探索一种有效、安全的药物载体来提高雷公藤多苷的药理性能。
目前多从药物炮制、中药配伍、剂量改变、剂型修饰和常规检测与预防等方面进行探索,来提高药物应用的安全性。纳米制剂被广泛用于新剂型研发中,具有明显的优势,如增强生物相容性和靶向性,增强生物分布和优化对靶器官的治疗效果,提高药物疗效和减轻相关器官的毒副作用[11]。为了降低TG的毒性、在抗RA中更好发挥其免疫抗炎等作用,本研究通过将其制成雷公藤多苷纳米粒,建立胶原诱导型(collagen-induced arthritis,CIA)动物模型,研究其对RA的治疗作用。
1 材料 1.1 实验动物♂SD大鼠,6~8周龄,体质量(180±20)g,购自北京华阜康有限公司,许可证号为SCXK(京)2019-0008。购回后在河南中医药大学动物中心SPF级条件下饲养。符合动物伦理委员会的认可。
1.2 药品与试剂聚乙二醇6k-腙键-甲氧聚己内酯2k(PCL6k-HYD-MPEG2k)(西安齐岳生物科技有限公司,批号:QM02202103),雷公藤多苷片(上海复旦复华药业有限公司,国家准字Z31020415),雷公藤多苷(西安昊轩生物科技有限公司,LGTHS20180722,纯度99%),雷公藤多苷纳米颗粒(实验室制备)。ELISA试剂盒TNF-α、IL-6和IL-1β(欣博盛生物科技股份有限公司,批号:R220617-102b、R220617-003b、R220617-007b),牛Ⅱ型胶原、完全弗氏佐剂(美国Chondrex公司,批号:210532、210574)。天门冬氨酸氨基转移酶(AST)试剂盒,尿素氮(BUN)试剂盒、丙氨酸氨基转移酶(ALT)试剂盒和肌酐(CRE)试剂盒(南京建成生物工程所,批号分别为:20220518、20220629、20220519、20220521)。
1.3 主要仪器酶标仪(美国Thermo Fisher Scientific公司,型号:1510-02820C)、粒径分析仪(Brookhaven Instruments,型号:250144),电子天平(梅特勒-托仪多仪器上海有限公司,型号:AL204)、透射电子显微镜[型号:JEM-1230(HC)]。
2 方法 2.1 TG-NPs的制备方法和质量控制称取雷公藤多苷6 mg、PCL6k-HYD-MPEG2k 30 mg分别加入适量丙酮溶解后混合。然后放置于烧瓶中,40 ℃条件下旋转蒸发直至底部出现均匀薄膜。转移至真空干燥箱20 ℃条件下放置12 h,除去丙酮。加入3 mL蒸馏水,800 r·min-1磁力搅拌2 h促进薄膜水合,250 W下超声处理5 min,促进纳米粒分散,然后过0.22 μm微孔滤膜,即得雷公藤多苷纳米粒(TG-NPs)。用透射电镜观察纳米粒的形态,动态光散射法检测纳米粒的粒径,高效液相色谱法(HPLC)测定纳米粒中的药物含量,测定包封率和纳米粒性质的稳定性,用于后续实验。
2.2 CIA模型的建立及分组给药在冰浴条件下将完全弗氏佐剂与牛Ⅱ型胶原1 ∶ 1充分乳化。在大鼠的脚趾、尾部、背部3个部位经皮注射混合乳剂,每只0.3 mL[12]。14 d后重复上述步骤。二次免疫后7 d,免疫组大鼠的脚趾肿胀、关节炎症指标均明显升高,提示CIA模型建立成功。再随机将其分为3组,即CIA模型组(Model)、雷公藤多苷组(TG)及雷公藤多苷纳米粒组(TG-NPs)。TG组每天灌胃6.25 mg·kg-1的雷公藤多苷片[13],TG-NPs组尾静脉注射6.25 mg·kg-1的雷公藤多苷纳米粒,给药周期为2天1次,给药的第1天记为d 0,正常组、模型组给予等量的生理盐水,持续20 d。
2.3 一般情况监测从第2次免疫后的第7天开始,每2 d对各组大鼠的进食、精神与活动等进行监测和记录,并检测各给药组对CIA大鼠体质量的影响。
2.4 大鼠足趾肿胀度与关节炎指数的测定免疫后第7天开始,每隔1天用游标卡尺测量各组大鼠双脚的肿胀情况,进行评分并计算大鼠的关节炎指数(arthritis index,AI),AI由所有关节炎指数之和构成,最高分值为16分。0分:足趾正常,无关节红肿;1分:足小趾关节红肿;2分:趾关节、足趾的关节红肿;3分:踝关节严重红肿,或踝以下足爪红肿;4分:踝关节和所有足趾肿胀,关节严重变形。
2.5 脏器指数的测定将大鼠处死后,取出其心脏、肝、肾、脾和睾丸等组织,用电子天平称重各脏器的质量。脏器指数=脏器质量(g)/大鼠体质量(g)×100%。
2.6 大鼠脏器组织的病理形态学观察组织在多聚甲醛中固定24 h,用常规方法制备石蜡切片(厚度为3 μm)后,用苏木精-伊红(HE)染色,在显微镜下观察组织的形态学变化。
2.7 大鼠膝关节与踝关节滑膜组织病理形态学观察用药20 d后,进行麻醉,腹主动脉采血,将血标本静置后以3 000 r·min-1离心10 min,取上层血清保存。之后取大鼠左后肢的膝关节和踝关节,用4%多聚甲醛溶液固定,切片并行HE与TUNEL染色,观察病理变化。
2.8 大鼠血清中ALT、AST、BUN、CRE及TNF-α、IL-1β、IL-6含量的测定ALT、AST用微板法检测,BUN用比色法,CRE用肌氨酸氧化酶法。TNF-α、IL-1β、IL-6的水平按照ELISA试剂盒的说明书,每项指标检测均严格按照各自试剂盒的说明进行,均用酶标仪检测。
2.9 统计学分析使用SPSS软件和GraphPad进行统计和数据分析。所有数据以x±s表示,单因素方差分析用于比较组间差异。
3 结果 3.1 TG-NPs的制备及质量评价 3.1.1 TG-NPs的形态及平均粒径在电镜下观察到纳米粒分布均匀,呈球形,有典型的环状结构。动态光散射法测定TG-NPs的粒径为(111.81±1.54) nm,(n=3)。PDI为0.157±0.009,表面带负电荷,Zeta电位为(-20.85±2.74) mV,见Fig 1。
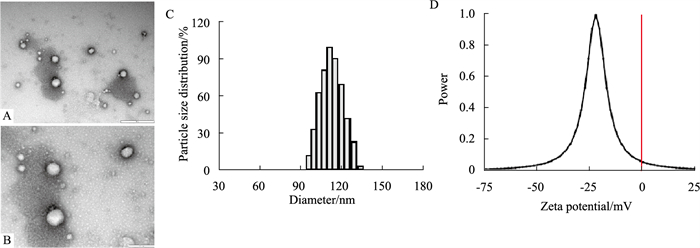
|
| Fig 1 Morphology, size distribution and potential distribution of nanoparticles under transmission electron microscopy(x±s, n=3) A: ×20 000; B: ×50 000; C: Particle size distribution; D: Potential distribution. |
使用高效液相法(HPLC)测定纳米粒中的药物含量,以TP为标准(加标),在1~100 mg·L-1浓度下,TP有良好的线性关系y=18 744x-1 128.7 (r=0.999 9)。将TG-NPs超滤前总浓度及超滤后上层及下层液体浓度代入公式计算,得包封率为(73.22±0.58)%,(n=3)。
3.1.3 TG-NPs的稳定性测定为考察TG-NPs的稳定性,将TG-NPs分别存放在4 ℃冰箱和25 ℃环境下。结果如Fig 2所示,在4 ℃条件下,纳米粒的粒径、PDI及Zeta电位都保持在一个相对稳定的状态,当纳米粒保存在25 ℃条件下,粒径及PDI变化程度较大,表明7 d内纳米粒可以在4 ℃条件下稳定存在,且直至20 d基本上无变化。为模拟体内环境,将TG-NPs分别加入PBS和DMEM培养基(含10%FBS),并置于恒温摇床中(100 r·min-1,37 ℃),于特定时间点检测粒径、PDI及Zeta电位。结果显示,在PBS中,粒径与在去离子水中相比有所增加,但还是保持在相对稳定的状态,Zeta电位均有较为明显的下降;在DMEM培养基(含10%FBS)中,纳米粒的粒径及Zeta电位在去离子水中有所下降,PDI较在去离子水中明显升高。
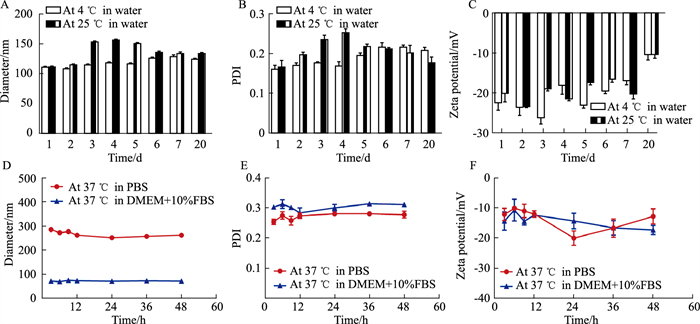
|
| Fig 2 TG-NPs size, PDI, Zeta in different environments (x±s, n=3) A, B and C were placed at 4 ℃ and 25 ℃ for 7 days, respectively. D, E and F were placed in PBS and DMEM medium containing 10% fetal bovine serum for 48 h at 37 ℃. |
免疫后,大鼠会出现乏力、尿量增多、食欲下降等症状。如Fig 3显示,与正常组相比,其余各组大鼠体质量明显降低(P < 0.01);给药治疗后,TG-NPs组大鼠体质量相较于模型组明显提高(P < 0.05)。
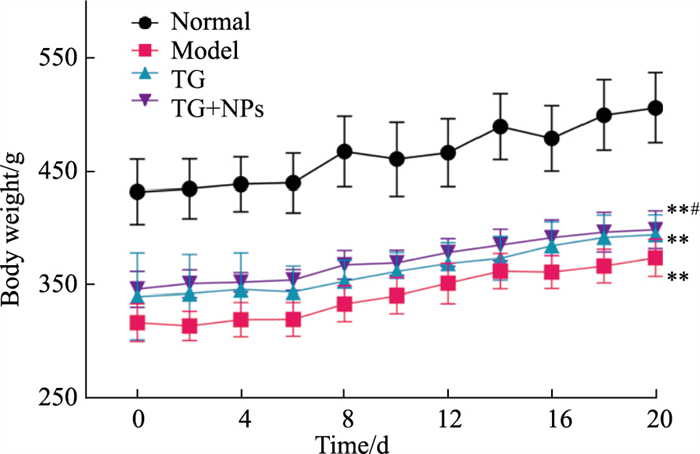
|
| Fig 3 Changes of body weight in each group (x±s, n=6) *P < 0.05, **P < 0.01 vs normal group; #P < 0.05 vs model group. |
与正常组比较,各组大鼠足趾肿胀度与关节炎指数均明显增加(P < 0.01);与模型组比较,给药组大鼠肿胀度与关节炎指数降低(P < 0.05),其中TG-NPs组疗效优于TG组(P < 0.05),如Fig 4。
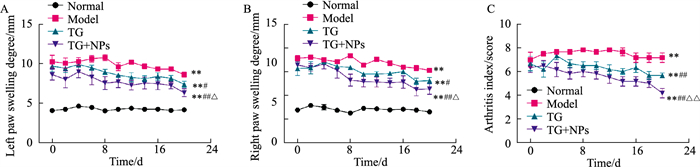
|
| Fig 4 Changes in swelling degree of left (A) and right (B) foot and scores of arthritis index (C) in each group (x±s, n=6) **P < 0.01 vs normal group; #P < 0.05, ##P < 0.01 vs model group, △P < 0.05, △△P < 0.01 vs TG group. |
与正常组相比,各组大鼠的脾、肾、睾丸指数均明显升高,差异具有统计学意义(P < 0.05,P < 0.01);各组的肝指数均降低,差异没有显著性。见Tab 1。
| Group | Cardiac index | Liver index | Spleen index | Renal index | Testicular index |
| Normal | 0.30±0.04 | 2.84±0.51 | 0.16±0.03 | 0.63±0.05 | 0.68±0.05 |
| Model | 0.36±0.02** | 2.59±0.14 | 0.24±0.05** | 0.77±0.04** | 0.94±0.09** |
| TG | 0.36±0.02** | 2.67±0.16 | 0.23±0.01** | 0.74±0.04** | 0.92±0.04** |
| TG-NPs | 0.34±0.04* | 2.72±0.20 | 0.22±0.03** | 0.73±0.04* | 0.91±0.03** |
| *P < 0.05,**P < 0.01 vs normal group. | |||||
心脏组织病理学观察结果显示:大鼠各组的心肌细胞形态正常,排列清晰,无明显差异。肝脏组织病理学观察结果显示:大鼠肝细胞正常组无肿胀变形,肝索排列整齐;模型组排列较紊乱,部分细胞稍肿胀呈空泡状,炎性细胞浸润;TG组肝细胞排列紊乱,胞质疏松呈网状,炎性细胞浸润明显;TG-NPs组肝细胞排列较整齐、炎性细胞浸润不明显,形态接近正常。脾脏组织病理学观察结果显示,正常组脾脏小体呈圆形,结构清晰;模型组白髓结构紊乱,有大量凋亡小体;TG组白髓结构稍紊乱,有部分凋亡小体;TG-NPs组较TG组明显改善,白髓损伤明显减少。肾脏组织病理学观察结果显示:正常组与模型组肾小管细胞排列紧密,肾脏肾小球结构完整,管腔清晰可见;TG组肾小球萎缩明显,间质内纤维组织弥漫性增多。与TG组相比,TG-NPs组肾组织病变明显减轻。睾丸组织病理学观察结果显示:正常组大鼠睾丸形态正常,细胞层次宽,间质细胞发育良好,管腔内丝状精子细胞排列紧密,模型组大鼠管腔内丝状精子细胞少于正常对照组。在TG的毒性作用下,大鼠曲细精管出现萎缩变形,且管腔内精子细胞数量明显少于正常组。与TG组相比,TG-NPs组大鼠的睾丸组织病变有所减轻。见Fig 5。

|
| Fig 5 Pathological micrograph of heart tissue of each group of mice stained with HE (×200) |
如Fig 6所示,正常组大鼠足趾正常,模型组大鼠足趾与踝关节肿胀明显,并伴有严重变形。TG组相比模型组肿胀较轻,变形不明显,TG-NPs组肿胀程度明显改善。从HE染色观察膝踝关节病理学变化,正常组细胞排列均匀整齐,细胞核清晰可见,着色均匀,未见滑膜增厚和血管新生;而模型组细胞排列杂乱,滑膜重度增生,部分细胞核坏死,着色不均,可见缺损和血管翳形成;TG相比于模型组,轻度增生,轻度血管新生及部分炎症细胞浸润;TG-NPs组细胞排列相对整齐,着色均匀,没有明显的增生,血管新生少,炎症细胞浸润少。提示经过治疗后,TG-NPs组对大鼠滑膜改善作用最为明显。
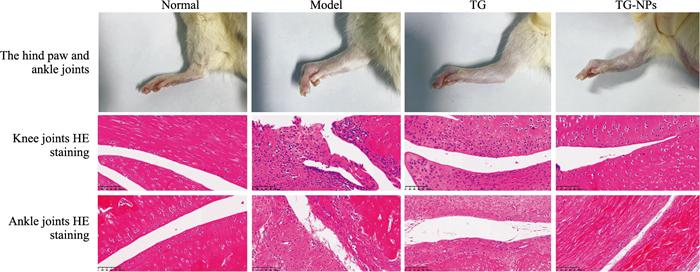
|
| Fig 6 Photographs of right hind foot and histopathological analysis of knee and ankle (HE, ×200) |
如Fig 7所示,大鼠滑膜TUNEL染色后,阳性凋亡细胞核为棕黄色。模型组的滑膜细胞有少量的凋亡,TG组相较于模型组滑膜细胞凋亡指数升高(P < 0.05),TG-NPs组相较于其他组滑膜细胞凋亡指数升高明显(P < 0.01)。
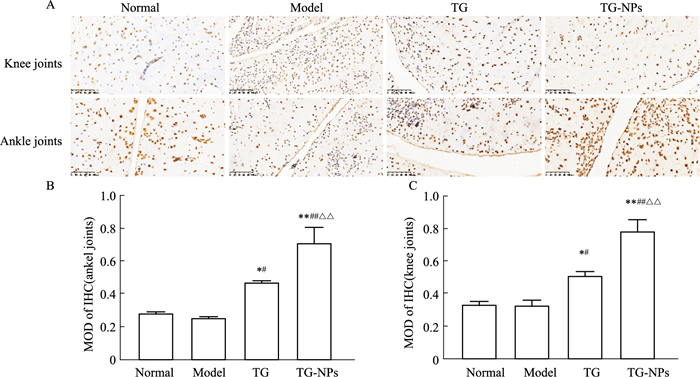
|
| Fig 7 Knee and ankle TUNEL staining (A) (×200) and quantitative analysis (B-C) (n=3) *P < 0.05, **P < 0.01 vs normal group; #P < 0.05, ##P < 0.01 vs model group; △△P < 0.01 vs TG group. |
如 Tab 2所示,与正常组相比,除BUN之外,所有模型组均有明显增加(P < 0.05),TG-NPs组大鼠中的ALT、BUN、CRE水平相较于模型组明显降低(P < 0.05),CRE水平相较于TG组下降明显(P < 0.05)。大鼠血清中的炎症因子,相比于正常组,模型组大鼠中TNF-α、IL-1β含量均明显增加(P < 0.01),TG-NPs组均明显低于模型组(P < 0.05),且效果优于TG组。见Tab 3。
| Group | AST/ U·L-1 |
ALT/ U·L-1 |
BUN/ mmol·L-1 |
CRE/ mmol·L-1 |
| Normal | 14.05±4.59 | 14.45±5.73 | 5.27±0.95 | 41.05±2.30 |
| Model | 37.26±16.06** | 21.08±5.42* | 6.19±1.19 | 52.36±10.96* |
| TG | 31.73±13.26* | 12.48±5.03## | 5.20±0.76 | 54.95±22.84 |
| TG-NPs | 27.07±14.92 | 9.61±1.30## | 4.91±0.55# | 38.25±7.36##△ |
| *P < 0.05,**P < 0.01 vs normal; #P < 0.05,##P < 0.01 vs model; △P < 0.05 vs TG. | ||||
| Group | TNF-α/ng·L-1 | IL-1β/ng·L-1 | IL-6/ng·L-1 |
| Normal | 26.31±8.05 | 26.51±3.61 | 35.79±17.27 |
| Model | 66.33±9.59** | 33.72±2.58** | 43.25±18.38 |
| TG | 53.14±7.79**# | 32.06±4.85* | 35.42±13.28 |
| TG-NPs | 42.22±8.53**##△ | 28.65±4.40# | 22.29±11.60# |
| *P < 0.05,**P < 0.01 vs normal; #P < 0.05,##P < 0.01 vs model; △P < 0.05 vs TG. | |||
RA是一种慢性全身性免疫疾病,通常表现为滑膜组织中炎症因子的过度分泌、关节软骨的侵蚀和血管翳的形成。与其他几种关节炎模型相比,大鼠胶原蛋白诱导的Ⅱ型关节炎(CIA)模型在病理学上与人类RA相似,目前普遍被作为RA的最佳模型[14]。在本研究中,通过皮下注射混合乳剂,在背部和掌垫的多个部位,建立大鼠CIA模型。与正常组相比,模拟大鼠表现为体质量减轻,尿量和食物消耗减少,脚趾关节肿胀变形,影响正常的活动,关节炎指数增加,表明CIA模型成功。
滑膜组织中炎症因子的过度产生是RA免疫病理的一个重要因素。这些因素包括TNF-α、IL-1β和IL-6。TNF-α已被证明可引起RA患者的各种T细胞功能障碍,在RA的活动期和晚期其分泌量增加,导致炎症反应增加,骨和关节破坏恶化[15]。IL-1β调节几种炎症因子的表达,促使炎症因子的协同增加。另一个重要的促炎因子IL-6作用于中性粒细胞,诱发炎症并可能导致关节破坏[16]。成纤维滑膜细胞(fibroblast-likesynoviocyte,FLS)凋亡不足在RA的发病机制中起着重要作用:当RA患者的微环境发生改变时,FLS无法凋亡,开始异常增殖,释放出大量的细胞因子,刺激滑膜细胞增殖、严重的炎症细胞浸润、血管翳形成和随后的骨和关节侵蚀[17]。
纳米粒是由天然或合成的高分子材料制成。纳米载体可以将治疗药物运送到靶点,改善生物分布、药代动力学、稳定性和可溶性,并减少药物的毒副作用。本实验通过制备TG-NPs,得到符合小鼠尾静脉的理想粒径[(111.81±1.54) nm],相较TG原药,纳米粒药物组的生化指标AST、ALT、BUN、CRE均明显下降,且有效减轻了TG对肾或肝等脏器的有害影响(Fig 5),说明TG以纳米粒作为载体后能起到明显减毒作用,明显提高TG的用药安全性。同时,TG-NPs治疗组大鼠的足趾肿胀程度和关节炎指数下降,体质量增加。TNF-α、IL-1β、IL-6的表达明显降低,其表达与大鼠的足趾肿胀、AI指数严重程度成正比,而与体质量成负比。此外,还观察到纳米粒组大鼠凋亡指数明显升高,炎性细胞浸润减少。表明本实验制备的雷公藤多苷纳米粒可能通过抑制炎症因子TNF-α、IL-1β、IL-6的表达,促进滑膜细胞凋亡,减轻CIA大鼠的炎症反应,保护软骨和关节滑膜,达到改善RA的目的。
综上所述,TG-NPs对CIA有较好的治疗作用,单独使用TG的毒副作用得到改善。这证明了所建立的纳米给药系统与其他常规药物相比,对RA具有优越的效果和较高的药物安全性,对今后的研究和开发具有参考价值。
| [1] |
Wang S, Zhou Y, Huang J, et al. Advances in experimental models of rheumatoid arthritis[J]. Eur J Immunol, 2023, 53(1): e2249962. doi:10.1002/eji.202249962 |
| [2] |
Lu Q, Xu J, Jiang H, et al. The bone-protective mechanisms of active components from TCM drugs in rheumatoid arthritis treatment[J]. Front Pharmacol, 2022, 13: 1000865. doi:10.3389/fphar.2022.1000865 |
| [3] |
Zhang S, Meng T, Tang C, et al. MicroRNA-340-5p suppressed rheumatoid arthritis synovial fibroblast proliferation and induces apoptotic cell number by targeting signal transducers and activators of transcription 3[J]. Autoimmunity, 2020, 53(6): 314-22. doi:10.1080/08916934.2020.1793134 |
| [4] |
Guo X, Ji J, Feng Z, et al. A network pharmacology approach to explore the potential targets underlying the effect of sinomenine on rheumatoid arthritis[J]. Int Immunopharmacol, 2020, 80: 106201. doi:10.1016/j.intimp.2020.106201 |
| [5] |
Li X Z, Zhang S N. Herbal compounds for rheumatoid arthritis: literatures review and cheminformatics prediction[J]. Phytother Res, 2020, 34(1): 51-66. doi:10.1002/ptr.6509 |
| [6] |
陈文娟, 吴晶金. 雷公藤毒性及中药配伍减毒研究进展[J]. 中成药, 2023, 45(2): 499-503. Chen W J, Wu J J. Research progress on toxicity of tripterygium wilfordii and attenuation of Chinese medicine compatibility[J]. Chin Tradit Pat Med, 2023, 45(2): 499-503. doi:10.3969/j.issn.1001-1528.2023.02.027 |
| [7] |
李波, 金伶佳, 吴美兰. 雷公藤临床应用、毒性及减毒增效研究进展[J]. 中华中医药杂志, 2020, 35(7): 3539-41. Li B, Jin L J, Wu M L. Toxicity of tripterygium wilfordii on clinical application, and attenuated synergistic research progress[J]. China J Tradit Chin Med Pharm, 2020, 35(7): 3539-41. |
| [8] |
李逸群, 胡瑞学, 贾可欣, 等. 雷公藤多苷(甙)片治疗类风湿关节炎的安全性系统评价[J]. 中国中药杂志, 2020, 45(4): 775-90. Li Y Q, Hu R X, Jia K X, et al. Systematic review of the safety of Tripterygium wilfordii polyglycosides tablets in the treatment of rheumatoid arthritis[J]. China J Chin Mater Med, 2020, 45(4): 775-90. |
| [9] |
李佳怡, 胡重文, 许昕玥, 等. 雷公藤多苷片抑制CIA大鼠的作用[J]. 嘉兴学院学报, 2022, 34(6): 65-73. Li J Y, Hu C W, Xu X Y, et al. Inhibition of tripterygium wilfordii polyglycoside tablets in CIA rats[J]. J Jiaxing Coll, 2022, 34(6): 65-73. |
| [10] |
杨冬梅, 刘俊. 雷公藤多苷临床应用及不良反应的研究进展[J]. 中国医院药学杂志, 2018, 38(20): 2185-90. Yang D M, Liu J. Research progress in clinical application and adverse reactions of Tripterygium wilfordii polyglycosides[J]. Chin J Hosp Pharm, 2018, 38(20): 2185-90. |
| [11] |
陈新美, 林志浙, 陈建明, 等. 雷公藤甲素及其衍生物纳米制剂研究进展[J]. 药学服务与研究, 2021, 21(6): 401-11. Chen X M, Lin Z Z, Chen J M, et al. Research progress of triptolide and its derivatives nanopreparation[J]. Pharm Care Res, 2021, 21(6): 401-11. |
| [12] |
郭睿博, 孔亮, 张璐, 等. 雷公藤甲素联合硫酸软骨素脂质体对关节炎大鼠的治疗作用[J]. 中国药理学通报, 2021, 37(7): 991-6. Guo R B, Kong L, Zhang L, et al. Effect of Triptolide combined with Chondroitin sulfate liposome on the treatment of arthritis in rats[J]. Chin Pharmacol Bull, 2021, 37(7): 991-6. |
| [13] |
朱健, 武璐璐, 张全书, 等. 枫杨乙醇提物对胶原诱导性关节炎大鼠的治疗作用及其机制研究[J]. 中国药理学通报, 2019, 35(1): 117-23. Zhu J, Wu L L, Zhang Q S, et al. Effects of ethanol extract from Maplewood on the treatment of collagen-induced arthritis in rats[J]. Chin Pharmacol Bull, 2019, 35(1): 117-23. |
| [14] |
于坤, 徐枝芳, 余楠楠, 等. 佐剂性和胶原诱导性关节炎模型比较分析[J]. 辽宁中医药大学学报, 2018, 20(1): 106-9. Yu K, Xu Z F, Yu N N, et al. Comparative analysis of adjuvant and collagen-induced arthritis models[J]. J Liaoning Univ Tradit Chin Med, 2018, 20(1): 106-9. |
| [15] |
Lai N S, Yu H C, Tung C H, et al. The role of aberrant expression of T cell miRNAs affected by TNF-α in the immunopathogenesis of rheumatoid arthritis[J]. Arthritis Res Ther, 2017, 19(1): 261. |
| [16] |
Mateen S, Zafar A, Moin S, et al. Understanding the role of cytokines in the pathogenesis of rheumatoid arthritis[J]. Clin Chim Acta, 2016, 455: 161-71. |
| [17] |
Alivernini S, Firestein G S, McInnes I B. The pathogenesis of rheumatoid arthritis[J]. Immunity, 2022, 55(12): 2255-70. |

