


2. 南昌大学第一附属医院骨科,江西 南昌 330006;
3. 江西省高安市瑞州医院,江西 宜春 336000;
4. 江西省赣州市寻乌县人民医院,江西 赣州 34100
2. Dept of Orthopedics, the First Affiliated Hospital of Nanchang University, Nanchang 330006, China;
3. Dept of Orthopedics, Ruizhou Hospital of Gaoan, Yichun Jiangxi 336000, China;
4. Dept of Orthopedics, the People's Hospital of Xunwu, Ganzhou Jiangxi 341000, China
绝经后妇女的雌激素缺乏被认为是骨质疏松的病因[1],现有观点认为,氧化应激也是参与骨质疏松发生[2]的主要因素之一,同时,雌激素的减少也会导致体内氧化应激反应的增加。许多研究者认为,绝经后骨质疏松妇女的骨质减少与超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(glutathione,GSH) 水平降低、血脂氧化水平升高有关[3]。在整个生命过程中,骨组织在不断更新,骨的形成和吸收不断进行,氧化还原状态的改变通过调节破骨细胞和成骨细胞活性之间的平衡来改变骨重塑过程[4]。ROS诱导成骨细胞凋亡,降低其活性,不利于骨形成。高水平的ROS阻断并减少成骨细胞分化,矿化和成骨减少[5]。
姜黄素是一种从姜黄科植物的根茎中提取的一种酚性色素,已被证明具有良好的抗炎和抗氧化等特性[6],其被发现能有效拮抗细胞内ROS和清除自由基[7],在氧化应激与骨形成中起着重要的作用。据报道,姜黄素可以通过减弱对Wnt/β-catenin信号的抑制来保护氧化损伤,促进成骨细胞分化[8]。线粒体氧化还原电位对细胞的影响至关重要,姜黄素不仅能降低线粒体氧化状态,还能改善线粒体膜电位,改善氧化应激诱导的成骨细胞凋亡[9]。许多体外研究表明,姜黄素逆转了氧化应激引发的破骨细胞的增殖和分化,并改善了去卵巢动物(ovariectomized,OVX) 在体内的骨丢失[10]。
关于姜黄素如何调节氧化应激和骨质疏松症的研究较少,其主要相关的信号通路也不清楚。姜黄素与骨质疏松症之间的剂量依赖性关系也需要说明。因此,本研究将利用体外H2O2诱导的氧化应激模型和体内小鼠去卵巢模型来研究姜黄素的抗氧化应激作用及其潜在机制。
1 材料与方法 1.1 材料 1.1.1 动物与细胞8周龄BALB/c雌性小鼠,体质量(20.52±1.27)g(南昌大学医学院实验动物中心),小鼠MC3T3-E1细胞(ATCC,Manassas,VA,USA)。动物实验符合3R原则,且本实验通过南昌大学医学院第一附属医院实验动物伦理委员会批准(批号:CDYFY-IACUC-202305QR002)。
1.1.2 药品与试剂姜黄素(Sigma公司,纯度98.0%,分子量368.38)、RANKL、IL-6 ELISA检测试剂盒(R&D公司,美国,货号分别为:MTR00、SM6000B)、IκB-α,p-p65,β-actin抗体(Cell Signaling Technology公司,美国,货号分别为:4814、4025、3700),小鼠NTX(I型胶原交联n-端肽)、PICP(1型前胶原羧基末端前肽)、ELISA试剂盒(伊莱瑞特公司,中国,货号分别为:E-EL-M3022、E-EL-R0740c)、BCA蛋白检测试剂盒(赛默飞公司,美国,货号:23235),GSH、MDA、BCIP/NBT碱性磷酸酶显色试剂盒(碧云天公司,中国,货号:C3206)、胎牛血清(Gibco Invitrogen,美国,货号:10099)、地塞米松、β-甘油磷酸、H2O2、N-乙酰-L-半胱氨酸(NAC)、茜素红S、甲基噻唑基四唑(MTS)、对硝基苯基磷酸(pNPP)购自Sigma公司,货号分别为:D4902、G9422、HX0636、01042、A5533、1.11714、20-106。
1.1.3 仪器全自动流式细胞仪(美国Agilent公司,型号:NovoCyte)、全自动酶标仪(美国Molecular Devices公司,型号:SpectraMax Gemini XPS),显微镜(日本OLYMPUS公司,型号:CX31)、多功能显微图象分析系统(德国Leica公司,型号:LK-5GHD)、荧光定量PCR仪(美国Thermo Fisher公司,型号:QuantStudio 1 Plus)、核酸/蛋白凝胶图象分析系统(中国上海嘉鹏科技有限公司,型号:Nano-600)等。
1.2 方法 1.2.1 细胞培养MC3T3-E1细胞培养与成骨诱导MC3T3-E1细胞按5×103细胞/cm2的密度接种于培养瓶,加入25 mL含10%胎牛血清的完全培养基,待细胞融合至80%~90%后传代。MC3T3-E1细胞融合达到80%~90%将基础培养基(BM)更换为成骨分化诱导液(OM,0.1 μmol·L-1地塞米松、50 mg·L-1维生素C和10 mmol·L-1β-甘油磷酸)每隔2~3 d更换诱导液1次。
1.2.2 造模与分组MC3T3-E1细胞种板于24孔板,每孔2.5×105个细胞,次日,待细胞完全贴壁后,分别与0、0.1、0.2、0.3、0.5、1 mmol·L-1 H2O2共培养24 h后,换成骨诱导液,分别诱导7、14、21 d。同法,细胞分别与0、1、5、10、20、50、100 μmol·L-1浓度姜黄素共培养24 h后,换成骨诱导液,诱导7、14、21 d。根据上述细胞分别被过氧化氢,姜黄素处理后成骨诱导分化的实验结果分为6组:①对照组;②H2O2组;③H2O2+姜黄素组(1 μmol·L-1);④H2O2+姜黄素组(10 μmol·L-1);⑤H2O2+姜黄素组(20 μmol·L-1);⑥ H2O2+NAC (2 mmol·L-1)。
1.2.3 细胞内ROS水平及细胞活力测定细胞种板培养后,不同浓度的H2O2(0.1、0.2、0.3、0.5、1、2 mmol·L-1) 作用于MC3T3-E1细胞24 h,然后将细胞在含20 μmol·L-1 DCFH-DA的37 ℃下培养30 min,洗涤,倒置显微镜观察荧光。消化后,上流式细胞仪在488 nm激发波长,525 nm发射波长条件下检测荧光强度。同样,在细胞中加入不同浓度的姜黄素(1、5、10、20、50、100和200 μmol·L-1溶解在蒸馏水中)作用24 h后检测细胞活力。0.1% DMSO作为对照组。细胞用姜黄素(1、5、10、20、50、100或200 μmol·L-1)全培养基培养24 h后,加入0.3 mmol·L-1H2O2培养24 h,检测细胞活力。
1.2.4 碱性磷酸酶(ALP)染色及活性测定根据试剂盒使用方法分别检测ALP活性以及ALP染色。用0.3 mmol·L-1H2O2处理MC3T3-E1细胞24 h,并加入含有不同浓度姜黄素的成骨诱导液诱导分化7 d,4%多聚甲醛固定细胞后,每孔加入BCIP/NBT染色工作液,用蒸馏水洗涤1~2次即可终止显色反应,并在405 nm处测定吸光度。
1.2.5 钙含量测定和茜素红染色根据试剂盒要求,在成骨诱导分化的第21天使用钙测定试剂盒测定钙含量。在6孔培养板中诱导后的细胞加入1 mol·L-1醋酸,在4 ℃下涡旋过夜提取钙。将50 μL提取物与150 μL钙测定试剂混合,在37 ℃下孵育30 s。用酶标仪测定575 nm处的吸光度。细胞用4%多聚甲醛固定15 min,室温下用40 mmol·L-1茜素红染色15 min,蒸馏水去除未结合染色,使用光学显微镜和数码相机对其细胞进行可视化和成像。
1.2.6 RANKL和IL-6测定暴露于H2O2 24 h后,小鼠MC3T3-E1细胞用含有3种不同浓度(1、10、20 μmol·L-1) 姜黄素的成骨分化诱导液诱导7 d,定期换液。按照试剂盒要求,收集上清液,分别检测各组上清液中的IL-6及RANKL的表达。
1.2.7 蛋白印迹试验姜黄素预处理细胞24 h,H2O2处理细胞1 h,收集细胞,加入200 μL RIPA裂解液,冰上裂解细胞30 min,将裂解后的样品4 ℃离心10 min(12 000 r·min-1),取上清。以BCA试剂盒测定蛋白浓度。加入适量的上样液,并在100 ℃×10 min条件下使蛋白变性,取20 μg样品进行电泳、转膜和封闭。按说明书分别加入抗体p-p65、p-IκBα和β-actin过夜,加入ECL显色液,避光反应1 min,显影并定影。以β-actin为内参对照,各条带灰度值采用ImageJ软件进行分析。
1.2.8 去卵巢小鼠模型及姜黄素处理采用双侧性腺(卵巢)摘除法制备氧化应激小鼠模型。假手术组小鼠只需做一长约1.5 cm背部切口后立即缝合。采用数字随机法将40只小鼠随机分为4组:①假手术组;②去卵巢组;③去卵巢+姜黄素低剂量组(5 μmol·kg-1·d-1);④去卵巢+姜黄素低剂量组(15 μmol·kg-1·d-1),第一次给药为术后1周,而后每24 h给药1次,连续8周。假手术组及去卵巢组给予等量含DMSO的生理盐水,所有给药方式均为腹腔注射。动物麻醉成功后,显露右心室,注射器彻底抽血处死,EP管收集血浆,试剂盒检测MDA、GSH、NTX、PICP。
1.2.9 采用Van Gieson (VG) 染色及显微CT扫描进行组织学检查获取各组双侧的股骨组织,标本用生理盐水冲洗后,用生理盐水浸润的纱布包裹,并用锡箔纸封存,置于-80 ℃冰箱中冻存,右侧股骨标本用作micro-CT检测骨显微结构特征后,将标本置于4%多聚甲醛溶液中固定24 h,并行脱钙处理,行VG染色,观察骨小梁结构变化。
1.2.10 统计学分析实验数据以x±s表示,两组之间的差异采用t检验。当3组或3组以上对比时采用单因素方差分析ANOVA方法或非配对t检验对数据进行统计学分析,P < 0.05为差异有统计学意义。
2 结果 2.1 细胞氧化应激模型的建立及姜黄素干预的影响体外将细胞暴露于H2O2中,建立了氧化应激细胞模型,并通过流式细胞术评估不同H2O2浓度下的氧化应激水平。在24 h内,细胞内ROS水平随着H2O2浓度的增加而升高(Fig 1A)。在浓度为0.3 mmol·L-1H2O2条件下,暴露于H2O2 24 h后,细胞活力明显下降(Fig 1B)。姜黄素20 μmol·L-1或较低浓度下培养24 h并不影响细胞活力(Fig 1C)。但是,暴露于0.3 mmol·L-1H2O2中,10 μmol·L-1或较低浓度的姜黄素预处理改善了细胞活力,而在20 μmol·L-1姜黄素中不存在这种作用(Fig 1D)。这表明姜黄素在10 μmol·L-1及以下浓度可部分抑制H2O2诱导的细胞毒性。
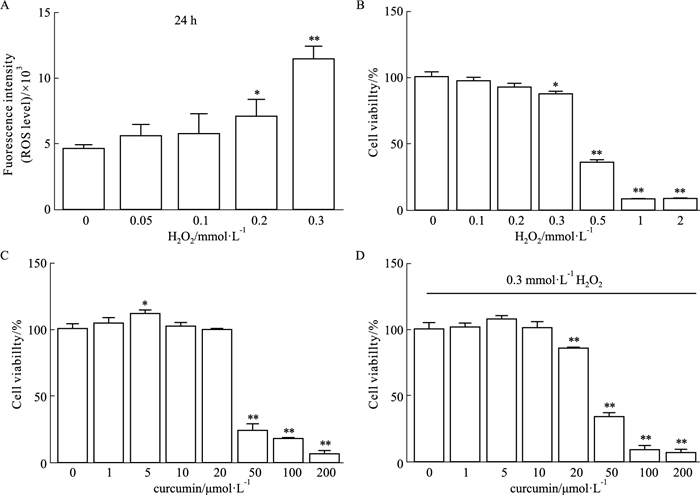
|
| Fig 1 Intracellular ROS after exposed to H2O2 and cell viability of different concentrations of H2O2 or curcumin(x±s) *P < 0.05 and **P < 0.01 vs Control group. |
在第7天检测ALP染色和活性,并在第21天评估钙水平。本实验选择了0.3 mmol·L-1H2O2,姜黄素浓度分别为1、10、20 μmol·L-1。细胞暴露于H2O2 24 h后,加入含姜黄素的成骨培养基。1、10 μmol·L-1姜黄素共培养逆转了H2O2诱导的成骨功能障碍,ALP活性和钙水平升高,而20 μmol·L-1并没有逆转功能障碍(Fig 2A-2D)。10 μmol·L-1姜黄素显著改变了H2O2诱导的钙沉积功能障碍,1 μmol·L-1处理显著逆转了ALP活性。
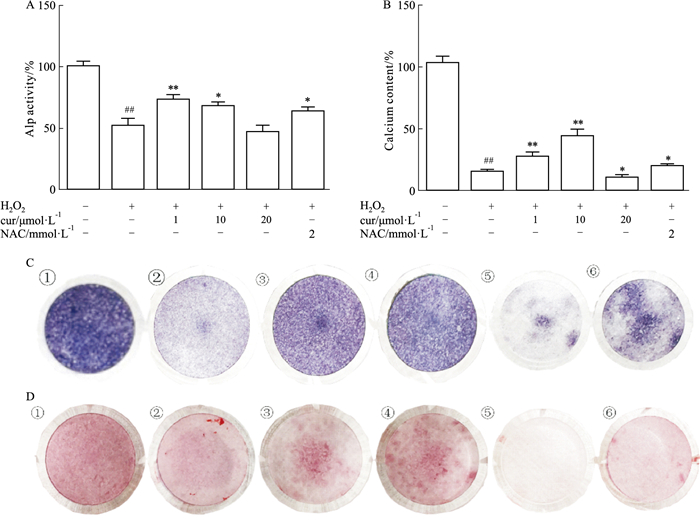
|
| Fig 2 Curcumin protected cell osteogenesis from H2O2 exposure A, B: ALP activity and the calcium content with curcumintreatment at different concentrations; C, D: ALP and Alizarin Red S staining withcurcumin treatment at different concentrations ①control; ② H2O2 ③ H2O2+cur(1 μmol·L-1); ④H2O2+cur(10 μmol·L-1); ⑤H2O2+cur (20 μmol·L-1); ⑥H2O2+NAC (2 mmol·L-1). ##P < 0.01 vs Control group; *P < 0.05 and **P < 0.01 vs H2O2group. |
IL-6和RANKL被认为是成骨细胞分泌的两种重要的细胞因子。0.3 mmol·L-1H2O2作用24 h后,IL-6和RANKL水平在成骨诱导后7 d显著升高。然而当与姜黄素共培养时,RANKL和IL-6的表达水平受到部分抑制,特别是在1 μmol·L-1和10 μmol·L-1时抑制明显(Fig 3A、3B)。
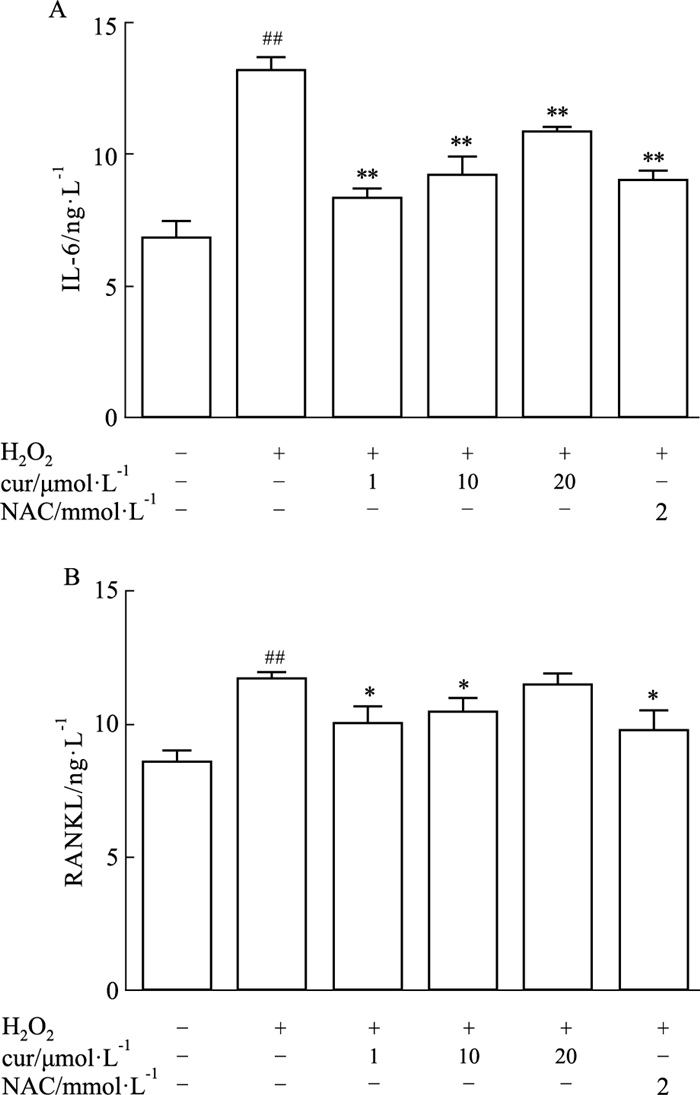
|
| Fig 3 Curcumindown-regulated level of IL-6 and RANKL *P < 0.05 and **P < 0.01 vs H2O2 alone treatment group; ##P < 0.01 vs Control group. |
NF-κB作为炎症反应中常见的核转录因子,在调节成骨过程中也起着重要作用。当暴露于H2O2时,磷酸化的p65亚基的表达增加,在细胞质中与p65亚基结合的IκB-α减少。而姜黄素(1 μmol·L-1) 则明显降低了p-p65的表达,但10、20 μmol·L-1的无显著性差异。IκB-α的表达水平与p-p65一致。因此,姜黄素可能通过NF-κB信号通路发挥抗氧化保护作用(Fig 4A-C)。
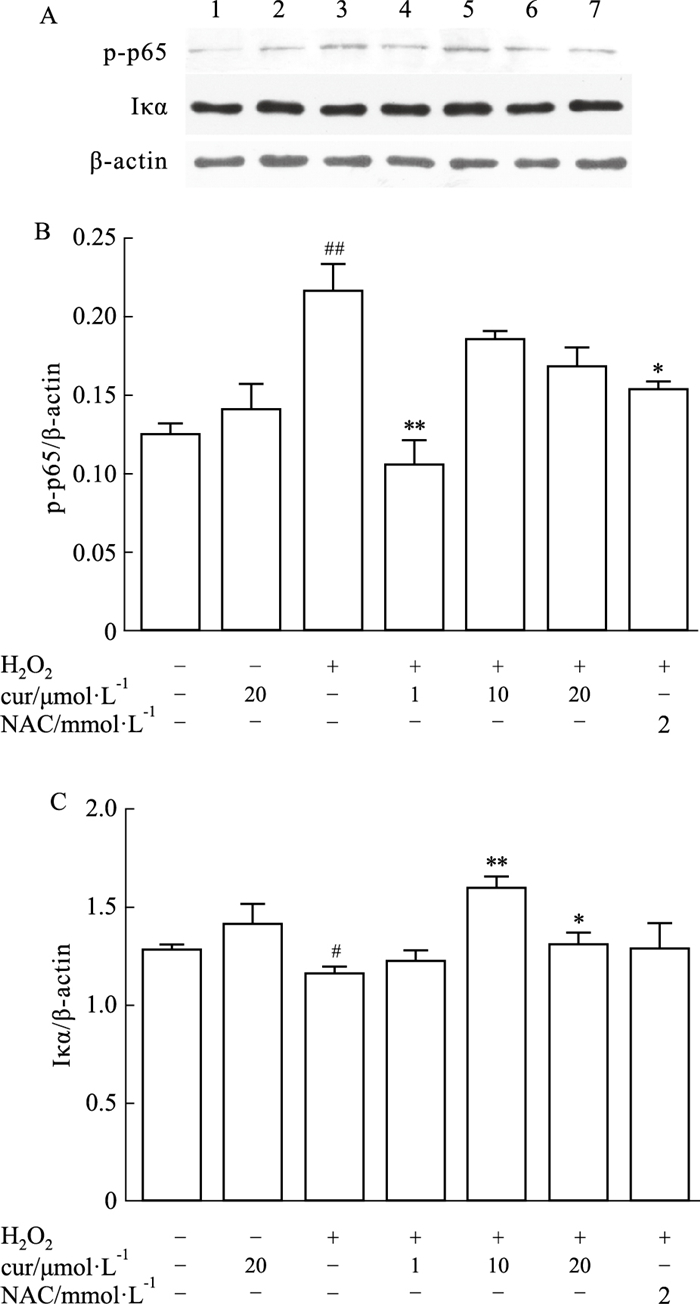
|
| Fig 4 NF-κB pathways involved in curcumin-mediated anti-oxidation 4A, 4B, 4C Western blot analysis and relative protein quantification of p-p65 and IκB-α ① Control group; ② Cur 20μmol·L-1; ③ H2O2; ④ H2O2+cur(1 μmol·L-1); ⑤ H2O2+cur(10 μmol·L-1); ⑥ H2O2+cur (20 μmol·L-1); ⑦ H2O2+NAC (2 mmol·L-1). Data are shown as the means±S.E.M. *P < 0.05 and **P < 0.01 vs H2O2-treatment group; #P < 0.05 and ##P < 0.01 vs Control group. |
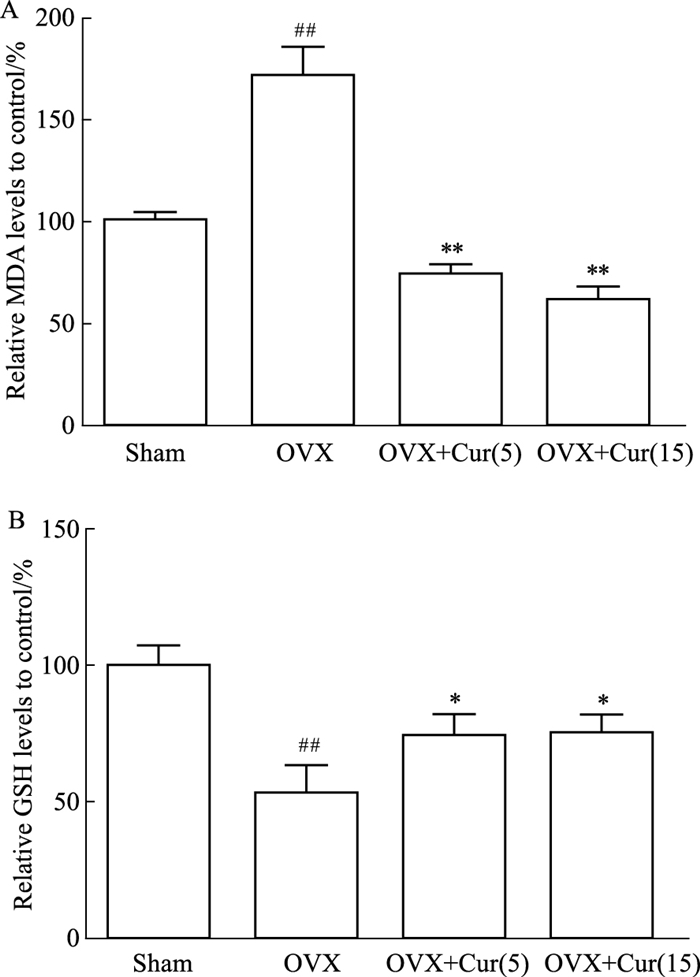
给OVX小鼠腹腔注射不同剂量的姜黄素后,体内氧化还原状态有不同的变化。结果发现,去卵巢组血清中MDA的活性升高,而GSH的活性降低,姜黄素处理后血清中MDA水平下降,GSH活性部分保留(Fig 5A、5B)。
|
| Fig 5 Curcumin attenuated expression of MDA and GSH in vivo *P < 0.05 and **P < 0.01 vs OVX group; ##P < 0.01 vs Sham group. |
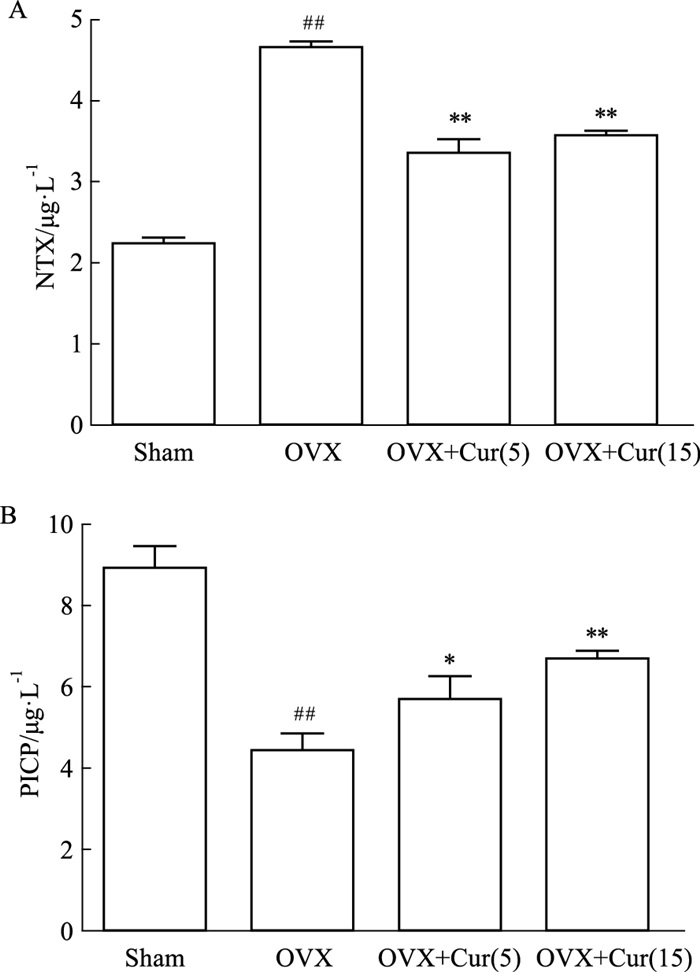
NTX和PICP值是绝经后妇女常见的骨代谢指标。为了评价姜黄素对骨代谢的影响,评价OVX小鼠中NTX和PICP的变化。NTX与破骨细胞活性相关,被认为是骨吸收的重要生化指标。OVX组的血清NTX(Fig 6A)明显高于其他组,姜黄素组(5和15 mg·kg-1)低于对照组。姜黄素各组(5和15 mg·kg-1)之间无差异。PICP与成骨细胞活性相关,被认为是骨形成的重要生化指标。OVX组血清PICP(Fig 6B)明显低于对照组,而姜黄素组血清PICP(5和15 mg·kg-1)均高于OVX组。姜黄素各组间存在显著差异(5mg和15 mg·kg-1)。这些结果表明,姜黄素抑制了破骨细胞的功能,但其抑制作用与剂量无关,姜黄素促进了骨形成,并与其剂量有关。
|
| Fig 6 Curcumin reversed bone turnover in vivo *P < 0.05 and **P < 0.01 vs OVX group; ##P < 0.01 vs Sham group. |
采用VG染色和显微计算机断层扫描(micro-CT) 检查检测骨量和显微结构。如Fig 7A所示,对照组小鼠股骨髁骨小梁结构正常。而VG染色的OVX小鼠骨小梁稀疏、稀薄,姜黄素处理改善了骨小梁的厚度、密度和数量。通过micro-CT扫描定量骨密度和骨量(Fig 7B)。通过姜黄素的处理,BMD、Tb.N、Tb.Th数值相对OVX组改善,且高剂量改善更为明显(Fig 7C-F)。可见姜黄素治疗以剂量依赖性的方式改善了骨密度及微结构。这些结果表明,姜黄素逆转了体内的骨丢失。

|
| Fig 7 Curcumin reversed bone harms in OVX animal model ①Sham group; ②OVX; ③OVX+cur(5 μmol/kg); ④OVX+cur(15 μmol/kg)Data are shown as the means±S.E.M. *P < 0.05 and **P < 0.01 vs OVX group; ##P < 0.01 vs Sham group. |
氧化应激被认为是目前导致骨质疏松症的主要原因,为此我们采用氧化应激细胞模型来研究骨质疏松症。在本实验中,研究者发现细胞的活力受H2O2浓度的影响,H2O2浓度越高,细胞的活力越低。该研究使用流式细胞仪检测细胞内ROS的变化,发现细胞内ROS随着H2O2浓度的增加而增加。在24 h内,它在0.3 mmol·L-1浓度下最高,因此本研究认为H2O2与细胞共培养24 h可以产生大量ROS。在Leichnitz的研究中使用流式细胞仪测量了ROS[11],结果与我们的是一致的。此外,本研究还评价了H2O2和姜黄素的毒性,0.3 mmol·L-1H2O2对细胞活力影响非常显著,20 μmol·L-1姜黄素对细胞活性没有影响,不能改善0.3 mmol·L-1H2O2共培养的细胞活力,所以研究中使用0.3 mmol·L-1H2O2和20 μmol·L-1及以下浓度的姜黄素。Wang等[12]报道的实验中使用0.2 mmol·L-1H2O2,与人成体干细胞(ASC) 共培养,Huang的实验中使用MC3T3-E1,也选择了0.3 mmol·L-1H2O2[13],本研究也证实了低浓度的姜黄素挽救了H2O2引起的损伤。虽然20 μmol·L-1姜黄素对细胞没有毒性,但20 μmol·L-1姜黄素未能挽救其前成骨细胞的活力。其作用机制尚不清楚,可能是20 μmol·L-1姜黄素在H2O2作用下具有毒性。许多研究表明,姜黄素逆转了阿尔茨海默病(AD) 动物模型中的神经毒性和行为损伤,这是由于大量ROS的产生,似乎是一种很有前途的预防AD的分子[14]。细胞内ROS的产生可以消耗细胞内还原剂的水平达到对细胞损伤的效果[15]。
ALP活性和钙含量是影响成骨的主要指标。ALP是一种成骨的早期生物标志物,而钙则是一种晚期的生物标志物。在此项研究中,测量了钙含量、ALP活性和染色的结果。结果发现,低浓度的姜黄素在氧化应激下保护成骨。Kim等[16]发现,姜黄素与BMP-2联合使用可促进骨组织再生,ALP和钙含量上调。因此,研究者推测1 μmol·L-1姜黄素在早期保护成骨,而10 μmol·L-1姜黄素在晚期保护成骨。也研究发现,姜黄素增加了大鼠间充质干细胞向成骨细胞的分化,ALP活性增强,矿化结节形成。人骨髓来源单个核细胞经H2O2培养时,破骨细胞的数量和活性显著增加[17]。NF-κB受体激活因子(RANKL) 和骨保护素(OPG) 的配体是破骨细胞和成骨细胞活性的重要调节因子。RANKL/OPG比值对氧化应激敏感,导致骨重塑过程中大量骨吸收。氧化应激还可以通过释放细胞因子和前列腺素来上调RANKL以增加破骨细胞的生成[18]。成骨细胞和破骨细胞共同决定是否存在骨质疏松症。
破骨细胞的分化在一定程度上依赖于成骨细胞,RANKL是促进破骨细胞成熟的重要因素[19]。成骨细胞还分泌炎症因子IL-6来调节骨重塑。研究证实,骨质疏松患者骨髓中IL-6和RANKL浓度较高[20]。该研究过程中,在培养上清液中也发现了大量RANKL和IL-6产生,并证实了姜黄素可以降低这两个细胞因子的水平。姜黄素也被认为是一种抗炎剂。苦参碱和杨梅树皮甙等抗氧化剂可以通过降低IL-6和RANKL的表达来抑制破骨细胞的生成,从而防止骨丢失[21-22]。结果表明,姜黄素在10 μmol·L-1浓度下具有保护作用,这与减弱H2O2对成骨的抑制作用的浓度相似。
NF-κB信号通路是炎症和氧化应激中的经典信号通路[23]。大量研究表明,姜黄素通过降低转录因子NF-κB的活性来逆转炎症和氧化过程中的生物学过程[24]。研究表明,姜黄素还降低了p-p65的表达和磷酸化因子的转录。1 μmol·L-1浓度的抑制作用显著,但高浓度的无抑制作用,这与对IL-6和RANKL的影响相一致。因此,NF-κB信号通路可能是调控IL-6和RANKL表达的潜在途径,同时也影响成骨前细胞的成骨过程。研究发现,甘草酸可以抑制NF-κB信号通路,减少炎症细胞因子IL-6和RANKL的分泌[25]。在本研究中,姜黄素共同具有抗氧化和抗炎作用,氧化会通过炎症因子的产生影响骨形成。姜黄素通过抑制P65的磷酸化来促进骨形成。
此外,为了验证姜黄素是否能减轻体内的氧化应激,本研究采用了小鼠OVX模型,该模型被认为是典型的模拟骨质疏松症。MDA是ROS脂质过氧化的产物;GSH是一种去除自由基,被认为是细胞内的抗氧化剂。这两个指标的数量通常代表了身体的氧化还原状态。一些研究发现,绝经后妇女的血清中MDA和GSH的产生发生了变化[26]。OVX组中MDA的产量增加,可能是对照组的1.6倍。相比之下,OVX组中GSH的数量减少到对照组的50%。姜黄素以剂量依赖性的方式逆转了治疗组的MDA/GSH的比值。姜黄素能有效地改变机体整体的氧化还原状态。有研究表明,绝经后妇女的NTX、PICP存在差异,上述两个指标被认为是骨转换的生化指标[27]。血清NTX显示姜黄素对破骨细胞有抑制作用,抑制骨吸收,且其作用与剂量无关,其潜在的机制尚不清楚,可能与微环境的氧化还原有关。姜黄素剂量可降低了血清PICP,表明姜黄素可能直接作用于成骨细胞,促进骨形成,这与姜黄素对P65表达的影响相一致。然而,未来还需要更多的证据来说明这一点。该试验使用VG染色和micro-CT扫描观察骨的结构,发现OVX患者的骨小梁骨的微结构显著恶化。在姜黄素作用下,小梁骨相对对照组,小梁网状骨结构得到改善。为了定量测定骨结构变化,研究中测量了股骨髁的骨密度、Tb.N、Tb.h等指标,与OVX组相比,治疗组的上述指标均有剂量改善。15 μmol·L-1组的骨结构似乎更致密,这可能是由于姜黄素抑制氧化应激以促进成骨前体细胞骨形成。
综上,氧化应激抑制了成骨细胞的骨形成,低浓度姜黄素(1~10 μmol·L-1) 可逆转抑制作用,但高浓度(20 μmol·L-1) 却不能。此外,NF-κB信号可能是其主要作用机制。姜黄素逆转了氧化剂和抗氧化剂的比例,抑制了高水平骨代谢,改善了OVX的骨微结构,它可能是骨质疏松治疗的理想药物之一。
| [1] |
智信, 陈晓, 苏佳灿. 绝经后骨质疏松症发病机制研究进展[J]. 中国骨质疏松杂志, 2018, 24(11): 1510-34. Zhi X, Chen X, Su J C. Research progress in the pathogenesis of postmenopausal osteoporosis[J]. Chin J Osteoporos, 2018, 24(11): 1510-34. doi:10.3969/j.issn.1006-7108.2018.11.025 |
| [2] |
Seeman E, Delmas P D. Bone quality——the material and structural basis of bone strength and fragility[J]. N Engl J Med, 2006, 354(21): 2250-61. doi:10.1056/NEJMra053077 |
| [3] |
Shen C L, Yang S, Tomison M D, et al. Tocotrienol supplementation suppressed bone resorption and oxidative stress in postmenopausal osteopenic women: a 12-week randomized double-blinded placebo-controlled trial[J]. Osteoporos Int, 2018, 29(4): 881-91. doi:10.1007/s00198-017-4356-x |
| [4] |
金昱彤, 祁琳, 牛芯蕊, 等. 红景天苷激活HIF-1α信号通路促进成骨细胞增殖的机制[J]. 中国药理学通报, 2022, 38(2): 190-5. Jin Y T, Qi L, Niu X R, et al. Research on mechanism of salidroside activating HIF-1ɑ signaling pathway to promote MOB proliferation[J]. Chin Pharmacol Bull, 2022, 38(2): 190-5. doi:10.3969/j.issn.1001-1978.2022.02.008 |
| [5] |
Jeong J W, Choi S H, Han M H, et al. Protective effects of fermented oyster extract against RANKL-Induced osteoclastogenesis through scavenging ROS generation in RAW 264.7 cells[J]. Int J Mol Sci, 2019, 20(6): 1439. doi:10.3390/ijms20061439 |
| [6] |
刘俐, 曾安琪, 张敏, 等. 四氢姜黄素抗氧化、抑制黑色素生成及其作用机制[J]. 中国药理学通报, 2022, 38(5): 698-704. Liu L, Zeng A Q, Zhang M, et al. Study on antioxidation and inhibiting melanin production of tetrahydrocurcumin and its mechanism[J]. Chin Pharmacol Bull, 2022, 38(5): 698-704. doi:10.12360/CPB202111012 |
| [7] |
Liu Z, Ying Y. The Inhibitory effect of curcumin on virus-induced cytokine storm and its potential use in the associated severe pneumonia[J]. Front Cell Dev Biol, 2020, 8: 479. doi:10.3389/fcell.2020.00479 |
| [8] |
Wang N, Wang F, Gao Y, et al. Curcumin protects human adipose-derived mesenchymal stem cells against oxidative stress-induced inhibition of osteogenesis[J]. J Pharmacol Sci, 2016, 132(3): 192-200. doi:10.1016/j.jphs.2016.10.005 |
| [9] |
李广悦, 尹东青, 徐凌, 等. 姜黄素调控脂多糖诱导成骨细胞线粒体功能改变及凋亡研究[J]. 重庆医科大学学报, 2019, 44(5): 581-7. Li G Y, Yin D Q, Xu L, et al. Effect of curcumin and lipopolysaccharide on mitochondrial function and cell apoptosis in osteoblasts[J]. J Chongqing Med Univ, 2019, 44(5): 581-7. |
| [10] |
Hussan F, Ibraheem N G, Kamarudin T A, et al. Curcumin protects against ovariectomy-induced bone changes in rat model[J]. Evid Based Complement Alternat Med, 2012, 2012: 174916. |
| [11] |
Leichnitz S, Heinrich J, Kulak N. A fluorescence assay for the detection of hydrogen peroxide and hydroxyl radicals generated by metallonucleases[J]. Chem Commun (Camb), 2018, 54(95): 13411-4. doi:10.1039/C8CC06996D |
| [12] |
Wang N, Wang F, Gao Y, et al. Curcumin protects human adipose-derived mesenchymal stem cells against oxidative stress-induced inhibition of osteogenesis[J]. J Pharmacol Sci, 2016, 132(3): 192-200. doi:10.1016/j.jphs.2016.10.005 |
| [13] |
Huang Q, Gao B, Jie Q, et al. Ginsenoside-Rb2 displays anti-osteoporosis effects through reducing oxidative damage and bone-resorbing cytokines during osteogenesis[J]. Bone, 2014, 66: 306-14. doi:10.1016/j.bone.2014.06.010 |
| [14] |
Da C I, Freire M, de Paiva C J, et al. Supplementation with curcuma longa reverses neurotoxic and behavioral damage in models of Alzheimer's disease: a systematic review[J]. Curr Neuropharmacol, 2019, 17(5): 406-21. doi:10.2174/0929867325666180117112610 |
| [15] |
张朋飞, 章立华, 华东. Triapine通过ROS/GSH/GPX4轴诱导A549细胞铁死亡[J]. 中国药理学通报, 2023, 39(5): 833-8. Zhang P F, Zhang L H, Hua D. Triapine induces ferroptosis via ROS/GSH/GPX4 axis in A549 cells[J]. Chin Pharmacol Bull, 2023, 39(5): 833-8. doi:10.12360/CPB202204041 |
| [16] |
Gu Q, Cai Y, Huang C, et al. Curcumin increases rat mesenchymal stem cell osteoblast differentiation but inhibits adipocyte differentiation[J]. Pharmacogn Mag, 2012, 8(31): 202-8. doi:10.4103/0973-1296.99285 |
| [17] |
Baek K H, Oh K W, Lee W Y, et al. Association of oxidative stress with postmenopausal osteoporosis and the effects of hydrogen peroxide on osteoclast formation in human bone marrow cell cultures[J]. Calcif Tissue Int, 2010, 87(3): 226-35. doi:10.1007/s00223-010-9393-9 |
| [18] |
任明诗, 丁羽, 李子涵, 等. 成骨细胞与破骨细胞相互调节作用的研究进展[J]. 中国药理学通报, 2022, 38(6): 822-7. Ren M S, Ding Y, Li Z H, et al. Research progress on interaction between osteoblasts and osteoclasts[J]. Chin Pharmacol Bull, 2022, 38(6): 822-7. doi:10.12360/CPB202109002 |
| [19] |
Hammerl A, Diaz C C, De-Juan-Pardo E M, et al. A growth factor-free co-culture system of osteoblasts and peripheral blood mononuclear cells for the evaluation of the osteogenesis potential of melt-electrowritten polycaprolactone scaffolds[J]. Int J Mol Sci, 2019, 20(5): 1068. doi:10.3390/ijms20051068 |
| [20] |
Pino A M, Rios S, Astudillo P, et al. Concentration of adipogenic and proinflammatory cytokines in the bone marrow supernatant fluid of osteoporotic women[J]. J Bone Miner Res, 2010, 25(3): 492-8. doi:10.1359/jbmr.090802 |
| [21] |
Huang Q, Gao B, Wang L, et al. Protective effects of myricitrin against osteoporosis via reducing reactive oxygen species and bone-resorbing cytokines[J]. Toxicol Appl Pharmacol, 2014, 280(3): 550-60. doi:10.1016/j.taap.2014.08.004 |
| [22] |
Chen X, Zhi X, Pan P, et al. Matrine prevents bone loss in ovariectomized mice by inhibiting RANKL-induced osteoclastogenesis[J]. FASEB J, 2017, 31(11): 4855-65. doi:10.1096/fj.201700316R |
| [23] |
Zhang Z, Zhao H, Ge D, et al. beta-Casomorphin-7 ameliorates sepsis-induced acute kidney injury by targeting NF-kappaB pathway[J]. Med Sci Monit, 2019, 25: 121-7. doi:10.12659/MSM.912730 |
| [24] |
Huang F, Yao Y, Wu J, et al. Curcumin inhibits gastric cancer-derived mesenchymal stem cells mediated angiogenesis by regulating NF-kappaB/VEGF signaling[J]. Am J Transl Res, 2017, 9(12): 5538-47. |
| [25] |
Li Z, Chen C, Zhu X, et al. Glycyrrhizin suppresses RANKL-induced osteoclastogenesis and oxidative stress through inhibiting NF-kappaB and MAPK and activating AMPK/Nrf2[J]. Calcif Tissue Int, 2018, 103(3): 324-37. doi:10.1007/s00223-018-0425-1 |
| [26] |
孙振双, 耿元卿, 张丽君, 等. 氧化应激介导绝经后骨质疏松发病机制的研究进展[J]. 中国骨质疏松杂志, 2016, 22(8): 1063-7. Sun Z S, Geng Y Q, Zhang L J, et al. Research progress on the pathogenesis of oxidative stress mediated osteoporosis[J]. Chin J Osteoporos, 2016, 22(8): 1063-7. doi:10.3969/j.issn.1006-7108.2016.08.028 |
| [27] |
钟燕婷, 杨亚军, 李嘉晓, 等. 基于GSK-3β信号通路防治骨质疏松的天然产物作用研究进展[J]. 中国药理学通报, 2022, 38(6): 817-21. Zhong Y T, Yang Y J, Li J X, et al. Development of natural products in prevention and treatment of osteoporosis based on GSK-3β signaling pathway[J]. Chin Pharmacol Bull, 2022, 38(6): 817-21. doi:10.12360/CPB202109090 |

