

2. 贵阳学院生物与环境工程学院,贵州 贵阳 550005;
3. 遵义医科大学研究生院,贵州 遵义 563000;
4. 韶关市食品药品检验所化学室,广东 韶关 521028;
5. 贵州省人民医院泌尿外科,贵州 贵阳 550000
2. College of Biological and Environmental Engineering, Guiyang University, Guiyang 550005, China;
3. Graduate School, Zunyi Medical University, Zunyi Guizhou 563000, China;
4. Chemistry Room, Shaoguan Institute for Food and Drug Control, Shaoguan Guangdong 521028, China;
5. Dept of Urology Surgery, Guizhou Provincial People′s Hospital, Guiyang 550000, China
肾细胞癌(renal cell carcinoma,RCC)在全球恶性肿瘤中排名第16位,占成人癌症的3%,占死亡人数的2%[1]。据估计,2020年,全球有43.1万例肾癌新发病例和17.9万例死亡病例[2]。2016年,WHO根据其形态、分子和遗传特征对肾癌进行了分类,最常见的亚型是肾透明细胞癌。在临床诊疗过程中,约30%的RCC患者在诊断时有转移,且由于RCC对传统的放化疗不敏感,30%~70%的RCC患者在手术治疗后仍有可能复发[3]。因此,必须更好地了解RCC的发病和进展相关机制,以寻找治疗这种恶性肿瘤的新策略。
活性氧(Reactive oxygen species, ROS)是一类寿命短且反应性高的小分子[4]。研究显示,低剂量ROS水平与细胞存活机制有关,例如增殖、分化和细胞周期进程[5],而细胞内ROS水平升高会引起线粒体DNA链断裂和DNA降解,导致细胞凋亡[6]。因此,调节异常ROS水平、细胞增殖和凋亡是治疗癌症的重要干预措施。
本研究旨在探讨八角莲(Dysosma versipellis)醇提物是否可以诱发ROS积累调节MAPK信号通路,并进一步调节肾透明细胞癌OS-RC-2细胞增殖、凋亡,为开发具有潜在抗RCC作用的新药提供理论基础。
1 材料与方法 1.1 药物与试剂八角莲购自贵州省贵阳市中药材市场,并经贵州省食品药品检验所中药室熊慧林主任药师鉴定为小檗科鬼臼属植物八角莲Dysosma versipellis的根茎。胎牛血清(以色列BI,批号:2351431);0.25%胰酶消化液(美国Gibco,批号:2428760);RPMI 1640培养液(美国Gibco,批号:8122551);细胞活力检测试剂盒(日本同仁,批号:SX748);ROS分析试剂盒(江苏凯基,批号:20220621);流式凋亡试剂盒(美仑生物,批号:MA0220-1);流式周期试剂盒(联科生物,批号:A10431);BCA蛋白浓度测定试剂盒(上海索莱宝,批号:20220225);JNK、ERK、P-ERK、p38、β-actin抗体(武汉三鹰,批号分别为:10023911、00115457、00116961、1004552、00095479);caspase-9、cleaved caspase-9、Bax、Bcl-2抗体(美国CST,批号分别为:9508S、20750S、2772S、15071S);超敏化学发光试剂(美国Affinity,批号:1927b02)。
1.2 主要仪器CO2细胞培养箱(日本SANYO);显微镜成像系统(日本Olympus);流式细胞仪(美国Beckman);酶标仪(美国Bio-teck);电泳槽和转膜仪(北京六一);化学发光成像系统(美国SYNGENE)。
1.3 数据库与软件TCMSP数据库(https://old.tcmsp-e.com/index.php);Swiss target数据库(https://swisstargetprediction.ch);Genecards数据库(https://www.genecards.org/);Venny2.1网站(https://bioinfogp.cnb.csic.es/tools/venny/);DAVID数据库(https://david.ncifcrf.gov/home.jsp);string数据库(https://cn.string-db.org/);Cytoscape3.5.1软件。
1.4 方法 1.4.1 药物的提取取适量八角莲干药材粉碎后70%乙醇浸泡2 h,并回流提取3次,每次1 h,合并提取液,过滤,70 ℃水浴浓缩成干浸膏。称取干浸膏100 mg,加DMSO充分溶解,并加细胞培养液定容至10 mL,0.22 μm小滤器过滤,制备成母液(10 g·L-1)备用。临用前加细胞培养液稀释至所需浓度给药(加入细胞中的药物DMSO终浓度 < 0.2%)。
1.4.2 细胞的培养OS-RC-2肾透明细胞癌细胞购自武汉普诺赛生命科技有限公司,并经STR鉴定。快速从液氮罐中取出细胞冻存管经37 ℃水浴,再加入5~10倍体积的RPMI 1640完全培养液低速离心5 min后弃上清液,加入1 mL 10%培养液重悬细胞后,加培养液至4 mL,置于37 ℃含5% CO2培养箱内,24 h后更换新培养液。
1.4.3 细胞活力(cell counting kit,CCK-8)检测按3×103个/孔将OS-RC-2细胞接种于96孔板,待细胞贴壁后进行给药处理,每组分别设6个复孔,并设置2个调零孔,继续培养24、48、72、96 h,然后加入10 μL CCK-8在37 ℃下孵育2 h,用酶标仪在450 nm处测量吸光度值。
1.4.4 克隆形成实验将细胞消化成单悬浮液,按1.5×103个/孔接种于6孔板,待细胞贴壁后进行给药处理,继续培养14 d,PBS洗2遍,4%多聚甲醛固定30 min,弃去固定液,台盼蓝染色30 min,后用流水缓缓洗去染色液,晾干后拍照。
1.4.5 划痕实验将2孔划痕插件与6孔板紧密粘连,接种OS-RC-2细胞,待细胞完全铺满两孔插件底部时,用镊子轻轻取出两孔插件;分别加入不同浓度的药物,24 h后100倍显微镜下拍照,相对迁移面积=(0 h空白面积-24 h空白面积)/0 h的空白面积×100%。
1.4.6 Transwell实验用无血清培养基重悬细胞,调整细胞密度为5×108·L-1。24孔板下室加入600 μL含20%胎牛血清的培养基,并取100 μL含/不含八角莲药物的细胞悬液加入Transwell小室,常规培养24 h。取出Transwell小室,弃去孔中培养液,PBS洗2遍,多聚甲醛固定30 min,弃去固定液,0.1%结晶紫染色30 min,后用流水缓缓洗去染色液,晾干后100倍显微镜下拍照。
1.4.7 ROS水平检测按1×106个/孔将细胞接种于6孔板,按照不同分组分别对相应的孔进行处理,放置于37 ℃、5% CO2培养箱内培养24 h。向孔中加入DCFH-DA使终浓度为10 μmol·L-1,吹打混匀后放入培养箱内避光孵育。流式细胞仪上机检测,使用488 nm激发波长,525 nm发射波长,各组细胞的平均荧光强度反映了细胞内的ROS水平。
1.4.8 八角莲活性成分及潜在作用靶点的获取利用TCMSP数据库获取八角莲化学成分,Swiss target数据库获取八角莲对应的作用靶点。利用Genecards数据库,以“ROS”为关键词进行检索,以种属为“Homo(智人)”,相关性“>1”为筛选标准,找到ROS的相关靶基因。利用venny2.1分析八角莲和ROS的共同靶点。利用DAVID数据库对以上共同靶点进行KEGG和GO富集分析。用Cytoscape3.5.1软件展示八角莲-成分-靶点的关系,并利用string数据库对所得共同基因进行PPI分析。
1.4.9 流式细胞凋亡检测取对数生长期的细胞,按1×109·L-1接种于6孔板内,进行所需的处理(加药或不加药),24 h后终止培养。收集细胞,加入400 μL 1×Binding Buffer轻轻重悬细胞,加入5 μL Annexin V-FITC轻轻混匀,室温避光孵育15 min,加入10 μL PI染色液,轻轻混匀,冰浴避光放置5 min,在30 min内进行流式细胞术检测。
1.4.10 流式细胞周期检测取对数生长期的细胞,按1×109·L-1接种于6孔板内,进行所需的处理(加药或不加药),24 h后终止培养。1 000 r·min-1离心5 min,收集细胞沉淀,弃上清,用预冷PBS洗涤2次,加入预冷75%乙醇,于4 ℃固定4 h。1 500 r·min-1离心5 min,弃上清,PBS洗涤1次,加入400 μL的PI染液,100 μL的RNase A,4 ℃避光孵育30 min,上机检测。
1.4.11 Western blot蛋白表达检测提取细胞总蛋白,按30 μg/孔进行蛋白上样,再进行SDS-PAGE,湿法转膜将蛋白条带转移至PVDF膜。将膜置牛奶封闭液中室温下摇床封闭2 h;加入JNK、ERK、P-ERK、caspase-9、cleaved caspase-9、Bax、Bcl-2、p38一抗工作液置4 ℃冰箱过夜;TBST缓冲液(pH=7.4)洗膜,室温下孵育稀释的二抗1.5 h;TBST洗膜,ECL发光液显影。同法封闭、孵育β-actin。ImageJ软件对条带进行灰度分析。
1.4.12 统计学分析计量资料使用GraphPad 9.0软件进行统计分析,结果以x±s表示。当数据服从正态分布时,两两比较采用LSD-t检验,多组间比较采用单因素方差分析。当数据不服从正态分布时,采用Mann-Whitney或Kruskal-Wallis分析两个或多个组之间的差异。检验水准α=0.05。
2 结果 2.1 八角莲给药对OS-RC-2细胞增殖、迁移能力及ROS水平的改变首先,将八角莲醇提物分别用不同浓度给药后检测细胞活力。CCK-8结果显示,相较于对照组,八角莲给药后可明显抑制OS-RC-2的细胞活力,且呈浓度及时间依赖性抑制细胞活力,见Fig 1A。将八角莲采用4、8、12 mg·L-1 3个浓度给药,并检测给药后细胞克隆形成的变化。结果显示,与DMSO对照组相比,3个浓度的八角莲给药后均可明显降低OS-RC-2细胞的克隆形成能力,且呈浓度依赖性降低细胞克隆形成数(P < 0.01),见Fig 1B。
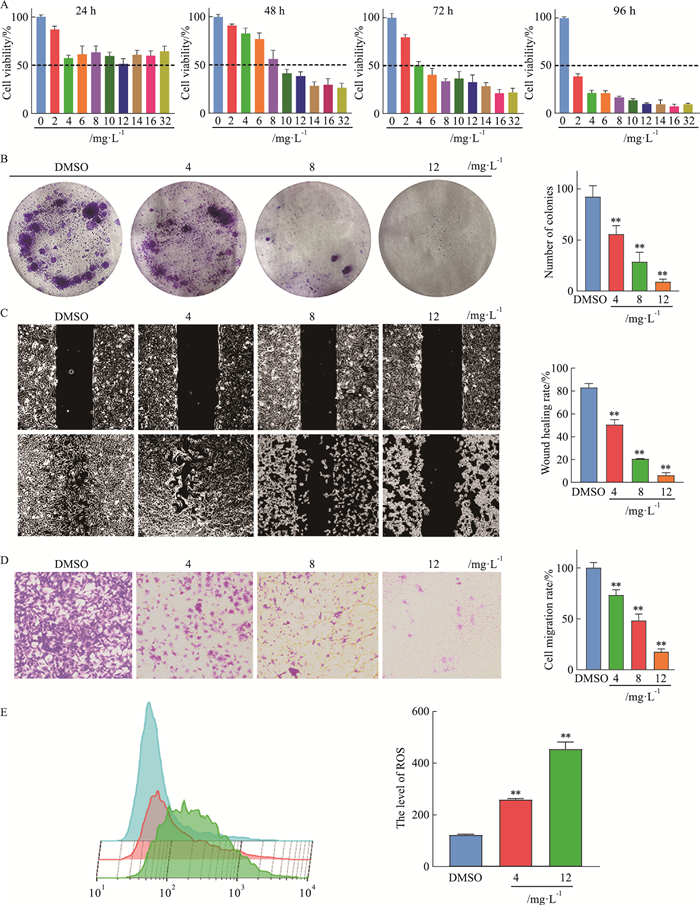
|
| Fig 1 Effect of Dysosma versipellis on cell viability, migration and ROS of OS-RC-2 cells(x±s, n≥3) A: The CCK-8 assay was used to detect the cell viability of OS-RC-2 cells in 24, 48, 72, 96 h. B: The clone formation assay was used to detect the proliferation of cells. C and D: The wound healing assay and transwell assay were employed to measure the migration rate of cells. E: The reactive oxygen detection kit was used to detect the level of ROS. **P < 0.01 vs DMSO. |
我们用划痕实验及Transwell实验检测八角莲对OS-RC-2细胞迁移能力的影响。结果显示,八角莲给药可明显抑制OS-RC-2细胞的迁移能力(P < 0.01),见Fig 1C, D。
接下来,我们进一步用4、12 mg·L-1两个浓度的八角莲给药后检测细胞ROS水平变化。结果显示,与DMSO对照组相比,八角莲给药后细胞ROS水平明显升高(P < 0.01),见Fig 1E。
2.2 八角莲活性成分及作用靶点的寻找为探索八角莲抑制OS-RC-2细胞增殖的分子机制,我们利用网络药理学寻找八角莲成份和靶点的关系。首先,利用TCMSP数据库获取八角莲的化学成分,用Swisstarget数据库获取八角莲的对应靶点,利用Genecards数据库获取ROS的相关靶点,并通过venny 2.1取交集得到八角莲-ROS的共同靶点,找到165个共同靶点,见Fig 2A。用Cytoscape3.5.1软件展示八角莲-成分-靶点的关系,Swisspredict数据库中,可能性大于0.5的靶点被展示(Fig 2B);利用DAVID数据库对以上165个基因进行KEGG(Fig 2C)和GO通路富集分析(Fig 2D),KEGG分析发现MAPK信号通路有明显的变化。
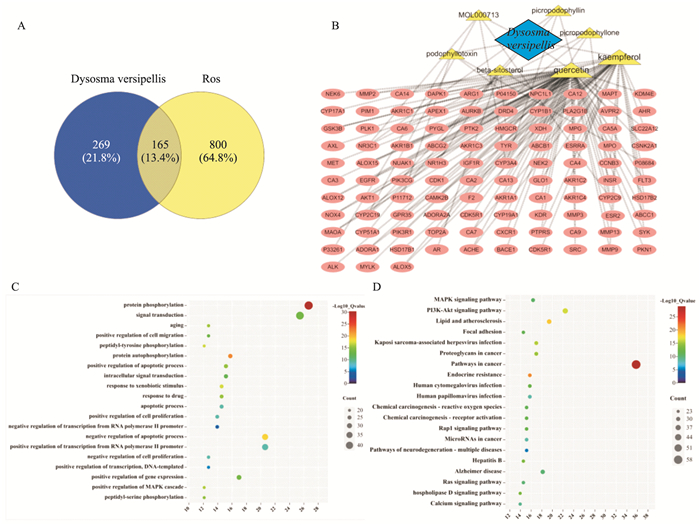
|
| Fig 2 The active ingredients and target map of Dysosma versipellis A: The venny 2.1 was used to obtain the common target between Dysosma versipellis and ROS. B: The software of Cytoscape3.5.1 was used to display the relationship between Dysosma versipellis, composition, and target. C and D: The KEGG and GO enrichment analysis was performed using the DAVID database. |
对以上165个共同靶点进行映射后所得交集靶点导入string数据库中进行检索,获取靶点相互作用的网络关系数据,绘制PPI网络图,共获得165个节点和511条蛋白网络互作关系,见Fig 3。
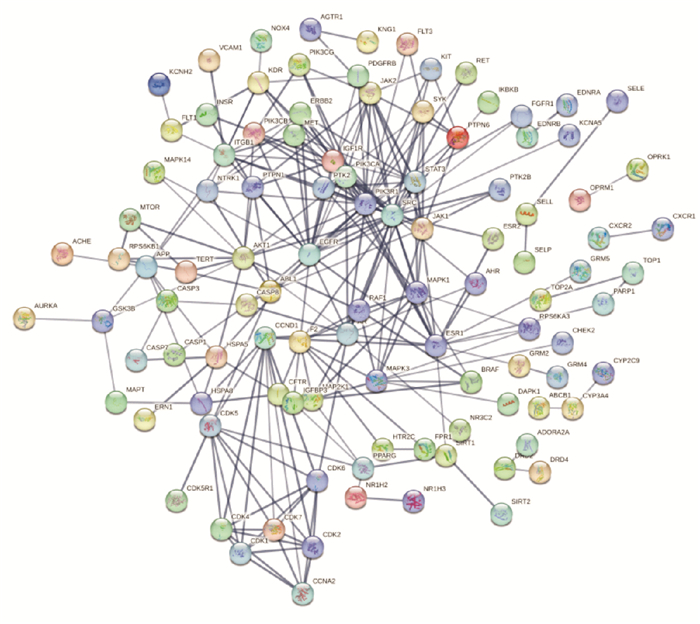
|
| Fig 3 Network diagram of common target in OS-RC-2 cells inhibited by Dysosma versipellis |
KEGG分析发现MAPK信号通路变化明显,故我们进一步用Western blot实验进行了信号通路关键蛋白JNK、ERK及p-ERK蛋白表达水平的检测。结果显示,八角莲给药48 h后,可明显降低JNK蛋白水平及p-ERK/ERK比值(P < 0.05,P < 0.01),见Fig 4A-C,提示八角莲可抑制MAPK信号通路关键蛋白表达。
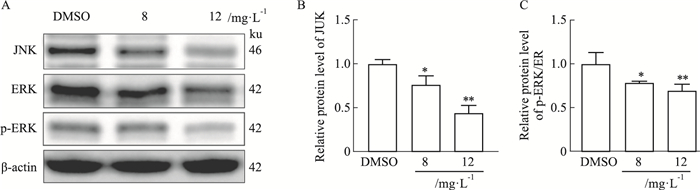
|
| Fig 4 Effect of Dysosma versipellis on protein level of MAPK signaling pathway(x±s, n=3) A: Western blot was used to detect the protein level of JNK, ERK, p-ERK. B and C: The relative protein expression of JNK, p-ERK/ERK. *P < 0.05, **P < 0.01 vs DMSO. |
研究显示八角莲给药能通过Wnt信号通路抑制细胞活力和侵袭能力,促进食管癌细胞凋亡[7],故我们进一步进行了细胞凋亡及周期的相关检测。流式细胞术结果显示,将八角莲给药48 h后,可明显促进细胞凋亡(P < 0.01),见Fig 5A;可减少G1期细胞量,并明显升高G2/M期细胞量,见Fig 5B;Western blot结果显示,八角莲给药后可降低caspase-9及Bcl-2蛋白表达水平,而升高cleaved caspase-9及Bax蛋白表达水平(P < 0.05,P < 0.01),见Fig 5C。以上结果表明八角莲给药可促进OS-RC-2细胞凋亡水平。

|
| Fig 5 Effect of Dysosma versipellis on cell apoptosis rate of OS-RC-2 cells(x±s, n=3) A, B: The flow cytometry was used to detect the apoptosis rate and cell cycle distribution. C: Western blot was used to detect the protein level of caspase-9, cleaved caspase-9, Bax, Bcl-2. *P < 0.05, **P < 0.01 vs DMSO. |
因用“八角莲”和“ROS”取交集后的共同靶点进行KEGG分析发现MAPK信号通路有变化,且文献报道[8-9] MAPK信号通路与细胞凋亡有关,故我们猜想,八角莲是否通过刺激ROS积累引起MAPK信号通路变化促进细胞凋亡这种机制来发挥抗肿瘤作用。接下来,我们用ROS抑制剂NAC进行了验证。实验分为:DMSO对照组、八角莲给药组、NAC(3 mmol·L-1)给药组、八角莲+NAC联合给药回复实验组。结果显示,NAC与八角莲联合给药48 h时可明显逆转八角莲单独给药对OS-RC-2的细胞活力(P < 0.01,见Fig 6A)及凋亡(P < 0.01,见Fig 6B)作用;此外,NAC与八角莲联合给药组可明显逆转八角莲单独给药对细胞凋亡关键蛋白caspase-9、cleaved caspase-9、Bax、Bcl-2的表达变化,及MAPK信号通路蛋白ERK、p38蛋白的表达改变(P < 0.05,P < 0.01),见Fig 6C。上述结果表明,八角莲可能是通过ROS积累发挥抑制OS-RC-2细胞的增殖及促进凋亡作用,以及发挥抑制MAPK信号通路的作用。
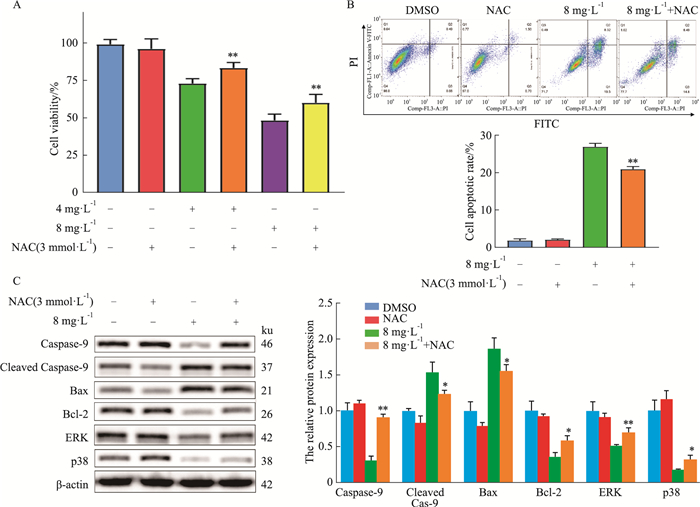
|
| Fig 6 Effect of NAC on cell viability, apoptosis rate and ROS of OS-RC-2 cells(x±s, n=3) A: The CCK-8 assay was used to detect the cell viability of OS-RC-2 cells under co-administration of NAC and Dysosma versipellis; B: The flow cytometry was used to detect the apoptosis rate; C: Western blot was used to detect the protein level of caspase-9, cleaved caspase-9, Bax, Bcl-2, ERK, and p38. *P < 0.05, **P < 0.01 vs group of 4 mg·L-1 or 8 mg·L-1. |
八角莲为小檗科八角莲属植物八角莲的根茎,主要为木脂素类、黄酮类、醌类等成分[10],具有抗肿瘤、抗病毒、抗炎等多种药理作用[11-12]。研究显示,八角莲提取物可抑制前列腺癌及胶质母细胞瘤细胞的增殖[13-14],但八角莲在RCC中的作用及其机制尚不清楚。
本课题用不同浓度的八角莲醇提物进行了增殖及迁移能力检测,初步验证了其对OS-RC-2细胞增殖、迁移能力的抑制作用。ROS水平检测显示八角莲能明显升高OS-RC-2细胞的ROS水平,研究显示细胞内ROS水平升高会引起线粒体DNA链断裂和DNA降解,导致细胞凋亡[6]。为探索八角莲升高OS-RC-2细胞ROS水平的作用机制,我们利用网络药理学进行八角莲成份和作用靶点的寻找,并通过维恩分析取交集,共得到165个八角莲-ROS的共同靶点。进一步对以上165个基因进行KEGG和GO通路富集分析,发现MAPK信号通路有明显的变化。
MAPK由ERK1/2、MEK1/2和p38组成[15],可被多种细胞外刺激激活。MAPK途径的激活可导致多种生理效应,包括凋亡、细胞增殖、有丝分裂等[16]。研究表明,MAPK/ERK信号通路的激活可促进多种类型肿瘤细胞的增殖、迁移,并抑制肿瘤细胞凋亡。例如,益气解毒方水提物通过抑制MAPK/ERK信号通路关键蛋白表达发挥促进鼻咽癌细胞凋亡的作用[17]。LncRNA DICER1-AS1通过靶向miR-650激活MAPK/ERK信号通路促进结直肠癌进展[18]。然而,八角莲是否影响RCC中的MAPK/ERK途径还有待明确。
我们进一步用八角莲给药,Western blot对MAPK信号通路关键蛋白及凋亡相关蛋白进行检测。结果显示,八角莲给药后,明显降低JNK、caspase-9、Bcl-2、p-ERK/ERK蛋白表达水平,而升高cleaved caspase-9、Bax蛋白表达水平。上述结果提示八角莲给药可能抑制MAPK/ERK信号通路,并促进细胞凋亡水平。
接下来,我们用ROS抑制剂NAC进行回复实验,检测OS-RC-2细胞增殖、凋亡及MAPK信号通路蛋白表达的变化。结果显示,NAC与八角莲联合给药可明显逆转八角莲单独给药对OS-RC-2的细胞活力及凋亡作用,并可明显逆转八角莲单独给药对细胞凋亡关键蛋白caspase-9、cleaved caspase-9、Bax、Bcl-2的表达变化,及MAPK信号通路蛋白ERK、p38蛋白的表达改变,提示:八角莲可能通过促进ROS水平变化发挥抑制MAPK信号通路,促凋亡及增殖抑制作用。
综上所述,八角莲可能通过促进ROS水平变化抑制MAPK信号通路,从而发挥对肾透明细胞癌OS-RC-2细胞的促凋亡及增殖抑制作用,此研究有望为开发具有潜在抗RCC作用的新药提供理论基础。
| [1] |
Iaxx R, Lefort F, Domblides C, et al. An evaluation of cabozantinib for the treatment of renal cell carcinoma: focus on patient selection and perspectives[J]. Ther Clin Risk Manag, 2022, 18: 619-32. doi:10.2147/TCRM.S251673 |
| [2] |
Sung H, Ferlay J, Siegel R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49. doi:10.3322/caac.21660 |
| [3] |
Xiang Y, Zheng G, Zhong J, et al. Advances in renal cell carcinoma drug resistance models[J]. Front Oncol, 2022, 12: 870396. doi:10.3389/fonc.2022.870396 |
| [4] |
Redza-Dutordoir M, Averill-Bates D A. Activation of apoptosis signalling pathways by reactive oxygen species[J]. Biochim Biophys Acta, 2016, 1863(12): 2977-92. doi:10.1016/j.bbamcr.2016.09.012 |
| [5] |
Perillo B, Di Donato M, Pezone A, et al. ROS in cancer therapy: the bright side of the moon[J]. Exp Mol Med, 2020, 52(2): 192-203. doi:10.1038/s12276-020-0384-2 |
| [6] |
Srinivas U S, Tan B W Q, Vellayappan B A, et al. ROS and the DNA damage response in cancer[J]. Redox Biol, 2019, 25: 101084. doi:10.1016/j.redox.2018.101084 |
| [7] |
Pu Y, Jin P, Liu L, et al. Dysosma versipellis extract inhibits esophageal cancer progression through the Wnt signaling pathway[J]. Evid Based Complement Alternat Med, 2021, 20: 1221899. |
| [8] |
Yu Y H, Zhang H J, Yang F, et al. Curcumol, a major terpenoid from Curcumae Rhizoma, attenuates human uterine leiomyoma cell development via the p38MAPK/NF-κB pathway[J]. J Ethnopharmacol, 2023, 310: 116311. doi:10.1016/j.jep.2023.116311 |
| [9] |
Lv X, Lin Y, Zhu X, et al. Isoalantolactone suppresses gallbladder cancer progression via inhibiting the ERK signalling pathway[J]. Pharm Biol, 2023, 61(1): 556-67. doi:10.1080/13880209.2023.2191645 |
| [10] |
马君, 江露, 陈虎, 等. 中药八角莲的研究进展[J]. 湖北医药学院学报, 2020, 39(1): 96-100. Ma J, Jiang L, Chen H, et al. The research progress on traditional Chinese medicine Dysosma versipellis[J]. J Hubei Univ Med, 2020, 39(1): 96-100. doi:10.13819/j.issn.2096-708X.2020.01.023 |
| [11] |
陈日道, 段瑞刚, 邹建华, 等. 八角莲愈伤组织中黄酮苷类化学成分研究[J]. 中国中药杂志, 2016, 41(1): 87-91. Chen R D, Duan R G, Zou J H, et al. Flavonoid glycosides from callus cultures of Dysosma versipellis[J]. China J Chin Mater Med, 2016, 41(1): 87-91. |
| [12] |
Zheng Y, Xie Y G, Zhang Y, et al. New norlignans and flavonoids of Dysosma versipellis[J]. Phytochem Lett, 2016, 16: 75-81. doi:10.1016/j.phytol.2016.03.001 |
| [13] |
Jiang R W, Zhou J R, Hon P M, et al. Lignans from Dysosma versipellis with inhibitory effects on prostate cancer cell lines[J]. J Nat Prod, 2007, 70(2): 283-86. doi:10.1021/np060430o |
| [14] |
Guerram M, Jiang Z Z, Sun L, et al. Antineoplastic effects of deoxypodophyllotoxin, a potent cytotoxic agent of plant origin, on glioblastoma U-87 MG and SF126 cells[J]. Pharmacol Rep, 2015, 67(2): 245-52. doi:10.1016/j.pharep.2014.10.003 |
| [15] |
Sun Y, Liu W, Liu T, et al. Signaling pathway of MAPK/ERK in cell proliferation, differentiation, migration, senescence and apoptosis[J]. J Recept Signal Transduct Res, 2015, 35(6): 600-4. doi:10.3109/10799893.2015.1030412 |
| [16] |
Dhillon A S, Hagan S, Rath O, et al. MAP kinase signalling pathways in cancer[J]. Oncogene, 2007, 26(22): 3279-90. doi:10.1038/sj.onc.1210421 |
| [17] |
胡晶, 刘洁, 徐冰雁, 等. MAPK/ERK信号通路在益气解毒方水提物诱导鼻咽癌细胞凋亡中的作用[J]. 中国药理学通报, 2019, 35(11): 1613-21. Hu J, Liu J, Xu B Y, et al. Role of MAPK/ERK signaling pathway in apoptosis of nasopharyngeal carcinoma cells by Yiqi Jiedu formula[J]. Chin Pharmacol Bull, 2019, 35(11): 1613-21. |
| [18] |
Li W, Ke C, Yang C, et al. LncRNA DICER1-AS1 promotes colorectal cancer progression by activating the MAPK/ERK signaling pathway through sponging miR-650[J]. Cancer Med, 2023, 12(7): 8351-66. doi:10.1002/cam4.5550 |

