

2. 海军军医大学麻醉系危重病医学教研室,上海 200433
张立超(1972-),男,博士,主任药师,硕士生导师,研究方向:抗炎免疫药理学,通信作者,E-mail:changhaiskin@163.com
2. Dept of Critical Care Medicine, School of Anesthesiology, Naval Medical University, Shanghai 200433, China
炎症性肠病(inflammatory bowel disease,IBD)是因异常免疫反应介导的肠道慢性及复发性炎症性疾病,主要包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)[1]。该病易导致严重的消化吸收障碍,病情反复,往往需要终身治疗。目前IBD的治疗药物主要包括氨基水杨酸类、皮质类固醇类、传统小分子免疫抑制药和TNF-α单克隆抗体等[2],但这些药物不良反应多,久用疗效减弱、价格也比较昂贵。因此,寻找并开发治疗效果确切、毒副作用小、价格低廉的药物是特别迫切的。天然小分子产物结构多样、效价高,具有很高的生物相容性,一直是新药开发的源泉。研究表明,多种天然小分子化合物在IBD的体内外研究中都显示出良好的治疗效果。
IBD的发病机制至今尚未明确,但肠屏障功能受损引起肠道通透性增加在IBD发病中起着重要作用,而位于上皮细胞顶端的紧密连接在维持肠屏障功能中起着关键作用[3]。随着现代药理学和分子生物技术的快速发展,国内外众多研究学者探讨了天然小分子化合物通过改善肠上皮紧密连接结构和功能来维持和修复肠屏障功能的潜力(Fig 1)。本文根据国内外已有报道,对多种天然产物来源的小分子化合物在防治IBD肠上皮紧密连接损伤中的作用及其机制进行了综述。
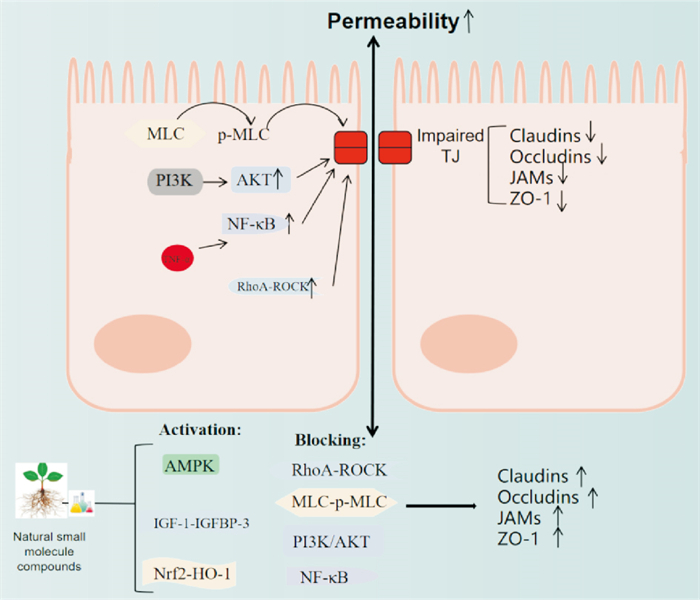
|
| Fig 1 Natural small molecules protect intestinal epithelial tight junction barrier |
IBD是遗传易感性和环境对菌群相互作用的结果,是通过削弱肠道屏障功能导致肠道免疫反应过度激活而引起的疾病[4]。肠道屏障包括机械屏障、化学屏障、微生物屏障和免疫屏障,其中机械屏障最为重要。机械屏障也被称为物理屏障,由肠上皮细胞和细胞顶端的紧密连接构成,可有效阻挡病毒、细菌及内毒素等有害物质的进入[5]。环境污染、饮食结构改变等危险因素会导致肠道机械屏障受损,肠道通透性增加,进而导致IBD易发。
2 肠上皮屏障与紧密连接蛋白肠上皮细胞之间的连接方式包括了紧密连接、缝隙连接、黏附连接以及桥粒连接。其中,位于细胞顶部的紧密连接是连接细胞间隙、调节肠黏膜通透性的关键。病理情况下,紧密连接的结构和功能会被破坏,进而导致肠屏障功能受损[5]。紧密连接是由Claudin、Occludin、连接黏附分子(junction adhesion molecular,JAM)和带状闭合蛋白(Zonula occludens 1,ZO-1)以及细胞骨架共同构成。其中,Claudin、Occludin和JAM是连接细胞的跨膜结构蛋白。ZO-1则位于胞内,与细胞骨架肌动蛋白直接结合,同时也可以与细胞膜上闭锁蛋白结合,在细胞骨架改变时直接影响紧密连接蛋白的正常防御功能[6]。
3 改善IBD肠上皮屏障功能的天然小分子化合物(Tab 1)| Compounds | Model | Regulated TJ protein | Mechanisms |
| Baicalin | TNBS-induced mouse colitis [7]; LPS stimulated the IEC-6 cell model [8] | ZO-1,β-catenin | Block of PI3K/AKT signaling [7]; Inhibition of production of inflammatory cytokines and upregulation of mRNA of ZO-1[8] |
| Puerarin | TNBS-induced colitis in rats[9] | Occludin,ZO-1,JAM-A | / |
| Kaempferol | Dioxyfusicallenol monolayers were stimulated with Caco-2[10] | Claudin-3,ZO-1 | / |
| Proanthocyanidin B2 | TNBS-induced colitis in mice[12] | Claudin-1 and ZO-1 | Inhibition of the PI3K/AKT signaling pathway[12] |
| Curcumin | Ethanol-induced Caco-2[14];In vitro co-culture model of Caco-2 cells with differentiated THP-1 cells[15] | Occludin,ZO-1 and Claudin-1 | Inhibition of ER stress and oxidative stress and resultant apoptosis[15] |
| Theaflavin | Model of the intestinal epithelial barrier in Caco-2 cells[16, 17] | Occludin,Claudin-1 and ZO-1 | Activation of the AMPK pathway |
| Peoniflorin | Caco-2 single-cell Layer model for LPS stimulation[18];Single-layer model of Caco-2 for TNF-α stimulation[19] | Occludin,ZO-1 and Claudin-5 | Activation of the Nrf2/HO-1 signaling pathway and in turn suppresses NF-B signaling[18];Suphibition of inducible expression of MLCK[19] |
| Artemisinine | Model of IEC-6 cell damage induced by LPS[20] | Occludin,Claudin-1and ZO-1 | Inhibition of the TLR4/MyD88/NF-B signaling pathway was correlated |
| Glycyrrhizic acid | Mouse UC model induced by DSS[21] | Occludin,Claudin-2 and Claudin-4 | / |
| Berberine | DSS-induced colitis in mice[22];LPS was induced in a rat intestinal inflammation model[23] | ZO-1、E-cadherin and Occludin,Claudin-1 | Activation of the IGF-1/IGFBP-3 signaling pathway[23] |
| Evodiamine | Caco-2 single-cell layer model for LPS stimulation[24] | Occludin and ZO-1 | Inhibition of the NF-κB signaling pathway and the NLRP3 inflammasome |
| Oxymatrine | DSS-induced colitis in mice[26] | Occludin,ZO-1 | Inhibition of the RhoA/ROCK signaling pathway |
| Polysaccharide | Rat UC model induced by TNBS[27-28] | Occludin,ZO-1 | Regulation of the Bcl-2 and Bax proteins |
| Carboxymet-hylpachymara | TNF-α stimulated model of Caco-2 monolayer injury[29] | Occludin,ZO-3 | Inhibition of MLCK-p-MLC signaling pathway regulated by NF-κB[29] |
| Aloe vera-polysaccharide | DSS-induced acute colitis in mice[30] | Occludin,ZO-1 | Upregulation of the Nrf2/HO-1 signaling pathway and increase of short-chain fatty acid metabolism[30] |
黄芩苷是从传统中药黄芩根茎中提取分离出的一种黄酮类化合物,具有抑菌、利尿消肿、抗炎、抗肿瘤及解痉等药理作用(Fig 2)。在TNBS诱导的小鼠结肠炎的模型中,黄芩苷不仅能减少IL-6、TNF-α和IL-1β的释放以及增加IL-10的水平,还能提高ZO-1和β-catenin的表达,阻断PI3K/AKT信号通路来增强肠上皮紧密连接屏障功能[7]。脂多糖(lipopolysaccharides,LPS)可直接破坏细胞的紧密连接,进而可能会引起肠屏障功能障碍。体外研究发现,黄芩苷可以抑制LPS诱导IEC-6细胞及细胞间紧密连接破坏,其机制可能与抑制炎症细胞因子的产生,上调ZO-1的mRNA和蛋白表达有关[8]。
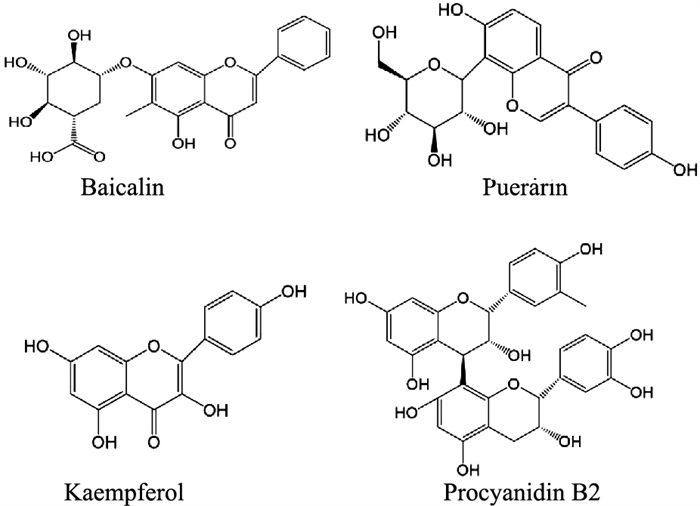
|
| Fig 2 Compound of flavonoids |
葛根素为中药葛根的主要活性成分之一,属于药食两用的中药活性成分,属异黄酮类化合物,现已作为注射剂型上市(Fig 2)。葛根素具抗炎、抗过敏和改善微循环等药理作用。吴轶[9]使用葛根素治疗TNBS诱导的大鼠结肠炎,发现葛根素不仅可减少结肠中TNF-α、IL-6和IFN-γ的表达,还可逆转大鼠结肠中Occludin、ZO-1和JAM-A等紧密连接蛋白的减少,有效地恢复了肠道屏障功能。
3.1.3 山奈酚山奈酚源自于姜科植物山奈的根茎,具有抗炎、杀菌和抗肿瘤等多种活性(Fig 2)。人结肠细胞系Caco-2单细胞层是一种被广泛用于模拟肠上皮屏障的体外模型,山奈酚曾被报道具有增强Caco-2单细胞层紧密连接完整性的作用[10]。研究还发现,山奈酚可减轻脱氧雪腐镰刀菌烯醇(DON)导致的肠道屏障损伤,通过增强Caco-2单层细胞跨膜电阻值(transepithelial electrical resistance,TEER),增加Claudin-3和ZO-1的表达水平来改善紧密连接完整性,从而维持肠道屏障稳态[11]。
3.1.4 原花青素B2原花青素B2(proanthocyanidin B2)是一种在自然界广泛存在的天然黄酮类物,有多种药理活性,如抗氧化、抗炎、抗肿瘤、降压、降脂和降血糖等(Fig 2)。原花青素B2安全性较高,可作为药食两用的活性成分,并且在人体的生物利用率也很高。研究发现,原花青素B2能够有效降低TNBS结肠炎小鼠肠道对硫氰酸荧光素-葡聚糖的通透性,提高Claudin-1及ZO-1的表达水平,缓解肠道黏膜屏障损伤,其分子调控机制与黄芩苷相似,也与抑制PI3K/AKT信号通路有关[12]。
3.2 多酚类化合物多酚在自然界来源较广,具有多种药理活性,包括抗炎、抗氧化、抗肿瘤和杀菌等作用。此外,多项研究表明多酚类化合物对结肠炎和结直肠癌等疾病具有潜在保护作用,这可能与其改变肠道微生物区系和改善肠道屏障功能密切相关[13](Fig 3)。
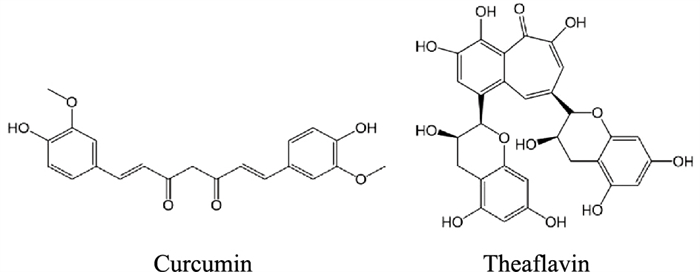
|
| Fig 3 Compound of polyphenol |
从传统中药姜黄、莪术中分离得到的有效成份姜黄素, 可调控炎性免疫反应,且不良反应较少,安全性较高,已被证实可以缓解IBD。此外,研究还发现姜黄素可以增加受损Caco-2单细胞层的TEER值,降低荧光素钠透过率,显著提高Occludin蛋白的表达,进而维护紧密连接屏障的完整[14]。另一研究发现,在Caco-2细胞与分化的THP-1细胞的体外共培养模型中,姜黄素可明显增加紧密连接蛋白ZO-1和Claudin-1的表达,进而减少肠上皮细胞的凋亡,增强了体外共培养模型中肠上皮屏障的完整性,潜在的机制可能是其抑制内质网应激和氧化应激及由此引发的细胞凋亡[15]。
3.2.2 茶黄素茶黄素是儿茶素的氧化偶联二聚体,为红茶中主要的多酚色素。研究发现,茶黄素可以通过激活腺苷酸活化蛋白激酶AMPK,进而减少多肽转运体PEPT1在Caco-2单细胞层的转运来抑制小肽的肠道转运,AMPK的激活与肠上皮屏障功能的维持有着密切的关系[16]。Park等[17]的研究也证明,茶黄素可通过激活AMPK通路来增加紧密连接蛋白Occludin、Claudin-1和ZO-1的表达,同时降低肠道荧光素钠透过率,改善肠屏障功能而缓解IBD。
3.3 萜类化合物萜类化合物作为天然产物中品种最为丰富的一类化合物,具有抗肿瘤、抗炎和杀菌等广泛药理活性(Fig 4)。
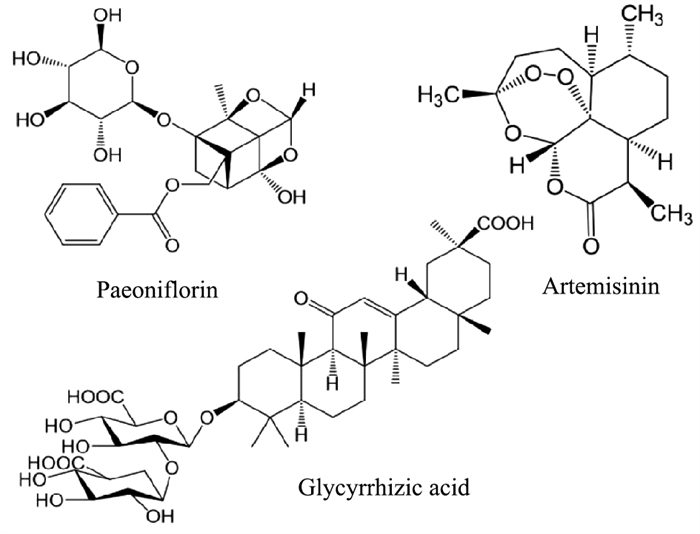
|
| Fig 4 Compounds of terpenoid |
芍药苷为一种单萜类糖苷化合物,存在于中药植物芍药的根茎中,可降糖、抗肿瘤和调节免疫。在LPS刺激的Caco-2单细胞层模型中,芍药苷可明显提高TEER值,降低FITC-葡聚糖的通透性,并改善Occludin、ZO-1和Claudin-5的表达下调。同时,芍药苷可抑制LPS刺激所诱导的环氧合酶2(COX-2)、诱导型一氧化氮合酶(iNOS)、TNF-α和IL-6的表达,其机制可能与激活Nrf2/HO-1信号传导途径,进而抑制NF-κB信号传导有关[18]。肌球蛋白轻链激酶(MLCK)过度激活可导致紧密连接蛋白的表达下降,进而加重肠上皮屏障紊乱。在TNF-α刺激的Caco-2单细胞层模型中,芍药苷呈剂量依赖性地抑制了MLCK的诱导型表达,同时抑制了紧密连接蛋白ZO-1的表达减少,进而恢复肠上皮紧密连接屏障功能[19]。
3.3.2 青蒿素青蒿素是从菊科植物黄花蒿叶中提取分离到的一种具有过氧化基团结构的倍半萜内酯化合物,具有调节免疫、抗炎和抗肿瘤等生物活性。在LPS诱导的IEC-6细胞损伤模型中,青蒿素可减轻肠上皮细胞通透性,并剂量依赖性地上调紧密连接蛋白Occludin、Claudin-1和ZO-1的表达,这些作用与其抑制TLR4/MyD88/NF-κB信号通路相关[20]。
3.3.3 甘草酸传统中药甘草在治疗“久痢”具有良好的效果,甘草酸是甘草和炙甘草的质控成分,为萜类化合物中的三萜类皂苷类,可抗炎、减轻肝毒性以及增强肠道药物吸收。有研究表明,甘草酸能够剂量依赖性地增强DSS诱导的UC模型小鼠肠黏膜紧密连接屏障功能,降低肠黏膜通透性,同时能够有效抑制小鼠结肠组织中紧密连接蛋白Occludin、Claudin-2及Claudin-4的异常表达与错误定位[21]
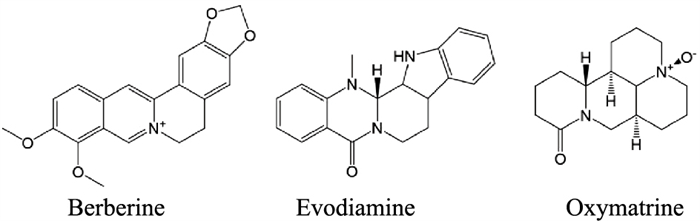
3.4 生物碱类化合物 3.4.1 小檗碱小檗碱是从中药黄连的根茎中分离而出的季铵生物碱,可抗炎、杀菌、缓解腹泻和调节免疫系统(Fig 5)。小檗碱可以促进多种原因引起的肠道黏膜屏障损伤的修复,降低肠壁通透性,维持肠屏障功能,在实验性UC模型中发挥良好的预防和治疗作用。我们先前的研究表明,小檗碱治疗可改善DSS-结肠炎小鼠的肠道屏障功能,抑制紧密连接蛋白ZO-1、E-cadherin和Occludin的下调,同时降低结肠组织中MPO的活性和促炎细胞因子(IL-6、IL-1β和TNF-α)的表达[22]。He等[23]通过LPS诱导大鼠肠道炎症模型,结果显示小檗碱可明显抑制大鼠回肠组织中紧密连接蛋白Occludin和Claudin-1的表达降低,这与小檗碱激活IGF-1/IGFBP-3信号通路有关。
|
| Fig 5 Compound of alkaloid |
从天然植物吴茱萸的成熟果实中提取得到的生物碱类化合物吴茱萸碱,在抗肿瘤、抗炎、镇痛、抑菌和降血脂等方面具有良好作用(Fig 5)。研究表明,吴茱萸碱可以修复TNBS诱导的结肠炎大鼠结肠的黏膜破坏。在LPS刺激的Caco2细胞中,吴茱萸碱可以减轻荧光素标记葡聚糖FD-4的通透率,增加TEER值,增加紧密连接蛋白ZO-1和Occludin的表达,机制与其抑制NF-κB信号通路和NLRP3炎性小体相关[24]。
3.4.3 氧化苦参碱氧化苦参碱源自苦参根茎,在抗炎、抗肿瘤和心血管保护方面发挥良好效果(Fig 5)。有研究显示,氧化苦参碱可治疗DSS诱导的大鼠结肠炎。ROCK通路具有许多典型的下游因子,例如MLC和NF-κB,二者在IBD的发病机理中起着重要作用[25]。在一项研究中发现,氧化苦参碱呈剂量依赖性的上调UC模型小鼠肠上皮内紧密连接蛋白ZO-1和Occludin表达[26],可能与其抑制RhoA/ROCK信号通路有关。
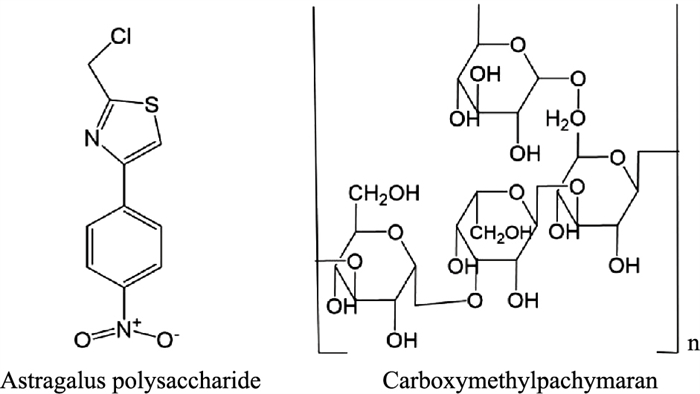
3.5 糖类化合物 3.5.1 黄芪多糖黄芪多糖从豆科植物黄芪根茎内的提取分离而得,在抗炎、抗病毒、抗肿瘤、保护肝肾和调节免疫等方面疗效良好(Fig 6)。在DSS诱导的大鼠UC模型中,黄芪多糖可提高Occludin和ZO-1的表达来降低肠黏膜通透性和修复肠道上皮损伤,这一作用还体现在黄芪多糖有效减低了UC模型大鼠血清内毒素、D-乳酸以及二胺氧化酶的水平,其作用机制与调节Bcl-2、Bax蛋白有关[27]。另有研究表明,黄芪多糖与苦参碱对TNBS诱导的大鼠UC模型具有协同保护作用,两者合用可逆转溃疡性结肠炎大鼠结肠与肺组织中ZO-1与Occludin表达减少,降低UC大鼠便血指数评分,增加体质量,并有效改善结肠和肺组织病理损伤[28]。
|
| Fig 6 Compound of saccharide |
茯苓在临床上常用于治疗胃肠道疾病,其主要活性成分茯苓多糖对胃肠道疾病有良好的防治作用(Fig 6)。β-茯苓聚糖与氯乙酸可在碱性条件中反应产生的一种水溶性良好的小分子化合物羧甲茯苓多糖。在TNF-α刺激的Caco-2单细胞层损伤模型中,羧甲基茯苓多糖有效逆转了细胞紧密连接损伤,表现为显著升高Caco-2单细胞层TEER值,以及上调Occludin和ZO-3蛋白表达表达,机制可能与抑制NF-κB调控的MLCK-p-MLC信号通路有关[29]。
3.5.3 芦荟多糖芦荟是一种药用价值极高的天然植物,可通过调节紧密连接蛋白来减轻DSS诱导的大鼠结肠炎。芦荟多糖类物质存在于芦荟叶片凝胶中,具有抗炎、抗辐射、调节免疫和改善溃疡病等作用。芦荟多糖可通过上调Nrf2/HO-1信号通路和增加短链脂肪酸代谢改善小鼠急性结肠炎,并呈剂量依赖的方式增加结肠炎小鼠肠上皮细胞中ZO-1和Occludin的表达,维持肠屏障内稳态[30]。
4 总结与展望众多天然小分子化合物对肠上皮黏膜屏障都有积极的调节作用,提示在开发IBD治疗药物时,可以把同时具备改善肠屏障功能和抗炎效应的天然小分子作为候选化合物。尽管天然小分子化合物在治疗IBD中有很大的潜力,但仍需要更多的研究来确定它们的安全性、有效剂量以及体内药代动力学参数等。此外,大多数天然小分子调控紧密连接蛋白的上游信号通路不明确,靶点研究仍是重点和难点工作。因此,把天然产物来源的小分子化合物转化为安全有效和作用机制明确的IBD治疗新药仍将面临重大挑战。
| [1] |
Pouillon L, Travis S, Bossuyt P, et al. Head-to-head trials in inflammatory bowel disease: past, present and future[J]. Nat Rev Gastroenterol Hepatol, 2020, 17(6): 365-76. doi:10.1038/s41575-020-0293-9 |
| [2] |
Neurath M. Current and emerging therapeutic targets for IBD[J]. Nat Rev Gastroenterol Hepatol, 2017, 14(11): 688. doi:10.1038/nrgastro.2017.138 |
| [3] |
Paradis T, Bègue H, Basmaciyan L, et al. Tight Junctions as a key for pathogens invasion in intestinal epithelial cells[J]. Int J Mol Sci, 2021, 22(5): 2560. doi:10.3390/ijms22052560 |
| [4] |
Mravec B. Pathophysiology of inflammatory bowel diseases[J]. N Engl J Med, 2021, 384(14): 1377-8. |
| [5] |
Otani T, Furuse M. Tight junction structure and function revisited[J]. Trends Cell Biol, 2020, 30(10): 805-17. doi:10.1016/j.tcb.2020.08.004 |
| [6] |
Mehandru S, Colombel J F. The intestinal barrier, an arbitrator turned provocateur in IBD[J]. Nat Rev Gastroenterol Hepatol, 2021, 18(2): 83-4. doi:10.1038/s41575-020-00399-w |
| [7] |
Zhu L, Shen H, Gu P Q, et al. Baicalin alleviates TNBS-induced colitis by inhibiting PI3K/AKT pathway activation[J]. Exp Ther Med, 2020, 20(1): 581-90. doi:10.3892/etm.2020.8718 |
| [8] |
Jian C, Ren Z, Jian W, et al. Protective effects of baicalin on LPS-induced injury in intestinal epithelial cells and intercellular tight junctions[J]. Can J Physiol Pharmacol, 2015, 93(4): 233-7. doi:10.1139/cjpp-2014-0262 |
| [9] |
吴轶. 葛根素基于黏蛋白调控缓解肠黏膜屏障损伤的机制[D]. 南昌: 南昌大学, 2018. Wu Y. Mechanism of puerarin relieving injury of intestinal mucosal barrier based on mucin regulation[D]. Nanchang: Nanchang Univ, 2018. |
| [10] |
Ren J, Lu Y, Qian Y, et al. Recent progress regarding kaempferol for the treatment of various diseases[J]. Exp Ther Med, 2019, 18(4): 2759-76. |
| [11] |
Wang X, Li L, Zhang G. A proteomic study on the protective effect of kaempferol pretreatment against deoxynivalenol-induced intestinal barrier dysfunction in a Caco-2 cell model[J]. Food Funct, 2020, 11(8): 7266-79. doi:10.1039/D0FO01579B |
| [12] |
姜从桥, 朱平胜, 时依, 等. 原花青素B2对三硝基苯磺酸结肠炎模型小鼠肠炎及肠屏障的保护作用[J]. 南方医科大学学报, 2019, 39(7): 778-83. Jiang C, Zhu P, Shi Y, et al. Protective effect of procyanidin B2 on intestinal barrier and against enteritis in a mouse model of trinitrobenzene sulphonic acid-induced colitis[J]. J Southern Med Univ, 2019, 39(7): 778-83. |
| [13] |
Zhang W, Q S, Xue X, et al. Understanding the gastrointestinal protective effects of polyphenols using foodomics-based approaches[J]. Front Immunol, 2021, 12: 671150. doi:10.3389/fimmu.2021.671150 |
| [14] |
王改, 王娜, 郝京霞. 姜黄素对肠上皮细胞屏障损伤保护作用的研究[J]. 胃肠病学, 2016, 21(1): 26-9. Wang G, Wang N, Hao J X. Study on the protective effect of curcumin on intestinal epithelial cell barrier injury[J]. Chin J Gastroentero, 2016, 21(1): 26-9. |
| [15] |
Zhou X, Ren M, Yang J, et al. Curcumin improves epithelial barrier integrity of Caco-2 monolayers by inhibiting endoplasmic reticulum stress and subsequent apoptosis[J]. Gastroenterol Res Pract, 2021, 2021: 5570796. |
| [16] |
Takeda J, Park H Y, Kunitake Y, et al. Theaflavins, dimeric catechins, inhibit peptide transport across Caco-2 cell monolayers via down-regulation of AMP-activated protein kinase-mediated peptide transporter PEPT1[J]. Food Chem, 2013, 138(4): 2140-5. doi:10.1016/j.foodchem.2012.12.026 |
| [17] |
Park H Y, Kunitake Y, Hirasaki N, et al. Theaflavins enhance intestinal barrier of Caco-2 cell monolayers through the expression of AMP-activated protein kinase-mediated Occludin, Claudin-1, and ZO-1[J]. Biosci Biotechnol Biochem, 2015, 79(1): 130-7. doi:10.1080/09168451.2014.951027 |
| [18] |
Wu X X, Huang X L, Chen R R, et al. Paeoniflorin prevents intestinal barrier disruption and inhibits lipopolysaccharide (LPS)-Induced Inflammation in Caco-2 cell monolayers[J]. Inflammation, 2019, 42(6): 2215-25. doi:10.1007/s10753-019-01085-z |
| [19] |
王亮, 杨芳, 回斯美, 等. 芍药苷抑制肌球蛋白轻链激酶缓解肠上皮细胞屏障功能紊乱[J]. 中国药理学通报, 2017, 33(11): 1541-5. Wang L, Yang F, Hui S M, et al. Paeoniflorin inhibits myosin light chain kinase and alleviates intestinal epithelial barrier dysfunction[J]. Chin Pharmacol Bull, 2017, 33(11): 1541-5. doi:10.3969/j.issn.1001-1978.2017.11.013 |
| [20] |
孙俊波, 赵璐, 史素琴, 等. 青蒿素减轻LPS诱导的肠上皮细胞屏障功能损伤的实验研究[J]. 中国病理生理杂志, 2016, 32(7): 1285-90. Sun J B, Zhao L, Shi S Q, et al. Effects of artemisinin on intestinal epithelial cell barrier function induced by LPS[J]. Chin J Pathophysiol, 2016, 32(7): 1285-90. doi:10.3969/j.issn.1000-4718.2016.07.021 |
| [21] |
衡宇. 甘草酸调节紧密连接蛋白修复溃疡性结肠炎肠黏膜屏障损伤的药理作用研究[D]. 西安: 第四军医大学, 2017. Heng Y. Pharmacological effect of glycyrrhizin regulating tight junction protein in repairing intestinal mucosal barrier injury in ulcerative colitis[D]. Xian: Fourth Military Med Univ, 2017 |
| [22] |
Zhang L C, Wang Y, Tong L C, et al. Berberine alleviates dextran sodium sulfate-induced colitis by improving intestinal barrier function and reducing inflammation and oxidative stress[J]. Exp Ther Med, 2017, 13(6): 3374-82. doi:10.3892/etm.2017.4402 |
| [23] |
He Y, Yuan X, Zhou G, et al. Activation of IGF-1/IGFBP-3 signaling by berberine improves intestinal mucosal barrier of rats with acute endotoxemia[J]. Fitoterapia, 2018, 124: 200-5. doi:10.1016/j.fitote.2017.11.012 |
| [24] |
Shen P, Zhang Z, Zhu K, et al. Evodiamine prevents dextran sulfate sodium-induced murine experimental colitis via the regulation of NF-κB and NLRP3 inflammasome[J]. Biomed Pharmacother, 2019, 110: 786-95. doi:10.1016/j.biopha.2018.12.033 |
| [25] |
Zhao H, Sun X, Tong J. Role of ROCK/NF-κB/AQP8 signaling in ethanolinduced intestinal epithelial barrier dysfunction[J]. Mol Med Rep, 2020, 22(3): 2253-62. doi:10.3892/mmr.2020.11318 |
| [26] |
Wang Y, Shou Z, Fan H, et al. Protective effects of oxymatrine against DSS-induced acute intestinal inflammation in mice via blocking the RhoA/ROCK signaling pathway[J]. Biosci Rep, 2019, 39(7): BSR20182297. doi:10.1042/BSR20182297 |
| [27] |
潘伟杰, 张连峰, 李良. 黄芪多糖对溃疡性结肠炎大鼠的作用及其机制研究[J]. 新中医, 2019, 51(9): 13-6. Pan W J, Zhang L F, Li L. Effect of astragalus polysaccharide on ulcerative colitis in rats and its mechanism[J]. J New Chin Med, 2019, 51(9): 13-6. |
| [28] |
Yan X, Lu Q G, Zeng L, et al. Synergistic protection of astragalus polysaccharides and matrine against ulcerative colitis and associated lung injury in rats[J]. World J Gastroenterol, 2020, 26(1): 55-69. doi:10.3748/wjg.v26.i1.55 |
| [29] |
Zhang J, Lu Y, Wei J, et al. Protective effect of carboxytmethylpachymaran on TNF-α-induced damage in Caco-2 cell monolayers[J]. Int J Biol Macromol, 2016, 93(Pt A): 506-11. |
| [30] |
Liu C, Hua H, Zhu H, et al. Aloe polysaccharides ameliorate acute colitis in mice via Nrf2/HO-1 signaling pathway and short-chain fatty acids metabolism[J]. Int J Biol Macromol, 2021, 185: 804-12. doi:10.1016/j.ijbiomac.2021.07.007 |

