


2. 安徽医科大学第一附属医院药剂科,安徽 合肥 230032
 ,
WANG Yan-yan2,
SUN Ran1,
ZHOU Hui-min1,
JI Peng-min1,
KONG Liang-liang1,
LI Wei-ping1,
LI Wei-zu1
,
WANG Yan-yan2,
SUN Ran1,
ZHOU Hui-min1,
JI Peng-min1,
KONG Liang-liang1,
LI Wei-ping1,
LI Wei-zu1

2. Dept of Pharmacy, the First Affiliated Hospital of Anhui Medical University, Hefei 230032, China
2型糖尿病(type 2 diabetes mellitus,T2DM)可由多种原因引起,其病理生理过程是胰岛素相对分泌不足或胰岛素抵抗导致葡萄糖利用障碍,而后期则会出现胰岛素绝对分泌不足,从而导致血糖水平持续升高[1]。糖脂代谢紊乱是T2DM的重要特征,该病可以导致包括眼睛、肾脏、心脏和血管等多个组织器官的损害,产生慢性病变并逐渐加重,且该病还能引起神经系统病变如神经元损伤以及出现认知功能障碍,增加患阿尔茨海默病(Alzheimer′s disease,AD)的概率。越来越多研究表明,AD和T2DM之间有比以前认为的更强的相似性[2-3],部分学者甚至将该神经疾病理解为3型糖尿病[4]。胰岛素影响着脑内的糖代谢,其受体广泛存在于海马神经元,而海马体是边缘系统调节学习、记忆、行为功能的重要组织之一,海马结构和功能的损伤可能影响着T2DM患者的学习记忆能力。总体来说,T2DM患者会增加患AD的概率,其机制可能是T2DM引起糖脂代谢障碍导致神经元的炎症和损伤,进而引起和促进AD的发生发展。因此,阐明T2DM导致学习记忆和神经元损伤的机制及寻找能改善T2DM导致的神经元损伤的药物具有至关重要的意义。
人参皂苷Rg1(Rg1)能够抗衰老、改善记忆和提高学习能力,它提取于人参,是其活性成分之一。研究发现,Rg1能降低糖代谢,调节由胰岛素诱导的肝糖原的生成[5]。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)由p38丝裂原活化蛋白激酶(p38 MAPK)、C-Jun N末端激酶(c-Jun N-terminal kinase,JNK)和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)这3个亚家族组成,在炎症反应中发挥着重要的调节作用[6]。神经元炎症在神经变性的发病机制中起着重要作用,众所周知,在机体细胞胞质内存在一种受体NLRP1,是炎症反应的关键组成部分。我们前期研究发现,Rg1通过NLRP1炎症小体明显减轻SAMP8小鼠的大脑受损[7]。另外,人参皂苷Rg1在不同的细胞系和实验动物模型中,通过其下调MAPK信号的能力显示出巨大的治疗潜力[8]。然而,人参皂苷Rg1通过介导MAPK通路治疗糖尿病引起的神经炎症的机制尚不清楚。基于此,本研究以MAPK-NLRP1通路为切入点,研讨Rg1对高脂所致T2DM鼠的神经细胞受损和记忆力下降的作用。
1 材料 1.1 动物8周龄C57BL/6小鼠(雄性,18~22 g)被饲养在光/暗周期为12 h、温度(22~24 ℃)和湿度(40%~70%)适宜的动物房中,可以自由摄取食物和水。本实验所有程序均按照安徽医科大学动物伦理委员会批准的规程进行。
1.2 药物与试剂人参皂苷Rg1(货号:DR0009)由德思特公司生产;免疫染色封闭液(货号:P0102)、Hoechst 33258(货号:C1018)、细胞衰老β-gal染色试剂盒(货号:C0602)均由碧云天公司生产;PrimeScript RT Master Mix(货号:RR036A)由TaKaRa公司生产;高脂饲料(货号:XTHF45-1)由协同生物公司生产;链脲霉素(货号:S8050)由索莱宝公司生产。
1.3 实验仪器CFX96 Touch PCR System(美国Bio-Rad公司);Morris water maze(上海软隆科技公司);血糖仪(长沙Sinocare公司);组织包埋机、组织脱水机、冰冻组织切片机、全自动轮转切片系统(德国莱卡公司);自动数字玻片扫描仪(匈牙利3D HISTECH公司)。
2 方法 2.1 动物分组及造模小鼠被分为7组(n=12):空白对照(Control)组、高脂(HFD)对照组、模型(HFD+STZ)组、人参皂苷Rg1(1,5,10 mg·kg-1)组、二甲双胍(Metformin,200 mg·kg-1)组,在进行7 d的适应性喂养后开始实验。在前8周里,从所有的小鼠中随机地选择12只小鼠作为空白对照组,给予它们正常的饮食,其他的则高脂喂养,两个月后从高脂饮食鼠中任意选12只为高脂组,剩下的在禁食8 h后腹腔注射110 mg·kg-1(0.1 mL·10g-1)的STZ(链脲霉素,溶于枸橼酸缓冲液)溶液,空白对照组和已选出的高脂饮食组腹腔注射相同量的溶剂,72 h后,测量空腹血糖值(fast blood glucose, FBG) (测量前禁食8 h,水正常给予), 若FBG≥16.8 mmol·L-1,则说明T2DM小鼠模型制造成功,若FBG<16.8 mmol·L-1,则再次注射链脲霉素溶液,直到剩下的所有小鼠造模成功。将T2DM小鼠随机分到剩下5组中,按以下要求给药8周:Rg1(1、5、10 mg·kg-1)组和二甲双胍组给予相应剂量药物,其他3组给予等量的0.5% CMC-Na溶液(0.1 mL·10 g-1,灌胃)。
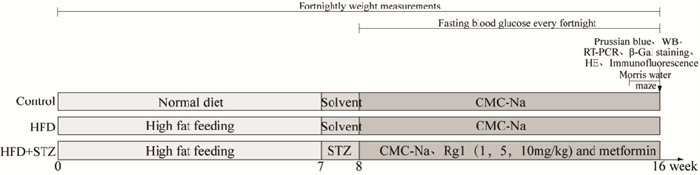
|
| Fig 1 Schematic diagram showing experimental protocol |
每半个月测量体质量,造模成功后每半个月鼠尾取血检测FBG。
2.3 Morris水迷宫(MWM)半径和高度均为0.6 m的圆形黑水桶和顶部的视频跟踪系统组成了Morris水迷宫,里面装有适量的水。用两条相互垂直的线将游泳池分成4个象限,在第三象限距离水面下方2 cm处固定直径为10 cm的圆形逃生平台。MWM测试包括连续4日每日在固定时间进行训练实验。在此期间,将小鼠轮流放置在四个象限且头朝壁,让它们1 min找到平台并记下平均逃避潜伏期(MEL,s),若找不到就帮助其到平台并让它们对平台的位置记忆10 s。第5天进行探测实验,移除平台,将小鼠放到第一象限,给予小鼠1 min的时间去找前4天第三象限里逃生平台的位置,ANY-maze跟踪软件记录和分析鼠在平台位置所在象限内的游水时长(STP,s)、第一次找到并经过原来平台所在位置的潜伏期(LFP,s)和通过的次数(NCP)等,以评估记忆能力。
2.4 HE染色取小鼠脑组织浸泡于4%多聚甲醛中,1 d后脱水包埋并切割成5 μm的切片脱蜡水合后用苏木精-伊红(HE)染色技术处理,仔细观察皮层和海马CA1和CA3区域的病理情况并进行比较。
2.5 β-半乳糖苷酶(β-Gal)染色取小鼠左侧半脑,用OCT包埋、冷冻,用冷冻切片机制备10 μm脑组织切片,滴加β-Gal染色固定液盖住组织15 min,PBS将切片稍微润洗后滴加数滴现配的染色工作液,放在避光切片盒里盖上盖子37 ℃孵育过夜,盒子里可装有少量水以防止切片上的染液蒸发。第2天去染液后润洗并封片,使用自动数字玻片扫描仪拍摄,评估β-Gal活性以指示小鼠脑衰老情况。
2.6 普鲁士蓝染色切片脱蜡后用普鲁士蓝染色液覆盖组织,室温染1 h后洗3遍,每遍数分钟,用核固红染液染色5 min后洗去染液,将洗好的切片依次放在梯度酒精中静置几分钟后用C6H4(CH3)2透明,盖上盖玻片后用玻片扫描仪拍照。
2.7 免疫荧光检测T2DM小鼠脑内NEUN和NLRP1的共定位及表达石蜡切片脱蜡至水,随后用0.25% TritonX-100渗透半小时,用1% BSA包裹切片1 h后稍微抖干,用一抗NEUN(1 ∶ 200)或NLRP1 (1 ∶ 200)覆盖组织,于4 ℃避光的条件下孵育,24 h后用PBS溶液将切片上的一抗洗干净,滴加相应二抗覆盖组织,室温遮光孵育1 h,1 h后洗去二抗,覆盖上Hoechest 33258染液,室温遮光孵一刻钟后洗去染液,抗荧光封片,并使用智能组织切片成像分析系统进行观察和记录。
2.8 RT-PCR检测组织内mRNA取20 mg小鼠的脑组织和裂解液充分研磨,结束后混匀匀浆液,14 000 g离心2 min,加入等体积结合液到裂解液中,混合液经纯化柱,12 000 g离30 s,弃滤液。用600 μL洗涤液Ⅰ 12 000 g离心30 s来洗涤纯化柱。弃废液后用600 μL洗涤液Ⅱ洗涤纯化柱2次,16 000 g离心2 min,弃废液。将RNA纯化柱放入RNA洗脱管中,加入50 μL洗脱液放置3 min,16 000 g离心30 s,最终得到即为RNA。制备PCR反应液,使用荧光定量PCR仪进行检测,反应条件为:95 ℃ 3 s后接着60 ℃ 30 s(40 cycles)。分析各分子mRNA相对表达水平。各引物序列见Tab 1。
| Gene | Forward(5′-3′) | Reverse(5′-3′) |
| ASC | GTCACAGAAGTGGACGGAGTG | CTCATCTTGTCTTGGCTGGTG |
| caspase-1 | AGAGGATTTCTTAACGGATGCA | TCACAAGACCAGGCATATTCTT |
| NLRP1 | AGACAACAATCAGGAGCCGAACAC | GTCAACCATCTCAGCAGTCACAGG |
| β-Actin | CTACCTCATGAAGATCCTGACC | CACAGCTTCTCTTTGATGTCAC |
称取0.05 g脑组织,加入0.6 mL预冷的现配裂解液,用冷冻研磨机将组织磨碎,裂解、离心后,上清液即为总蛋白。在进行蛋白质浓度定量和蛋白变性后,用10% SDS聚丙烯酰胺凝胶电泳分离蛋白,随后用200 mA的电流转膜适当时间。用TBST配制5%脱脂奶粉,将膜放进奶粉中常温浸泡2 h,接着用TBST将膜摇床上摇洗数次,总计时间约为0.5 h即可,最后将膜放入一抗,4 ℃慢摇18 h左右后洗膜,将膜放进一抗相应的二抗孵1 h后显影,使用ImageJ分析蛋白条带。
2.10 统计学处理所有的计量资料均以x±s表示。使用GraphPad Prism 6.0软件分析统计差异,采用单因素方差分析比较各组间的差异。
3 结果 3.1 Rg1治疗对T2DM小鼠体质量、血糖的影响Fig 2A结果显示,HFD组小鼠体质量明显高于control组(P < 0.01),说明高脂饲料喂养能够明显增加小鼠体质量,T2DM小鼠出现了体质量下降的情况,Rg1 10 mg·kg-1治疗组能够改善T2DM小鼠体质量下降,但效果不如Metformin组(P < 0.01)。Fig 2B的FBG结果显示,HFD组出现了较为明显的胰岛素抵抗(P < 0.01),血糖的变化说明了Rg1 5和10 mg·kg-1都有减缓T2DM小鼠血糖增加的作用,但效果不如Metformin组(P < 0.01)。
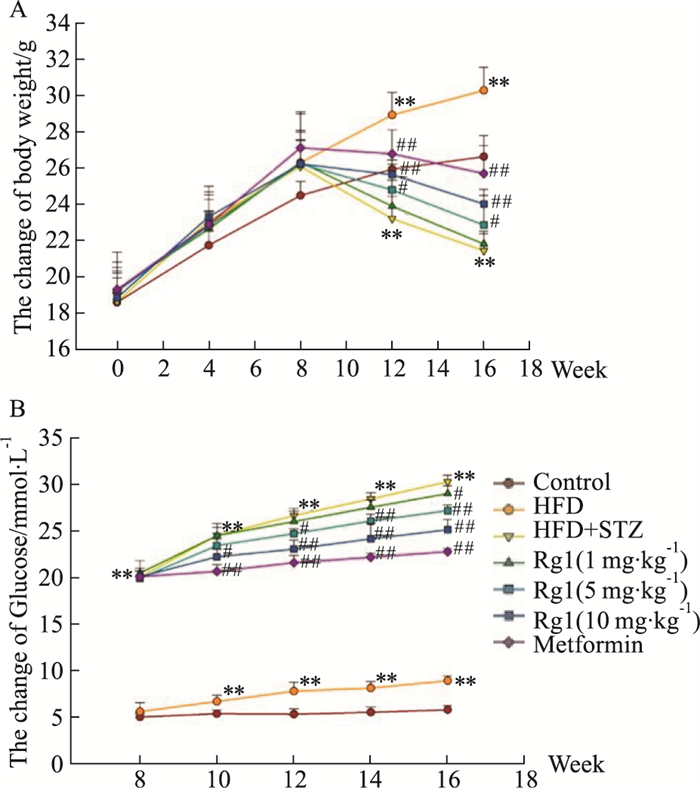
|
| Fig 2 Regulation of body weight and blood glucose in T2DM mice by Rg1 treatment (x±s, n=10) A: 0-16 weeks of body weight; B: 8-16 weeks of fasting blood glucose. **P < 0.01 vs Control group; #P < 0.05, ##P < 0.01 vs HFD+STZ group. |
相较于空白对照组,高脂对照组小鼠的平均逃逸潜伏期没有明显区别,T2DM模型组小鼠明显延长,而所有治疗组都有所减少,特别是Rg1 10 mg·kg-1最明显(Fig 3A-D, P < 0.05或P < 0.01)。在d 1-4的训练中,小鼠的平均逃逸潜伏期随着训练时间增加而下降,说明训练有效(Fig 3A-D, P < 0.05或P < 0.01)。Fig 3E表示d 5的水迷宫实验中典型轨迹图,由图中结果可得,相较于空白对照组小鼠,高脂对照组没有明显区别,而T2DM模型组小鼠第一次经过平台的潜伏期明显延长,在平台所在象限的存在时长以及经过次数明显下降,(Fig 3F-H, P < 0.01)。在经过Rg1不同剂量治疗后的小鼠在平台所在象限存在的时间有所延长,经过平台所在象限的次数有所增加,第一次经过平台的潜伏期也缩短了(Fig 3F-H, P < 0.01)。灌胃给药二甲双胍的小鼠的表现也有所好转,但其疗效仍然不及Rg1 10 mg·kg-1组(Fig 3F-H, P < 0.05或P < 0.01)。这些结果表明,Rg1治疗能明显提高T2DM鼠的学习记忆能力。
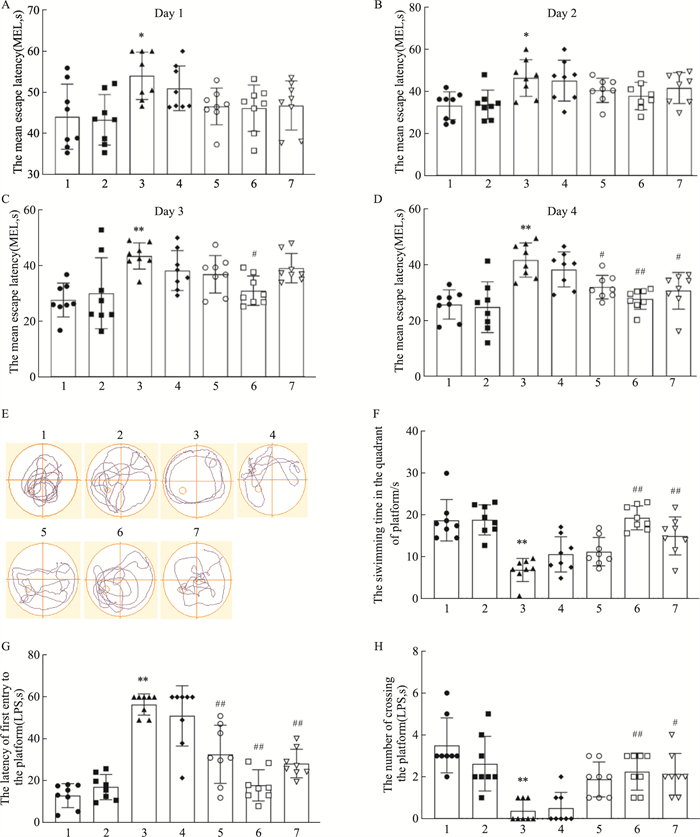
|
| Fig 3 Effects of Rg1 treatment on cognitive function in T2DM mice (x±s, n=8) 1:Control; 2:HFD; 3:HFD+STZ; 4:Rg1(1 mg·kg-1); 5:Rg1(5 mg·kg-1); 6:Rg1(10 mg·kg-1); 7:Metformin. A-D: Average escape duration in the training test; E: Swim trajectory in the Morris water maze test; F: Length of swim in the quadrant where the platform is located; G: Latency of first entry to the platform; H: Number of platform entries. *P < 0.05, **P < 0.01 vs Control group; #P < 0.05, ##P < 0.01 vs HFD+STZ group. |
空白对照组和高脂对照组呈现小鼠皮层和海马神经元数目较多,形态饱满,多数细胞都偏圆,没有明显的核固缩,细胞构造完好,核仁分明。T2DM模型组小鼠显现明显的病理损伤,胞体形状不规则,细胞之间排列繁杂混乱,呈梭形,出现核固缩及深染。所有的治疗组都能够明显改善患病小鼠海马、皮质部位的核固缩等神经元损伤的现象(Fig 4)。
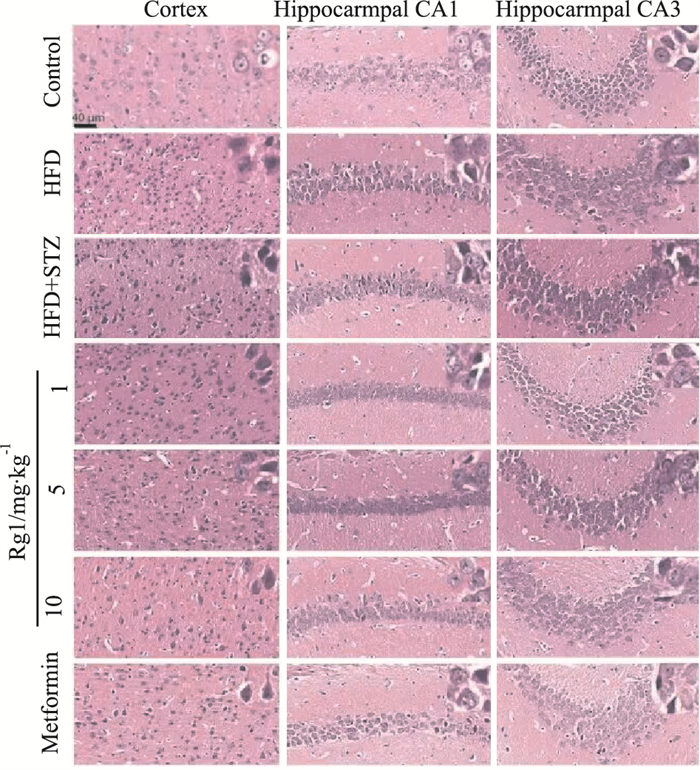
|
| Fig 4 The morphological changes in cortical and hippocampal pathology after Rg1 treatment in T2DM mice (×400) |
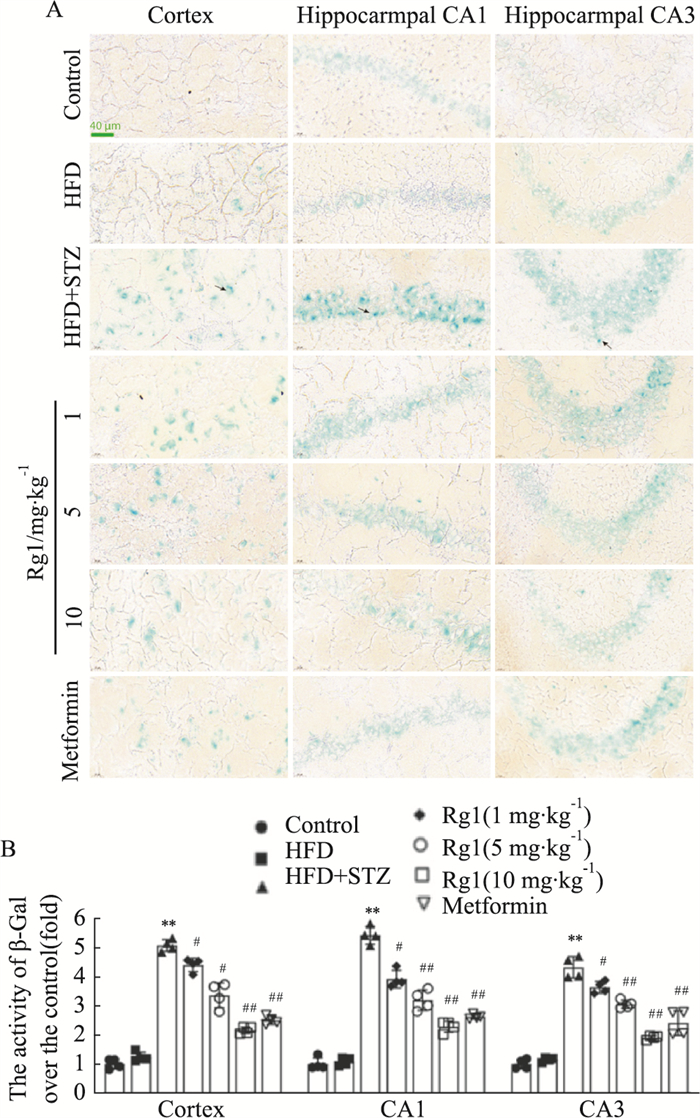
高脂对照组小鼠大脑内衰老的神经细胞与空白对照组数量相似。T2DM模型组小鼠与空白对照组相比,其皮层和海马相同位置中表达β-半乳糖苷酶的神经细胞明显增多,进一步实验显示,对于糖尿病导致的神经细胞衰老,Rg1 10 mg·kg-1在所有治疗组中效果最佳(Fig 5A, B, P < 0.05或P < 0.01)。
|
| Fig 5 Changes in number of senescent neurons in cortex and hippocampus of T2DM mice after Rg1 treatment (x±s, n=4) A: The results of β-gal staining; B: Activity of β-Gal in various regions. **P < 0.01 vs Control group; #P < 0.05, ##P < 0.01 vs HFD+STZ group. |
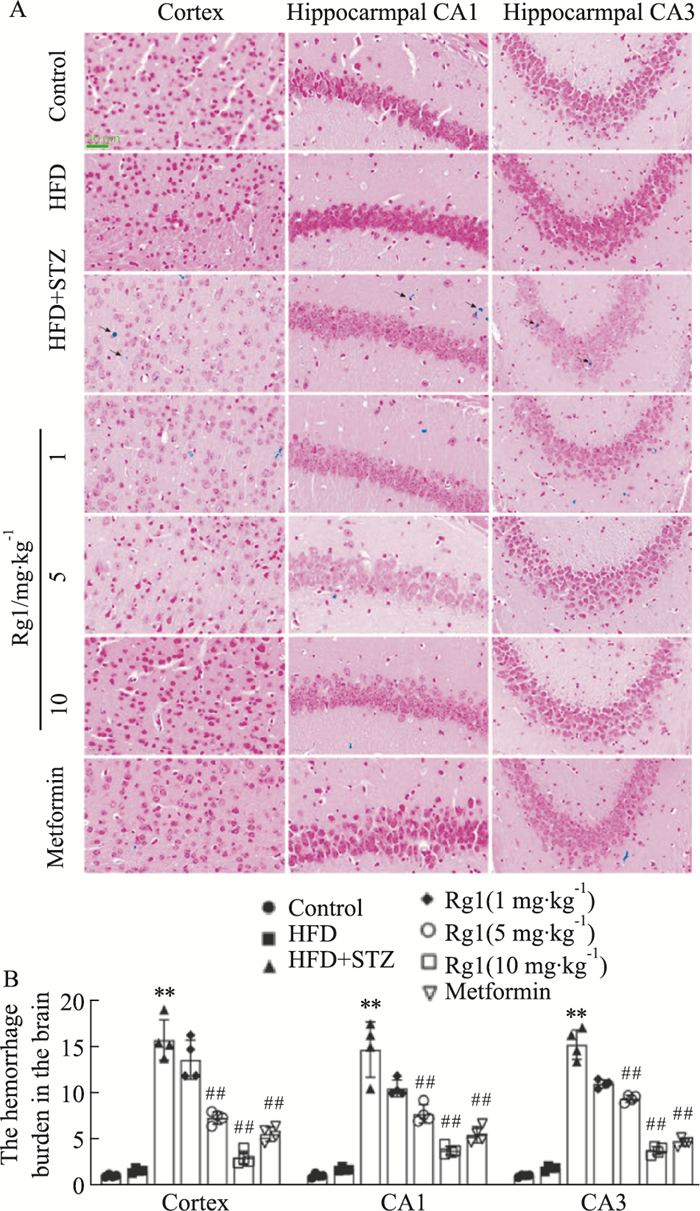
普鲁士蓝染色结果显示,空白对照组和高脂对照组小鼠大脑皮质、海马CA1区和CA3区几乎没有出血点(黑色箭头指示的蓝色斑点)。而相较于空白对照组,T2DM模型组小鼠皮质、海马CA1区和CA3区则出现了一些的出血点,Rg1和二甲双胍治疗能够改善T2DM小鼠皮质、海马CA1区和CA3区出血现象,且Rg1 10 mg·kg-1的效果优于二甲双胍(Fig 6A-B, P < 0.05或P < 0.01)。
|
| Fig 6 Effects of Rg1 treatment on cerebral cortex and hippocampal vascular lesions in T2DM mice (x±s, n=4) A: Prussian blue staining (×400); B: Hemorrhage in the studied area of the brain. **P < 0.01 vs Control group; ##P < 0.01 vs HFD+STZ group. |
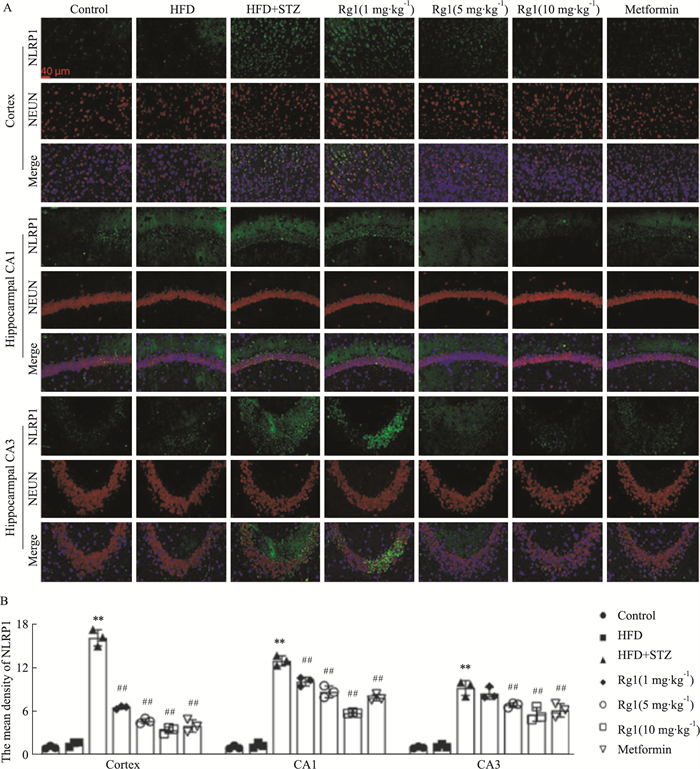
免疫荧光染色结果显示,NEUN在细胞核中表达,细胞共同表达NEUN和NLRP1。NLRP1主要在T2DM小鼠的大脑皮质和海马神经细胞中表达(Fig 7A),NLRP1在空白对照组和高脂对照组的小鼠皮层和海马内表达较少且两组之间无显著性差异(Fig 7B, P>0.05),在T2DM模型组中,可以观察到NLRP1表达明显增加(Fig 7B, P < 0.01),在给予二甲双胍和Rg1的治疗组中均发现NLRP1的表达减少,其中Rg1 10 mg·kg-1组在所有用药组中降低NLRP1表达的程度最明显。
|
| Fig 7 Effects of Rg1 treatment on colocalization and expression of NEUN and NLRP1 in cerebral cortex and hippocampus of T2DM mice (x±s, n=3) A: Expression of NEUN and NLRP1 in the various regions of the brain studied in T2DM mice (immunofluorescence, ×400); B: Relative expression of NLRP1 in various regions of the brains of the studied T2DM mice **P < 0.01 vs Control group; ##P < 0.01 vs HFD+STZ group. |
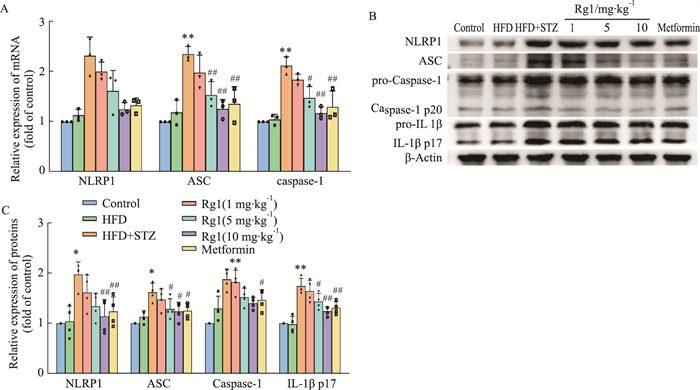
PCR实验检测出高脂饮食组相比于空白对照组caspase-1, NLRP1, ASC相应mRNA的表达程度上无明显的差异,T2DM模型组相比于空白对照组其相应的mRNA明显增加,且所有的治疗组其相应mRNA的表达均有所减少(Fig 8 A-C, P < 0.05或P < 0.01)。Western blot实验结果表明,与空白对照组小鼠相比,高脂对照组小鼠大脑内NLRP1相关的炎症蛋白的表达没有明显变化,T2DM模型组相比于空白对照组,caspase-1,NLRP1,IL-1β,ACS蛋白有着更多的表达,而药物治疗都能够有效减少患病鼠脑内这些蛋白的表达量。(Fig 8 D-H, P < 0.05或P < 0.01)
|
| Fig 8 Role of Rg1 on expression of IL-1β, ASC, caspase-1 and NLRP1 in brain of T2DM mice (x±s, n=3 or 4) A: Relative mRNA expression of NLRP1, ASC and caspase-1(n=3); B: Protein bands of NLRP1, ASC, caspase-1, and IL-1β; C: Relative protein expression of NLRP1, ASC, caspase-1, and IL-1β(n=4). *P < 0.05, **P < 0.01 vs Control group; #P < 0.05, ##P < 0.01 vs HFD+STZ group. |
Western blot实验表明,高脂对照组小鼠脑内p-ERK、ERK、p-JNK、JNK、p-P38、P38、p-GSK-3β和GSK-3β蛋白的表达与和空白对照组无明显差别。T2DM模型组小鼠脑内p-ERK、p-JNK、p-P38和p-GSK-3β蛋白的表达相较于对照组明显升高,而Rg1与二甲双胍治疗能够降低这些蛋白在脑内的表达(Fig 9A-I, P < 0.05或P < 0.01)。
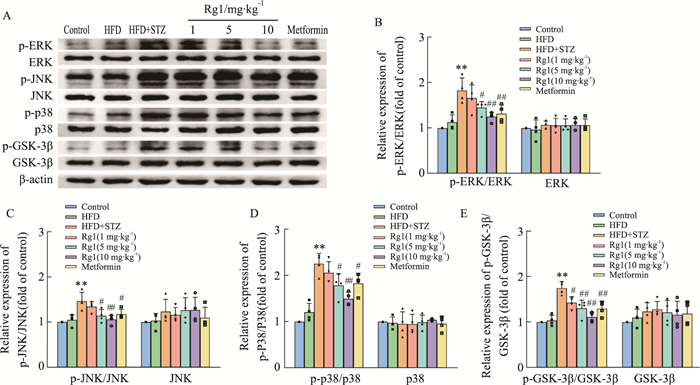
|
| Fig 9 Effects of Rg1 on expressions of p-ERK, p-JNK, p-P38, p-GSK-3β in brain tissue of T2DM mice (x±s, n=4) A: Protein bands of p-ERK, ERK, p-JNK, JNK, p-P38, P38, p-GSK-3β, GSK-3β; B: Relative protein expression of p-ERK/ERK; C: Relative protein expression of p-JNK/JNK; D: Relative proteins of p-P38/P38; E: Relative protein expression of p-GSK-3β/GSK-3β. **P < 0.01 vs Control group; #P < 0.05, ##P < 0.01 vs HFD+STZ group. |
众所周知,T2DM是代谢异常综合征的一种,具体来说主要是由胰岛素相对缺乏造成的,通常伴有体质量减轻、高脂血症和持续性高血糖等症状[9]。而持续性高血糖的并发症其中之一就是高血糖诱导的认知功能障碍[10]。本研究观察到,在HFD喂养8周后的小鼠体质量明显高于对照组,在注射STZ后T2DM小鼠FBG也明显升高,而体质量减轻,这些结果表明成功建立了T2DM小鼠模型。然而,用Rg1治疗明显逆转了T2DM引起的小鼠体质量减轻和糖脂代谢功能障碍,表明Rg1在高血糖治疗中具有一定的积极作用。与上述结果一致,T2DM模型组的小鼠在HE、MWM实验中也有神经元明显受损的情况和认知功能障碍的行为表现,Rg1治疗可以逆转神经元细胞的变性损伤,恢复T2DM模型组小鼠的探索和记忆能力。
细胞衰老源于细胞受到应激,据报道,糖尿病和细胞衰老会导致恶性循环,从而促进T2DM及其并发症的发展[11]。Senolytic是近年来进入临床试验一种药物,通过靶向清理机体中衰老凋亡的细胞,解决衰老导致的一些生理问题,包括T2DM导致的认知问题[12]。此外,有研究显示,T2DM由于持续性高血糖和高血脂等糖脂代谢障碍导致脑血管破裂的风险很高,这可能加剧神经元变性和认知功能障碍[13]。在本研究中我们发现T2DM模型组小鼠相比于空白对照组小鼠脑内神经元β-gal的活性和出血区域明显增加,表明T2DM模型组小鼠出现了明显的神经元老化损伤和脑内微血管的破裂出血等变化。而用Rg1治疗则明显降低了T2DM模型小鼠脑中神经元β-gal的活性及微血管破裂出血病变的发生率。这些研究结果进一步解释了Rg1恢复T2DM模型小鼠的行为功能也许与减缓微血管病变和神经元衰老有关。
除了上述的脑血管病变外,现有研究还证实神经炎症和氧化应激是导致T2DM病人认知障碍的重要原因[14]。另有研究说到,有一种机制是大量促炎因子分泌引起的持续性炎症[15]。NLRP1是一种NOD样受体家族蛋白,在外部刺激时被激活,并招募下游ASC和caspase-1以形成炎性小体。然后,caspase-1通过自我裂解激活,产生成熟的IL-1β,从而启动炎症反应[16]。实验中,相比于模型组,Rg1治疗抑制了NLRP1小体的活化。免疫荧光实验数
据也显示,相较于空白对照组,模型组小鼠大脑中NLRP1蛋白明显增多,而Rg1用药后能够明显降低它的表达。其中,在炎症、胰岛素抵抗和T2DM的过程中,丝裂原激活蛋白激酶(MAPK)信号通路起着关键作用。Zu等[17]证明了T2DM和AD的共享关键通路是“MAPK”,并推测槲皮素通过靶向MAPK信号传导在T2DM中具有治疗作用。因此,我们推测Rg1可能通过作用于MAPK通路来抑制T2DM诱发的NLRP1炎症体的活化从而改善神经元损伤和学习记忆。本研究进一步检测了T2DM鼠脑内MAPK相关蛋白的表达,结果表明,T2DM明显激活了脑组织中MAPK信号通道,而Rg1减少了患T2DM小鼠脑内的p-ERK等蛋白。上述结果意味着MAPK-NLRP1通路可能在T2DM导致的小鼠认知能力下降和神经细胞受损中意义重大,而Rg1可以通过抑制T2DM导致的MAPK-NLRP1信号激活,改善认知能力下降和神经细胞衰老损伤等情况。
综上所述,人参皂苷Rg1对T2DM诱导的学习记忆和神经元损伤有明显减轻作用,其机制是人参皂苷Rg1抑制MAPK通路的磷酸化,减少脑内NLRP1炎症体活化,减轻神经细胞的炎症,从而减小T2DM对神经元的损伤,提高小鼠的学习记忆能力。
| [1] |
王艳丽, 宁宇, 丁莹, 等. 针药结合干预2型糖尿病胰岛素抵抗的研究进展[J]. 针灸临床杂志, 2023, 39(4): 103-6. Wang Y L, Ning Y, Ding Y, et al. Advances in combining needle and medicine to intervene in insulin resistance in type 2 diabetes[J]. J Clin Acupuncture Moxibustion, 2023, 39(4): 103-6. |
| [2] |
Zhang D, Lei Y, Gao J, et al. Right frontoinsular cortex: a potential imaging biomarker to evaluate T2DM-induced cognitive impairment[J]. Front Aging Neurosci, 2021, 13: 674288. doi:10.3389/fnagi.2021.674288 |
| [3] |
Walker J M, Harrison F E. Shared neuropathological characteristics of obesity, type 2 diabetes and Alzheimer's disease: impacts on cognitive decline[J]. Nutrients, 2015, 7(9): 7332-57. doi:10.3390/nu7095341 |
| [4] |
Steen E, Terry B M, Rivera E J, et al. Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease-is this type 3 diabetes?[J]. Alzheimers Dis, 2005, 7(1): 63-80. doi:10.3233/JAD-2005-7107 |
| [5] |
Liu Q, Zhang F G, Zhang W S, et al. Ginsenoside Rg1 inhibits glucagon-induced hepatic gluconeogenesis through Akt-FoxO1 interaction[J]. Theranostics, 2017, 7(16): 4001-12. doi:10.7150/thno.18788 |
| [6] |
周慧敏, 张洁, 黄蕾, 等. 人参皂苷Rg1通过抑制NOX4/MAPK通路减轻棕榈酸钠诱导HMCs细胞的纤维化[J]. 中国药理学通报, 2023, 39(5): 917-25. Zhou H M, Zhang J, Huang L, et al. Ginsenoside Rg1 attenuates palmitate-induced HMCs fibrosis by inhibiting NOX4/MAPK pathways[J]. Chin Pharmacol Bull, 2023, 39(5): 917-25. |
| [7] |
Chen Y L, Ding S X, Zhang H. Protective effects of ginsenoside Rg1 on neuronal senescence due to inhibition of NOX2 and NLRP1 inflammasome activation in SAMP8 mice[J]. Funct Foods, 2020, 65: 103713. doi:10.1016/j.jff.2019.103713 |
| [8] |
Arafa E A, Refaey M S, Abd El-Ghafar OAM, et al. The promising therapeutic potentials of ginsenosides mediated through p38 MAPK signaling inhibition[J]. Heliyon, 2021, 7(11): e08354. doi:10.1016/j.heliyon.2021.e08354 |
| [9] |
Salem M A, Matta L F, Tantawy A A, et al. Single photon emission tomography (SPECT) study of regional cerebral blood flow in normoalbuminuric children and adolescents with type 1 diabetes[J]. Pediatr Diabetes, 2002, 3(3): 155-62. doi:10.1034/j.1399-5448.2002.30306.x |
| [10] |
Knight E M, Martins I V, Gumusgoz S, et al. High-fat diet-induced memory impairment in triple-transgenic Alzheimer's disease (3xTgAD) mice is independent of changes in amyloid and tau pathology[J]. Neurobiol Aging, 2014, 35(8): 1821-32. doi:10.1016/j.neurobiolaging.2014.02.010 |
| [11] |
Ghiso J, Frangione B. Amyloidosis and Alzheimer's disease[J]. Adv Drug Deliv Rev, 2002, 54(12): 1539-51. doi:10.1016/S0169-409X(02)00149-7 |
| [12] |
Baglietto-Vargas D, Shi J, Yaeger D M, et al. Diabetes and Alzheimer's disease crosstalk[J]. Neurosci Biobehav Rev, 2016, 64: 272-87. doi:10.1016/j.neubiorev.2016.03.005 |
| [13] |
Chavda V, Vashi R, Patel S. Cerebrovascular complications of diabetes: SGLT-2 inhibitors as a promising puture pherapeutics[J]. Curr Drug Targets, 2021, 22(14): 1629-36. doi:10.2174/1389450121666201020163454 |
| [14] |
Dove A, Shang Y, Xu W, et al. The impact of diabetes on cognitive impairment and its progression to dementia[J]. Alzheimers Dement, 2021, 17(11): 1769-78. doi:10.1002/alz.12482 |
| [15] |
Franc D T, Kodl C T, Mueller B A, et al. High connectivity between reduced cortical thickness and disrupted white matter tracts in long-standing type 1 diabetes[J]. Diabetes, 2011, 60(1): 315-9. doi:10.2337/db10-0598 |
| [16] |
Chavarria-Smith J, Vance R E. The NLRP1 inflammasomes[J]. Immunol Rev, 2015, 265(1): 22-34. doi:10.1111/imr.12283 |
| [17] |
Zu G, Sun K, Li L, et al. Mechanism of quercetin therapeutic targets for Alzheimer disease and type 2 diabetes mellitus[J]. Sci Rep, 2021, 11(1): 22959. doi:10.1038/s41598-021-02248-5 |