


2. 广东药科大学药学院,广东 广州 510006;
3. 代睿欣中医诊所,广东 广州 510006
2. School of Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, China;
3. Dai Ruixin Clinic of Traditional Chinese Medicine, Guangzhou 510006, China
糖尿病(diabetes mellitus, DM)是全球增长最快的疾病之一,预计到2045年将影响6.93亿成年人,其微血管并发症(如糖尿病肾病(diabetes kidney disease, DKD)、糖尿病视网膜病变等)将会导致DM患者死亡率增加、肾功能衰竭和总体生活质量下降[1]。糖尿病肾病(diabetes kidney disease, DKD)是DM的一种严重且高发的并发症,临床表现为肾小球结节样病变、持续白蛋白尿和肾小球滤过率逐渐下降[2],病理特征是肾小球和肾小管细胞中细胞外基质的积累、肥大和纤维化[3]。我国临床上DKD发病率呈现明显的上升趋势,有统计结果显示,目前全球范围内DKD发病人数约为4亿人,且预计2035年约增至5.92亿,在全球人口中占8%~10%[4]。约有30%~40%的DM患者发展为DKD,其中50% 可进展为终末期肾病(end stage renal disease,ESRD)[5-6]。DKD的发生发展与肾脏纤维化进展息息相关,且肾脏纤维化是各种慢性肾脏疾病的重要病理特征和最终病理结果。转化生长因子-β1(TGF-β1)是介导肾脏纤维化的关键因子,Smads是TGF-β1信号转导通路中下游主要效应分子[7]。研究表明当TGF-β1/Smad信号通路被激活时,机体的生长因子和血管内皮因子表达增多,使得细胞上皮间充质转化和细胞外基质不断沉积,进而促进肾脏纤维化,影响肾功能[8],细胞外基质中存在纤维黏连蛋白(fibronectin, FN)及胶原蛋白(collagen),此二者大量分泌时,将促进肾小球硬化和肾间质纤维化的发生与发展[9]。目前,临床上常通过降低血糖、抑制肾素-血管紧张素-醛固酮系统及降低血压等综合措施干预DKD[10],但易出现低血糖等并发症。因此,开发治疗DKD的新型靶向药物一直是国内外研究的热点。降糖丸(jiangtang Wan,JTW)是广东省中医院代睿欣副主任医师根据多年临床经验得出的简便效廉的方剂,由黄芪、人参、白术、石斛、黄连、葛根、玉竹、天花粉、生地黄等15味中药组成,具有益气健脾、滋阴降火之功效,主治DKD中气阴两虚、脾肾阳虚等辩证。本研究旨在评价降糖丸在链脲佐菌素(streptozotocin,STZ)合并高脂饮食诱导的DKD小鼠中的治疗作用,并探讨降糖丸改善DKD肾损伤及肾间质纤维化的作用机制。
1 材料与方法 1.1 实验动物32只C57BL6/J小鼠,♂,8周龄,质量(20~26) g,SPF级。动物生产许可证号为SCXK(粤)2021-0057,购自广东省医学动物中心。在广东药科大学动物中心饲养。实验设计已经广东药科大学(中国广州)实验室动物伦理委员会论证(动物伦理号:No.gdpulacspf2017619)。
1.2 药物及试剂降糖丸(黄芪、人参、白术、石斛、黄连、葛根、玉竹、天花粉、生地黄等15味中药),饮片购自代睿欣中医诊所,批号为20220608,按比例称取上述饮片制成丸剂;阳性药盐酸二甲双胍片(规格:0.5 g,批号:ACA5354,中美上海施贵宝制药有限公司);羧甲基纤维素钠(批号:20190304,生工生物工程有限公司);葡萄糖(批号:20210901,天津市大茂化学试剂有限公司);STZ(批号:WXBD0304V,美国Sigma公司);Schiff试剂(货号:DG0004,北京雷根生物技术有限公司),0.5%过碘酸溶液(货号:DG0001,北京雷根生物技术有限公司)、血肌酐(批号:20210915,南京建成生物技术研究所)和尿蛋白(批号:20210730,南京建成生物技术研究所)检测试剂盒;高脂饮食(蛋白质19%,脂肪18%,碳水化物50%,广东省医学实验动物中心);FN抗体(Boster,货号:BA1772,批号:153188),GAPDH抗体(Transgen,货号:HC307,批号:Q10301),Smad 3抗体(CST, 货号:9523T,批号:5),p-Smad 3抗体(佰嘉,货号:IPH2281),辣根酶标记山羊抗兔lgG(H+L)(中杉金桥,货号:ZB-2301,批号:229760111),DAB显色液(Thermo Scientific,货号:1856090,批号:UD283195),HRP标记兔二抗(Promega,货号:W01B,批号:0000497927),HRP标记鼠二抗(Promega,货号:W402B,批号:0000502814)。
1.3 仪器One-Touch Ultra型血糖仪(型号:One-Touch Ultra Vue,美国强生);低温高速离心机(型号:cf1524r,美国SCILOGEX)奥林巴斯荧光显微镜(型号:BX51,日本Olympus);多功能酶标仪(型号:1510,美国Thermo Fisher Scientific);微型蛋白电泳转印系统(型号:Power Pac Basic,美国BioRad)。
2 方法 2.1 建立动物模型[11-12]所有小鼠适应性喂养1周,取32只雄性小鼠随机分为4组,每组8只,即为正常对照组、模型组、二甲双胍组(阳性药,200 mg·kg-1)、降糖丸组(1 250 mg·kg-1)。除正常组外,其余小鼠禁食12 h,持续4 d同一时间腹腔注射STZ,50 mg·kg-1,7 d后使用血糖仪检测小鼠空腹血糖,当小鼠空腹血糖值>11.1 mmol·L-1,表示DM模型建立成功,后续用高脂饮食喂养8周,以诱导DKD模型。降糖丸和二甲双胍混悬于0.5%羧甲基纤维素钠(CMC-Na)中,每日固定时间灌胃给药,给药剂量如上所述。同时,正常对照组和模型组给予等量等浓度CMC-Na。持续给药8周后,小鼠禁食不禁水,于代谢笼中收集24 h尿液。最后一次给药后24 h麻醉后眼眶取血,全血在室温条件下静置30 min,以3 000 r·min-1离心15 min得到小鼠血清样本。脱颈椎处死小鼠,取单侧肾脏的一半固定在福尔马林溶液中,4 ℃固定24 h后,以乙醇梯度脱水后包埋在石蜡中,剩余肾脏组织用PBS冲洗,放入液氮速冻后储存于-80 ℃冰箱中。
2.2 生化检测收集小鼠24 h尿液并记录尿液体积。根据试剂盒的说明,检测24 h尿蛋白及血清中血肌酐、TC、TG水平。
2.3 肾脏组织病理学观察取各组肾组织石蜡包埋后,切片厚度为4 μm。随后进行苏木精-伊红(hematoxylin-eosin, HE)染色、马松(masson)染色、糖原(periodic acid-schiff, PAS)染色,使用光学显微镜观察肾脏结构病理改变、肾间质纤维化、肾组织糖原堆积情况并进行组织学分析。
2.4 免疫组化(Immunocytochemistry,IHC)检测小鼠肾组织中FN的表达将小鼠肾脏石蜡切片经二甲苯及梯度乙醇脱蜡后,使用柠檬酸盐缓冲液在高温高压下进行修复,滴加3%过氧化氢室温孵育以阻断内源性过氧化物酶的活性。滴加1% BSA封闭1 h,滴加一抗FN(1∶200),4 ℃过夜,室温孵育二抗1.5 h,PBS涮洗后进行DAB显色,苏木素复染,将组织脱水后用中性树脂封片,于显微镜下观察小鼠肾组织中FN蛋白的表达。
2.5 荧光定量PCR检测肾脏FN、TGF-β1及Ⅳ型胶原蛋白(Collagen Ⅳ)mRNA表达情况每只小鼠取20 mg肾组织研磨后提取总RNA。随后将RNA逆转录为cDNA,进行荧光定量PCR并测定Ct值。扩增条件:95 ℃反应5 min,95 ℃反应10 s,60 ℃反应15 s,72 ℃反应20 s。进行40个周期的循环。结果以β-actin为内参,根据各样本Ct值,使用2-△△Ct法计算目的基因的相对表达量(△Ct=目的基因Ct值-内参基因Ct值)。引物序列详见Tab 1。
| Gene | Primer | Sequences (5′-3′) |
| FN | Forward | GATTGGCGACAAGTGGAG |
| Reverse | TAGGTGAACGGGAGGACA | |
| TGF-β1 | Forward | CCAGATCCTGTCCAAACTAAGG |
| Reverse | CTCTTTAGCATAGTAGTCCGCT | |
| Collagen Ⅳ | Forward | ATGTCAATGGCACCCATCAC |
| Reverse | CTTCAAGGTGGACGGCGTAG | |
| β-actin | Forward | ATGGAGGGGAATACAGCCC |
| Reverse | TTCTTTGCAGCTCCTTCGTT |
剪取小鼠肾脏组织后,加入RIPA裂解液后研磨,离心后收集上清,测定蛋白含量后将总蛋白定量至同一水平。在蛋白样品中加入5×蛋白上样缓冲液,煮沸变性10 min,冷却至室温后上样进行SDS-PAGE凝胶电泳。湿法转膜后封闭,加入一抗、二抗孵育,最后以GAPDH为内参,测定蛋白的相对含量,使用ImageJ软件分析条带的灰度值。
2.7 统计学分析实验数值均使用Graph Prism 9.0软件进行统计分析,以x±s表示,使用单因素方差分析法(One way ANOVA)检测各组间差异, 使用T检验进行两两比较。
3 结果 3.1 降糖丸对DKD小鼠体质量、空腹血糖、肾指数的影响模型组小鼠较正常对照组小鼠体质量明显降低,血糖明显升高。与模型对照组相比,降糖丸组和二甲双胍组小鼠血糖明显下降,并能够明显降低STZ合并高脂饮食引起的肾指数升高(P<0.05)。给药8周后,降糖丸明显降低DKD小鼠空腹血糖(P<0.01)。以上结果说明,降糖丸能够明显改善STZ合并高脂饮食诱发的DKD小鼠肾指数及血糖升高,具有明显的降血糖作用。

|
| Fig 1 Effect of Jiangtang Wan on body weight of DKD mice (x±s, n=6) A: Control group; B: Model group; C: Metformin group; D: JTW group (similarly hereinafter) |
与正常组相比,模型组小鼠24 h尿蛋白量明显上升(P<0.01),血肌酐明显上升(P<0.01),血清中TC、TG含量也明显增加(P<0.01)。给药降糖丸后,DKD小鼠的肾功能明显改善,与模型组小鼠相比,降糖丸组小鼠的24 h尿蛋白量明显降低(P<0.05),血肌酐值明显降低(P<0.01),血清中TC含量明显降低(P<0.01),血清中TG含量明显降低(P<0.01)。这表明降糖丸给药后能明显保护DKD小鼠肾功能,并调节DKD小鼠的脂代谢紊乱,从而发挥对DKD的治疗作用。
| Group | Dose/mg·kg-1 | Fasting blood glucose/mmol·L-1 | Kidney weight/body weight/mg·kg-1 |
| Control | - | 6.663±1.099** | 10.52±0.881 6** |
| Model | - | 22.58±3.631 | 13.73±1.478 |
| Metformin | 200 | 11.15±4.784** | 11.94±1.342* |
| JTW | 1 250 | 11.70±3.826** | 11.57±1.147* |
| *P<0.05, **P<0.01 vs model (similarly hereinafter). | |||
病理染色显示,STZ组小鼠肾组织中肾小球基质增生,系膜扩张,球囊壁粘连,炎性细胞大量浸润;肾间质出现大面积纤维化;肾小球及肾小管出现糖原大量堆积,肾小球基底膜增厚,肾小管基底膜增厚。降糖丸给药后能明显逆转上述变化,尤其体现在改善肾间质纤维化方面,表现类似出阳性药效果。以上结果表明,降糖丸能够良好的改善DKD小鼠体内肾脏病理损伤及肾间质纤维化。
3.4 降糖丸对小鼠肾组织中FN表达的影响模型对照组小鼠肾组织中FN的阳性着色程度明显升高,较对照组差异明显(P<0.01)。与模型组相比,阳性药组及降糖丸给药组均可明显减少小鼠肾脏中FN的阳性表达(P<0.01),提示降糖丸可明显抑制DKD小鼠肾组织中FN的表达。
3.5 降糖丸在转录水平上对DKD小鼠肾组织中FN、TGF-β1、Collagen Ⅳ的影响在mRNA水平上,与对照组相比,模型组FN表达明显升高(P<0.01),TGF-β1明显升高(P<0.01),给药降糖丸后,DKD小鼠肾组织中FN,TGF-β1与Collagen Ⅳ在mRNA水平上均明显下调(P<0.01,P<0.05),提示降糖丸可能是通过调节DKD小鼠肾组织中FN,TGF-β1与Collagen Ⅳ的转录水平表达,从而影响DKD小鼠的疾病发展。
3.6 降糖丸对DKD模型小鼠肾脏FN、Smad 3及p-Smad 3蛋白表达的影响模型对照组小鼠肾脏中FN、Smad 3及p-Smad 3的蛋白表达明显上调,较正常组差异明显(P<0.01或P<0.05);与模型组相比,降糖丸组和二甲双胍组小鼠肾脏组织中FN、Smad 3及p-Smad 3蛋白的表达明显下调(P<0.01),见Fig 4、Tab 6。

|
| Fig 2 Effect of Jiangtang Wan on renal pathological changes in DKD mice (HE, 400×; PAS, 400×; Masson, 400×) |
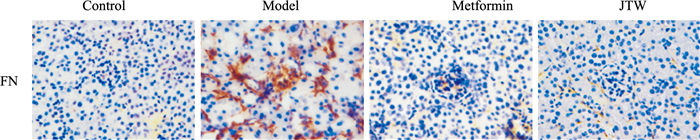
|
| Fig 3 Effect of Jiangtang Wan on expression of FN in renal tissue of mice (IHC, 400×) |

|
| Fig 4 Effect of Jiangtang Wan on protein expression of FN, Smad 3 and p-Smad 3 of DKD mice A: Control group; B: Model group; C: Metformin group; D: JTW group (similarly hereinafter) |
| Group | 24 h urine volume /mL | 24 h-pro/mg·d-1 | Scr /μmol·L-1 | TC/mmol·L-1 | TG/mmol·L-1 |
| Control | 1.14±0.50** | 0.81±0.41** | 17.38±3.63** | 1.69±0.07** | 0.30±0.04** |
| Model | 9.54±6.03 | 6.35±4.81 | 69.89±40.47 | 3.38±0.72 | 1.43±0.13 |
| Metformin | 4.50±5.63 | 2.28±1.77* | 23.45±12.04** | 2.73±0.13 | 0.32±0.13** |
| JTW | 1.46±1.89** | 1.59±1.54* | 19.48±3.34** | 2.10±0.89** | 0.32±0.14** |
| *P<0.05, **P<0.01 vs Normal | |||||
| Group | Dose /mg·kg-1 | Positive area/% |
| Control | - | 2.24±1.99** |
| Model | - | 10.72±2.67 |
| Metformin | 200 | 3.80±2.12** |
| JTW | 1 250 | 2.34±2.23** |
| **P<0.01 vs Model | ||
| Group | Dose/mg·kg-1 | FN/2-△△Ct | TGF-β1/2-△△Ct | Col Ⅳ/2-△△Ct |
| Control | - | 1.00±0.16** | 1.00±0.14** | 1.00±0.22* |
| Model | - | 8.81±3.86 | 3.06±1.19 | 1.54±0.50 |
| Metformin | 200 | 3.12±1.62** | 1.95±0.80* | 0.86±0.30** |
| JTW | 1 250 | 3.22±1.14** | 1.47±0.35** | 0.97±0.28* |
| *P<0.05, **P<0.01 vs Model | ||||
| Group | FN/GAPDH | p-Smad 3/GAPDH | Smad 3/GAPDH |
| Control | 1.00±0.30 ** | 1.00±0.33* | 1.00±0.21** |
| Model | 2.01±0.26 | 1.76±0.43 | 3.02±0.38 |
| Metformin | 0.85±0.16** | 0.73±0.17** | 1.12±0.07** |
| JTW | 0.89±0.13** | 0.70±0.19* | 1.18±0.18** |
| *P<0.05, **P<0.01 vs Model | |||
DM发病机制复杂,但目前研究认为高血糖在DKD的发病早期及晚期中都具有关键作用[13]。高血糖状态可改变细胞内的代谢,包括影响葡萄糖代谢、脂代谢、线粒体呼吸链功能和呼吸链蛋白的解耦连等。病理情况下,持续的高血糖状态会明显增加糖基化终末产物(advanced glycation end products,AGEs),同时,肾功能受损时对AGEs清除能力降低,最终导致AGEs大量蓄积。高血糖状态同时将会激活肾素-血管紧张素-醛固酮系统中的主要活性产物血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ),活化的AngⅡ通过上调TGF-β1促进肾间质纤维化[14],从而参与DKD的发生和发展。目前大量研究表明,DKD患者的治疗应注重严格的血糖控制及高血压治疗,已有报道强化血糖控制可预防2型DM患者发展为终末期肾病[15]。二甲双胍是2型DM降血糖的首选药物,其降血糖作用已经临床证实,但当患者肾功能不全时,二甲双胍的肾脏清除率下降,血浆中二甲双胍浓度上升,增加乳酸性酸中毒风险[16]。临床上,血管紧张素受体阻滞剂(angiotensin receptor blocker, ARB)及钠-葡萄糖协同转运蛋白2抑制剂(sodium glucose cotransporter 2 inhibitor, SGLT2i)也是DKD的常规治疗药物。ARB可发挥抗炎、抗纤维化作用,延缓尿蛋白进展,明显改善肾脏功能,降低心血管疾病风险,控制血压,但对血糖并无影响。SGLT2i类药物能够通过影响线粒体功能明显改善肾功能,延缓慢性肾病发展,同时能够降低血糖,改善DKD患者的高血糖状态[17]。在本研究中,降糖丸能够明显降低DKD小鼠的空腹血糖水平,并且在减少DKD小鼠尿量、降低小鼠24 h尿蛋白、降低小鼠血肌酐、降低TGF-β1表达方面略优于二甲双胍,但对于DKD小鼠血尿素氮并无明显影响。
降糖丸由多味中药组成,其中主要成分为黄芪、人参、白术、石斛、黄连、葛根、玉竹、天花粉、生地黄,本方组成特点在于兼顾阴虚的病机的同时,尤其重视脾胃的功能,与传统中医所认为的阴虚为主要病机有所区别。脾胃是升清降浊的枢纽,脾胃功能受损,气血阴液无法充盛,则表现为阴虚。因此,在治疗DKD时,不仅要注重养阴清热,还必须兼顾脾胃功能,故黄芪、人参、白术的应用是该方的特殊之处;石斛、黄连、葛根、玉竹、天花粉则主要用于清除胃火,同时生地黄能够补肾阴、降肾火。同时,现代药理学研究表明上述药物具有一定的降糖作用[18],可以保护肾脏。综合而言,该方除清肺热外,对清胃热、治疗肾阴亏虚均有兼顾,用以针对目前DM发现较早、肺阴虚表现不明显的情况,顾护中焦,恢复脾胃的升清降浊功能则是本处方的特殊之处,也是对传统中医药理论的创新和发展。
综上所述,本研究证明降糖丸可以减轻病理状态下肾间质纤维化,进而明显延缓DKD的病理进程,其机制可能与抑制TGF-β1与FN的表达有关。然而本研究存在一定的局限性,需要对降糖丸有效成分进行分析,明确降糖丸对于DKD模型中肾脏系膜细胞、肾小管上皮细胞、足细胞、内皮细胞的保护作用,设置多个剂量验证降糖丸的量效关系,探究降糖丸治疗DKD的具体分子机制,使其在患者体内发挥更精准的治疗作用。
| [1] |
Cole J B, Florez J C. Genetics of diabetes mellitus and diabetes complications[J]. Nat Rev Nephrol, 2020, 16: 377-90. doi:10.1038/s41581-020-0278-5 |
| [2] |
Forbes J M, Thorburn D R. Mitochondrial dysfunction in diabetic kidney disease[J]. Nat Rev Nephrol, 2018, 14: 291-312. doi:10.1038/nrneph.2018.9 |
| [3] |
Oshima M, Shimizu M, Yamanouchi M, et al. Trajectories of kidney function in diabetes: A clinicopathological update[J]. Nat Rev Nephrol, 2021, 17: 740-50. doi:10.1038/s41581-021-00462-y |
| [4] |
张玲, 李明, 林红. 蛇床子素对糖尿病肾病大鼠NF-κB信号通路介导的炎症反应的影响[J]. 中华中医药学刊, 2022, 40: 1-13. Zhang L, Li M, Lin H. Effects of osthole on inflammatory response mediated by NF-kB signaling pathway in diabetic nephropathy rats[J]. Chin Arch Tradit Chin Med, 2022, 40: 1-13. doi:10.13193/j.issn.1673-7717.2023.01.046 |
| [5] |
Alicic R Z, Rooney M T, Tuttle K R. Diabetic kidney disease: Challenges, progress, and possibilities[J]. Clin J Am Soc Nephrol, 2017, 12: 2032-45. doi:10.2215/CJN.11491116 |
| [6] |
Yaribeygi H, Katsiki N, Butler A E, et al. Effects of antidiabetic drugs on NLRP3 inflammasome activity, with a focus on diabetic kidneys[J]. Drug Discov Today, 2019, 24: 256-62. doi:10.1016/j.drudis.2018.08.005 |
| [7] |
Sun Z, Ma Y, Chen F, et al. MiR-133b and miR-199b knockdown attenuate TGF-β1-induced epithelial to mesenchymal transition and renal fibrosis by targeting SIRT1 in diabetic nephropathy[J]. Eur J Pharmacol, 2018, 837: 96-104. doi:10.1016/j.ejphar.2018.08.022 |
| [8] |
Lan H Y. Transforming growth factor-β/Smad signalling in diabetic nephropathy[J]. Clin Exp Pharmacol Physiol, 2012, 39: 731-8. doi:10.1111/j.1440-1681.2011.05663.x |
| [9] |
Jie R, Zhu P, Zhong J, et al. LncRNA KCNQ1OT1 affects cell proliferation, apoptosis and fibrosis through regulating miR-18b-5p/SORBS2 axis and NF-κB pathway in diabetic nephropathy[J]. Diabetol Metab Syndr, 2020, 12: 77. doi:10.1186/s13098-020-00585-5 |
| [10] |
Selby N M, Taal M W. An updated overview of diabetic nephropathy: Diagnosis, prognosis, treatment goals and latest guidelines[J]. Diabetes Obes Metab, 2020, 22(Suppl 1): 3-15. |
| [11] |
Ji X, Li C, Ou Y, et al. Andrographolide ameliorates diabetic nephropathy by attenuating hyperglycemia-mediated renal oxidative stress and inflammation via Akt/NF-κB pathway[J]. Mol Cell Endocrinol, 2016, 437: 268-79. doi:10.1016/j.mce.2016.06.029 |
| [12] |
Fan L, Xiao Q, Zhang L, et al. CAPE-pNO(2) attenuates diabetic cardiomyopathy through the NOX4/NF-κB pathway in STZ-induced diabetic mice[J]. Biomed Pharmacother, 2018, 108: 1640-50. doi:10.1016/j.biopha.2018.10.026 |
| [13] |
Anders H J, Huber T B, Isermann B, et al. CKD in diabetes: Diabetic kidney disease versus nondiabetic kidney disease[J]. Nat Rev Nephrol, 2018, 14: 361-77. doi:10.1038/s41581-018-0001-y |
| [14] |
Van Beusekom C D, Zimmering T M. Profibrotic effects of angiotensin Ⅱ and transforming growth factor beta on feline kidney epithelial cells[J]. J Feline Med Surg, 2019, 21: 780-7. doi:10.1177/1098612X18805862 |
| [15] |
Wong M G, Perkovic V, Chalmers J, et al. Long-term benefits of intensive glucose control for preventing end-stage kidney disease: Advance-on[J]. Diabetes Care, 2016, 39: 694-700. doi:10.2337/dc15-2322 |
| [16] |
吴私, 王艳秋, 周华. 药物相关乳酸性酸中毒研究进展[J]. 沈阳药科大学学报, 2022, 39: 1028-35. Wu S, Wang Y Q, Zhou H. Research progress of drug-related lactic acidosis[J]. J Shenyang Pharm Univ, 2022, 39: 1028-35. |
| [17] |
吴金珊. 单细胞测序探讨SGLT2i和ARB类药物对糖尿病小鼠肾脏保护作用及其分子机制[D]. 重庆: 重庆医科大学; 2022. Wu J S. Single-cell RNA sequencing to explore the renal protective effects of SGLT2I and ARB on diabetic mice and molecular mechanisms[D]. Chongqing: Chongqing Med Univ, 2022. |
| [18] |
王宗隅, 范琦强, 赵艳, 等. 中介素改善IgA肾病大鼠肾脏结构和功能以及微血管损伤[J]. 中国药理学通报, 2022, 28: 1559-64. Wang Z Y, Fan Q Q, Zhao Y, et al. Intermedin improves renal structure and function and microvascular injury in IgA nephropathy rats[J]. Chin Pharmacol Bull, 2022, 28: 1559-64. |

