

2. 石河子大学医学院第一附属医院药学部,新疆 石河子 832008
王新春(1969-),女,博士,主任药师,硕士生导师,研究方向:中药民族药新药研究与开发,E-mail: 841175436@qq.com;
曹文疆(1966-),男,硕士,副主任技师,研究方向:临床检验,E-mail: cwjwxc@163.com。
2. Dept of Pharmacy, the First Affiliated Hospital of the Medical College, Shihezi University, Shihezi Xinjiang 832008, China
动脉粥样硬化(atherosclerosis,AS)被认为是一种慢性炎症性疾病,炎症是AS发生发展过程中主要的生理和病理变化的标志[1]。在AS发展早期阶段,多种刺激因素诱导脂质聚集在动脉血管壁部位,诱发的炎症反应,引起细胞黏附,生成脂质斑块,引起平滑肌增殖、迁移,引发巨噬细胞泡沫化,致使细胞破裂死亡,细胞因子释放,炎症反应发生的同时也影响脂质代谢[2-3]。在AS发生发展中,高水平的氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)可以募集单核细胞,从而促进内皮细胞上黏附分子的表达随后单核细胞与内膜的黏附,形成AS斑块[4]。核因子κB (nuclear factor κB,NF-κB)和NOD样受体家族3(NOD-like receptors 3,NLRP3)炎症小体是AS发病机理中炎症和细胞死亡的关键调节因子[5],因此,抑制巨噬细胞中NF-κB的活化可减少泡沫细胞的形成,并且抑制细胞凋亡及炎症的产生[6]。
香青兰(Dracocephalum moldavica L.)是青兰属(Dracocephalum)是唇形科(Lamiaceae)植物的重要成员,新疆地产维吾尔药,资源丰富,维吾尔名为巴迪然吉布亚(Badiranjbuya),主要用于治疗心血管类疾病;香青兰总黄酮(total flavonoids of Dracocephalum moldavica L.,TFDM)为香青兰植物中提取的多种黄酮类成分的混合物,课题组前期研究证明[7],香青兰中的黄酮成分可调节脂质代谢,减少炎症介质的生成,达到抑制炎症的发生或减轻炎症程度,在抗炎,抗氧化,降血脂方面有明显效果,可增加斑块的稳定性,从而起到保护心血管系统的作用。因此本研究基于NF-κB和NLRP3炎症信号通路,探究TFDM调控炎症信号通路抗AS的机制,为预防治疗AS提供新的途径。
1 材料与方法 1.1 材料小鼠RAW264.7巨噬细胞购自于武汉普诺赛公司(CL-0190)。TFDM(新疆自治区药物研究所自知),纯度为57%;辛伐他汀(北京Solarbio公司,批号IS0170),HPLC≥98%。DMEM培养基、胎牛血清(美国Thermo Fisher SCIENTIFIC公司,批号为8119446、26010074);ox-LDL广州奕源生物有限公司,批号20190521);CCK-8试剂盒(北仁化学科技有限公司,批号CK04);IκB α、NF-κB p65、NLRP3、IL-18、IL-1β抗体(美国Abcam,货号分别为ab32518、ab16502、ab214185、ab207323、ab234437);GAPDH、β-actin、山羊抗小鼠IgG、山羊抗兔IgG(北京中杉金桥,货号分别为19F00411、201050827、140193、141987);TNF-α、IL-10 ELISA试剂盒(联科生物有限公司,货号分别为EK282/3-01、EK210/4-03)
1.2 仪器Forma 2系列水套-三气CO2培养箱(美国Thermo Scientific公司);BCM-1000-生物净化工作台(苏州净化设备有限公司);CKX53-倒置型电子显微镜(日本OLYMPUS公司)VE-180-垂直电泳及电转仪(海天能科技有限公司);M200 PRO -多功能酶标仪(瑞士Tecan公司);Gel Doc EZ-Bio- Rad凝胶成像系统(美国Bio-Rad);LightCycler480 Ⅱ-实时荧光定量PCR仪(瑞士Roche公司);TGL-20M-台式高速冷冻离心机(湘仪离心机仪器有限公司);Axio Imager 2-蔡司全自动正置荧光显微镜(德国Zeiss公司);NanoDrop 2000c-微量分光光度计/核酸蛋白测定仪(美国Thermo Scientific公司)。
1.3 方法 1.3.1 细胞培养小鼠RAW264.7巨噬细胞系来自武汉赛诺菲,细胞于DEME完全培养基(含10%胎牛血清、100 kU·L-1青霉素和100 g·L-1链霉素),并置于5% CO2、37 ℃、饱和湿度恒温培养箱培养。
1.3.2 泡沫细胞的建立以25、50、100 mg·L-1 ox-LDL诱导RAW264.7细胞,CCK-8检测细胞活力。同时将RAW264.7巨噬细胞均匀接种于6孔板内,给药处理结束后吸去上清,用预冷的PBS多次洗涤细胞,在细胞表面加入固定液(甲醇或4%多聚甲醛),室温下放置30 min后吸出固定液,用PBS洗2次,待爬片快干时加入提前配好的试剂进行油红O染色。
1.3.3 CCK-8测定细胞毒性将细胞随机分为正常对照组(Normal):10 %的正常;模型对照组(Model):给予50 mg·L-1 ox-LDL培养24 h;TFDM高、中、低剂量组(TFDM-H,TFDM-M组,TFDM-L):分别加100、50、25 mg·L-1 TFDM 1 h后加入终浓度为50 mg·L-1 ox-LDL共同作用24 h;阳性对照组(Simvastatin组):加10 μmol辛伐他汀1 h后加入终浓度为50 mg·L-1 ox-LDL共同作用24 h。处理结束后每孔加入100 μL稀释的CCK-8溶液,继续孵育2 h,检测450 nm处的吸光度值。
1.3.4 油红O染色观察TFDM对巨噬细胞泡沫化的影响取对数生长期的的RAW264.7细胞,按照“2.3”项下进行分组给药处理后进行油红O染色,倒置显微镜下察看并拍照记录,应用Image-Pro Plus 6.0软件计算染色面积。
1.3.5 细胞活性氧的测定取对数生长期的RAW264.7细胞,将细胞接种于24孔板中的细胞爬片上,按照分组进行处理,于细胞培养箱37 ℃、5% CO2下培养24 h后弃去细胞上清液,用PBS洗涤培养板中细胞2次,加入终浓度为10 μmol·L-1的DCFH-DA液1 mL,于37 ℃培养箱内孵育30 min,用无血清培养基洗3次以去除未结合的DCFH-DA,倒置荧光显微镜下拍照并观察结果。使用Image-Pro Plus(IPP)软件分析荧光拍照图片,选择相同测量面积(Area),以细胞内ROS的Sum IOD值作为结果。
1.3.6 ELISA法检测巨噬细胞上清液TNF-α和IL-10的水平根据ELISA试剂盒说明书操作,检测巨噬细胞上清液TNF-α和IL-10炎症因子的表达。
1.3.7 PCR法检测细胞内NF-κB p65、NLRP3、caspase-1、IL-1β和IL-18 mRNA的表达按“2.3”项下方法处理细胞后分别提取各组细胞RNA,逆转录为cDNA,PCR扩增,以GAPDH为内参,采用2-ΔΔCt法计算各目的基因的相对表达量。引物序列及扩增产物长度见Tab 1。
| Gene | Forward | Reverse |
| NF-κB p65 | 5′-agg ctt ctg ggc ctt atg tg-3′ | 5′-tgc ttc tct cgc cag gaa tac-3′ |
| NLRP3 | 5′-att acc cgc ccg aga aag g-3′ | 5′-tcg cag caa aga tcc aca cag-3′ |
| Caspase-1 | 5′-aca agg cac ggg acc tat g-3′ | 5′-tcc cag tca gtc ctg gaa atg-3′ |
| IL-1β | 5′-atg atg gct tat tac agt ggc aa-3′ | 5′-gtc gga gat tcg tag ctg ga-3′ |
| IL-18 | 5′-gac tct tgc gtc aac ttc aag g-3′ | 5′-cag gct gtc ttt tgt caa cga-3′ |
| GAPDH | 5′-acg gca agt tca acg gca cag-3′ | 5′-cag cat act cag cac cag cat cac-3′ |
分组处理后分别提取细胞总蛋白、浆蛋白、核蛋白,采用BCA法测定其蛋白浓度。蛋白经100 ℃变性处理10 min后,经10%SDS-PAGE电泳分离,200 mA湿法转膜至PVDF膜上;5%脱脂奶粉封闭1 h,分别加入一抗:IκBα(1∶1 000)、NF-κB p65(1∶1 000)、NLRP3(1∶500)、caspase-1(1∶1 000)、IL-18(1∶1 000)、IL-1β(1∶1 000)、Histone H3(1∶1 000)、GAPDH(1∶2 000)、β-actin(1∶2 000), 4 ℃孵育过夜,TBST漂洗4次,每次5 min,然后加入二抗(稀释比例1∶20 000),室温孵育1 h,TBST清洗4次,每次5 min;ECL化学发光液法显影,通过ImageJ 1.6.0软件对条带进行灰度值分析。
1.3.9 数据分析与统计采用GraphPad Prism 8.0软件处理数据。数据均用x±s的形式表达,组间比较采用单因素方差分析(ANOVA)及t检验。
2 结果 2.1 泡沫细胞模型的确定给予25、50、100 mg·L-1 ox-LDL诱导RAW264.7细胞24 h后,结果显示ox-LDL浓度在50 mg·L-1时的细胞活力在80%以上;油红O染色结果显示, 正常细胞内未见脂滴;25 mg·L-1诱导的细胞内少见脂滴;50 mg·L-1诱导的细胞脂滴明显增多,环状排列在细胞膜内侧;100 mg·L-1诱导的细胞大多已经破裂凋亡,细胞核明显,脂滴遍布分散。确定建立泡沫细胞模型的最佳刺激浓度为50 mg·L-1,此时细胞内充满橘红色脂滴,细胞形态如同指环,说明泡沫细胞造模成功。
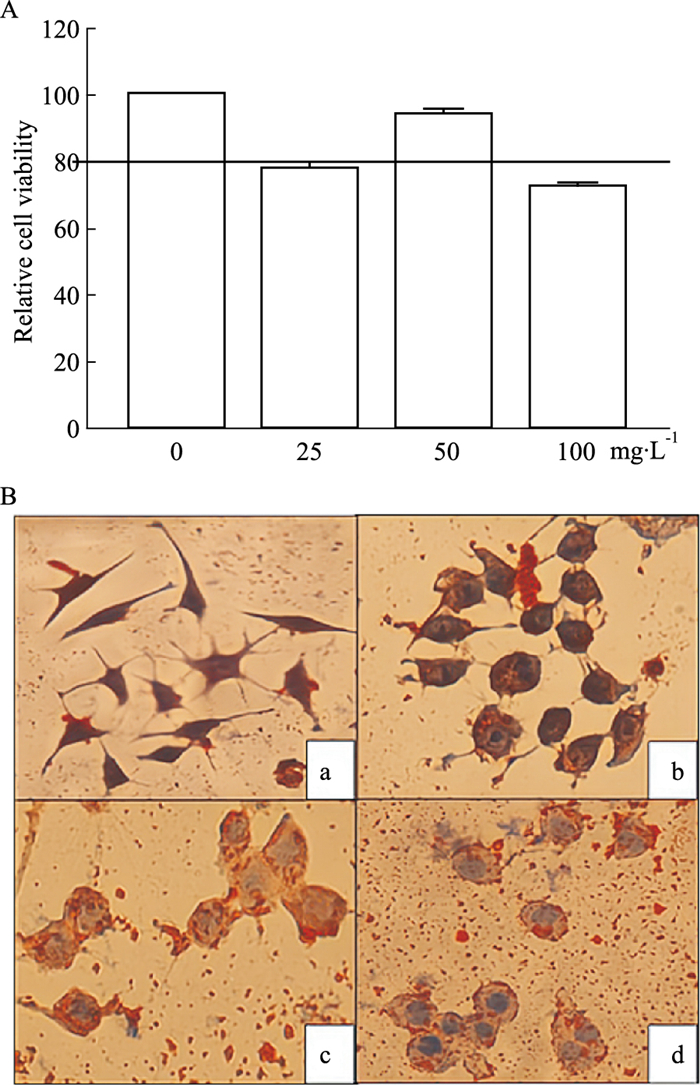
|
| Fig 1 A: Effects of different concentrations of ox-LDL on proliferation of RAW264.7 cells; B: Oil red O staining results (× 400)(x±s, n=3) a: Normal cells.b: 25 mg·L-1 ox-LDL.c: 50 mg·L-1 ox-LDL.d: 100 mg·L-1 ox-LDL. Under the microscope of Zeiss, (× 400) observed and pictures taken. |
结果如Fig 2,分组给药处理后,Model组、TFDM-H组、TFDM-M组、TFDM-L组和Simvastatin组对细胞活力无影响(P>0.05),表明选择的给药浓度合适。
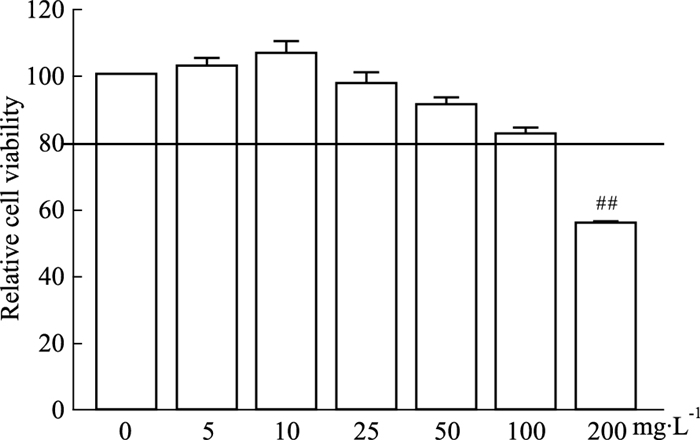
|
| Fig 2 Effect of TFDM on viability of RWA264.7 macrophages induced by ox-LDL (x±s, n=3) ##P < 0.01 vs Normal group. |
油红O染色结果如Fig 3A,脂质会被染成红色,细胞核会被染成蓝色。Normal组细胞内无脂质堆积;Model组细胞内红色明显,大量脂质堆积,巨噬细胞泡沫化明显;TFDM组红色减少,细胞核明显,巨噬细胞泡沫化减轻;Simvastatin组细胞内有少量脂质被染成红色。
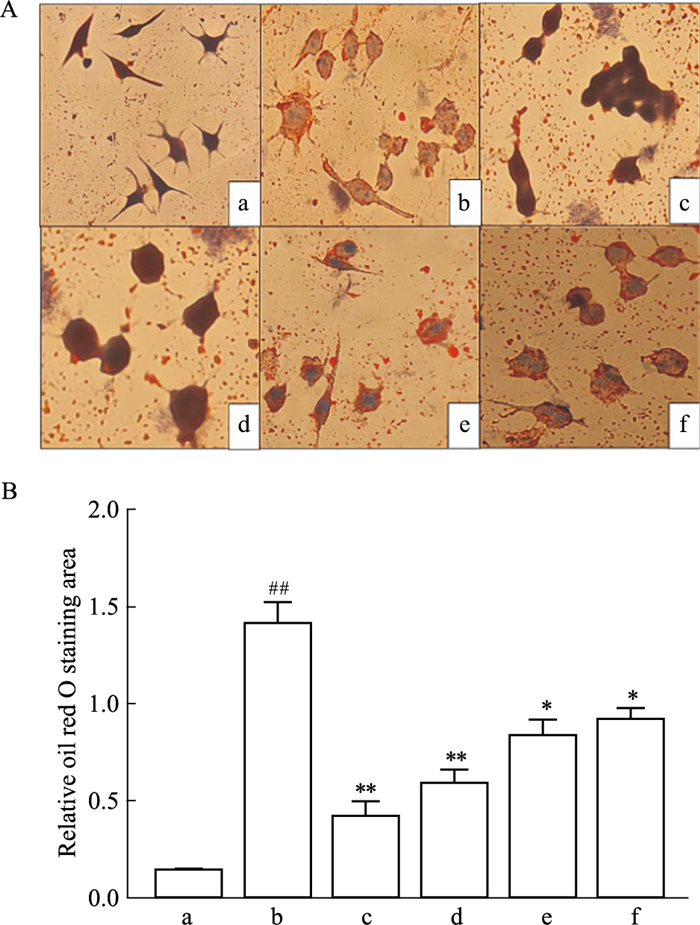
|
| Fig 3 A: Oil red O staining result (× 400); B: Foam cell oil red O area (x±s, n=3) a: Normal; b: Model; c: TFDM-H; d: TFDM-M; e: TFDM-L; f: Simvastatin, Zeiss positive position microscope(×400). ##P < 0.01 vs Normal group; *P < 0.05, **P < 0.01 vs Model group. |
与Normal组相比,Model组泡沫细胞脂质明显,染色面积相对明显较大(P<0.05);与Model组相比,TFDM组脂质染色面积减少(P<0.05);Simvastatin组脂质染色面积减少(P<0.05)。结果表明TFDM可以减少巨噬细胞脂质吞噬从而减轻巨噬细胞的泡沫化。
2.4 TFDM对巨噬细胞活性氧的影响与Normal组相比,Model组细胞内ROS的含量明显增加(绿色荧光增强),统计结果显示差异具有显著性(P<0.01);与Model组相比,TFDM-H组、TFDM-M组及TFDM-L组的细胞胞内ROS的含量下降(绿色荧光明显减弱),统计结果显示差异具有显著性(P<0.05);Simvastatin组细胞胞内ROS的含量明显下降(绿色荧光明显减弱),统计结果显示差异具有显著性(P<0.01);TFDM组与Simvastatin组相比差异无显著性(P>0.05)。实验结果表明TFDM对泡沫化的巨噬细胞中ROS的产生有明显的抑制作用。
2.5 TFDM对巨噬细胞上清液中炎症因子TNF-α和IL-10的影响与Normal组比较,Model组中促炎因子TNF-α表达增加(P<0.001),抑炎因子IL-10表达减少(P<0.001);与Model组比较,TFDM-H组、TFDM-M组及TFDM-L组中促炎因子TNF-α表达均降低(P<0.05),抑炎因子IL-10表达均增加(P<0.05),且呈一定的浓度依赖性;Simvastatin组中TNF-α表达降低(P<0.05),抑炎因子IL-10表达差异无显著性(P>0.05)。
2.6 TFDM对NF-κB p65、NLRP3、caspase-1、IL-1β和IL-18 mRNA表达的影响与Normal组相比,Model组中的NF-κB p65、NLRP3、caspase-1、IL-18以及IL-1β mRNA的表达升高(P<0.01);与Model组相比,TFDM-H组、TFDM-M组及TFDM-L组的NF-κB p65、NLRP3、caspase-1、IL-18和IL-1β mRNA的表达均降低(P<0.05),表明TFDM对泡沫化的巨噬细胞中NF-κB p65、NLRP3、caspase-1、IL-1β和IL-18 mRNA表达有明显的抑制作用;Simvastatin组的NF-κB p65、NLRP3、caspase-1、IL-18和IL-1β mRNA的表达降低(P<0.05);TFDM组与Simvastatin组相比差异无显著性(P>0.05)。
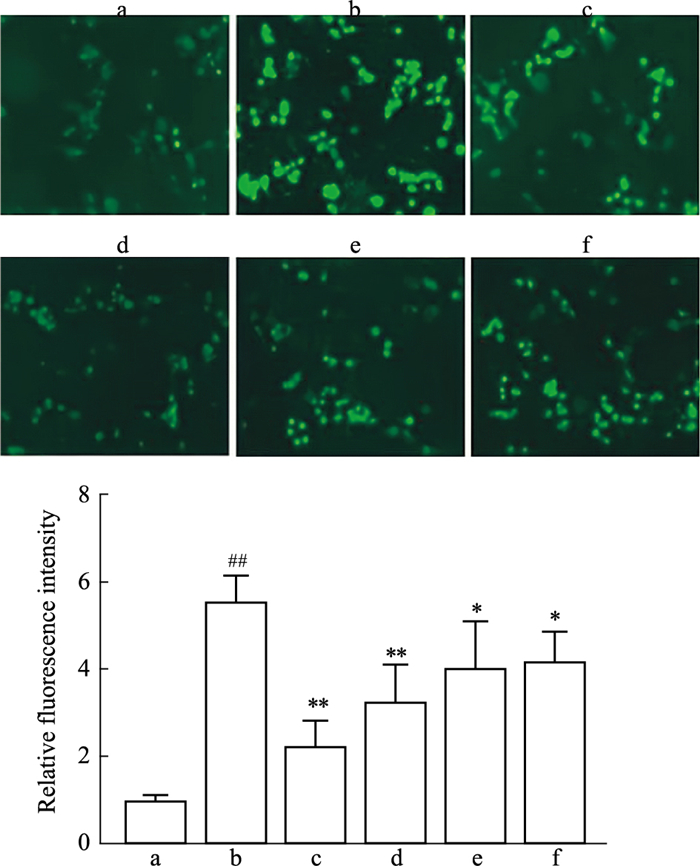
|
| Fig 4 Effect of TFDM on relative fluorescence intensity of ROS in macrophages, Zeiss positive position microscope (200×)(x±s, n=3) a: Normal; b: Model; c: TFDM-H; d: TFDM-M; e: TFDM-L; f: Simvastatin. ##P < 0.01 vs Normal group; *P < 0.05, **P < 0.01 vs Model group. |
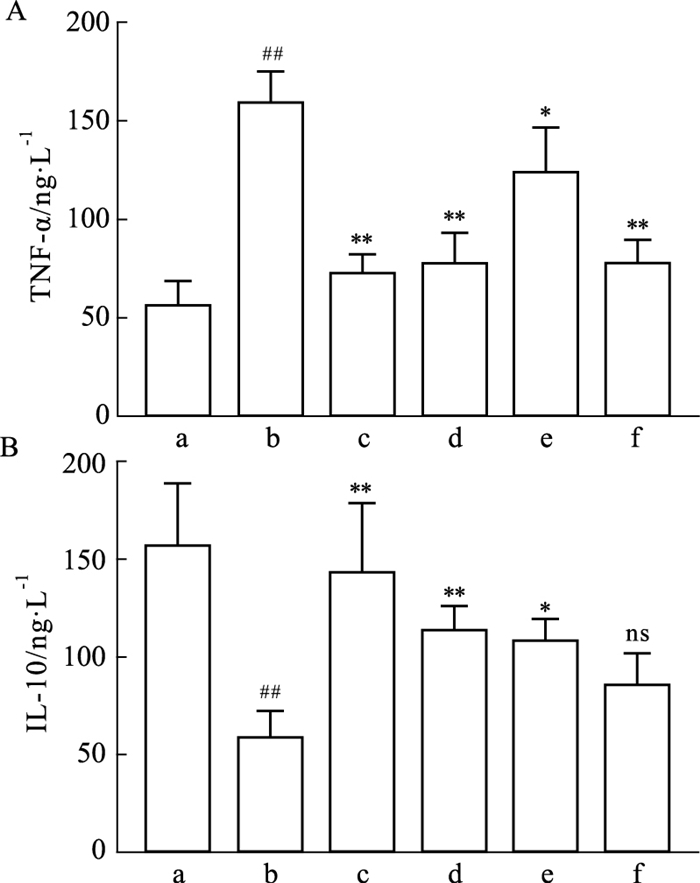
|
| Fig 5 Effect of TFDM on expression of TNF- α and IL-10 in cell supernatant (x±s, n=3) A: Relative expression of TNF-α; B: Relative expression of IL-10. a: Normal; b: Model; c: TFDM-H; d: TFDM-M; e: TFDM-L; f: Simvastatin. ##P < 0.01 vs Normal group; *P < 0.05, **P < 0.01 vs Model group. |
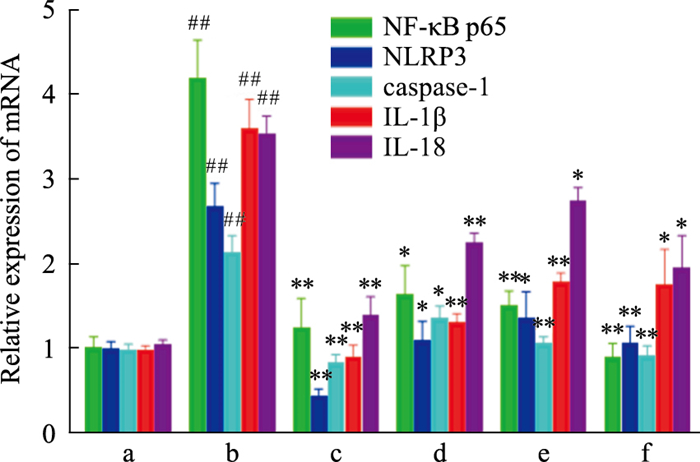
|
| Fig 6 Effect of TFDM on expression of NF-KB p65, NLRP3, caspase-1, IL-1 β and IL-18 mRNA (x±s, n=3) a: Normal; b: Model; c: TFDM-H; d: TFDM-M; e: TFDM-L; f: Simvastatin. #P < 0.05, ##P < 0.01 vs Normal group; *P < 0.05, **P < 0.01 vs Model group. |
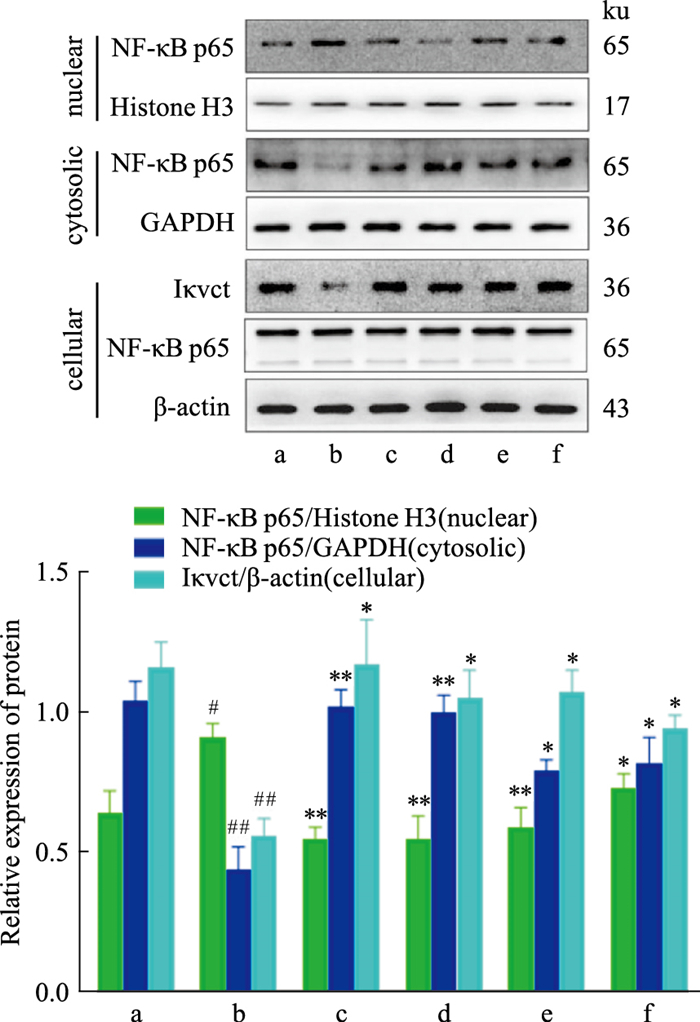
|
| Fig 7 Effect of TFDM on expression of I κ Ba protein and NF- κB p65 in macrophages (x±s, n=3) a: Normal; b: Model; c: TFDM-H; d: TFDM-M; e: TFDM-L; f: Simvastatin. #P < 0.05, ##P < 0.01 vs Normal group; *P < 0.05, **P < 0.01 vs Model group. |
与Normal组比较,Model组的IκBα蛋白表达降低(P<0.01),胞质中NF-κB p65蛋白表达降低(P<0.01),细胞核中NF-κB p65蛋白表达增加(P<0.05);与Model组比较,TFDM-H组、TFDM-M组及TFDM-L组的IκBα蛋白表达增加(P<0.05),胞质中NF-κB p65蛋白表达增加(P<0.01),细胞核中NF-κB p65蛋白表达降低(P<0.05);Simvastatin组中的IκBα蛋白表达增加(P<0.05),胞质中NF-κB p65蛋白表达增加(P<0.05),细胞核中NF-κB p65蛋白表达降低(P<0.05);TFDM组与Simvastatin组相比差异无显著性(P>0.05)。
2.8 TFDM对NLRP3、caspase-1、IL-1β和IL-18蛋白的表达的影响与Normal组比较,Model组中NLRP3、caspase-1、IL-1β以及IL-18蛋白的表达蛋白表达增强(P<0.01);与Model组比较,TFDM-H组、TFDM-M组及TFDM-L组中NLRP3、caspase-1、IL-1β和IL-18蛋白的表达蛋白表达降低(P<0.05),Simvastatin组中NLRP3、caspase-1、IL-1β和IL-18蛋白的表达蛋白表达降低(P<0.05),TFDM组与Simvastatin组相比差异无显著性(P>0.05)。
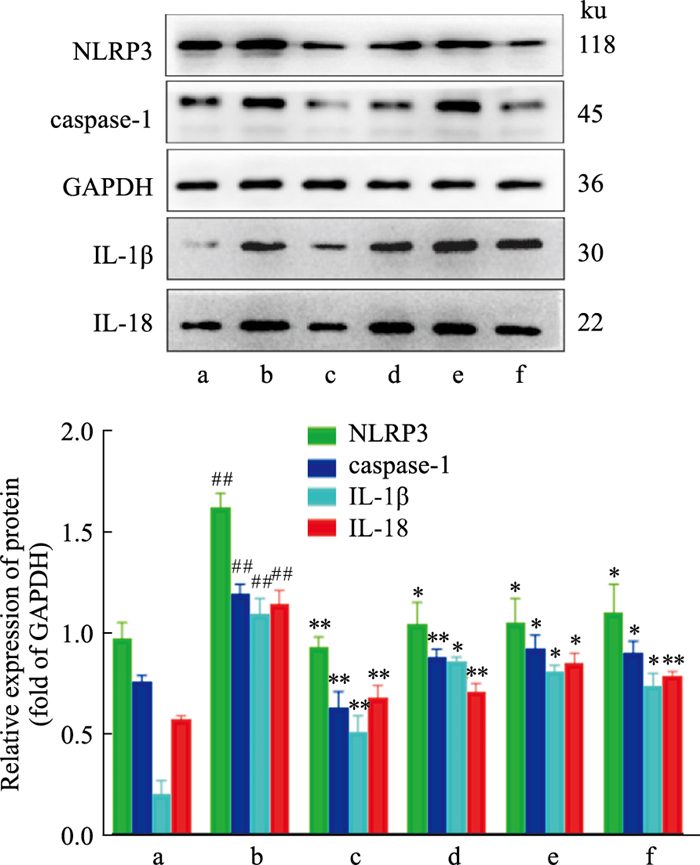
|
| Fig 8 Effect of TFDM on expression of NLRP3, caspase-1, IL-1 β and IL-18 protein (x±s, n=3) a: Normal; b: Model; c: TFDM-H; d: TFDM-M; e: TFDM-L; f: Simvastatin. ##P < 0.01 vs Normal group; *P < 0.05, **P < 0.01 vs Model group. |
在AS进展中,巨噬细胞是第一个侵袭AS病变的炎症细胞,并最终成为斑块的主要组成部分[8]。巨噬细胞泡沫化及其死亡是AS发生发展的关键环节,死亡的泡沫细胞会释放大量的促炎细胞因子和介质,如IL-1β、IL-18和基质金属蛋白酶[9],这些促炎细胞因子和介质进一步触发炎症反应,炎症因子及细胞因子可进一步激活单核-巨噬细胞,此时的单核细胞收到信号被刺激分化为吞噬ox-LDL以及其他细胞分泌物的巨噬细胞,形成泡沫细胞,并在血管内壁积聚,引起AS斑块的形成[10]。因此,抑制炎症在炎症相关疾病治疗中起关键作用。TFDM为新疆特种植物药香青兰植物中提取的多种黄酮类成分的混合物,而黄酮类化合物广泛用于防治心脑血管类疾病,其能降低血管的脆性,改善血管的通透性、降低血脂和胆固醇[11-12]等。因此,在抗炎、抗氧化、降血脂方面有明显效果。基于此,本研究选用ox-LDL诱导小鼠单核巨噬细胞RAW264.7炎症模型探讨TFDM对巨噬细胞泡沫化及炎症反应的调控作用。
胆固醇代谢的失衡,特别是修饰过的低密度脂蛋白,会导致巨噬细胞功能障碍,核受体激活改变,炎症反应,最终导致AS[13]。巨噬细胞不仅组装脂质,还释放TNF-α、IL-1β、IL-6等促炎细胞因子,进一步刺激血管内皮,促进疾病进展[14]。与此相一致,本研究发现,在ox-LDL的作用下,RAW264.7巨噬细胞内会储存大量脂质,油红O染色结果显示,在50 mg·L-1 ox-LDL的作用下可以成功将巨噬细胞转化为泡沫细胞;而给予TFDM干预后巨噬细胞的泡沫化明显减轻,细胞内红色脂滴减少;阳性药辛伐他汀组干预后巨噬细胞泡沫化相较模型组也明显减轻,而TFDM与辛伐他汀组差异无显著性,说明TFDM可以减少巨噬细胞脂质吞噬从而减轻巨噬细胞的泡沫化。ROS具有较强的毒性作用,会破坏细胞生物大分子成分及细胞器,ROS检测结果显示,巨噬细胞成为泡沫细胞时会有大量的ROS产生,而给予TFDM干预后巨噬细胞的ROS含量明显降低,说明TFDM可以减轻ROS的生成。ox-LDL刺激泡沫细胞形成过程中会释放炎性因子TNF-α,而在给予TFDM干预后,TNF-α的表达也明显降低;此外,IL-10是重要的免疫调节细胞因子,对炎症有抑制作用,能抑制T细胞,单核细胞和巨噬细胞的活化和效应功能。而ox-LDL诱导使巨噬细胞中IL-10的表达明显降低,在给予TFDM后,IL-10的表达明显升高;表明TFDM对炎症因子有一定的调节作用,且呈现一定的浓度依赖性。
NF-κB是调节巨噬细胞极化的经典途径[15]。活化的NF-κB进入细胞核发挥重要的作用,作为调节炎症反应、氧化应激和免疫的主要核转录因子[16]。有研究报道,TNF-α和IL-1β等细胞因子的表达受到NF-κB调控,而其也可作为刺激因素,进一步活化NF-κB,造成持续或放大的炎症反应[17]。本研究结果显示,ox-LDL可促进NF-κB入核,发挥转录调节的作用,导致NF-κB、NLRP3、IL-1β以及IL-18 mRNA表达上调;并且在ox-LDL诱导的巨噬细胞中,NF-κB/NLRP3炎症信号通路的相关蛋白均被激活,而TFDM干预后,NF-κB p65核蛋白的表达被抑制,且NLRP3、caspase-1、IL-1β以及IL-18蛋白表达明显被抑制,表明在AS的发生发展中NF-κB/NLRP3炎症小体信号通路直接的参与了泡沫细胞的形成和巨噬的炎症反应,而TFDM可以减轻这些炎症蛋白的表达。此外,NF-κB在诸如类风湿性关节炎、炎性肠病和自身免疫性之类的炎性疾病中起着核心作用[18],抑制NF-κB的活化可有效的抑制炎症反应,在诸多疾病中有研究意义。
综上所述,NF-κB/NLRP3炎症小体信号通路的激活可促进巨噬细胞向泡沫细胞转化,导致巨噬细胞死亡,发生炎症反应,进一步促进AS的发生,而TFDM可以调节相关蛋白的表达,且对ROS的生成以及炎症因子的生成有明显的抑制作用,AS发生发展中,NF-κB/NLRP3炎症小体信号通路会参与泡沫细胞的形成,因此可通过调节NF-κB/NLRP3炎症小体的激活程度,来改善AS的进展,这为AS新的防治策略以炎症机制的不同环节为靶向研发新的抗炎药物用于AS性疾病的治疗提供了理论基础。
| [1] |
Ross R. Atherosclerosis——an inflammatory disease[J]. N Engl J Med, 1999 Jan 14;340(2): 115-26.
|
| [2] |
褚现明, 李冰, 安毅, 等. 炎症与动脉粥样硬化关系研究进展[J]. 中国分子心脏病学杂志, 2010, 11(3): 184-8. Chu X M, Li B, An Y, et al. Progress in studying the relationship between inflammation and atherosclerosis[J]. Mol Cardiol Chin, 2010, 11(03): 184-8. |
| [3] |
王隐, 赵庭瑞, 邹瑶, 等. 早期动脉粥样硬化中炎症细胞的分布情况[J]. 中国药理学通报, 2022, 38(7): 1043-52. Wang Y, Zhao T R, Zou Y, et al. Distribution of inflammatory cells in early atherosclerosis[J]. Chin Pharmacol Bull, 2022, 38(7): 1043-52. |
| [4] |
Kong P, Cui Z Y, Huang X F, et al. Inflammation and atherosclerosis: signaling pathways and therapeutic intervention[J]. Signal Transduct Target Ther, 2022, 7(1): 131. doi:10.1038/s41392-022-00955-7 |
| [5] |
郑学忠, 万怡轩, 王清岑, 等. NF-κB信号通路在动脉粥样硬化中的作用及机制研究进[J]. 西南国防医药, 2018, 28(3): 285-7. Zheng X Z, Wan Y X, Wang Q C, et al. The role and mechanism of NF- κ B signaling pathway in atherosclerosis were studied in[J]. Med J Natl Defending Forces Southwest Chin, 2018, 28(3): 285-7. |
| [6] |
de Winther M P, Kanters E, Kraal G, et al. Nuclear factor kappaB signaling in atherogenesis[J]. Arterioscler Thromb Vasc Biol, 2005, 25(5): 904-14. doi:10.1161/01.ATV.0000160340.72641.87 |
| [7] |
曹文疆, 彭克军, 袁勇, 等. 香青兰总黄酮抗大鼠动脉粥样硬化作用的初步研究[J]. 中国医院药学杂志, 2013, 33(19): 1570-2. Cao W J, Peng K J, Yuan Y, et al. Preliminary study on the antiatherosclerotic effect of total flavonoids in rats[J]. Chin J Hosp Pharm, 2013, 33(19): 1570-2. |
| [8] |
Tabas I, Bornfeldt K E. Macrophage phenotype and function in different stages of atherosclerosis[J]. Cir. Res, 2016, 118(4): 653-67. doi:10.1161/CIRCRESAHA.115.306256 |
| [9] |
Yu X H, Fu Y C, Zhang D W, et al. Foam cells in atherosclerosis[J]. Clin Chim Acta, 2013, 424: 245-52. doi:10.1016/j.cca.2013.06.006 |
| [10] |
Kanters E, Pasparakis M, Gijbels M J, et al. Inhibition of NF-kappaB activation in macrophages increases atherosclerosis in LDL receptor-deficient mice[J]. J Clin Invest, 2003, 112(8): 1176-85. doi:10.1172/JCI200318580 |
| [11] |
Deng Y, Tu Y, Lao S, et al. The role and mechanism of citrus flavonoids in cardiovascular diseases prevention and treatment[J]. Crit Rev Food Sci Nutr, 2022, 62(27): 7591-614. |
| [12] |
Choy K W, Murugan D, Leong X F, et al. Flavonoids as natural anti-inflammatory agents targeting nuclear factor-kappa b (NF-κB) signaling in cardiovascular diseases: a mini review[J]. Front Pharmacol, 2019, 10: 1295. |
| [13] |
张瀚文, 贲晶晶, 朱旭冬, 等. 心血管疾病中的巨噬细胞[J]. 中国科学: 生命科学, 2022, 52(5): 709-31. Zhang H W, Ben J J, Zhu X D, et al. Macrophages in cardiovascular disease[J]. Scientia Sinica Vitae, 2022, 52(5): 709-31. |
| [14] |
Khan R., Spagnoli V., Tardif J C L., et al. Novel anti-inflammatory therapies for the treatment of atherosclerosis[J]. Atherosclerosis, 2015, 240: 497-509. |
| [15] |
Jin Z, Luo Y, Zhao H, et al. Qingre Huoxue Decoction regulates macrophage polarisation to attenuate atherosclerosis through the inhibition of NF-κB signalling-mediated inflammation[J]. J Ethnopharmacol, 2023, 301: 115787. |
| [16] |
王雪, 刘燕, 史玉柱. 基于NF-κB/MAPK信号通路探讨天山堇菜七叶内酯对脂多糖诱导RAW 264.7细胞的保护作用及机制[J]. 中国药理学通报, 2022, 38(9): 1340-9. Wang X, Liu Y, Shi Y Z. Exploring the protective effect and mechanism of LPS-induced RAW 264.7 cells based on NF- κ B / MAPK signaling pathway[J]. Chin Pharmacol Bull, 2022, 38(9): 1340-9. |
| [17] |
Pasparakis M. Regulation of tissue homeostasis by NF-κB signalling: implications for inflammatory diseases[J]. Nature Reviews Immunology, 2009, 778-88. |
| [18] |
Durand J K, Baldwin A S. Targeting IKK and NF-kappaB for therapy[J]. Adv Protein Chem Struct Biol, 2017, 107: 77-115. |
