


2. 安徽医科大学药学院,安徽 合肥 230032
2. School of Pharmacy, Anhui Medical University, Hefei 230032, China
糖尿病是近年来常见的代谢性疾病,会引发一系列糖尿病并发症如糖尿病肾病(diabetic nephropathy, DN),DN是一种严重的微血管糖尿病并发症,以尿蛋白为主要临床表现,也是终末期肾脏疾病常见的继发原因[1]。DN的发病机制及其复杂性可能与高血糖、脂代谢障碍、肾小球血流动力学、炎症反应和纤维化的发生有关[2]。大量临床和基础实验表明,持续的炎症反应在DN中起着至关重要的作用[3]。高血糖可刺激肾小球内皮细胞及细胞分泌炎症因子如IL-6、MCP-1等,国外的相关研究报道可以通过减少NLRP3/ASC炎症小体来预防小鼠2型糖尿病和1型糖尿病的炎症和肾损伤[4]。同时,也有研究显示,黄酮类化合物二氢槲皮素(dihydroquercetin)通过抑制活性氧(ROS) 和肾组织中的NLRP3炎症小体可以对高脂饮食(HFD)/streprozozo催产素(STZ)注射诱导的DN模型大鼠的肾脏起到明显的保护作用[5]。除此之外,还有报道表明,外源性硫化氢通过抑制H9c2心脏细胞中Toll样受体4 (TLR4)/核因子(NF)-κB信号通路及其下游NLRP3炎症小体的激活来减弱高糖诱导的心肌细胞炎症[6]。TLR4是一种刺激包括MAPK和NF-κB通路在内的几种下游通路的受体,是NLRP3炎性小体通路的关键调节因子,NF-κB能够促进NLRP3等促炎细胞因子的合成,因此,NF-κB和丝裂原活化蛋白激酶(MAPK)信号通路的激活,参与了炎症和纤维化反应[7]。由此我们进一步推测,在DN模型中,通过靶向TLR4/MAPK/NF-κB信号通路抑制NLRP3炎性小体的激活,是否可以对DN大鼠抗肾纤维化产生有效的保护作用。
近年研究发现,许多中药和中成药,包括芍药总苷、黄芪总皂苷等,可以通过抑制一些信号通路如JAK/STAT的激活,降低下游炎症因子和纤维化因子的表达,进而缓解DN的发生和发展。汉黄芩素是植物黄芩的主要药用成分之一,具有抗炎和抗氧化等多种药理作用,一直被广泛应用于肿瘤、炎症等多种疾病治疗研究[8]。汉黄芩素是从植物黄芩中分离出来的活性成分,具有抗炎和抗氧化等多种活性,已有研究证实了其保护肝脏的作用。汉黄芩素在体外具有促进间充质干细胞向功能肝细胞分化的作用,并为体内CCl4诱导的肝纤维化提供有效的治疗。本研究旨在探究汉黄芩素对DN大鼠肾纤维化损伤是否具有治疗作用。
1 材料与方法 1.1 材料 1.1.1 实验动物健康成年SD、SPF级大鼠,(200~220) g,60只均购自安徽医科大学动物实验中心,动物生产许可证号:SYXK(皖)2023-4571。饲养环境:室温(23~25) ℃,相对湿度50%~60%,饲料由安徽医科大学实验动物中心提供,动物可自由饮水摄食。本动物实验均遵循动物实验伦理要求。
1.1.2 实验试剂汉黄芩素(货号:GD-GSJ532-674;纯度>98%)购自逊希公司;二甲双胍购自大连美仑生物科技有限公司规格: 0.25 g/片);链脲佐菌素购自齐鲁制药有限公司;24 h尿蛋白量(24 h-Pro)、尿素氮(BUN)、肌酐(SCr)、Masson染色试剂盒均购自碧云天生物技术有限公司;BCA蛋白浓度测定试剂盒、DAB化学发光试剂盒购自南京建成生物技术有限公司;TLR4、MAPK、NF-κB、Col-Ⅰ、Col-Ⅲ蛋白抗体均购自美国Sigma公司。高脂高糖饲料配方(蔗糖20%+猪油10%+胆固醇2.5%+常规饲料67.5%)。
1.1.3 实验仪器多功能酶标仪(瑞士罗氏公司);凝胶成像系统(上海勤翔科技有限公司);电泳设备(美国Beckma公司);电子分析天平(德国Leica公司);Mini ProteanTeraCell型垂直电泳转印系统(美国Bio-Rad公司);SC-2546低速离心机(美国Beckma公司);倒置荧光显微镜(蔡司);贝克曼库尔特AU5800全自动生化分析仪(日本奥林巴斯Olympus有限公司生产,型号: TC-XDS-500C)。
1.2 方法 1.2.1 构建DN大鼠模型及实验分组除对照组外,其余各组大鼠均采用腹腔注射链脲佐菌素65 mg·kg-1联合高脂高糖喂养12周的方法构建DN大鼠模型。造模完成后,各组分别连续28 d灌胃给予相应药物或生理盐水,每天1次,汉黄芩素低剂量组、汉黄芩素中剂量组、汉黄芩素高剂量组的药物使用剂量分别为50、100、150 mg·kg-1,二甲双胍组为阳性对照,其药物使用剂量为500 mg·kg-1。每组10只大鼠。
1.2.2 各组大鼠空腹血糖(FBG)含量检测于给药前至给药后的28 d内每间隔1周,尾静脉取血,通过血糖仪测定各组大鼠FBG含量。
1.2.3 各组大鼠体质量、24 h-Pro、BUN、SCr含量检测给药完成后,收集各组大鼠尿液和血液,离心取上清,并按照试剂盒说明书步骤检测各组大鼠24 h-Pro和BUN、SCr含量。
1.2.4 HE染色检测肾组织病理损伤组织固定包埋后石蜡切片,将蜡块固定在切片机上,切片厚度4 μm,烘干;脱蜡及水化:二甲苯Ⅰ 20 min→二甲苯Ⅱ 20 min→无水乙醇Ⅰ 5 min→无水乙醇Ⅱ 5 min→90%乙醇3 min→80%乙醇3 min→70%乙醇3 min→超纯水3 min;HE染色:切片置于苏木精染液10 min,流水冲洗10 min至组织蓝化,再浸入伊红染液30 s,流水冲洗切片3 min后于显微镜下观察染色效果。将染色后的切片于无水乙醇Ⅰ、Ⅱ各脱水10 min,二甲苯Ⅰ、Ⅱ中各透明10 min;封片:将封片液滴在组织上并盖上盖玻片,于60 ℃烘干;镜检拍照:通过玻扫仪采集图片。
1.2.5 Masson染色检测肾组织纤维化情况按照上述步骤将各组大鼠肾组织制成切片,并按照Masson染色试剂盒说明书步骤进行染色,染色完成后在显微镜下观察肾纤维化状况,并以胶原面积(蓝色着色)所占面积百分比计为胶原容积分数(CVF)。
1.2.6 免疫组化检测相关蛋白表达按照上述步骤将各组大鼠肾组织制成切片,经内源性过氧化物酶阻断剂阻断、抗原修复、组织封闭后,滴加NLRP3抗体(1 ∶ 500),孵育过夜,对应二抗孵育2 h,滴加DAB显色液,于倒置荧光显微镜下观察染色结果。
1.2.7 Western blot检测相关蛋白表达通过15% SDS-PAGE分离蛋白质,并在200 mA和1 h条件下,将蛋白质转移至PVDF膜。将膜在含有5%脱脂奶粉的TBST溶液中于室温封闭1 h左右。将膜与TLR4、MAPK、NF-κB、Col-Ⅰ、Col-Ⅲ抗体在4℃孵育过夜。用TBST缓冲液洗涤PVDF膜3次,每次10 min,在室温下与山羊抗兔IgG一起孵育1 h。最后,用ChemiQ4600min化学发光成像系统成像,并通过ImageJ测定蛋白条带的灰度值。
1.2.8 统计学分析所有统计分析使用GraphPad Prism 8软件。单因素方差分析(ANOVA) 和t检验分析和比较实验结果。P < 0.05具有统计学意义。所有数据均以x±s表示。
2 结果 2.1 汉黄芩素对DN大鼠FBG的影响与对照组相比,模型组大鼠给药前和给药后第7、14、21、28 d的FBG含量明显升高(P < 0.01);与模型组相比,汉黄芩素各剂量组和二甲双胍组大鼠给药后第7、14、21、28天的FBG含量明显降低(P < 0.01),差异均有统计学意义。见Tab 1。
| Group | FBG before administration/mmol·L-1 | FBG after administration/mmol·L-1 | |||
| 7 d | 14 d | 21 d | 28 d | ||
| Control | 5.61±0.82 | 5.50±0.71 | 5.66±0.88 | 5.69±0.58 | 5.65±0.68 |
| Model | 19.10±1.62 | 18.81±1.22 | 17.88±1.61 | 17.79±1.65 | 17.66±1.75 |
| Baicalin low dose | 18.76±1.81 | 16.55±1.58 | 16.21±1.38 | 15.10±1.81 | 14.55±1.51 |
| Baicalin medium dose | 19.22±1.62 | 17.33±1.28 | 15.12±1.07 | 14.70±1.27 | 14.30±1.21 |
| Baicalin high dose | 18.90±1.02 | 16.13±1.31 | 14.60±1.15 | 13.45±1.06 | 13.21±1.44 |
| Metformin | 18.98±1.50 | 15.25±1.25 | 14.20±1.08 | 12.55±1.43 | 12.81±1.36 |
与对照组相比,模型组大鼠体质量、24 h-Pro、BUN、SCr含量均升高(P < 0.01);与模型组相比,汉黄芩素各剂量组和二甲双胍组大鼠体质量、24 h-Pro、BUN、SCr含量均降低(P < 0.01),差异均有统计学意义。见Tab 2。
| Group | Body mass/g | 24 h-Pro/mg/24 h | BUN/mmol·L-1 | SCr/μmol·L-1 |
| Control | 310.2±25.1 | 10.1±2.1 | 6.4±1.5 | 30.1±2.2 |
| Model | 425.2±15.2** | 35.5±2.5** | 25.4±1.5** | 56.5±3.1** |
| Baicalin low dose | 385.8±24.8# | 30.2±1.2# | 21.3±2.5# | 45.5±2.4# |
| Baicalin medium dose | 369.6±10.5## | 25.6±1.8## | 19.3±1.5## | 44.2±1.7## |
| Baicalin high dose | 355.9±17.4## | 19.3±3.1## | 15.2±2.4## | 35.5±2.3## |
| Metformin | 325.7±23.7## | 24.1±2.0## | 12.5±1.6## | 36.8±3.3## |
| **P < 0.01 vs control;#P < 0.05, ##P < 0.01 vs model. | ||||
与对照组相比,模型组大鼠肾组织出现肌束紊乱、炎性细胞浸润、弥漫性水肿、肾小球体积增大、系膜增生,肾小管扩张,肾间质大量炎性细胞浸润等病理学改变;与模型组相比,汉黄芩素各剂量组和二甲双胍组大鼠肾组织病理损伤明显得到改善。见Fig 1。
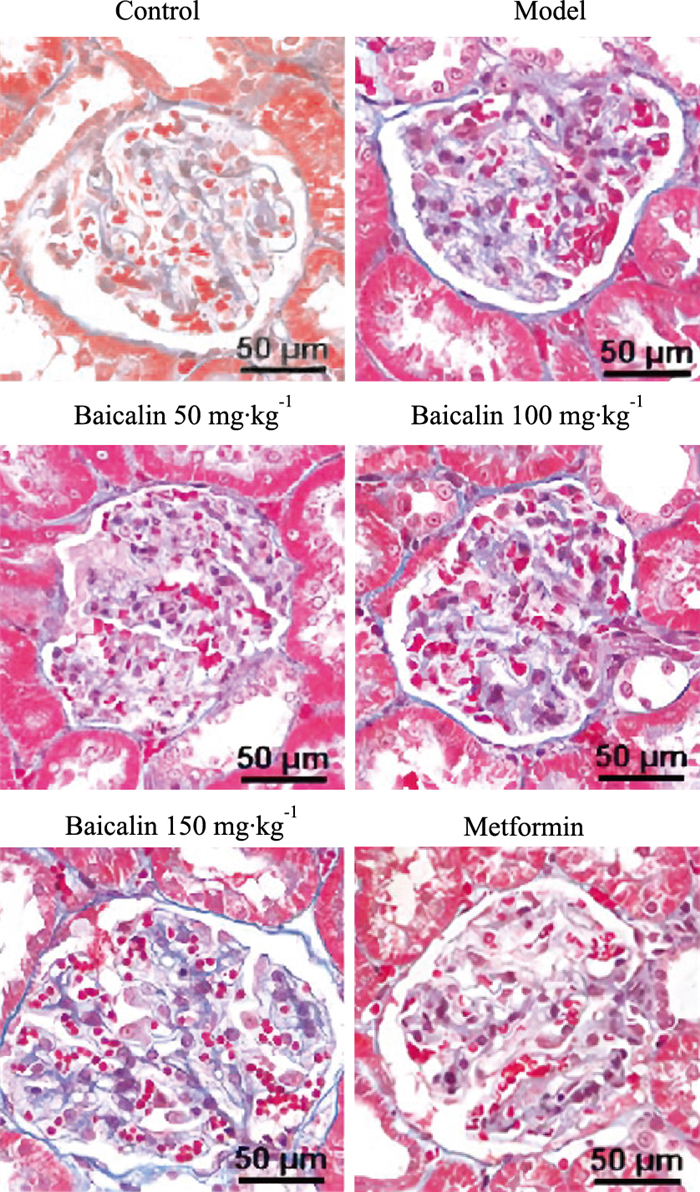
|
| Fig 1 Pathological changes of rat kidney tissue in different treatment groups detected by HE staining (×200) |
与对照组相比,模型组大鼠肾血管壁及肾小球、肾小管间质丝状胶原沉淀明显增多;与模型组相比,汉黄芩素各剂量组和二甲双胍组大鼠肾组织纤维化明显得到改善。见Fig 2。

|
| Fig 2 Masson staining of renal fibrosis injury in different treatment groups of rats (×200) |
与对照组相比,模型组大鼠肾组织NLRP3表达明显增加;与模型组相比,汉黄芩素各剂量组和二甲双胍组大鼠肾组织NLRP3表达明显减少(P < 0.01),差异均有统计学意义。见Fig 3。
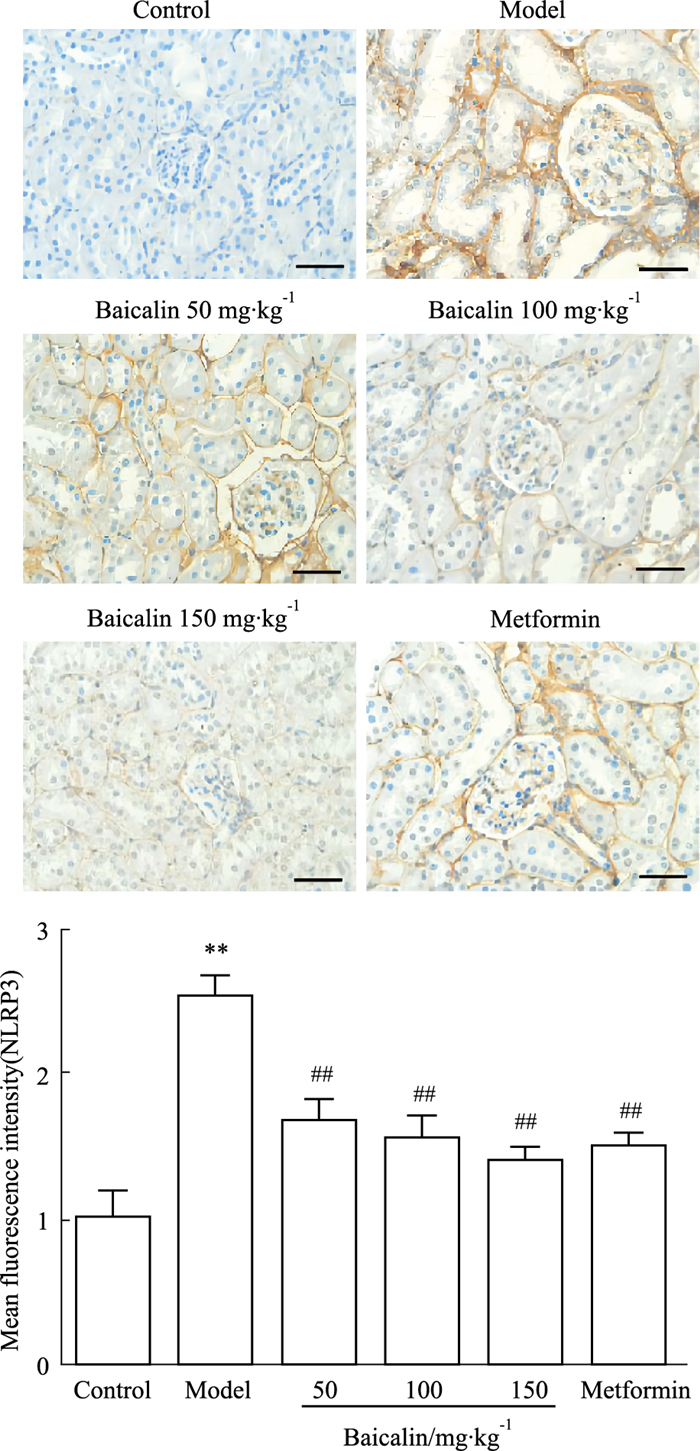
|
| Fig 3 Immunohistochemical detection of NLRP3 inflammatory vesicles expression in kidney tissue of rats in different treatment groups (x±s, n=6) A: Changes in NLRP3 expression in kidney tissue of rats in various groups; B: Semi-quantitative statistical analysis of NLRP3 expression in each group; **P < 0.01 vs control group; ##P < 0.01 vs model group. |
与对照组相比,模型组TLR4、MAPK、NF-κB、Col-Ⅰ、Col-Ⅲ蛋白表达明显上调(P < 0.01);与模型组相比,汉黄芩素各剂量组和二甲双胍组TLR4、MAPK、NF-κB、Col-Ⅰ、Col-Ⅲ蛋白表达明显下调(P < 0.01),差异均有统计学意义。见Fig 4。
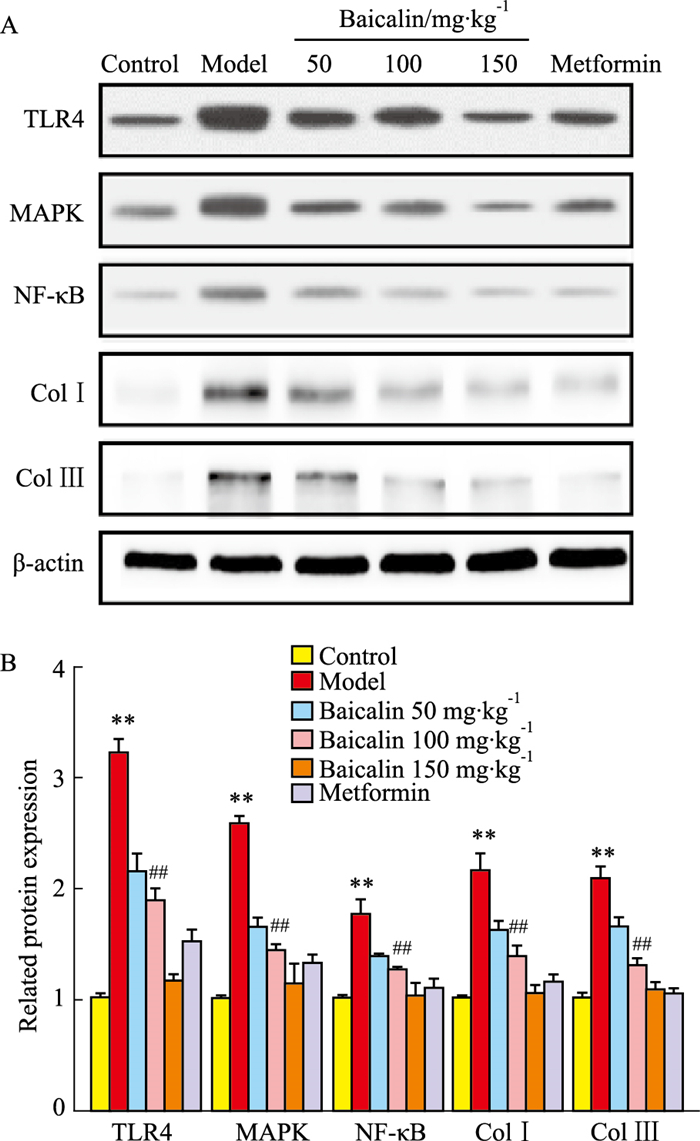
|
| Fig 4 Changes in expression of related proteins in kidney tissue of each group of rats (x±s, n=3) A: Related protein bands for each group; B: Semi-quantitative statistical analysis of related proteins in each group.**P < 0.01 vs control group; ##P < 0.01 vs model group. |
近年来,糖尿病的患病率和发病率在世界范围内持续上升。DN是糖尿病的主要微血管并发症之一,也是导致终末期肾病(end-stage renal disease, ESRD)的重要原因之一。然而,目前DN的发病机制仍未完全阐明。大量的报道证明,蛋白尿是DN的主要临床表现,也是糖尿病并发症如心血管疾病的重要危险因素。临床研究显示,只有通过严格控制血压、血糖、血脂水平以及生活方式干预,才能减缓DN的进展,但仍不能阻止其向ESRD进展[9]。因此,迫切需要寻找新的有效药物来干预DN。DN的主要病理特征是肾小球硬化和肾小管间质纤维化,抑制肾纤维化已成为DN治疗的重要措施之一。在本研究中,我们发现不同浓度的汉黄芩素均能逆转造模后DN大鼠FBG、体质量、24 h-Pro、BUN、SCr的升高,这就表明汉黄芩素可以改善由造模引起的肾功能下降。此外,HE染色和Masson染色结果同样证明了这一点,结果显示不同浓度的汉黄芩素均能逆转造模后DN大鼠肾组织的病理损伤以及肾脏纤维化程度,然而,汉黄芩素改善DN大鼠肾脏功能的机制仍不清楚,这也是我们研究的重要内容。
近年来,临床和动物实验研究中越来越多的证据表明,NLRP3炎症小体激活参与了包括DN在内的多种糖尿病并发症的病理过程[10]。NLRP3炎性小体是炎性小体家族中的典型成员,在本研究中免疫组化染色结果显示,与对照组相比,模型组大鼠肾组织中NLRP3表达明显增加,而汉黄芩素和二甲双胍给药后能够逆转造模引起的NLRP3表达的增加。这就提示我们汉黄芩素可能通过抑制肾组织中NLRP3的表达来发挥延缓DN进展的作用,同时说明抑制NLRP3炎症小体的激活可能为早期DN患者的治疗提供了非常有意义的参考[11]。然而,目前对高血糖状态下肾脏NLRP3炎症小体激活的分子机制和信号通路尚不清楚,同时,汉黄芩素通过何种分子机制调控NLRP3炎症小体激活也不明确,需要进一步研究。
TLRs作为模式识别受体,可通过多种炎症因子的释放触发信号级联。一些分子和细胞事件被认为是NLRP3炎性小体激活的触发因素,包括K+外排、Ca2+信号、ROS、线粒体功能障碍和溶酶体破裂。有研究显示,可溶性尿酸通过TLR4介导的信号通路增加人原代肾近端小管上皮细胞中NALP3炎症小体和IL-1β的表达[12]。此外,还有报道高血糖通过上调TLR4/NF-κB信号通路及其下游NLRP3激活诱导心肌细胞炎症[13]。因此,我们有理由推测汉黄芩素是否通过靶向TLR4/NF-κB信号通路,减弱NLRP3炎性小体激活引起的肾组织炎症和纤维化损伤。有研究表明在DM患者体内的TLR4和内源性配体以及其下游激活的NF-κB等信号级联增加[14-15]。此外,TLR4的下调时会降低NF-κB信号通路的活性以及IL-1、IL-6等炎症因子的表达,同时,NF-κB也会促进NLRP3、IL-1β和其他促炎细胞因子的合成。而在本研究中,实验结果证实造模后确实会上调TLR4表达,TLR4高表达会诱导NF-κB和丝裂原活化蛋白激酶(MAPK)信号通路的激活,进而导致下游的NLRP3炎性小体激活引起DN大鼠的肾组织炎症和纤维化反应,而汉黄芩素和二甲双胍给药后可以不同程度地降低TLR4、MAPK、NF-κB以及胶原蛋白的表达。这就提示汉黄芩素可能通过抑制TLR4/MAPK/NF-κB信号通路的激活,进而减轻由体内血液中高血糖引起的肾组织炎症和肾脏纤维化,最终发挥改善和延缓DN发生发展的进程。
综上所述,本研究表明汉黄芩素能在一定程度上减轻DN大鼠的肾脏炎症反应和肾脏纤维化程度,其机制可能与抑制TLR4/MAPK/NF-κB信号通路的激活有关。
| [1] |
宋娜, 罗敏, 王鹏, 等. 糖尿病肾脏纤维化的研究进展[J]. 中国药理学通报, 2019, 39(7): 1222-7. Song N, Luo M, Wang P, et al. Research progress of diabetic renal fibrosis[J]. Chin Pharmacol Bull, 2019, 39(7): 1222-7. |
| [2] |
程明慧, 秦虹. AMPK在糖尿病防控中的作用机制研究进展[J]. 中国药理学通报, 2021, 37(9): 1208-12. Cheng M H, Qin H. Research progress of AMPK in the prevention and control of diabetes[J]. Chin Pharmacol Bull, 2021, 37(9): 1208-12. |
| [3] |
Samsu N. Diabetic nephropathy: challenges in pathogenesis, diagnosis, and treatment[J]. Biomed Res Int, 2021, 2021: 1497449. |
| [4] |
Liu S J, Tang G, Duan F Q, et al. MiR-17-5p inhibits txnip/NLRP3 inflammasome pathway and suppresses pancreatic β-cell pyroptosis in diabetic mice[J]. Front Cardiovasc Med, 2021, 8: 768029. doi:10.3389/fcvm.2021.768029 |
| [5] |
Ding T, Wang S F, Zhang X Y, et al. Kidney protection effects of dihydroquercetin on diabetic nephropathy through suppressing ROS and NLRP3 inflammasome[J]. Phytomedicine, 2018, 41: 45-53. doi:10.1016/j.phymed.2018.01.026 |
| [6] |
Xia Y X, Zhang W Y, He K C, et al. Hydrogen sulfide alleviates lipopolysaccharide-induced myocardial injury through TLR4-NLRP3 Pathway[J]. Physiol Res, 2023, 72(1): 15-25. doi:10.33549/physiolres.934928 |
| [7] |
Shen X L, Guo Y N, Lu M H, et al. Acetaminophen-induced hepatotoxicity predominantly via inhibiting Nrf2 antioxidative pathway and activating TLR4-NF-κB-MAPK inflammatory response in mice[J]. Ecotoxicol Environ Saf, 2023, 252: 114590. doi:10.1016/j.ecoenv.2023.114590 |
| [8] |
黎浩, 胡蕴然, 杨慧, 等. 基于Keap1/Nrf2/HO-1通路汉黄芩素7-O-β-D-乙基葡萄糖醛酸苷体外抗氧化应激作用研究[J]. 药物评价研究, 2023, 46(4): 772-80. Li H, Hu Y R, Yang H, et al. Effect of baicalin 7-O-β-D-ethyl glucuronide on oxidative stress in vitro based on Keap1/Nrf2/HO-1 pathway[J]. Drug Evaluation Res, 2023, 46(4): 772-80. |
| [9] |
张哲, 王杏, 杨林泉, 等. 利拉鲁肽通过调控AMPK/mTOR自噬信号减轻糖尿病大鼠心肌炎症和氧化应激损伤[J]. 中国药理学通报, 2023, 39(1): 43-50. Zhang Z, Wang X, Yang L Q, et al. Liraglutide alleviates myocardial inflammation and oxidative stress injury in diabetic rats by regulating AMPK/mTOR autophagy signaling[J]. Chin Pharmacol Bull, 2023, 39(1): 43-50. |
| [10] |
Shao B Z, Xu Z Q, Han B Z, et al. NLRP3 inflammasome and its inhibitors: a review[J]. Front Pharmacol, 2015, 6: 262. |
| [11] |
Wang X H, Li Q, Sui B Z, et al. Schisandrin A from schisandra chinensis attenuates ferroptosis and nlrp3 inflammasome-mediated pyroptosis in diabetic nephropathy through mitochondrial damage by adipor1 ubiquitination[J]. Oxid Med Cell Longev, 2022, 2022: 5411462. |
| [12] |
易扬. TLR4介导自噬流异常在可溶性尿酸诱导肾小管上皮细胞炎症反应中的作用[D]. 南宁: 广西医科大学, 2020. Yi Y. The role of TLR4 mediating abnormal autophagy flow in the inflammatory response of renal tubular epithelial cells induced by soluble uric acid[D]. Nanning: Guangxi Med Univ, 2020. |
| [13] |
邓璇, 王瑜. Toll样受体4与Nod样受体蛋白3炎性小体在糖尿病肾脏疾病中的研究进展[J]. 临床肾脏病杂志, 2022, 22(7): 595-601. Deng X, Wang Y. Research progress of Toll-like receptor 4 and NOD-like receptor protein 3 inflammasome in diabetic kidney disease[J]. J Clin Nephrol, 2022, 22(7): 595-601. |
| [14] |
Tang J, Xu L, Zeng Y, et al. Effect of gut microbiota on LPS-induced acute lung injury by regulating the TLR4/NF-κB signaling pathway[J]. Int Immunopharmacol, 2021, 91: 107272. |
| [15] |
常华, 孟海燕, 王勇, 等. 黄芩对肝纤维化的抑制作用及尿代谢组学研究[J]. 中国医药杂志, 2018, 43(10): 2140-6. Chang H, Meng H Y, Wang Y, et al. Inhibitory effect of Scutellariae Radix on hepatic fibrosis based on urinary metabonomic[J]. Chin Med, 2018, 43(10): 2140-6. |

