


李东垣在《脾胃论》中写道:“脾胃之气既伤,而元气亦不能充,而诸病之所由生也。”表明“脾胃虚”是全身脏腑经络、四肢九窍产生疾病之根本原因。脾胃虚寒为“脾胃虚”的一种,主要症状为胃脘痛、脘腹胀,以及表现出喜温喜按、口淡不渴、四肢不温、大便稀溏、舌淡苔白、脉虚缓等,临床上多见于胃/十二指肠溃疡、慢性胃炎、功能性消化不良等。近年来研究表明,该系列病症多由幽门螺旋杆菌感染诱发,且该病原体在世界上超过一半人口的胃中定居,与胃癌的发展密切相关,胃黏膜IL-8与幽门螺杆菌感染引起的相关胃疾病存在重要关系[1]。临床上西医治疗该系列病症主要以给予质子泵抑制剂或者胃黏膜保护剂为主,但多易产生耐药、不良反应和停药后复发等副作用,导致治疗该病症的疗效不够理想。
厚朴温中汤出自金代李东垣的《内外伤辨惑论》,收录于国家中医药管理局发布的《古代经典名方目录(第一批)》,主治脾胃虚寒、脘腹胀满或疼痛等,临床应用于治疗慢性萎缩性胃炎、功能性消化不良[2]。现代研究发现,厚朴温中汤单味药厚朴、陈皮、甘草、木香、草豆蔻仁、茯苓、干姜、生姜等均具有不同程度的抗炎、抗溃疡及调节胃肠道功能的作用,但该方治疗脾胃虚寒型胃病的作用机制尚未明确。网络药理学以大数据为手段,分析靶向互连分子系统中的多个节点关系,中药复方是通过多成分、多靶点、多途径实现治疗疾病的效果,二者在整体性、系统性等方面不谋而合。中药复方网络药理学研究能够有效推动中药复方的深入挖掘,阐明复方药效物质基础及其治疗疾病的分子机制。本研究首次基于网络药理学方法筛选厚朴温中汤活性成分,预测其治疗脾胃虚寒型胃病的潜在靶点和相关通路,通过构建“药材-成分-靶点-通路”网络,分析该方治疗脾胃虚寒型胃病的作用机制,并通过分子对接技术和细胞实验对结果进行模拟验证,阐明厚朴温中汤治疗脾胃虚寒型胃病的药效物质基础和潜在作用机制。
1 材料与方法 1.1 材料与试剂厚朴酚对照品(批号:110729-201714;纯度:100.0%;规格:20 mg)、橙皮苷对照品(批号:110721-202019;纯度:96.2%;规格:20 mg)、6-姜辣素对照品(批号:110729-201714;纯度:100.0%;规格:20 mg)均购自中国食品药品检定研究院。
脂多糖(LPS,美国Sigma公司);胎牛血清(FBS,美国Gibco公司);DEME培养基(美国Gibco公司);MTT试剂盒(美国Sigma公司)、NO试剂盒(南京建成生物科技有限公司);IL-8 ELISA检测试剂盒(北京索莱宝科技有限公司);Multiskan Go1510酶标仪(美国Thermo公司)。
1.2 方法 1.2.1 研究思路本研究基于网络药理学和分子对接,探讨厚朴温中汤治疗脾胃虚寒型胃病的有效成分与作用机制关联分析,研究思路见Fig 1。
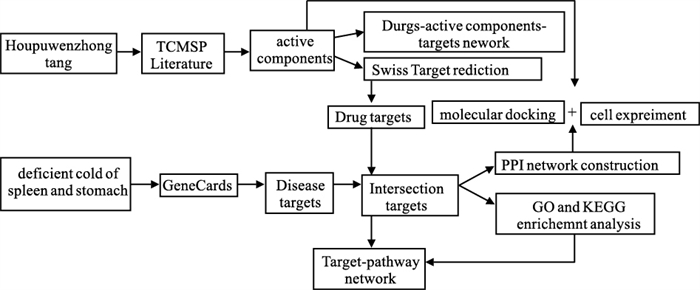
|
| Fig 1 Network pharmacology research diagram |
通过检索TCMSP数据库(https://tcmsp-e.com/)得到厚朴温中汤所有药材的成分,依据ADME筛选其可能的活性成分,其中筛选条件为口服生物利用度(OB)≥30%、类药性(DL)≥0.18,再根据已有文献报道补充整合该方治疗脾胃虚寒型胃病的活性成分,删除重复值。将得到的活性成分的化学结构导入Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/) 预测其可能的作用靶点,删除重复值,得到厚朴温中汤的作用靶点。
1.2.3 厚朴温中汤“各药材-成分-靶点网络”构建厚朴温中汤“各药材-成分-靶点网络”主要通过网络图像化软件Cytoscape 3.7.2进行构建和分析,将获得的活性成分以及活性成分预测得到的靶点一同导入软件完成相关网络构建,采用network analyzer插件进行网络特征分析,以明确厚朴温中汤中较为重要的成分和靶点,结合文献以分析其中的相互作用。
1.2.4 脾胃虚寒型胃病相关疾病靶点检索利用“deficient cold of spleen and stomach(脾胃虚寒)”、“chronic gastritis(慢性胃炎)”、“gastric ulcer(胃溃疡)”、“dyspepsia(消化不良)”、“epigastric pain(胃脘痛)”作为关键词,在GeneCards数据库(https://www.genecards.org)中进行疾病靶点检索,整合检索得到的结果,并删除重复靶点。
1.2.5 厚朴温中汤与脾胃虚寒型胃病的关键靶点筛选及PPI网络构建依据Cytoscape 3.7.2软件的BisoGenet筛选关键靶点。将厚朴温中汤活性成分对应的靶点与脾胃虚寒型胃病疾病靶点分别导入BisoGenet内,分别生成各自的靶点作用网络,通过Cytoscape中的Merge功能提取厚朴温中汤与脾胃虚寒型胃病的交集靶点,并运用CytoNCA分析交集网络中各个节点的属性值。计算交集靶点Degree值的中位数并筛选其大于2倍中位数的节点,以此为依据筛选得到关键靶点。将筛选得到的关键靶点导入STRING 11.5数据库(https://string-db.org/)构建PPI网络,选择研究物种为人类,设置靶点之间置信度分数为0.9,获得靶点与靶点相互作用的网络图,将该图导入Cytoscape 3.7.2软件进行可视化分析。
1.2.6 通路富集分析将“1.2.5”筛选的到的关键作用靶点导入Metascape平台(https://metascape.org/)分别进行GO和KEGG通路富集分析,保存其分析结果,提取出所需要的信息,进行可视化分析。
1.2.7 厚朴温中汤治疗脾胃虚寒型胃病的有效成分与关键靶点的分子对接验证通过蛋白数据库(PDB)(http://www.rcsb.org)检索并下载各关键靶点的结构文件,采用Discovery Studio 4.5软件对活性小分子结构及蛋白结构进行处理,运用LibDock模块进行小分子与靶点的结合预测,以对接打分(LibDock score)评价活性成分与关键靶点的相互作用。结合活性成分的靶点越多,产生药效的可能性越大,成为关键节点可能性越高;与靶点结合得分越高的活性成分,通过该靶点产生作用的可能性越大[3]。本研究基于分子对接技术分析厚朴温中汤活性成分与关键节点的相互作用,进而验证该方治疗脾胃虚寒型胃病的活性成分及网络关键靶点。
1.2.8 细胞活力实验采用CCK-8法检测厚朴酚、橙皮苷和6-姜辣素等3个有效成分对RAW264.7细胞的毒性。取对数生长期的RAW264.7细胞用DMEM培养基(含10%FBS培养液)调整细胞密度,接种于96孔板中,分为给药组、正常细胞对照组。给药组以100 μL/孔加入含有不同药物浓度化合物的细胞培养液,正常细胞对照组中加入无药物的细胞培养液,每组均为6个复孔。于37 ℃、5% CO2条件下培养24 h后,弃去上清液加入10%的CCK-8溶液,每孔100 μL,于酶标仪450 nm处测定吸光度(A值),计算细胞存活率。细胞存活率=[(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)×100%。
1.2.9 NO抑制率采用Griess法测定厚朴酚、橙皮苷和6-姜辣素等3个有效成分对LPS诱导的RAW264.7细胞产生NO的抑制作用。取对数生长期的RAW264.7细胞接种于96孔板中(5×104个细胞/孔),于37 ℃、5% CO2条件下培养24 h,弃去旧培养基,给药组分别加入100 μL含不同浓度厚朴酚、橙皮苷和6-姜辣素的DMEM培养基,同时设置空白对照组(仅培养液)和模型组(仅培养液),培养1 h后,除空白组外,其余各组加入100 μL的LPS溶液(1 mg·L-1),继续培养24 h,再每孔吸取50 μL上清液于新的96孔板中,先后加入Griess Ⅰ液与Griess Ⅱ液各50 μL,用酶标仪在540 nm处测其A值,计算NO抑制率。
1.2.10 IL-8 ELISA实验取对数生长期的RAW264.7细胞接种于培养板中,于37 ℃、5% CO2条件下培养24 h,弃去旧培养基。设置空白对照组(仅培养液)、模型组(仅培养液)和给药组(含不同浓度厚朴酚、橙皮苷和6-姜辣素的DMEM培养基),培养1 h后,除空白组外,其余各组加入100 μL的LPS溶液(1 mg·L-1),继续培养24 h,按照ELISA试剂盒说明书操作,检测细胞上清液中IL-8的含量。
1.2.11 统计学分析使用专业软件GraphPad Prism 6.0、Image ProPlus 7.0及BD Accuri C6 Plus进行数据处理与分析。使用SPSS 22.0进行统计学分析,所有数据结果均用x±s表示,多组比较采用单因素方差分析,组间的两两比较使用LSD法检验。
2 结果 2.1 厚朴温中汤中活性成分的筛选和靶点预测通过TCMSP数据库和PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)检索得到厚朴化学成分139种、陈皮化学成分63种、甘草化学成分280种、木香化学成分106种、草豆蔻化学成分71种、茯苓化学成分34种、干姜化学成分148种、生姜化学成分265种,经OB和DL参数筛选后,并根据文献报道补充未筛选到的成分,共获得厚朴8种、陈皮9种、甘草93种、木香8种、草豆蔻14种、茯苓6种、干姜7种、生姜6种活性成分。靶点预测得到厚朴成分作用靶点132个、陈皮成分作用靶点136个、甘草成分作用靶点1 574个、木香成分作用靶点49个、草豆蔻成分作用靶点366个、茯苓成分作用靶点30个,干姜成分作用靶点86个、生姜成分作用靶点79个,合并后删除重复值共得到靶点292个。
2.2 厚朴温中汤“各药材-成分-靶点网络”的构建和分析将“2.1”得到的活性成分及作用靶点导入Cytoscape 3.7.2软件,绘制“各药材-成分-靶点网络”,并以节点形状大小确定厚朴温中汤中发挥重要作用的成分和靶点。成分/靶点对应的形状越大、表明其作用越强,对应的Degree值越大、说明其相对重要性越高。通过Cytoscape 3.7.2网络构建共获得473个节点和2 290个关系,预测结果显示其中槲皮素、木犀草素、木香烃内酯、川陈皮素、甘草查尔酮A、6-姜辣素、柚皮素、橙皮苷、厚朴酚、和厚朴酚为Degree值前12的活性成分,见Tab 1。
| Compound | Degree | Betweenness | Closenesss |
| Quercetin | 71 | 0.194 3 | 0.540 7 |
| Luteolin | 68 | 0.052 6 | 0.468 6 |
| Kaempferol | 50 | 0.019 1 | 0.439 3 |
| Nobiletin | 45 | 0.014 7 | 0.431 4 |
| Costunolide | 37 | 0.029 5 | 0.431 4 |
| Licochalcone A | 35 | 0.011 9 | 0.429 9 |
| 6-Gingerol | 33 | 0.010 3 | 0.427 8 |
| Naringenin | 32 | 0.011 0 | 0.426 8 |
| Tangeretin | 31 | 0.003 6 | 0.423 8 |
| Hesperidin | 30 | 0.002 3 | 0.399 7 |
| Magnolol | 30 | 0.002 2 | 0.413 5 |
| Honokiol | 30 | 0.002 2 | 0.413 5 |
从Genecards数据库获得脾胃虚寒型胃病靶点11 147个,由于靶点过多,设定Relevance Score值大于中位数的目标靶点为脾胃虚寒型胃病的潜在靶点,得到靶点共1 395个。
2.4 厚朴温中汤治疗脾胃虚寒型胃病的关键靶点筛选及PPI网络构建通过BisoGenet功能,得到活性成分的靶点可与2 147个靶点产生直接或者间接作用,而这些靶点与靶点的相互作用关系可达52 050种。脾胃虚寒型胃病的相关靶点可达5 329个,相互联系可达130 512种。将两者靶点取交集,再运用CytoNCA计算网络拓扑学特征属性值,筛选获得关键靶点189个,具体筛选步骤见Fig 2。再将关键靶点导入STRING平台,得到关键靶点的PPI网络,通过Cytoscape软件可视化分析,其中STAT3、TP53、AKT1、MAPK1、MAPK3、JUN、TNF、RELA、IL6、IL8等为Gegree值前10(Degree≥29)的靶点。
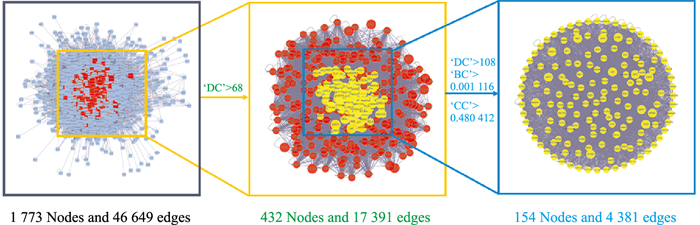
|
| 图 2 Network topology analysis of protein-protein interaction |
将“2.4项下”得到的厚朴温中汤治疗脾胃虚寒型胃病的关键靶点导入Metascape数据库,得到生物过程(GO-BP)共有2 491条结果,细胞成分(GO-CC)共有165条,分子功能(GO-MF)共有189条。将各模块排序前20的条目可视化,见Fig 3。厚朴温中汤治疗脾胃虚寒型胃病的BP富集结果主要包括炎症反应、药物应答、LPS应答、氧化应激反应、对细菌的反应、调节蛋白质丝氨酸/苏氨酸激酶活性等生物过程,CC富集结果主要包括膜筏、细胞外基质、丝氨酸/苏氨酸蛋白激酶复合物、溶酶体等细胞成分,MF富集结果主要包括激酶结合、转录因子结合、激酶活性、细胞因子活性、蛋白丝氨酸/苏氨酸激酶活性等分子功能。
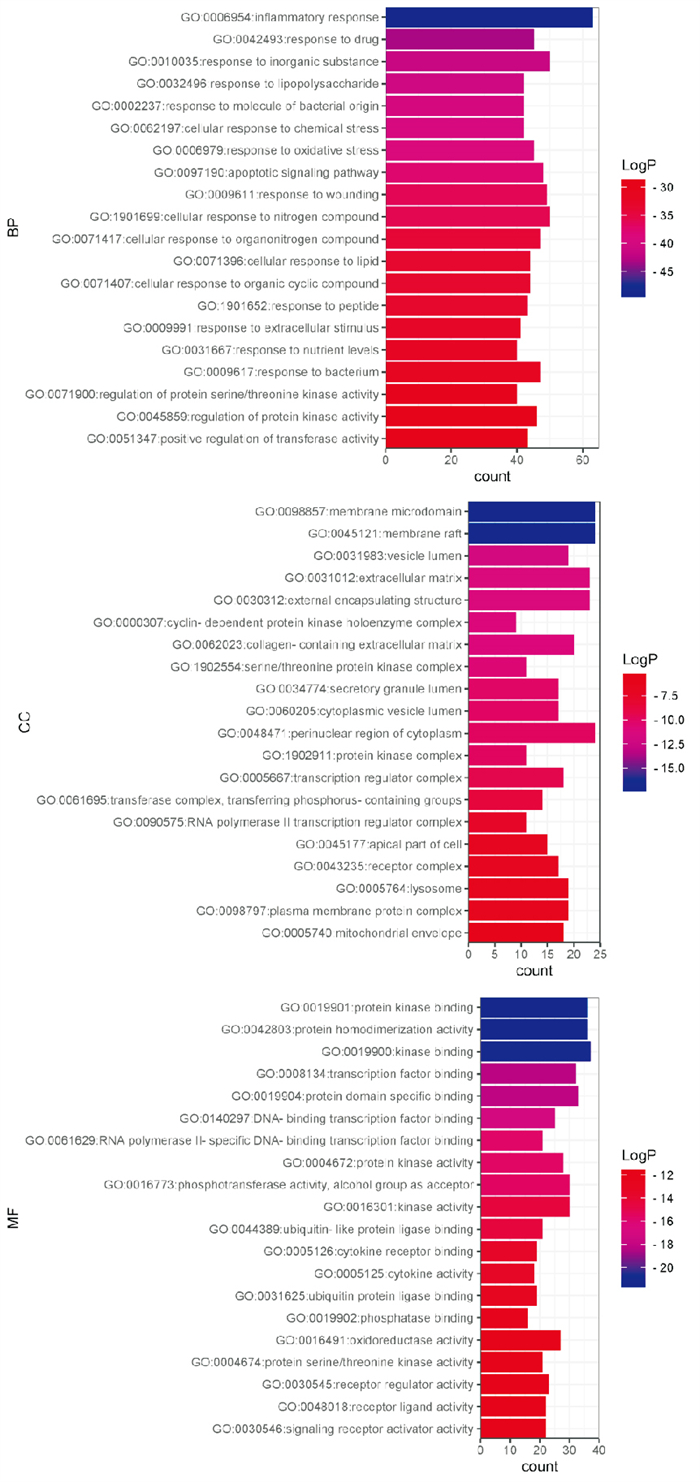
|
| Fig 3 Visualization results of GO function enrichment analysis BP: biological process; CC: cellular constituent; MF: molecular function |
将“2.4”关键靶点进行KEGG富集分析共得到181条通路,将各模块排序前20的条目可视化,见Fig 4。结果显示,厚朴温中汤治疗脾胃虚寒型胃病主要参与免疫系统、信号转导、细胞增殖与凋亡等通路,包括TNF信号通路、NF-κB信号通路、PI3K-Akt信号通路、糖尿病并发症中的AGE-RAGE信号通路、幽门螺杆菌感染中的上皮细胞信号、癌症、结直肠癌等。其中该方参与PI3K-Akt信号通路的关键靶点有35个、参与NF-κB信号通路的有40个、参与幽门螺杆菌感染中的上皮细胞信号通路的有16个,且多数靶点处于上述3条通路的下游,能够调控细胞周期、凋亡和自噬等多种生物过程。
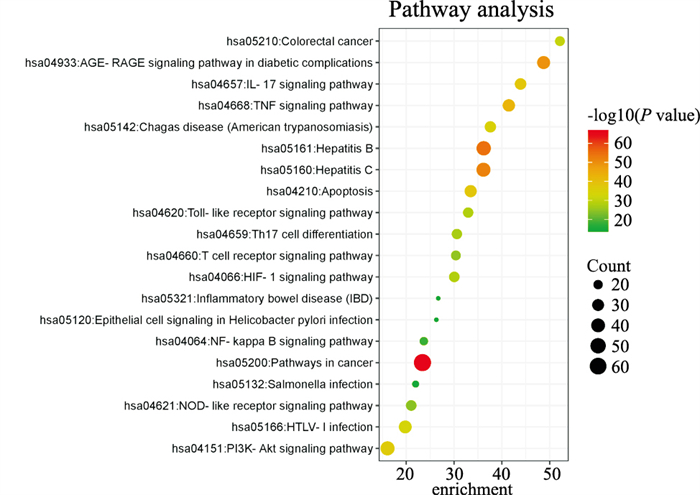
|
| Fig 4 Visualization results of KEGG signaling pathways |
结合通路中涉及的靶点数及靶点的调节作用,推测PI3K-Akt信号通路、NF-κB信号通路、幽门螺杆菌感染中的上皮细胞信号转导为厚朴温中汤治疗脾胃虚寒型胃病的关键通路,见Fig 5。
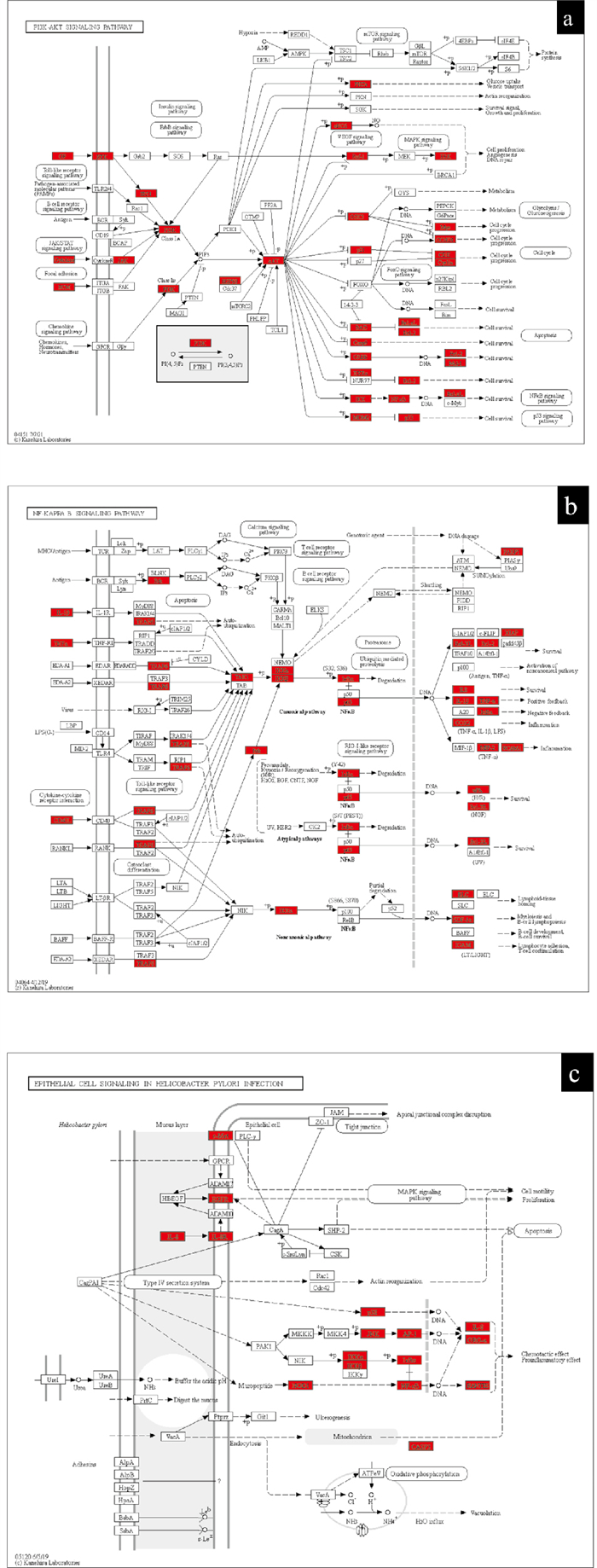
|
| Fig 5 Key signaling pathway of Houpuwenzhongtang a: PI3K-AKT signal pathway; b: NF-κB signal pathway; c: Epithelial cell signal transduction in Helicobacter pylori infection; red: Target of Houpuwenzhongtang on spleen and stomach deficiency cold stomach disease |
通过连接度(degree)、介度(betweenness)及紧密度(closenesss)等网络拓扑参数,得到STAT3、TP53、AKT1、MAPK1、MAPK3、JUN、TNF、RELA、IL-6、IL-8等前10个关键活性靶点,见Tab 2;PI3K-Akt、NF-κB、幽门螺杆菌感染中的上皮细胞信号转导等3条主要信号通路,见Tab 3。
| Target | Degree | Betweenness | Closenesss |
| STAT3 | 46 | 0.101 1 | 0.498 5 |
| TP53 | 45 | 0.083 2 | 0.495 5 |
| AKT1 | 45 | 0.100 0 | 0.498 5 |
| MAPK1 | 39 | 0.070 8 | 0.492 6 |
| MAPK3 | 38 | 0.045 1 | 0.488 3 |
| JUN | 36 | 0.040 7 | 0.485 5 |
| TNF | 34 | 0.050 7 | 0.463 9 |
| RELA | 32 | 0.032 0 | 0.467 8 |
| IL-6 | 28 | 0.030 2 | 0.446 5 |
| IL-8 | 28 | 0.038 9 | 0.436 0 |
| Pathway | Degree | Betweenness | Closenesss |
| Pathways in cancer | 65 | 0.261 1 | 0.542 0 |
| PI3K-Akt signaling pathway | 46 | 0.140 4 | 0.467 4 |
| NF-κB signaling pathway | 44 | 0.073 7 | 0.460 7 |
| HIF-1 signaling pathway | 44 | 0.089 6 | 0.460 7 |
| AGE-RAGE signaling pathway in diabetic complications | 35 | 0.084 1 | 0.432 9 |
| TNF signaling pathway | 35 | 0.061 9 | 0.432 9 |
| HTLV-I infection | 34 | 0.083 5 | 0.430 0 |
| IL-17 signaling pathway | 32 | 0.039 6 | 0.424 3 |
| HIF-1 signaling pathway | 31 | 0.072 4 | 0.421 6 |
| Toll-like receptor signaling pathway | 27 | 0.028 8 | 0.410 8 |
采用Discovery Studio 4.5软件的LibDock模块,对12个厚朴温中汤治疗脾胃虚寒型胃病的关键成分进行分子对接验证。以关键成分及对应关键靶点的对接分数经加权后构建热图(Fig 6)。热图分析发现:活性成分橙皮苷、6-姜辣素与AKT1、JUN、STAT3、IL-8等靶点的对接分数均大于9.5;关键靶点JUN、AKT1与9个活性成分的对接分数均大于9.5;AKT1靶点与橙皮苷、6-姜辣素、厚朴酚、和厚朴酚、柚皮素的对接分数也均大于9.5。其中橙皮苷、6-姜辣素、厚朴酚与AKT1、JUN、MAPK1的对接模式,见Fig 7。
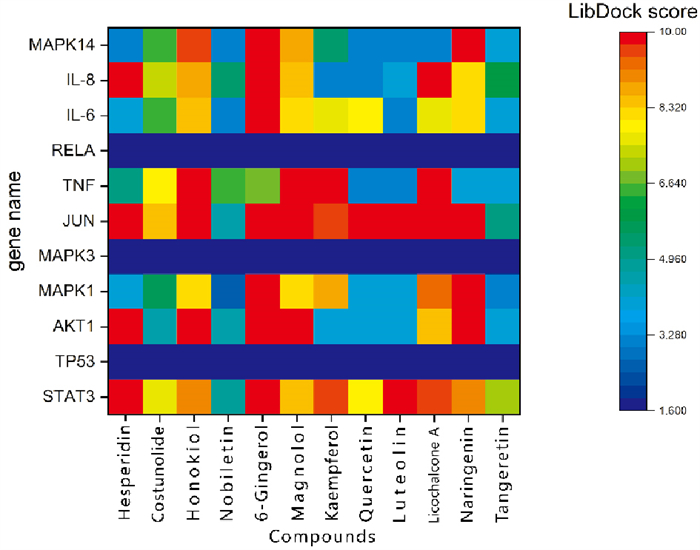
|
| Fig 6 The docking score heat map of key components and targets of Houpuwenzhongtang |
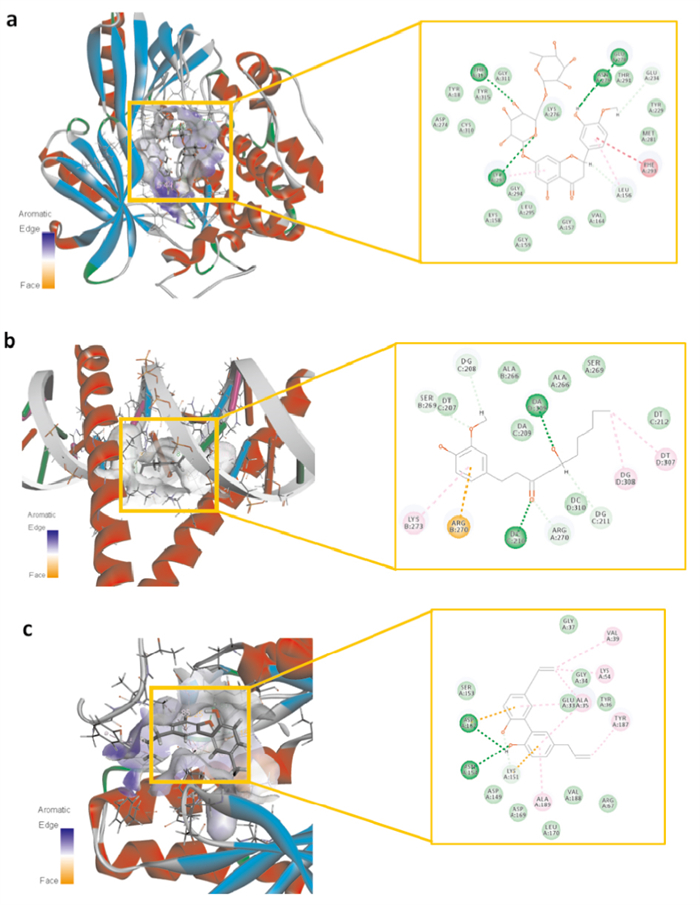
|
| Fig 7 Molecular docking diagram of part of key components and targets a: Hesperidin-AKT1;b: 6-gingerol-JUN; c: Magnolol-MAPK1 |
分子对接结果表明,厚朴温中汤关键活性成分与治疗脾胃虚寒型胃病关键靶点具有较好的结合能力。已报道的实验研究结果表明,分子对接中结合活性较好的成分如厚朴酚、橙皮苷、姜辣素类提取物等能够抑制脾胃虚寒性胃炎、胃溃疡细胞或实验动物中STAT3和MAPK的表达。此外分子对接结果还表明,多数成分与IL-8结合活性较好,已报道的实验结果表明,IL-8能够诱发一系列病理生理变化,导致胃黏膜损伤,与幽门螺杆菌感染引起的相关胃疾病存在重要关系。
2.8 有效成分与关键靶点IL-8的细胞验证网络药理学及分子对接分析预测显示,厚朴温中汤中的厚朴酚、橙皮苷、6-姜辣素等多个关键活性成分能够作用STAT3、IL-8、AKT1等靶点,能够通过调控多个信号通路达到治疗脾胃虚寒型胃溃疡(包括幽门螺杆菌引起的胃溃疡)、慢性胃炎等疾病的目的。目前,已有文献报道表明,抑制炎症反应可恢复胃黏膜组织,减轻胃黏膜损伤[1],其中抑制炎症反应中的炎性细胞因子IL-8,能够达到促(脾虚证患者)胃溃疡愈合的目的。但并无对本方及方中关键成分是否能够抑制IL-8的相关报道,在此基础上,本文选择部分关键活性成分厚朴酚、橙皮苷和6-姜辣素进行IL-8的细胞实验,初步验证网络药理学与分子对接预测分析的结果。
2.8.1 厚朴酚、橙皮苷和6-姜辣素对RAW264.7细胞活力的影响采用CCK-8法检测不同浓度厚朴酚、橙皮苷和6-姜辣素对RAW264.7细胞活力的影响,结果见Tab 4。厚朴酚在浓度范围为0~25 μmol·L-1时,RAW264.7细胞的存活率高于80%;橙皮苷在浓度范围为0 ~125μmol·L-1时,细胞的存活率高于100%;6-姜辣素在终浓度范围为0~125 μmol·L-1时,细胞的存活率高于80%。认定厚朴酚在25 μmol·L-1以下、橙皮苷在125 μmol·L-1以下、6-姜辣素在125 μmol·L-1以下时对RAW264.7细胞活力无明显影响。
| Active ingredient | Concentration/μmol·L-1 | Cell viability/% |
| Magnolol | 100 | 9.02±1.79 |
| 50 | 66.91±8.36 | |
| 25 | 86.95±15.96 | |
| 12.5 | 122.88±24.77 | |
| 6.25 | 125.60±17.24 | |
| Hesperidin | 125 | 130.50±6.03 |
| 62.5 | 109.80±10.56 | |
| 31.25 | 109.95±15.16 | |
| 15.625 | 108.40±16.80 | |
| 7.812 5 | 109.79±9.83 | |
| 6-gingerol | 500 | 51.34±1.91 |
| 250 | 76.00±4.99 | |
| 125 | 80.24±8.77 | |
| 62.5 | 88.70±8.13 | |
| 31.25 | 96.84±14.39 |
采用Griess法测定3个有效成分对LPS诱导的RAW264.7细胞产生NO的抑制作用。结果显示在厚朴酚浓度范围为3.125~25 μmol·L-1时,对NO的抑制效果逐渐增强,呈剂量依赖关系,其IC50值为18.53 μmol·L-1;橙皮苷浓度范围为7.812 5~125 μmol·L-1时,对NO的抑制效果也呈剂量依赖关系,逐渐增强,其IC50值为16.11 μmol·L-1;6-姜辣素浓度范围为7.812 5~125 μmol·L-1时,对NO的抑制效果呈剂量依赖关系,其IC50值为13.55 μmol·L-1,见Fig 8。
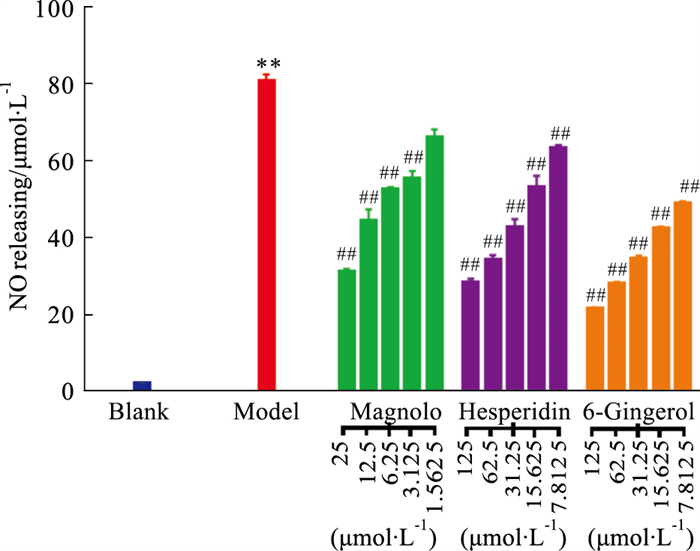
|
| Fig 8 Effects of magnolol, 6-gingerol and hesperidin on NO release from RAW264.7 cells induced by LPS **P < 0.01 vs blank, ##P < 0.01 vs model. |
ELISA实验结果见Tab 5、Fig 9,结果显示1 mg·L-1的LPS诱导RAW264.7细胞后,模型组细胞炎症因子IL-8的分泌水平显著高于空白对照组(P < 0.01),说明RAW264.7细胞炎症模型构建成功。与模型组比较,6-姜辣素7.812 5、15.625、31.25 μmol·L-1,厚朴酚6.25、12.5、25 μmol·L-1,橙皮苷7.812 5、15.625、31.25 μmol·L-1组IL-8的分泌水平均明显降低(P < 0.01),且呈剂量依赖关系。表明厚朴酚、橙皮苷和6-姜辣素均能够抑制炎症巨噬细胞中IL-8的分泌,与分子对接结果相吻合。
| Group | Concentration (μmol·L-1) | IL-8 (ng·L-1) |
| Blank | 17.53±3.26 | |
| Model | 59.20±3.83** | |
| 6-Gingerol | 31.25 | 24.51±3.05## |
| 15.625 | 29.31±3.82## | |
| 7.812 5 | 35.47±4.58## | |
| Magnolol | 25 | 23.30±5.21## |
| 12.5 | 31.80±2.33## | |
| 6.25 | 38.19±9.48## | |
| Hesperidin | 31.25 | 22.74±2.22## |
| 15.625 | 28.05±3.50## | |
| 7.812 5 | 36.19±9.79## | |
| **P < 0.01 vs blank,## P < 0.01 vs model. | ||
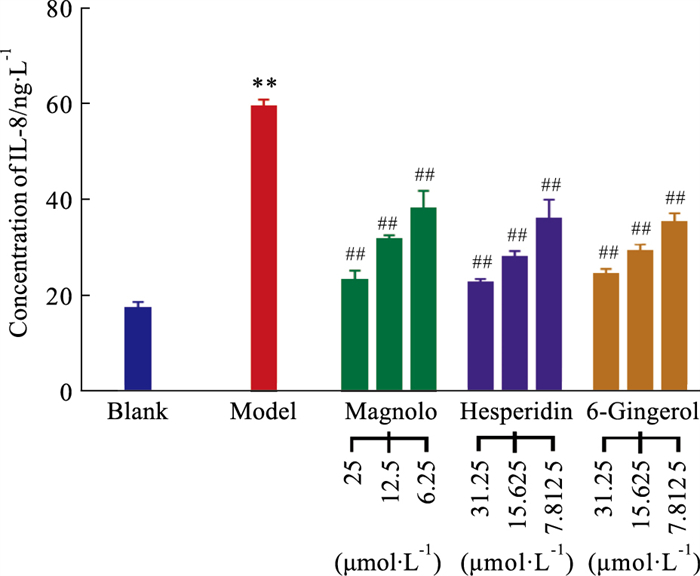
|
| Fig 9 Effects of magnolol, 6-gingerol and hesperidin on LPS-induced IL-8 secretion in RAW264.7 cells **P < 0.01 vs blank, ##P < 0.01 vs model. |
厚朴温中汤作为经典名方,在李东垣的《内外伤辨惑论》中主治脾胃虚寒型胃病,通过以“厚朴温中汤”为关键词在中国知网、Web of science等数据库检索发现,大多文献偏向于该方在临床上加减味的使用和质量分析两个方面,在治疗脾胃虚寒型胃病的作用机制方面缺乏深入探索。本研究基于复方多成分、多靶点作用的研究思路,结合网络药理学分析技术,首次构建了厚朴温中汤治疗脾胃虚寒型胃病的蛋白互作网络和“药材-成分-靶点-通路网络”,对GO和KEGG进行富集分析,以期阐明该方治疗脾胃虚寒型胃病的作用机制。
本研究通过厚朴温中汤治疗脾胃虚寒型胃病的网络药理学分析,发现该方关键活性成分主要有槲皮素、木犀草素、山奈酚、木香烃内酯、川陈皮素、甘草查尔酮A、6-姜辣素、柚皮素、桔皮素、橙皮苷、厚朴酚、和厚朴酚;关键靶点主要有STAT3、AKT1、MAPK1、JUN、TNF、IL-6、IL-8、TNF、MAPK14等。GO富集分析结果显示,厚朴温中汤的作用靶点分布在多种细胞组分中,能够通过多种结合方式参与多种生物进程。KEGG通路富集分析显示,厚朴温中汤主要参与TNF信号通路、NF-κB信号通路、PI3K-Akt信号通路、HIF-1信号通路、糖尿病并发症中的AGE-RAGE信号通路、EB病毒(EBV)感染、癌症、结直肠癌等多条信号通路,主要与调节信号转导、免疫与炎症,抗寄生虫以及调控癌症进程相关。
3.1 药效成分治疗脾胃虚寒型胃病的药理作用分析活性成分槲皮素是甘草和草豆蔻的共有成分,且存在于多种中药中,研究表明,槲皮素对胃癌、结肠癌等具有抗肿瘤疗效,对胃炎和幽门螺杆菌感染引起相关的凋亡具有保护作用。木犀草素能够显著诱导IL-8、IL-10和NF-κB在mRNA和蛋白水平上的表达,作用于幽门螺杆菌感染引起的胃癌伴慢性胃炎[4]。山奈酚通过促炎细胞因子TNF、IL-1、IL-6和NO保护乙醇诱导的小鼠胃溃疡。甘草查尔酮A很可能通过抑制NF-κB信号通路发挥抗炎作用和激活Nrf2信号通路发挥抗氧化作用,显著拮抗DSS诱导的溃疡性结肠炎。
川陈皮素、桔皮素和柚皮素均为陈皮中的成分,川陈皮素与幽门螺杆菌目标蛋白的结合亲和力较高,推测为抗幽门螺杆菌的有效成分。桔皮素可以下调NF-κB p65蛋白表达,起到抗炎效果。柚皮素可通过抑制PI3K/Akt信号通路促进人胃癌SGC-7901细胞凋亡发挥抑癌作用。
木香烃内酯、6-姜辣素、橙皮苷、厚朴酚、和厚朴酚均为厚朴温中汤中木香、干姜、陈皮、厚朴药材在《中国药典(2020年版)》中的质量控制成分。研究表明,木香烃内酯能够抑制NF-κB蛋白和MAPK蛋白激酶的活化[5];也能通过PI3K/AKT信号通路调控结直肠癌细胞的增殖、凋亡和迁移[6]。Mahady等[7]研究表明,姜的提取物-姜辣素对幽门螺杆菌CagA+菌株的体外生长具有抑制作用,推测其可能是预防幽门螺杆菌性胃炎的机制之一。橙皮苷能够调控MAPK信号通路[8]和PI3K-Akt信号通路[9],且具有促胃肠运动作用。厚朴酚能够改善功能性消化不良[10],能够通过抑制白细胞介素分泌,影响NF-κB通路信号传导,减少TNF等促炎因子释放进而减轻炎症,推测可能是其治疗胃炎的作用机制之一[11]。和厚朴酚能够有效增强信号转导和转录激活子(STAT-3) 去磷酸化并抑制STAT-3 DNA结合活性[12]。
3.2 关键靶点与治疗脾胃虚寒型胃病的相关机制分析关键靶点IL-8和IL-17是重要的促炎症细胞因子,能够通过信号转导复合体激活下游NF-κB、JNK等信号通路。研究显示IL-17能够影响相关中性粒细胞的浸润与幽门螺旋杆菌的清除,进而调控胃炎[13]。有临床研究数据显示,幽门螺杆菌阳性患者IL-8、IL-17的浓度均高于阴性患者,推断细胞因子IL-8、IL-17参与慢性活动性胃炎的发生发展[14]。本研究细胞实验验证表明,6-姜辣素、厚朴酚、橙皮苷均能显著抑制IL-8的表达水平(P<0.01),且呈剂量依赖关系;而抑制炎性细胞因子IL-8,可减轻胃黏膜损伤,达到促(脾虚证患者)胃溃疡愈合的目的。由此推测,厚朴温中汤可能主要通过厚朴酚、6-姜辣素、橙皮苷等成分发挥对IL-8的抑制作用。肿瘤坏死因子TNF-α能够激活多个信号转导通路的关键分子,如MAPK、PI3K等,已有研究表明降低TNF-α的含量,能够清除血浆内的炎性介质,改善乙醇诱导的小鼠胃溃疡。AKT1蛋白调控细胞增殖和生长,通过抑制AKT1蛋白激酶的磷酸化和激活,能够降低IKKα激酶的表达,进而抑制免疫性细胞因子的表达上调[9]。
3.3 关键通路与治疗脾胃虚寒型胃病的相关机制分析信号通路PI3K/ AKT能够促进细胞增殖、细胞运动及糖原代谢。研究结果显示,经胃前壁胃窦部浆膜层处注入冰乙酸所致胃溃疡大鼠的胃组织中胃蛋白酶活性升高,会激活PI3K/Akt信号通路,进而促进炎症因子IL-4、IL-2R的表达[15]。另有研究显示,木香颗粒能够通过上调转化生长因子β的表达,从而激活结肠上皮细胞中PI3K/Akt信号通路,达到改善溃疡性结肠炎大鼠的胃痛、腹泻和便血等症状[16],推测PI3K/Akt信号通路可能为治疗胃溃疡的通路之一。
NF-κB信号通路在细胞的炎症反应和免疫应答等过程中起着关键性作用。降低IL-6和TNF-α水平,升高PGE2、COX-1、COX2水平能够阻断NF-κB信号通路,进而治疗吲哚美辛引起的胃溃疡[17],也可能通过上调内源性一氧化氮合酶表达来使胃上皮细胞免受幽门螺杆菌诱导的凋亡[18]。
许多研究报道,厚朴酚、橙皮苷、木香烃内酯、柚皮素等活性成分能够作用STAT3、TNF、AKT1等靶点,这些靶点能够通过调控PI3K-AKT和NF-κB信号通路达到治疗脾胃虚寒型胃溃疡(包括幽门螺杆菌引起的胃溃疡)、慢性胃炎等疾病的目的。本研究还首次通过网络药理学技术、分子对接验证发现,6-姜辣素能够与多个治疗脾胃虚寒型胃病的疾病靶点稳定结合,例如AKT1、MAPK1、IL-8,推测6-姜辣素值得进一步研究开发,或能为该方中生姜、干姜的加减用量提供参考。
此外,细胞实验结果表明,在幽门螺杆菌感染中的上皮细胞信号转导通路中,IL-8参与调控幽门螺杆菌感染中的上皮细胞信号转导通路,分布在细胞核内,能够直接调控细胞产生凋亡、自噬等生物进程,这提示该通路可能成为厚朴温中汤治疗由幽门螺杆菌引起的相关胃疾病的关键机制之一。
| [1] |
许春进, 张西亮, 刘伟, 等. 幽门螺杆菌感染患者白细胞介素-8和粒细胞集落刺激因子水平的分析[J]. 中国医师杂志, 2007, 1: 117-8. Xu C J, Zhang X L, Liu W, et al. Analysis of interleukin-8 and granulocyte colony stimulating factor levels in patients with helicobacter pylori infection[J]. J Chin Physician, 2007, 1: 117-8. |
| [2] |
刘建群, 闫君, 舒积成, 等. 经典名方厚朴温中汤的研究进展[J]. 中国实验方剂学杂志, 2019, 25(17): 209-18. Liu J Q, Yan J, Shu J C, et al. Research progress of Houpo Wenzhongtang[J]. Chin J Exp Tradit Med Formulae, 2019, 25(17): 209-18. |
| [3] |
赵欢, 开国银, 韩冰. 基于网络药理学和分子对接的丹参饮抗结肠癌作用机制[J]. 中国药理学通报, 2022, 38(4): 598-605. Zhao H, Kai G Y, Han B. Study of Danshen decoction on colon cancer based on network pharmacology and molecular docking[J]. Chin Pharmacol Bull, 2022, 38(4): 598-605. |
| [4] |
Radziejewska I, Borzym-kluczyk M, Leszczyńska K. Luteolin alters MUC1 extracellular domain, sT antigen, ADAM-17, IL-8, IL-10 and NF-κB expression in Helicobacter pylori-infected gastric cancer CRL-1739 cells: a preliminary study[J]. Biomed Rep, 2021, 14(2): 19. |
| [5] |
Soon K J, Dae Y Y, Hoon L K, et al. Costunolide inhibits interleukin-1beta expression by down-regulation of AP-1 and MAPK activity in LPS-stimulated RAW 264.7 cells[J]. Biochem Biophys Res Commun, 2004, 313(1): 171-7. doi:10.1016/j.bbrc.2003.11.109 |
| [6] |
吴文宇, 杨柱, 龙奉玺, 等. 木香烃内酯通过PI3K/AKT信号通路调控结直肠癌细胞增殖、凋亡、侵袭和迁移[J]. 中药材, 2020, 43(2): 429-35. Wu W Y, Yang Z, Long F X, et al. The regulation of costunolide on colorectal cancer cell proliferation, apoptosis, invasion and migration through PISK/AKT signaling pathway[J]. J Chin Med Mater, 2020, 43(2): 429-35. |
| [7] |
Mahady G B, Pendland S L, Yun G S, et al. Ginger (Zingiber officinale Roscoe) and the gingerols inhibit the growth of Cag A+Strains of helicobacter pylori[J]. Anticancer Res, 2003, 23(5A): 3699-702. |
| [8] |
王振东, 巩会杰, 马俊文. 橙皮苷诱导人胃癌AGS细胞凋亡机制的研究[J]. 中草药, 2019, 50(22): 5484-91. Wang Z D, Gong H J, Ma J W. Effects of hesperidin on apoptosis of human gastric cancer AGS cells and its mechanism[J]. Chin Tradit Herb Drugs, 2019, 50(22): 5484-91. |
| [9] |
Shahbazi R, Cheraghpour M, Homayounfar R, et al. Hesperidin inhibits insulin-induced phosphoinositide 3-kinase/Akt activation in human pre-B cell line NALM-6[J]. J Cancer Res Ther, 2018, 14(3): 503-8. |
| [10] |
王振奋, 黄平, 蔡国豪. 厚朴酚对功能性消化不良小鼠消化液分泌和胃肠运动功能的影响[J]. 现代消化及介入诊疗, 2020, 25(4): 454-8. Wang Z F, Huang P, Cai G H. Effects of magnolol on digestive fluid secretion and gastrointestinal motion function in mice with functional dyspepsia[J]. Mod Interv Dig, 2020, 25(4): 454-8. |
| [11] |
莫斯喻, 钟淇滨, 蔡肇栩, 等. 厚朴酚对LPS致炎小鼠抗炎效应的初步研究[J]. 海南医学院学报, 2019, 25(5): 335-8, 342. Mo S Y, Zhong Q B, Cai Z X, et al. Preliminary study on the anti-inflammatory effect of magnolol on LPS-induced mice[J]. J Hainan Med Coll, 2019, 25(5): 335-8, 342. |
| [12] |
Liu S H, Wang K B, Lan K H, et al. Calpain/SHP-1 Interaction by honokiol dampening peritoneal dissemination of gastric cancer in nu/nu mice[J]. PLoS One, 2012, 7(8): 43711-29. |
| [13] |
Melo F, Rocha A, Rocha G A, et al. A regulatory instead of an IL-17 T response predominates in helicobacter pylori-associated gastritis in children[J]. Microbes Infect, 2012, 14(4): 341-7. |
| [14] |
马健, 孟欣颖, 王涛, 等. 慢性活动性胃炎患者血清IL-6、TGF-β1及IL-17的水平与幽门螺杆菌的关系及临床意义[J]. 中华临床医师杂志, 2012, 6(11): 2908-10. Ma J, Meng X Y, Wang T, et al. The relationship between helicobacter pylori and the concentration of serum IL-6, TGF-31 and lL-17 in chronic active gastritis and its clinical significance[J]. Chin J Clin, Electron Ed, 2012, 6(11): 2908-10. |
| [15] |
巩子汉, 王艳威, 段永强, 等. 白及多糖对GU模型大鼠胃组织PI3K/Akt的影响[J]. 中国实验方剂学杂志, 2020, 26(6): 52-7. Gong Z H, Wang Y W, Duan Y Q, et al. Effect of bletillae rhizoma polysaccharide on PI3K/Akt in gastric tissue of GU model rats[J]. Chin J Exp Tradit Med Formulae, 2020, 26(6): 52-7. |
| [16] |
Wang X H, Li D, Zhang Y, et al. Costus root granules improve ulcerative colitis through regulation of TGF-beta mediation of the PI3K/AKT signaling pathway[J]. Exp Ther Med, 2018, 15(5): 4477-84. |
| [17] |
Xue H P, Li S, Sui X, et al. 1-Deoxynojirimycin (DNJ) ameliorates indomethacin-induced gastric ulcer in mice by affecting NF-kappaB signaling pathway[J]. Front Pharmacol, 2018, 9: 372-86. |
| [18] |
Mogg K J, Sung K J, Chae J H, et al. Helicobacter pylori infection activates NF-kappaB signaling pathway to induce iNOS and protect human gastric epithelial cells from apoptosis[J]. Am J Physiol-Gastr L, 2003, 285(6): 1171-80. |

