


2. 延边大学附属医院耳鼻喉科,吉林 延吉 133002;
3. 延边大学医学院解剖学教研室,吉林 延吉 133002
金永德(1964-),男,博士,博士生导师,研究方向:变应性鼻炎,通信作者,E-mail: jyd0091@126.com
 ,
DAI Long-zhu1,3,
CHEN Mu1,2,
SONG Yi-lan1,3,
YAN Guang-hai1,3,
WANG Chong-yang1,3
,
DAI Long-zhu1,3,
CHEN Mu1,2,
SONG Yi-lan1,3,
YAN Guang-hai1,3,
WANG Chong-yang1,3
 ,
JIN Yong-de1,2
,
JIN Yong-de1,2

2. Dept of Otorhinolaryngology, Affiliated Hospital of Yanbian University, Yanji Jilin 133002, China;
3. Dept of Anatomy, Yanbian University School of Medicine, Yanji Jilin 133002, China
过敏性鼻炎(allergic rhinitis, AR)是人接触过敏原后,由免疫球蛋白IgE介导的鼻黏膜炎症性疾病,表现为打喷嚏、流鼻涕、鼻塞等症状。AR是耳鼻喉科常见疾病之一,其发病率在全球范围内逐年增加,使世界上30%的人口受其困扰,明显影响了人们的生活质量、睡眠和工作效率[1]。虽然用于治疗AR的药物有很多,例如皮质类固醇、抗组胺和鼻内抗胆碱能药物,但它们副作用大。因此,寻找一种对治疗AR有效的新型靶向药是当务之急。
线粒体结构和功能完整性是维持细胞能量稳态和健康的基础。线粒体的功能障碍与许多疾病有关,包括癌症、哮喘等。线粒体裂变需要的主要调节因子是dynamin-related protein 1 (Drp1),其是GTP酶动力蛋白家族的一个成员。Drp1受到磷酸化和多种翻译修饰调节,通过这些修饰改变了Drp1定位、活性,然后胞质的Drp1被招募到线粒体中,被GTP水解导致线粒体分裂[2]。Drp1在细胞凋亡、氧化还原修饰、钙稳态扮演着至关重要的角色。然而,目前尚未发现线粒体损伤和凋亡与AR的相关研究。
RhoA是小GTP酶家族的一员。在这些成员中,RhoA与其下游靶点Rhoassociated coil kinase 1(ROCK1)进行了深入研究。研究表明,鸦胆子苦醇可通过RhoA/ROCK1通路抑制结直肠癌细胞HCT-116的迁移和侵袭[3]。RhoA/ROCK1信号介导了内皮细胞炎症、迁移、凋亡。此外Rivera等[4]进一步研究表明,RhoA/ROCK1与线粒体也有密切关系。激活RhoA/Rock1通路可以提高线粒体ROS并降低线粒体膜电位。ROCK1激酶抑制剂Y27632可以通过RhoA/ROCK1信号通路介导一系列生物学行为,如哮喘、癌症、青光眼、胰岛素抵抗、肾衰竭、神经退行性疾病和骨质疏松。然而,RhoA/ROCK1信号通路在OVA诱导下AR的作用尚未明确。
JTE-013[N-(2, 6-dichloro-4-pyridinyl)-2-[1, 3-dimethyl-4-(1-methylethyl)-1H-pyrazolo[3, 4-b]pyridin-6-yl]-hydrazinecarboxamide],分子量为408.29,其分子式是C17H19N7OCl2,结构见Fig 1A。S1P是近年来发现的一种具有重要生理功能的磷脂类物质,通过S1P受体(S1PR1、S1PR2、S1PR3、S1PR4、S1PR5)的依赖和独立途径,调节细胞分化、炎症和凋亡等过程[5]。JTE-013是S1PR2的特异性抑制剂,可能是一种有前景的AR治疗药物。在糖尿病中,Chen等[6]提出了JTE-013可以通过抑制ROCK1改善高糖诱导人肾小球内皮细胞(HRGECS)线粒体分裂和功能障碍。本研究通过抑制RhoA/Rock1/Drp1介导的线粒体损伤和凋亡探索JTE-013对AR的缓解作用,从而说明JTE-013在AR中的潜在作用和作用机制。
1 材料与方法 1.1 诱导小鼠AR模型和症状评估本研究获得了延边大学伦理委员会的批准(No 20220614b 0321217)。30只雌性BALB/c小鼠,体质量(18~25)g,购自延边大学医学实验动物中心,实验动物使用许可证号:SYXK(吉)2020-0009。并将小鼠在特定无病原体(SPF)条件下,室温为22~24 ℃,相对湿度为60%±5%饲养1周。将小鼠随机分为3组:对照组(Control组)、模型组(OVA组)、治疗组(8 mg·kg-1,JTE-013组)。在第0、7和14天通过腹膜内注射(ip)25 μg OVA(Sigma-Aldrich, USA)和2 mg氢氧化铝佐剂(Sigma-Aldrich),总体积为300 μL,致敏小鼠,而对照组按相同时间、同剂量注射PBS溶液。致敏后,第21~27天,用OVA(5 g·L-1,20 μL/孔)每日给予鼻内(in)激发这些致敏小鼠,对照组小鼠用PBS和氢氧化铝佐剂代替OVA致敏和激发。第21~27天,治疗组(8 mg·kg-1,JTE-013组)经腹腔注射(ip)给予JTE-013(Sigma),每次OVA激发前30 min给药,而模型组(OVA组)经腹腔注射生理盐水。第27天末次激发后20 min,由2名对实验不知情的观察者记录每只小鼠的揉鼻及打喷嚏次数,不少于30 min。第27天后,处死所有小鼠,并取其鼻及鼻黏膜组织和眼球血,用于之后的实验。
1.2 鼻组织病理分析在27 d末次激发后24 h内,所有小鼠均处死。切除鼻组织,用4%多聚甲醛固定2 d,并在10%乙二胺四乙酸脱钙溶液(E1171,Solarbio)中脱钙11 d。然后将鼻组织标本脱水,石蜡包埋,切成4~5 μm厚切片,切片用苏木精-伊红(HE) (Sigma)染色。以光学显微镜下评估鼻中隔黏膜中组织病理学变化。
1.3 二氢乙锭(DHE)染色检测鼻组织活性氧(ROS)不同处理后,依据鼻组织病例分析步骤得到4~5 μm的鼻组织切片,PBS漂洗3次,每次5 min。然后按照DHE试剂盒(APEXBIO, USA)说明, 用染色溶液覆盖组织,并在37 ℃的湿盒中孵育10 min。然后采用倒置显微镜观察荧光强度。
1.4 TUNEL染色取鼻组织切片脱蜡后,加入无DNA酶的蛋白酶K(#ST532,上海碧云天)孵育30 min,然后按照TUNEL试剂盒(Sangon Biotech, China)说明,通过原位标记检测细胞凋亡。使用Cytation 5荧光显微镜拍照检测样本。
1.5 细胞培养和处理原代人鼻上皮细胞系HNEpCs购自赛百慷(上海)生物技术股份有限公司。HNEpCs在含2%胎牛血清的icell原代上皮细胞基础培养基中于37 ℃、5%CO2培养箱培养。用10 μg·L-1重组人IL-13(rhIL-13,#78029.1,STEMCELL,Canada)处理第2~4代细胞24 h。用10 μmol·L-1 JTE-013(Sigma-Aldrich, USA)或10 μmol·L-1 Y27632(Santa Cruz Biotechnology, USA)预处理细胞30 min, 然后去评估JTE-013和ROCK1抑制剂在HNEpCs中的调节作用。
1.6 蛋白质印迹分析将鼻组织和处理过的细胞用RIPA (#P0013B, 上海碧云天)裂解,裂解液在冰上放置30 min,然后在4 ℃下以12 000 r·min-1离心10 min。用BCA检测试剂盒(#P0010S, 上海碧云天)定量总蛋白浓度。通过10%的SDS-PAGE凝胶上分离蛋白样品,然后电泳转移到PVDF膜上(Millipore, USA)。用5%脱脂乳在室温下封闭2 h后,将膜与一抗在4 ℃孵育一夜。清洗后,将膜与二抗在室温下孵育1 h。暴露显色后,对蛋白条带进行成像和分析。
一抗信息如下: ROCK1(#ab134181)、RhoA(#ab187027)、Drp1 (#ab184247)、B-cell lymphoma-2 (Bcl-2,#ab194583)、Cyt-c(#ab133504)、Apaf-1(#ab234436)均购自美国Abcam公司; β-actin(#3700)、cleaved-caspase-3(#9644)、cleaved-caspase-9 (#20750S)均购自美国CST; p-Drp1(616) (#AF8470)、p-Drp1 (637)(#DF2980)、GAPDH (#AF7021)均购自美国Affinity; Bcl-2相关x蛋白(Bax,#A19684)购自美国Abclonal公司。二抗为hrp-山羊抗兔抗体(#5151, CST, USA)和hrp-小鼠抗体(#5257, CST, USA)。
1.7 免疫荧光为了检测细胞中的Cyt-c,我们在12孔的玻璃孔板培养的HNEpCs,用10 μg·L-1 IL-13和10 mg·L-1 JTE-013、Y27632处理后。用磷酸盐缓冲液洗涤细胞3次,每次5 min,4%多聚甲醛室温下静置固定10 min,0.2%TritonX-100室温静置1 h。然后用5%封闭液(BSA)处理60 min,并用兔抗cyt-c的抗体(在封闭液1 ∶100稀释)在4 ℃下孵育过夜。最后,再用二抗(在封闭液中1 ∶100稀释)避光孵育2 h, 磷酸盐缓冲液洗涤细胞洗2次,间隔5 min,DAPI封片,采用Cytation 5荧光显微镜拍摄。
1.8 细胞的活性氧(ROS)分析使用2, 7,二氯荧光素二乙酸酯(DCFH-DA)(10 mg·L-1,#S0033S, 上海碧云天) 检测HNEpCs的细胞内ROS产生,当ROS产生时,DCFH-DA被氧化为荧光染料。用IL-13处理后,用10 μm DCF-DA染料在37 ℃下孵育30 min,洗涤2次。然后在荧光显微镜下对细胞产生荧光进行成像。对mtROS的检测,细胞用mitoSOX染料(5 μmol·L-1,#M36008,Thermo Fisher Scientific,USA)在37 ℃下孵育30 min。观察并拍照HNEpCs产生荧光染色的细胞(红色荧光)。
1.9 线粒体膜电位(MMP)检测和线粒体裂变分析不同处理后的HNEpCs细胞,在恒温下与JC-1 (5 μmol·L-1, #C2006, 上海碧云天)染色液孵育15 min。用400 nmol·L-1的MitoTracker Red (#M7521, Life, USA)对线粒体裂变进行检测,在恒温下染色30 min。然后,细胞在经固定、渗透,并用一抗Drp1抗体在4 ℃下孵育一夜。冲洗后,用Alexa Fluor 488标记的驴抗山羊IgG (H + L)抗体(#TF271743A, Invitrogen, USA)在室温下孵育细胞2 h。通过Cytation 5采集图像。
1.10 统计学分析统计分析数据采用SPSS 19.0软件进行分析。计量数据表示为x±s。分组数据表示为相对数(%)。使用方差分析进行组间比较,q检验进行两两比较。
2 结果 2.1 JTE-013可以降低小鼠炎症反应为了检测JTE-013对AR的影响,我们用OVA通过腹腔注射和滴鼻两种方式建立AR模型,然后用JTE-013(8 mg·kg-1)治疗AR小鼠后。记录了小鼠揉鼻和打喷嚏的临床症状。结果显示,与模型组相比,JTE-013治疗明显减少了打喷嚏和揉鼻的次数(P < 0.01; Fig 1B),HE染色显示,与模型组相比,JTE-013治疗减少了鼻黏膜下浸润的嗜酸性粒细胞聚集和炎症(Fig 1C)。这些结果表明,JTE-013可以减轻AR的炎症反应。
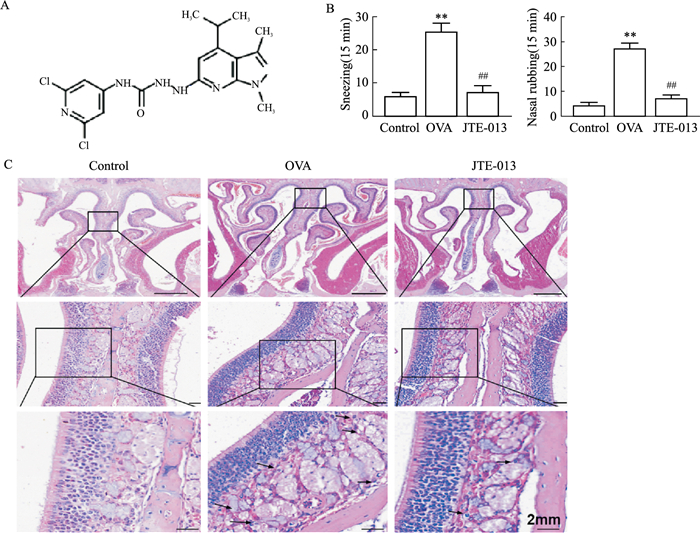
|
| Fig 1 JTE-013 reduced inflammatory response in mice(x±s, n=3) A: Structure of JTE-013; B: Frequency of sneezing and nasal rubbing in AR mice; C: HE staining of nasal tissue sections. Arrows indicate eosinophils. **P < 0.01 vs control group, ##P < 0.01 vs OVA model group. |
为了探讨JTE-013对AR影响机制,我们用Western blot检测RhoA、ROCK1、Drp1及相关磷酸化的位点p-Drp1(616)、p-Drp1(637)及线粒体分裂蛋白(Fis1)蛋白水平,检测结果提示,与模型组相比,治疗组RhoA、ROCK1、Drp1、p-Drp1(616)和Fis1蛋白相关表达量均明显减少(P < 0.05),而p-Drp1(637)相比与模型组明显增加,差异具有统计学意义(P < 0.05, Fig 2A)。DHE染色结果提示,与模型组相比,JTE-013治疗可以减少AR小鼠鼻黏膜组织的ROS产生(Fig 2B)。这些结果表示JTE-013可以抑制RhoA、ROCK1、Drp1通路相关蛋白及ROS产生。

|
| Fig 2 Effect of JTE-013 on RhoA, ROCK1, Drp1 pathway-related protein expression and ROS production (x±s, n=3) A: Western blot analysis of RhoA, ROCK1, p-Drp1 (616), p-Drp1 (637), Fis1, Drp1 expression in nasal tissue. B: DHE staining of nasal tissue sections.*P < 0.05, **P < 0.01 vs control group, #P < 0.05, ##P < 0.01 vs OVA model group. |
为验证JTE-013对AR小鼠鼻黏膜上皮细胞凋亡的影响,采用TUNEL染色和Western blot检测鼻组织中凋亡情况。与模型相比,JTE-013组鼻黏膜组织TUNEL阳性细胞比例降低。此外,JTE-013抑制了鼻上皮细胞的凋亡蛋白,包括cleaved-caspase-3、Bax、Cyt-c、Apaf-1、cleaved-caspase-9的表达(P < 0.05,Fig 3A),但上调了抗凋亡蛋白Bcl-2(P < 0.05, Fig 3B)。提示JTE-013对AR小鼠鼻组织具有抗凋亡作用。
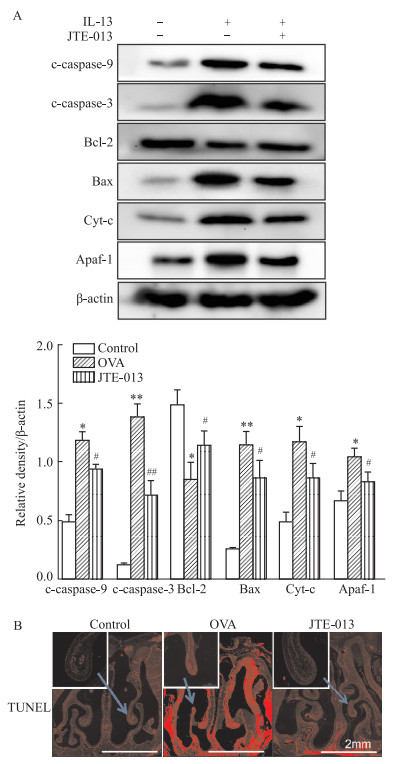
|
| Fig 3 JTE-013 inhibited apoptosis of nasal mucosal epithelial cells in allergic rhinitis mice(x±s, n=3) A: Western blot analysis of Bax, cleaved-caspase-3, Bcl-2, cleaved-caspase-9, Cyt-c, and Apaf-1 expression in nasal tissue. B: TUNEL staining of nasal tissue sections. *P < 0.05, **P < 0.01 vs control group, #P < 0.05, ##P < 0.01 vs OVA model group. |
激活的ROCK1可以促进Drp1募集到线粒体并且诱导线粒体裂变。因此检测JTE-013在IL-13诱导下,ROCK1、Drp1、p-Drp(616)、p-Drp(637)和Fis1蛋白表达,及Drp1的易位情况和线粒体功能障碍。我们发现,IL-13刺激下RhoA、ROCK1、Drp1及在其磷酸化位点ser616处蛋白表达增加(P < 0.05),而Drp1总蛋白表达不变(P>0.05,Fig 4A),表明RhoA/ROCK1介导Drp1及其磷酸化。但是,JTE-013可以逆转这些改变。接下来我们通过MitoTracker Red染色进一步研究了线粒体形态的变化发现,IL-13刺激后的线粒体由高度动态的管状网络组织,发展为碎裂或球形线粒体,线粒体出现裂变,治疗组则逆转了该现象。研究报道[7],Drp1通过易位和活化来调节线粒体裂变和细胞凋亡。结果显示,JTE-013减少了IL-13刺激鼻黏膜上皮细胞Drp1易位(Fig 4D)。由此可见,JTE-013能够抑制IL-13诱导的线粒体裂变,Drp1易位,从而抑制鼻黏膜上皮细胞线粒体损伤。已知,线粒体可以产生ROS,而ROS的积聚诱导线粒体裂变和凋亡[8]。在IL-13处理后鼻黏膜上皮细胞中JTE-013可以抑制ROS产生(P < 0.01,Fig 4C)。利用mitoSOX检测到线粒体ROS,检测发现mtROS产生降低(P < 0.01,Fig 4B)。这些结果很好地证明了JTE-013能够逆转IL-13诱导的鼻黏膜上皮细胞ROS介导线粒体裂变的功能障碍。

|
| Fig 4 JTE-013 reversed IL-13-induced mitochondrial division and dysfunction in nasal epithelial cells (x±s, n=3) A: RhoA, ROCK1, p-DRP1 (616), p-DRP1 (637), fis1, and Drp1 expression levels in HNEpCs detected by Western blot; B: mtROS in HNEpCs detected by mitoSOX staining; C: ROS production in HNEpCs detected with DCFH-DA probe.D: Co-localization of MitoTracker Red and Drp1 in HNEpCs. *P < 0.05, **P < 0.01 vs control group, #P < 0.05, ##P < 0.01 vs IL-13 treated group. |
为了检测JTE-013对AR小鼠线粒体膜电位及细胞凋亡的影响。如Fig 5A所示,利用JC-1染料检测和分析发现,JTE-013治疗可以恢复IL-13诱导的线粒体膜电位的丢失(P < 0.05)。如Fig 5B所示,与对照组相比,IL-13导致cleaved-caspase-3、Bax、cleaved-caspase-9表达和活性的明显增加,经JTE-013治疗后明显降低(P < 0.05)。而Bcl-2则结果相反(P < 0.05)。如Fig 5C所示,用免疫荧光检测Cyt-c表达,结果显示IL-13显著上调了Cyt-c的表达,而JTE-013治疗下调这一表达(P < 0.05)。这些结果表明,JTE-013能够恢复IL-13诱导的线粒体膜电位丢失以及具有抗凋亡作用。
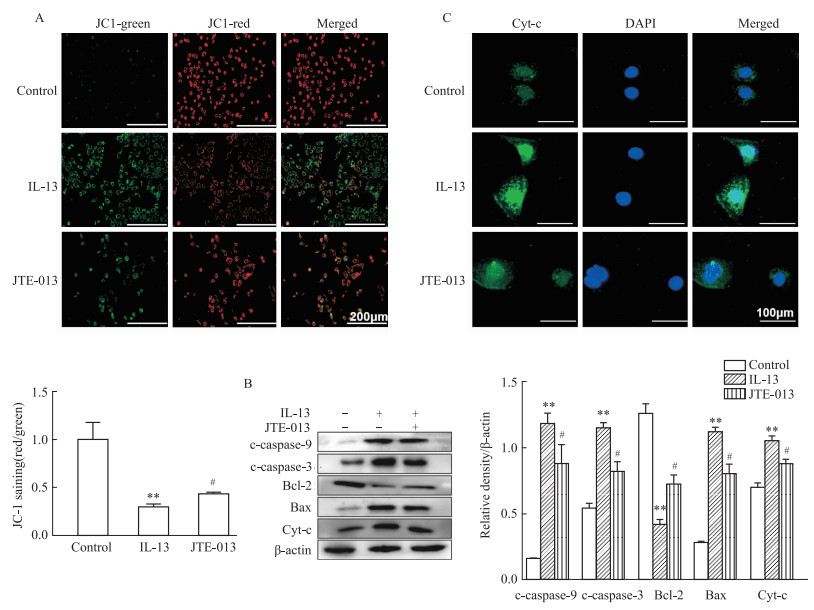
|
| Fig 5 JTE-013 restored IL-13-induced mitochondrial membrane potential loss and reduced apoptosis in nasal mucosal epithelial cells(x±s, n=3) A: MMP of HNEpCs detected by JC-1 staining. Ratio of red-green fluorescence intensity; B: Western blot for cleaved-caspase-9, Bax, cleaved-caspase-3, Bcl-2, Cyt-c; C: Cyt-c expression after stimulation with IL-13 detected by immunofluorescence. *P < 0.05, **P < 0.01 vs control group, #P < 0.05 vs IL-13 treated group. |
为了阐明ROCK1在IL-13诱导鼻黏膜上皮细胞的线粒体裂变和功能障碍的作用,用ROCK1抑制剂Y27632处理鼻黏膜上皮细胞。由于Drp1是线粒体裂变关键因子,因此我们检测ROCK1是否通过调节Drp1介导线粒体裂变和功能障碍。如Fig 6A所示,与模型组相比,Y27632能明显减弱Drp1磷酸化位点(ser616)和Fis1的表达(P < 0.05),增强Drp1另外一个磷酸化位点(ser637)表达(P < 0.05),但是总的Drp1表达没有变(P>0.05),结果表明Drp1表达上调需要ROCK1。我们进一步研究证明,Y27632对ROCK1的抑制改善了IL-13诱导的鼻黏膜上皮细胞Drp1易位和线粒体ROS, mitoSOX产生(P < 0.01, Fig 6B-D)。

|
| Fig 6 Inhibition of ROCK1 reversed IL-13-induced mitochondrial division and dysfunction in HNEpCs(x±s, n=3) A: p-DRP1 (637), p-DRP1 (616), Fis1, and Drp1 levels in HNEpCs detected by Western blot; B: ROS production in HNEpCs detected with DCFH-DA probe; C: mtROS in HNEpCs detected by mitoSOX staining; D: Co-localization of MitoTracker Red and Drp1 in HNEpCs.*P < 0.05, **P < 0.01 vs control group, #P < 0.05, ##P < 0.01 vs IL-13 treated group. |
为了检测抑制ROCK1是否逆转了IL-13诱导的线粒体膜电位丢失和鼻黏膜上皮细胞的凋亡。经Y27632治疗鼻黏膜上皮细胞,用JC-1染料检测显示,Y27632治疗可以恢复IL-13诱导的线粒体膜电位的丢失(P < 0.05,Fig 7A)。Western blot检测显示,IL-13导致cleaved-caspase-3、Bax、cleaved-caspase-9表达和活性的显著增加,经Y27632组显着降低,而Bcl-2则结果相反(P < 0.05, Fig 7B)。用免疫荧光检测Cyt-c表达,结果显示Y27632显著降低IL-13诱导Cyt-c的表达(P < 0.05, Fig 7C)。这些结果表明,Y27632通过抑制ROCK1逆转了IL-13诱导的线粒体膜电位丢失和鼻黏膜上皮细胞的凋亡。
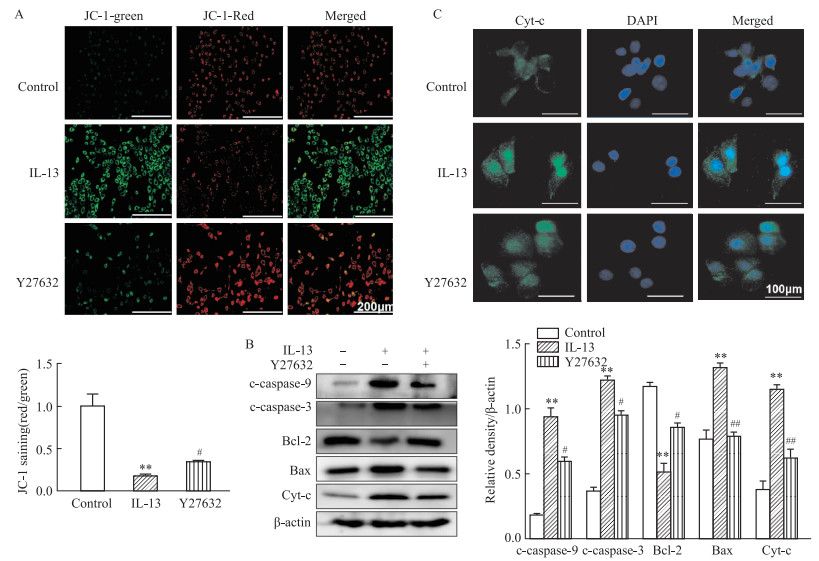
|
| Fig 7 Inhibition of ROCK1 reversed IL-13-induced mitochondrial membrane potential loss and apoptosis of nasal mucosal epithelial cells(x±s, n=3) A: MMP of HNEpCs detected by JC-1 staining.Ratio of red-green fluorescence intensity; B: Cleaved-caspase-9, Bax, cleaved-caspase-3, Bcl-2, and Cyt-c in HNEpCs detected by Western blot; C: Cyt-c expression detected by immunofluorescence. **P < 0.01 vs control group, #P < 0.05, ##P < 0.01 vs IL-13 treated group. |
AR是世界上最常见的疾病之一,全世界约有30%患者[1]。AR临床症状包括鼻塞、流涕、鼻痒和打喷嚏。此外,AR是一种复杂气道炎症疾病,涉及多种炎症介质和细胞。嗜酸性粒细胞炎症是AR主要特征之一。在炎症、凋亡等过程中,JTE-013参与调节此过程, 并证实通过抑制支气管上皮细胞炎症减轻过敏性哮喘[5]。本研究发现,JTE-013减少了OVA诱导小鼠的揉鼻和打喷嚏次数和炎症细胞浸润。目前,尚无获批的有效治疗药物用于AR的靶向治疗。JTE-013有望成为AR治疗的新药。
线粒体功能改变在细胞凋亡中起着关键的作用。在线粒体功能改变过程中,通常线粒体ROS生成增强诱导线粒体损伤和凋亡。在细胞凋亡过程中,Drp1从细胞质转移到线粒体外膜并在线粒体周围形成环状结构,导致线粒体裂变和Cyto C释放和半胱天冬酶活化,最终导致细胞凋亡[9]。研究发现,细胞凋亡与Bax、Bcl-2的异常表达和下游半胱天冬酶家族(包括半光天冬酶-3、9)级联活化有关[10]。Ser616/ser637磷酸化导致Drp1易位和线粒体分裂。Jhun等[11]推测ser-637基础磷酸化水平对于维持ser-616的基础磷酸化状态是必要的,并且ser-637磷酸化引发了ser-616磷酸化。Li等[12]已证明重楼皂苷Ⅰ使Drp1在Ser637去磷酸化激活Drp1,随后使其易位至线粒体和线粒体裂变,细胞色素C释放,导致凋亡。本研究中,经OVA诱导AR小鼠和IL-13刺激的HNEpC中,JTE-013抑制鼻组织和鼻黏膜上皮细胞ROS生成,并且抑制线粒体mtROS生成。Western blot结果显示线粒体介导的内源性凋亡途径被抑制。由此可见,JTE-013逆转了OVA和IL-13刺激物导致AR中的Bax、Bcl-2表达失衡、线粒体膜电位丢失、Cyt-c增加、还可以抑制线粒体裂变蛋白Drp1、Drp1(ser637)表达和Drp1的易位,最终导致细胞凋亡。综上,我们证实了JTE-013对AR小鼠和IL-13刺激HNEpCs诱导Drp1调控线粒体损伤和凋亡机制。
据报道,RhoA/ROCK1的激活了增加与哮喘患者的气道高反应性(AHR)相关[13]。RhoA是Rho家族小GTP酶的成员,通过活化GTP的RhoA激活其关键下游因子ROCK1[14]。另外一方面,Rho激酶抑制剂Y27632可减弱哮喘中的炎症和AHR[15]。另一份报告表明,在帕金森病中,抑制神经钙蛋白活性可以使Drp1在Ser 637处去磷酸化阻断线粒体裂变[16]。在本研究中,为了确定JTE-013是否通过RhoA/ROCK1/Drp1来缓解AR,我们发现了JTE-013通过RhoA/ ROCK1在体外和体内激活Drp1介导的异常线粒体裂变起着关键作用。我们的数据还表明ROCK1是通过Drp1将JTE-013与线粒体裂变和功能障碍联系起来的关键位点,所以我们使用了ROCK1激活抑制剂Y27632来抑制Drp1介导的异常线粒体分裂和鼻黏膜上皮细胞凋亡。上述研究结果提示,RhoA/ROCK1/Drp1信号通路是JTE-013调控的重要机制。
综上所述,我们证明了JTE-013可以缓解小鼠AR。再者,JTE-013极大的抑制Drp1磷酸化介导线粒体分裂和细胞凋亡。从而提示JTE-013与AR小鼠RhoA/ROCK1/Drp1信号通路的调节有关。基于我们的发现,我们认为JTE-013可能是AR药物治疗的潜在候选药物。
| [1] |
Wang T, Chen D, Wang P, et al. miR-375 prevents nasal mucosa cells from apoptosis and ameliorates allergic rhinitis via inhibiting JAK2/STAT3 pathway[J]. Biomed Pharmacother, 2018, 103: 621-7. doi:10.1016/j.biopha.2018.04.050 |
| [2] |
Liu Z, Li H, Su J, et al. Numb depletion promotes Drp1-mediated mitochondrial fission and exacerbates mitochondrial fragmentation and dysfunction in acute kidney injury[J]. Antioxid Redox Signal, 2019, 30(15): 1797-16. doi:10.1089/ars.2017.7432 |
| [3] |
卢睿瑾, 杜玉梅, 黄世莹, 等. 鸦胆子苦醇通过RhoA/ROCK1信号通路抑制人结直肠癌细胞HCT-116的侵袭和迁移[J]. 中国药理学通报, 2021, 37(10): 1360-5. Lu R J, Du Y M, Huang S Y, et al. Brucea javanica bitter alcohol inhibits the invasion and migration of human colorectal cancer cell line HCT-116 through RhoA/ROCK1 signaling pathway[J]. Chin Pharmacol Bull, 2021, 37(10): 1360-5. |
| [4] |
Rivera J, Proia R L, Olivera A. The alliance of sphingosine-1-phosphate and its receptors in immunity[J]. Nat Rev Immunol, 2008, 8(10): 753-63. doi:10.1038/nri2400 |
| [5] |
Liu H, Li L, Chen Z, et al. S1PR2 inhibition attenuates allergic asthma possibly by regulating autophagy[J]. Front Pharmacol, 2021, 11: 598007. doi:10.3389/fphar.2020.598007 |
| [6] |
Chen W, Xiang H, Chen R, et al. S1PR2 antagonist ameliorate high glucose-induced fission and dysfunction of mitochondria in HRGECs via regulating ROCK1[J]. BMC Nephrol, 2019, 20(1): 135. doi:10.1186/s12882-019-1323-0 |
| [7] |
Zhang C, Huang J, An W. Hepatic stimulator substance resists hepatic ischemia/reperfusion injury by regulating Drp1 translocation and activation[J]. Hepatology, 2017, 66(6): 1989-2001. doi:10.1002/hep.29326 |
| [8] |
Diwanji N, Bergmann A. An unexpected friend-ROS in apoptosis-induced compensatory proliferation: implications for regeneration and cancer[J]. Semin Cell Dev Biol, 2018, 80: 74-82. doi:10.1016/j.semcdb.2017.07.004 |
| [9] |
Hu J, Zhang Y, Jiang X, et al. ROS-mediated activation and mitochondrial translocation of CaMKII contributes to Drp1-dependent mitochondrial fission and apoptosis in triple-negative breast cancer cells by isorhamnetin and chloroquine[J]. J Exp Clin Cancer Res, 2019, 38(1): 225. doi:10.1186/s13046-019-1201-4 |
| [10] |
Abate M, Festa A, Falco M, et al. Mitochondria as playmakers of apoptosis, autophagy and senescence[J]. Semin Cell Dev Biol, 2020, 98: 139-53. doi:10.1016/j.semcdb.2019.05.022 |
| [11] |
Jhun B S, O-Uchi J, Adaniya S M, et al. Protein kinase D activation induces mitochondrial fragmentation and dysfunction in cardiomyocytes[J]. J Physiol, 2018, 596(5): 827-55. doi:10.1113/JP275418 |
| [12] |
Li G B, Fu R Q, Shen H M, et al. Polyphyllin Ⅰ induces mitophagic and apoptotic cell death in human breast cancer cells by increasing mitochondrial PINK1 levels[J]. Oncotarget, 2017, 8(6): 10359-74. doi:10.18632/oncotarget.14413 |
| [13] |
Xu C, Wu X, Lu M, et al. Protein tyrosine phosphatase 11 acts through RhoA/ROCK to regulate eosinophil accumulation in the allergic airway[J]. FASEB J, 2019, 33(11): 11706-20. doi:10.1096/fj.201900698R |
| [14] |
Chiba Y, Uchida T, Sakai H, et al. Acetylcholine-induced translocation of RhoA in freshly isolated single smooth muscle cells of rat bronchi[J]. J Pharmacol Sci, 2004, 95(4): 479-82. doi:10.1254/jphs.SC0040031 |
| [15] |
Wang W, Wang Y, Long J, et al. Mitochondrial fission triggered by hyperglycemia is mediated by ROCK1 activation in podocytes and endothelial cells[J]. Cell Metab, 2012, 15(2): 186-200. doi:10.1016/j.cmet.2012.01.009 |
| [16] |
Buhlman L, Damiano M, Bertolin G, et al. Functional interplay between Parkin and Drp1 in mitochondrial fission and clearance[J]. Biochim Biophys Acta, 2014, 1843(9): 2012-26. doi:10.1016/j.bbamcr.2014.05.012 |