

2. 郑州大学第三附属医院中医科,河南 郑州 450052;
3. 河南中医药大学第一附属医院脑病科,河南 郑州 450099
2. Dept of Traditional Chinese Medicine, the Third Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China;
3. Dept of Encephalopachy, the First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450099, China
脑卒中作为全球第二大死亡原因,每年影响近1 200万人,其中60%~80%为缺血性脑卒中[1]。缺血性脑卒中的损伤结果在很大程度上取决于受影响大脑区域中与缺血相关的神经元死亡的数量。脑组织的缺血和再灌注会引发生物能量衰竭、细胞离子稳态丧失、兴奋性毒性、线粒体功能受损、活性氧(rective oxygen species,ROS)的产生和神经元细胞中半胱天冬酶的激活等多种致病途径,这些途径都被认为是缺血性中风神经元死亡的核心机制。在缺血期间,由于不同区域的血液供应不同,脑组织受到的影响也不同,因此缺血性损伤区域涉及缺血核心和半暗带区。了解不同机制的作用原理,可以更好地挽救缺血半暗带神经元,并改善机体的功能结果。本文主要针对缺血脑卒中后神经元死亡的几种主要机制及其潜在治疗靶点进行阐述,为作用机制研究的进一步完善和药物的开发提供依据和帮助。
1 病理性影响 1.1 凋亡细胞凋亡是程序性细胞死亡的一种形式,神经元细胞凋亡的发生可以在缺血性损伤的缺氧应激下和再灌注损伤ROS产生过程中被激活。凋亡机制分为两大途径:外源性途径和内源性途径。
内源性途径也称为线粒体途径,当缺血性卒中发生后,能量供应受到限制,神经元细胞的葡萄糖代谢方式从有氧氧化转变为无氧转化,因此1分子葡萄糖所产生的ATP由38个减少至2个。这种改变引起细胞膜上离子泵功能紊乱,使神经元去极化,激活电压依赖性钙离子通道,并引起以谷氨酸盐为主的兴奋性神经递质的大量释放[2]。由于能量耗尽和由此导致的谷氨酸转运蛋白1 (glutamate transporter1,GLT-1)的功能破坏,加剧谷氨酸盐在细胞外的积累,进一步激活N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)和α-氨基-3-羟基-5-甲基-4-异唑受体(α-amino-3-hydroxy-5-methyl-4-isox-azole propionic acid receptor,AMPAR)。在静止状态下,NMDAR通道孔的内向电流通常被Mg2+阻塞。当谷氨酸从突触前位点释放时,Na+通过突触后细胞中的AMPAR流入,导致NMDAR突触后膜部分去极化,去除Mg2+对NMDAR的抑制。一旦NMDAR被激活,Na+和Ca2+会进一步流入细胞,导致神经元内的钙超载。
同时,糖酵解产生的大量乳酸堆积使缺血脑组织细胞外pH明显降低,激活酸敏感离子通道(acid-sensing ion channels,ASICs),进一步促进缺血诱导的Ca2+内流,触发以B细胞白血病/淋巴瘤蛋白2(B cell leukemia/lymphoma 2, Bcl-2)为底物的钙蛋白酶(calpain)激活。钙蛋白酶将与Bcl-2相互作用的结构域(Bcl-2 interacting domain,BID)切割成其截短的活性形式tBID,tBID与线粒体膜上Bax相互作用形成二聚体,促进线粒体外膜透化(mitochondrial outer membrane permeability,MOMP),并释放包括细胞色素C(cytochrome C,CytC)和凋亡诱导因子(apoptosis inducing factor,AIF)在内的促凋亡因子[3]。同时,缺血/再灌注后大量累积的ROS也促进了CytC的释放[4]。CytC与凋亡蛋白酶激活因子1(apoptosis protease-activating factor1,APAF-1)、caspase-9蛋白前体和dATP相互作用,形成凋亡小体。凋亡小体可以激活caspase-9, 并诱导caspase-3等在内的一系列级联反应来促进凋亡。AIF则易位至细胞核与核酸内切酶G相互作用,启动大规模DNA断裂和细胞死亡。
在ROS等应激诱导的DNA损伤后,p53诱导具有死亡结构域蛋白(p53-induced protein with a death domain,PIDD)、RIP相关的具有死亡结构域的Ich-1/Ced-3同源蛋白(RIP-associated Ich-1/Ced-3 homologous protein with a death domain,RAIDD)与caspase-2前体相互作用,进一步激活caspase-2, 并切割下游半胱天冬酶以驱动凋亡。同时,核内p53上调的凋亡调节因子(p53 up-regulated modulator of apoptosis,PUMA)、NOXA和Bax转录激活,并抑制抗凋亡蛋白Bcl-2的表达[5]。此外,p53可易位到线粒体,激活线粒体途径发挥细胞凋亡的非转录效应。
外源性途径,也称为死亡受体途径,通过外部死亡信号,由配体-受体相互作用激活。Fas配体(Fas ligand, FasL)、肿瘤坏死因子相关凋亡诱导配体(TNF-α related apoptosis-inducing ligand,TRAIL)和肿瘤坏死因子样配体1A(tumor necrosis factor-like ligand 1A,TL1A)等死亡信号与受体形成复合物后,招募Fas相关死亡受体结构域(Fas-associated death domain,FADD),激活蛋白酶caspase-8切割caspase-3,最后通过诱导受损细胞中的蛋白水解导致细胞死亡。外源性凋亡可以独立发生,也可以与线粒体途径协同发生(Fig 1)。
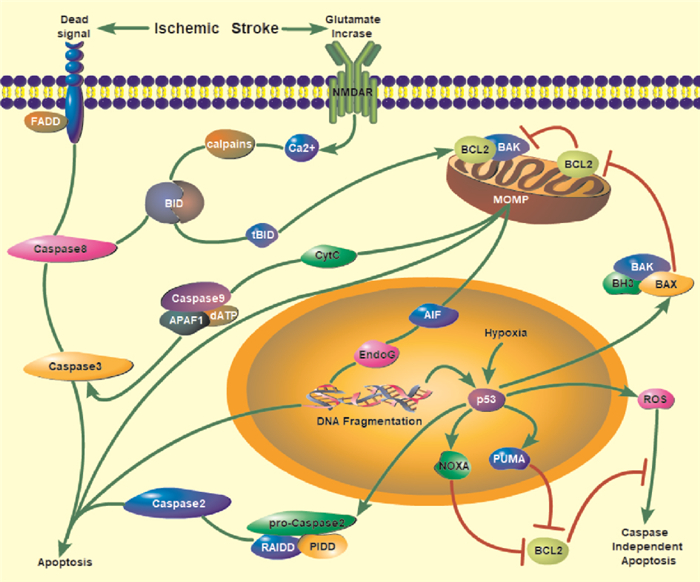
|
| Fig 1 Mechanism of neuronal apoptosis after ischemic stroke |
自噬(autophagy)是哺乳动物细胞中另一种程序性细胞死亡途径,它在溶酶体系统的作用下,对细胞质中聚集的大分子和受损细胞器的降解进行调节。自噬可以通过维持神经元稳态、清除蛋白质聚集体和受损线粒体、通过氨基酸和葡萄糖的再循环保持能量平衡,以及缓解内质网(endoplasmic reticulum,ER)应激来确保神经元细胞的存活和中枢神经系统的整体健康[6]。缺血性卒中后,氧气和营养缺乏时可以激活脑细胞自噬。关于神经元自噬的机制尚未完全了解,但目前公认的是,适度的自噬可以保护机体,而过度的自噬反而会造成一定的危害。自噬过程通常由诱导自噬泡的形成、自噬体形成、自噬体-溶酶体融合、降解和回收4个连续的步骤组成。
营养丰富时,生长因子、氨基酸和氧气等信号因子可以激活磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)-(mTOR complex 1, mTORC1),Akt通路,解除结节硬化症蛋白(tuberous sclerosis complex,TSC)TSC1-TSC2复合物对大脑富集Ras同源蛋白(Ras homolog enriched in brain,Rheb)的抑制,激活mTOR复合物1(mTOR complex 1, mTORC1)。mTORC1是调节细胞生长最重要的信号节点之一。
缺血性脑卒中发生后,神经元能量供应不足,导致AMP/ATP比例增加和ER应激激活AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)。AMPK通路的上调可以通过磷酸化Unc-51样激酶(Unc-51-like kinase,ULK)的丝氨酸(serine,Ser)317和Ser777位点,启动自噬,或通过抑制mTORC1的活性,间接激活ULK。而ULK1-Atg13-视网膜母细胞瘤卷曲螺旋蛋白1(retinoblastoma coiled coil protein1,RB1CC1)复合物是诱导自噬起始阶段所必需的复合物。
哺乳动物中,ULK1-Atg13-RB1CC1复合物的结合非常稳定,并且无论营养状况如何均会形成。在营养丰富的条件下,mTORC1与其结合使ULK1/2和Atg13磷酸化,导致复合物失活。然而,缺乏营养时,mTORC1会从诱导复合物中解离,并使其去磷酸化, 诱导自噬膜的形成。激活的ULK1复合物进一步激活III类PI3K复合物(beclin1-VPS34-VPS15), 启动吞噬细胞的成核。Atg12-Atg5-Atg16复合物和Atg8/LC3这两个泛素化结合系统参与囊泡的延伸。细胞质中游离的LC3-Ⅰ与磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)结合形成LC3-Ⅱ。LC3-Ⅱ可以作为特异性标记定位于吞噬细胞膜,诱导自噬体的形成。自噬在系统中的存在程度主要取决于LC3-Ⅱ/Ⅰ比率[7]。
在再灌注阶段,ROS大量产生,mTOR通路受到ROS信号的抑制,从而促进自噬体的启动和成核。同时激活HIF-1α,与HIF-1β结合,并通过Bcl-2 19-ku相互作用蛋白3(Bcl-2 19-ku interacting protein 3, BNIP3)和p53引发DNA损伤,诱导自噬[8]。此外,本课题组研究发现,脑缺血/再灌注损伤后,可以通过PINK1/Parkin途径激活线粒体自噬[9](Fig 2)。
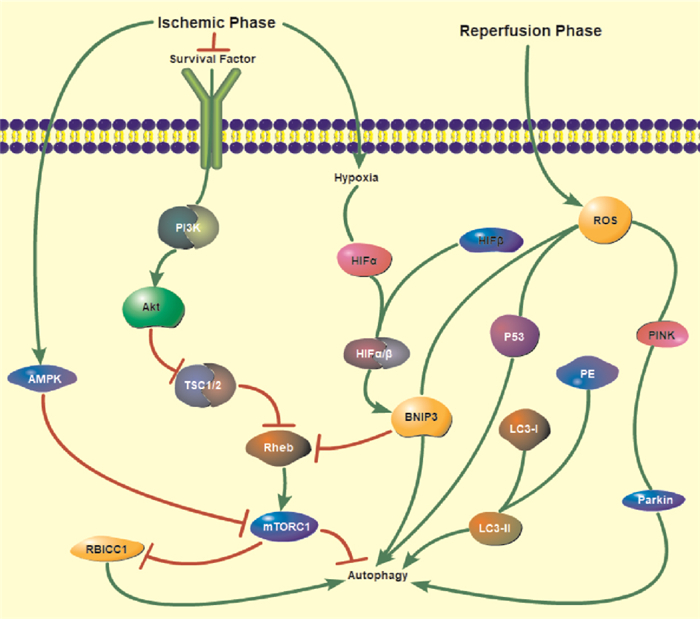
|
| Fig 2 Mechanism of neuronal autophagy after ischemic stroke |
坏死是缺血引起的一种重要的调节性细胞死亡形式。当脑缺血发生时,小胶质细胞被激活,并在大脑中任何其他细胞做出反应之前,迁移到缺血区。小胶质细胞的激活释放TNF-α、TRAIL和FasL等死亡信号,与它们所对应的细胞膜上受体结合,触发受体相互作用蛋白激酶1(receptor interacting protein kinase1, RIPK1)和其他蛋白的募集,形成复合物Ⅰ[10]。除了RIPK1,另一个包含死亡结构域(death domain,DD)的接头蛋白肿瘤坏死因子受体1相关死亡域蛋白(tumor necrosis factor receptor 1 associated death domain protein,TRADD)与肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)结合,并募集肿瘤坏死因子受体相关因子(tumor necrosis factor receptor associated factor,TRAF)2/5和E3泛素连接酶细胞凋亡抑制因子1/2(cellular inhibitor of apoptosis 1/2,cIAP1/2)来促进RIPK1泛素化,使复合物Ⅰ更加稳定[11]。
死亡信号因子可以通过各自同源的死亡结构域蛋白激活caspase-8,进一步触发细胞凋亡。然而,在某些条件下,抑制caspase-8或DD反而会增加对这些细胞因子的敏感性,导致细胞坏死。缺血时的能量剥夺引起ATP减少,当ATP不足以激活caspase-8,使其对圆柱瘤基因(cylindromatosis,CYLD)的募集及分解减少,从而引发RIPK1的去泛素化,并使RIPK1从复合物Ⅰ中释放出来。激活的RIPK1磷酸化后, 与RIPK3通过内在的RIPK同型基序相互作用,RIPK3介导并驱动混合谱系激酶结构域样蛋白(mixed lineage kinase domain-like protein,MLKL)的磷酸化和寡聚化,使其易位到质膜, 触发细胞膜的透化和细胞裂解(Fig 3)。MLKL是坏死性凋亡的主要参与者,也是迄今为止发现的最下游的执行者。
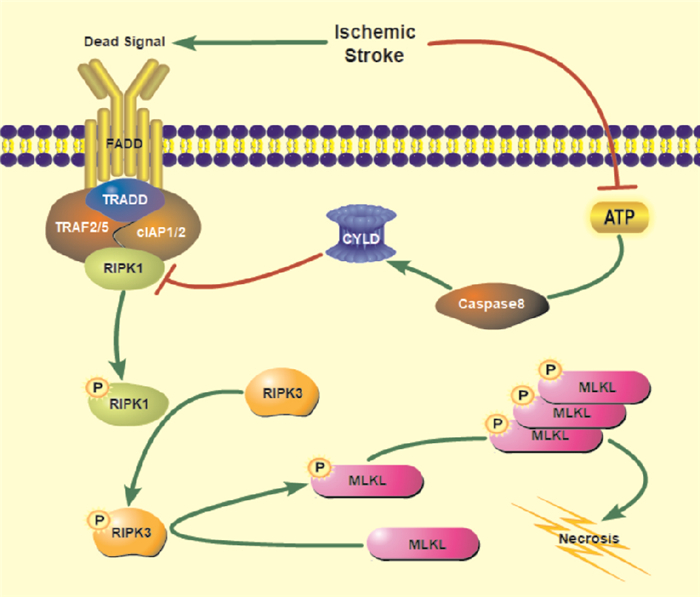
|
| Fig 3 Mechanism of neuronal necrosis after ischemic stroke |
铁死亡是一种铁依赖形式的调节性细胞死亡。缺血性卒中后,急性神经元损伤与脑铁稳态紊乱密切相关。近年来,人们发现细胞内Fe2+可以在12/15-脂氧合酶(12/15-lipoxygenase,12/15-LOX)的催化作用下,通过芬顿反应将脂质过氧化为脂质ROS。而脂质ROS的产生可能是铁死亡的直接原因。
缺血性脑卒中后,铁外流减少、血脑屏障受损以及pH下降使铁从转铁蛋白中释放出来,被神经元细胞大量摄取,引起胞内活性铁的累积。铁转运蛋白是细胞膜上的铁外排泵。转铁蛋白受体1(transferrin receptor 1,TfR1)与转铁蛋白(transferrin,Tf)结合后,将神经元细胞外的Fe3+摄入细胞内,并由铁还原酶前列腺六跨膜上皮抗原3(six-transmembrane epithelial antigen of prostate 3,STEAP3)还原成Fe2+,由二价金属转运蛋白1(divalent metal transporter 1,DMT1)转化为不稳定的铁库。铁稳态的维持依赖于铁转运蛋白和可以储存过量铁的铁蛋白。
同时,谷氨酸盐激活NMDAR、AMPK和激酶受体,使Ca2+大量流入,激活Ca2+依赖的胞质磷脂酶A2α(cytoplasmic phospholipase A2α,cPLA2α),将以花生四烯酸(arachidonic acid,AA)为主的多不饱和脂肪酸从磷脂中释放出来[12]。在酰基辅酶A合成酶长链家族成员4(acyl CoA synthetase long chain family member 4,ACSL4)和溶血磷脂酰胆碱酰基转移酶3(lysophosphatidylcholine acyltransferase 3,LPCAT3)作用下,与PE结合形成PE-AA。
过氧化物酶4 (glutathione peroxidase 4,GPX4)是一种谷胱甘肽(glutathione,GSH)依赖性酶,是关键的铁死亡调节因子。正常情况下,GPX4可以将以PE-AA为主有毒的脂质氢过氧化物(lipid peroxide,L-OOH)转化为无毒的脂质醇(lipid alcohol,L-OH),同时将GSH转化为氧化型谷胱甘肽(oxidized glutathione,GSSG),进而预防铁死亡的发生。硒可以通过驱动转录因子激活蛋白2γ(transcription factor activating protein 2γ,TFAP2γ)和特异性蛋白1(specificity protein 1,Sp1), 上调GPX4的表达,导致铁抑制。然而,缺血性脑卒中发生后,在麦角素、谷氨酸盐和柳氮磺胺吡啶等诱导剂的作用下,使神经元胞膜上由轻链亚单位溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)和重链亚单位溶质载体家族3成员2(solute carrier family 3 member 2,SLC3A2)组成的胱氨酸/谷氨酸反向转运体(cystine/glutamate reverse transporter system,Xc-)受到抑制,胞内谷氨酸不能与胞外胱氨酸进行交换,胱氨酸通过反式硫酸化反应转化的半胱氨酸减少,进而引起GSH的合成减少(Fig 4)。由于GSH合成的减少,使其在胞内逐渐耗竭,导致脂质ROS的累积增加,从而造成细胞损伤,甚至死亡。
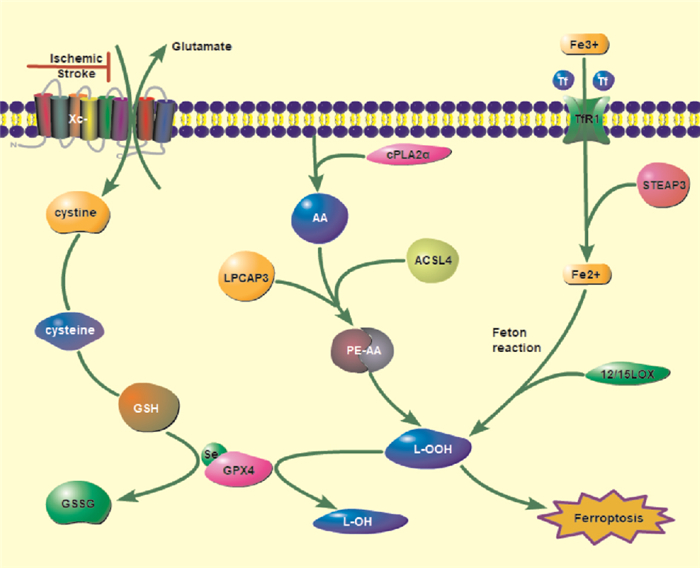
|
| Fig 4 Mechanism of neuronal iron death after ischemic stroke |
脑血流的迅速恢复可以挽救缺血半暗带的大量脑组织,从而减少卒中后的肢体运动障碍,但可供临床治疗的药物依旧有限,而且存在着时间窗狭窄、副作用明显等不足。因此,确定更有效和更安全的缺血性脑卒中治疗药物显得尤为重要。目前,对缺血性脑卒中后病理变化的认识有了很大的进步,潜在治疗靶点逐渐增多,但针对这些靶点所研制的药物能够成功转化为临床的数目不尽人意,因此需要我们对潜在的靶点进行更加深入的理解。以下介绍几种常见的缺血性脑卒中潜在治疗靶点(Tab 1)。
| Therapeutic target | Specific therapeutic drug | Research phase |
| p53 | Pifithrin-μ | Preclinical |
| Pifithin-α | Preclinical | |
| NMDAR | NA-1 | Clinical Ⅱ |
| AVLX-144 | Clinical Ⅰ | |
| ASICs | PcTx1 | Preclinical |
| Calpain | AK295 | Preclinical |
| AK275 | Preclinical | |
| CX295 | Preclinical | |
| MDL28170 | Preclinical | |
| cPLA2α | ATK | Preclinical |
p53不仅参与自噬、凋亡等多种死亡机制,而且可以参与铁死亡途径,因此该蛋白可能是多个细胞死亡途径的中心环节,成为缺血性脑卒中病理生理变化的关键因素。神经元对缺血特别敏感,可以在卒中后通过激活细胞死亡机制做出反应。p53的线粒体效应比转录途径出现更早,往往在缺血后30~60 min内发生,是对细胞生存的主要威胁。因此,线粒体促凋亡途径的激活将降低卒中后从受损大脑中拯救受影响神经元的机会。任何可以有效降低p53稳定性及阻止其迁移到线粒体中的方法,都将有效减轻缺血性脑区的神经元损伤。阻止p53线粒体易位的特异性抑制剂Pifithrin-μ通过降低p53与抗凋亡蛋白Bcl-xL和Bcl-2的亲和力, 抑制p53对线粒体的作用,而不影响p53的转录活性。Pifithin-μ显示出强大的神经保护作用,表现为对caspase-3的抑制,细胞色素C释放以及其他促凋亡蛋白NOXA和PUMA表达的减少。相反,抑制剂Pifithin-α通过抑制p53的转录效应而发挥神经保护作用[13],而其作用相对较弱,这再次说明了线粒体途径在缺血性损伤后细胞存活中的重要性。p53抑制剂已经在卒中动物模型中显示出神经保护作用,但是由于p53参与许多重要的细胞过程,使得p53抑制剂难以转化为临床实践。以抑制线粒体途径为主的p53靶点抑制剂Pifithin-μ在未来或可以完成这一转化。
2.2 NMDAR生理状态下,突触NMDAR活动具有神经保护作用,其在促进受损神经元恢复和防止半暗带神经元丢失方面具有一定作用。然而,NMDAR的过度激活导致神经元内钙超载,触发级联反应,最终引发神经元细胞坏死或凋亡。NMDAR拮抗剂可能会阻断响应缺血性挑战而触发的NMDAR激活的促死亡信号,但也会干扰半影区的一些恢复或预处理过程。NMDAR拮抗剂在大鼠的临床前研究中,可以保护神经元免于缺血性死亡。然而,其治疗时间窗短(必须在缺血性脑卒中之前或之后立即给药才能有效),而且可以引发严重的恶心、呕吐、心血管疾病等副作用,未能转化为临床应用。因此,神经保护的重点转向识别由NMDAR触发的下游细胞内信号通路。
进一步研究表明,NMDAR中被激活受体的亚细胞位置和亚型可能决定了神经元存活或死亡[14]。含有NMDA受体(NMDA receptor,GluN)2A或GluN2B的NMDAR在对缺血损伤的反应中扮演着不同的角色:含有GluN2B的NMDAR的激活会引起兴奋性毒性,导致神经元凋亡;含有GluN2A的NMDAR的激活则会保护缺血性损伤的神经元,有利于神经元存活。因此,选择性抑制GluN2B或其下游信号通路可能成为缺血性卒中的有效靶点。GluN2B与突触后密度蛋白95(postsynaptic density protein95,PSD95)的第1个盘状同源区域(discs large-zonula occludens 1, PDZ1)和PDZ2结构域结合后,可以激活神经型一氧化氮合酶(neuronal nitric oxide synthase, nNOS)并产生毒性效应。因此,破坏GluN2B-PSD95-nNOS复合物可抑制NMDAR介导的NO产生,并保护神经元免受兴奋性毒性。PSD95抑制剂Tat-NR2B9c(NA-1)在动物研究方面已被证明能够减少梗死体积、改善神经行为学评分。而且已经在一项招募颅内动脉瘤修复术后出现缺血脑卒中患者的临床试验中,证明了NA-1作用下的患者缺血性脑卒中的发生率更低[15]。因此,用靶向PSD95的药物治疗缺血性脑卒中的策略具有临床前景。目前,已有研究小组设计出针对PSD95的PDZ结构域的小分子抑制剂,如AVLX-144等,并证明与单体肽NA-1相比,AVLX-144的亲和力提高了1 000倍[16]。目前,正在进行一项针对健康志愿者以评估其安全性、耐受性和药代动力学的Ⅰ期临床研究。
2.3 ASICs缺血性脑卒中期间,pH值降低可以使ASICs从静止状态转变为开放的导电状态。阿米洛利作为ASICs的非特异性抑制剂,在短暂的大脑中动脉闭塞之前,于小鼠脑室内注射阿米洛利可明显降低缺血性损伤[17]。与阿米洛利一样,非甾体抗炎药也是ASICs的非特异性抑制剂,有研究表明,高剂量的阿司匹林可以抑制由ASICs介导的酸诱导的神经元损伤[18]。其他非甾体抗炎药如布洛芬、氟比洛芬和双氯芬酸,也对ASIC1a通道起抑制作用,可能是因为非甾体抗炎药限制神经炎症所引发的ASICs的表达增加,从而减少ASICs介导的神经元损伤。ASICs的特异性抑制剂可以通过对亚基进行特异性拮抗来实现,其中亚基ASIC1a与缺血性脑卒中的病理联系更为密切。从南美狼蛛的毒液中分离出的Psalmotoxin 1 (PcTx1) 是ASIC1a同源通道的特异性抑制剂。由于ASICs与酸中毒相关的神经元损伤的直接关系而受到越来越多的关注,因此被认为是卒中治疗干预的有希望的新靶点。
2.4 钙蛋白酶钙蛋白酶通常以静止、无活性状态存在,当细胞内有高水平的钙离子刺激时,具有蛋白水解活性。细胞内钙水平受到严格调节,而缺血性脑卒中可以诱发细胞内钙超载,从而引起钙蛋白酶的激活。因此,选择性抑制钙蛋白酶的药物可能提供一种新的、潜在的有效手段,来减少缺血性脑卒中相关的损害。天然产物钙蛋白酶抑制剂Ⅰ、Ⅱ、E64和亮肽素,均不能穿过细胞壁和血脑屏障,而钙蛋白酶抑制剂AK295、AK275和CX295作为草酰胺分子抑制剂具有足够的效力、溶解性和膜通透性,已在成人脑缺血模型中显示出神经保护作用[19]。MDL 28170作为钙蛋白酶的竞争性抑制剂,能够迅速穿透细胞和血脑屏障,具有很强的中枢神经系统渗透性,在成年大鼠局灶性脑缺血模型中注射MDL 28170后30 min,即可观察到梗死体积的减少,而且保护作用可以延迟至8 h,估计药效半衰期为2 h[20]。目前,已观察到MDL 28170在体外和体内均能有效地抑制细胞的凋亡和坏死,然而,目前钙蛋白酶抑制剂均未很好地进行临床转化。
2.5 cPLA2α磷脂酶A2 (phospholipase A2, PLA2)是膜磷脂中脂肪酸代谢的重要酶,其中IV族钙依赖性PLA2α(cPLA2α)受到最多关注,因为其几乎在所有哺乳动物细胞中广泛表达,并积极参与细胞代谢。cPLA2α能够参与早期脑缺血损伤,引起神经元兴奋性毒性以及脂质氧化和炎症反应等。Zhang等[21]使用cPLA2α抑制剂花生四烯基三氟甲基酮(arachidonyl trifluoromethyl ketone, ATK)对大脑中动脉闭塞小鼠进行治疗时发现,小鼠缺血1 h后,在再灌注的72 h内连续输注ATK可明显减少皮质和整个半球梗死体积。此研究首次证明了cPLA2α抑制剂对缺血和再灌注损伤的治疗作用,并确定了治疗时间窗。
3 总结综上所述,本文讨论了缺血性脑卒中神经元发生凋亡、坏死、自噬、铁死亡等的作用机制,然而,由于病理生理的复杂性,目前对此尚未完全了解。随着对缺血脑卒中后神经元作用机制的不断深入研究,可能有助于寻找新的神经保护靶点。缺血性脑卒中引起的神经元损伤不仅存在以上几种常见的可以直接导致神经元死亡的途径,随着神经血管单元概念的提出,人们已经发现吞噬、焦亡等脑细胞之间的相互作用机制,然而,此类作用更为复杂,所涉及的潜在治疗靶点也更为广泛。
由于严重缺血,缺血核心神经元的病理变化通常在缺血后20~30 min内发生, 且损伤是不可逆转的,而周围的缺血半暗带却存在着代谢活跃且可能挽救的细胞。如果缺血脑组织长时间没有再灌注,梗死核心可能向半暗带延伸,大脑其他区域的神经元也可能因失去与缺血神经元的接触而死亡(即继发性神经元丢失)。因此,挽救半暗带神经元对于神经保护治疗至关重要。
对机制进行探讨的主要目的在于希望能够通过机制的不断研究,找到可能有效挽救缺血半暗带区神经元损伤的药物靶点。本文对p53、NMDAR、ASICs、calpain、cPLA2α等几种主要的潜在治疗靶点进行阐述,并对针对这些靶点的部分抑制剂做了简单介绍,这些靶点的抑制剂大部分已经在动物和/或细胞实验中显示出很好的治疗效果[22-24]。然而,仅有少数能够进入临床研究。如何进一步将此类药物实现临床转化仍是一大难关。通过对以上几种靶点的抑制剂分析发现,针对潜在治疗靶点下游信号通路蛋白进行特异性结合的药物具有效果明显、副作用小的特点,由于目前人们对缺血脑卒中后神经元细胞死亡机制的认识并不完全清楚,因此需要更加深入的研究,进一步探寻潜在治疗靶点下游信号通路蛋白,或将有助于设计和开发新的治疗策略。
| [1] |
GBD 2019 Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990-2019:a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet Neurol, 2021, 20(10): 795-820. doi:10.1016/S1474-4422(21)00252-0 |
| [2] |
李春艳, 赵洪庆, 杨蕙, 等. 谷氨酸兴奋毒性及其调节剂的研究进展[J]. 中国药理学通报, 2022, 38(5): 645-9. Li C Y, Zhao H Q, Yang H, et al. Research progress on excitotoxicity of glutamate and its modulators[J]. Chin Pharmacol Bull, 2022, 38(5): 645-9. |
| [3] |
Chen X, Zhang X, Xue L, et al. Treatment with enriched environment reduces neuronal apoptosis in the periinfarct cortex after cerebral ischemia/reperfusion injury[J]. Cell Physiol Biochem, 2017, 41(4): 1445-56. doi:10.1159/000468368 |
| [4] |
Pu H, Shi Y, Zhang L, et al. Protease-independent action of tissue plasminogen activator in brain plasticity and neurological recovery after ischemic stroke[J]. Proc Natl Acad Sci U S A, 2019, 116(18): 9115-24. doi:10.1073/pnas.1821979116 |
| [5] |
Liu Y, Tavana O, Gu W. P53 modifications: exquisite decorations of the powerful guardian[J]. J Mol Cell Biol, 2019, 11(7): 564-77. doi:10.1093/jmcb/mjz060 |
| [6] |
Peker N, Gozuacik D. Autophagy as a cellular stress response mechanism in the nervous system[J]. J Mol Biol, 2020, 432(8): 2560-88. doi:10.1016/j.jmb.2020.01.017 |
| [7] |
Sekerdag E, Solaroglu I, Gursoy-Ozdemir Y. Cell death mechanisms in stroke and novel molecular and cellular treatment options[J]. Curr Neuropharmacol, 2018, 16(9): 1396-415. doi:10.2174/1570159X16666180302115544 |
| [8] |
Tuo Q Z, Zhang S T, Lei P. Mechanisms of neuronal cell death in ischemic stroke and their therapeutic implications[J]. Med Res Rev, 2022, 42(1): 259-305. doi:10.1002/med.21817 |
| [9] |
Lan R, Wu J T, Wu T, et al. Mitophagy is activated in brain damage induced by cerebral ischemia and reperfusion via the PINK1/Parkin/p62 signalling pathway[J]. Brain Res Bull, 2018, 142: 63-77. doi:10.1016/j.brainresbull.2018.06.018 |
| [10] |
Yuan J, Amin P, Ofengeim D. Necroptosis and RIPK1-mediated neuroinflammation in CNS diseases[J]. Nat Rev Neurosci, 2019, 20(1): 19-33. doi:10.1038/s41583-018-0093-1 |
| [11] |
Liu Z, Chan F K. Regulatory mechanisms of RIPK1 in cell death and inflammation[J]. Semin Cell Dev Biol, 2021, 109: 70-5. doi:10.1016/j.semcdb.2020.06.013 |
| [12] |
Lebrero P, Astudillo A M, Rubio J M, et al. , Cellular plasmalogen content does not influence arachidonic acid levels or distribution in macrophages: a role for cytosolic phospholipase A2γ in phospholipid remodeling[J]. Cells, 2019, 8(8): 799. doi:10.3390/cells8080799 |
| [13] |
Leker R R, Aharonowiz M, Greig N H, et al. The role of p53-induced apoptosis in cerebral ischemia: effects of the p53 inhibitor pifithrin α[J]. Exp Neurol, 2004, 187(2): 478-86. doi:10.1016/j.expneurol.2004.01.030 |
| [14] |
Wu Q J, Tymianski M. Targeting NMDA receptors in stroke: new hope in neuroprotection[J]. Mol Brain, 2018, 11(1): 15. doi:10.1186/s13041-018-0357-8 |
| [15] |
Hill M D, Martin R H, Mikulis D, et al. Safety and efficacy of NA-1 in patients with iatrogenic stroke after endovascular aneurysm repair (ENACT): a phase 2, randomised, double-blind, placebo-controlled trial[J]. Lancet Neurol, 2012, 11(11): 942-50. doi:10.1016/S1474-4422(12)70225-9 |
| [16] |
Bach A, Clausen B H, Møller M, et al. A high-affinity, dimeric inhibitor of PSD-95 bivalently interacts with PDZ1-2 and protects against ischemic brain damage[J]. Proc Natl Acad Sci U S A, 2012, 109(9): 3317-22. doi:10.1073/pnas.1113761109 |
| [17] |
Xiong Z G, Zhu X M, Chu X P, et al. Neuroprotection in ischemia: blocking calcium-permeable acid-sensing ion channels[J]. Cell, 2004, 118(6): 687-98. doi:10.1016/j.cell.2004.08.026 |
| [18] |
Wang W, Ye S D, Zhou K Q, et al. High doses of salicylate and aspirin are inhibitory on acid-sensing ion channels and protective against acidosis-induced neuronal injury in the rat cortical neuron[J]. J Neurosci Res, 2012, 90(1): 267-77. doi:10.1002/jnr.22742 |
| [19] |
Bartus R T, Hayward N J, Elliott P J, et al. Calpain inhibitor AK295 protects neurons from focal brain ischemia. Effects of postocclusion intra-arterial administration[J]. Stroke, 1994, 25(11): 2265-70. doi:10.1161/01.STR.25.11.2265 |
| [20] |
Markgraf C G, Velayo N L, Johnson M P, et al. Six-hour window of opportunity for calpain inhibition in focal cerebral ischemia in rats[J]. Stroke, 1998, 29(1): 152-8. doi:10.1161/01.STR.29.1.152 |
| [21] |
Zhang J, Barasch N, Li R C, et al. Inhibition of cytosolic phospholipase A(2) alpha protects against focal ischemic brain damage in mice[J]. Brain Res, 2012, 1471: 129-37. doi:10.1016/j.brainres.2012.06.031 |
| [22] |
Ballarin B, Tymianski M. Discovery and development of NA-1 for the treatment of acute ischemic stroke[J]. Acta Pharmacol Sin, 2018, 39(5): 661-8. doi:10.1038/aps.2018.5 |
| [23] |
Cristofori-Armstrong B, Saez N J, Chassagnon I R, et al. The modulation of acid-sensing ion channel 1 by PcTx1 is pH-, subtype-and species-dependent: importance of interactions at the channel subunit interface and potential for engineering selective analogues[J]. Biochem Pharmacol, 2019, 163: 381-90. doi:10.1016/j.bcp.2019.03.004 |
| [24] |
Ugalde-Triviño L, Díaz-Guerra M. PSD-95:an effective target for stroke therapy using neuroprotective peptides[J]. Int J Mol Sci, 2021, 22(22): 12585. doi:10.3390/ijms222212585 |

