

2. 西北民族大学生命科学与工程学院, 甘肃 兰州 730030;
3. 西北大学生命科学学院,陕西 西安 710069;
4. 西北民族大学生物医学研究中心生物工程与技术国家民委重点实验室;
5. 西北民族大学实验教学部,甘肃 兰州 730030
程燕(1978-),女,博士,副教授,研究方向:肿瘤及代谢疾病,通信作者,E-mail:chengyan@xbmu.edu.cn;
郑晓晖(1968-),男,博士,教授,研究方向:药物分析与药物合成,通信作者,E-mail:zhengxh@nwu.edu.cn
2. College of Life Science and Engineering, Northwest Minzu University, Lanzhou 730030, China;
3. The College of Life Sciences, Northwest University, Xi'an 710069, China;
4. Key Lab of Biotechnology and Bioengineering of State Ethnic Affairs Commission, Biomedical Research Center, Northwest Minzu University;
5. Experimental Center of Northwest Minzu University, Lanzhou 730030, China
目前,有很多关于非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)发病机制的研究,但由于其机制的复杂,至今没有明确的结论,现如今得到学术界广大认可的是“二次打击学说”[1]。其中“第一次打击”以胰岛素抵抗引起肝脏脂质沉积为主,主要是游离脂肪酸(free fatty acid,FFA) 在肝细胞中沉积而引起脂肪变性,肝细胞中异常甘油三酯(triglycerides,TG)的积累,从而导致“第二次打击”,二次打击主要是氧化应激、线粒体功能障碍、脂质过氧化、内质网应激、肝细胞大量炎症坏死,导致脂肪肝炎或肝脏组织纤维化。这些损伤与氧化应激增加有关,导致活性氧(reactive oxygen species,ROS) 的形成,进而促进肝细胞炎症和细胞死亡[2-3]。其中涉及了代谢功能障碍,故有研究人员指出将NAFLD定义为代谢功能障碍类疾病,并将其名称变更为代谢相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD)[4]。尽管NAFLD起源于多种因素,但线粒体功能障碍已被确定在该疾病的发病机制和进展中起着核心作用。
线粒体功能障碍是以线粒体膜通透性转换孔开放、线粒体DNA损伤、线粒体呼吸链障碍以及线粒体质量失衡为基本特征[5]。线粒体作为机体内的ROS产生的主要场所,产生的ROS主要负责线粒体结构、膜通透性和流动性,在NAFLD中线粒体功能障碍的一个主要机制是产生过量的ROS,大量的ROS会导致线粒体膜电位(mitochondrial membrane potential,MMP)的降低和功能受损,加强氧化应激[6],同时,ROS可导致脂质蓄积和线粒体DNA的氧化修饰,并进一步损伤线粒体膜结构。有研究报道,利用苯并芘乙醇共暴露诱导NAFLD模型,结果显示NAFLD的进展与线粒体呼吸链活性和线粒体DNA的减少有关[2]。在NAFLD小鼠中线粒体ROS的产生增强,线粒体呼吸链复合物Ⅰ的表达降低,导致线粒体功能障碍并加剧NAFLD的发展[7],同时NAFLD大鼠内肝线粒体膜通透性增加,膜电位降低,ATP生成减少,伴随氧化应激促进肝细胞凋亡。鉴于线粒体功能障碍在NAFLD发病机制的重要性,缓解或改善线粒体功能障碍对于预防和治疗NAFLD具有重要意义。
有些中医药可以通过改善线粒体结构、稳定线粒体膜电位,进而影响线粒体能量代谢起到保护线粒体功能的作用[8]。研究报道,白藜芦醇(resveratrol,RES)是芪类结构的多酚化合物,可以降低肝组织中ROS水平同时提高ATP表达量,透射电子显微镜下线粒体结构多数较完整,说明RES可以改善线粒体功能和结构[9]。中药成分复方GC方由京尼平苷和绿原酸以固定比例组成,可明显抑制棕榈酸诱导的线粒体脂毒性细胞模型内脂滴的蓄积和TG的累积,提高线粒体膜电位水平和保护肝细胞线粒体膜通透性,促进ATP合成,有效调节线粒体稳态治疗NAFLD[10]。因此,针对如何通过缓解氧化应激并调节能量代谢,改善线粒体功能治疗NAFLD的药物亟需明确。
丹参素异丙酯[isopropyl3-(3,4-dihydroxyphenyl)-2-hydroxypropanoate,IDHP]是丹参素的衍生物,通过对中草药丹参素提纯优化所获得,其药物结构稳定且具有药代动力学特征[11]。研究发现,IDHP可以延缓小鼠肾脏衰老,其机制可能与其抗氧化有关[12];IDHP具有减少自由基或清除自由基的作用,抑制细胞内ROS的生成,具有抗氧化作用[11]。
本课题组前期研究利用游离脂肪酸诱导细胞脂肪化,采用Nile Red染色和TG、TC含量检测,判断细胞脂肪蓄积程度;之后基于IDHP的抗氧化功能,加入不同浓度的IDHP干预,通过检测ROS水平、GSH的活性、ATP的含量和线粒体膜电位的变化,来综合评价IDHP对脂肪化细胞的治疗效果,为其通过改善线粒体功能治疗NAFLD提供一定的研究基础。
1 材料与方法 1.1 材料和仪器WRL68、Huh6、HepG2和Huh7细胞购自上海富衡生物科技有限公司;IDHP由西北大学郑晓晖教授赠予,MEM、DMEM、RPMI 1640培养基和胰蛋白酶-EDTA(0.25%)及PBS购自美国HyClone公司; 胎牛血清FBS购自澳洲Noverse公司; 棕榈酸(palmitic acid,PA)、油酸(oleic acid,OA)、牛血清白蛋白(BSA)和Nile Red检测试剂盒购自美国Sigma公司; TG、TC测定试剂盒购自南京建成生物公司; 还原型谷胱甘肽(glutathione,GSH)含量检测试剂盒、线粒体膜电位检测试剂盒(JC-10)和BCA蛋白浓度检测试剂盒购自北京索莱宝科技有限公司; CCK-8试剂盒、青霉素链霉素混合物和ROS检测试剂盒购自大连美仑生物技术有限公司,增强型ATP含量测试盒购自上海碧云天生物技术有限公司;二氧化碳培养箱(Thermofisher,BB150);倒置显微镜(Olympus,CKX53);流式细胞仪(Amnis,Flow Sight);双萤光素酶检测仪(Promega,GloMax Explorer)。
1.2 实验方法 1.2.1 细胞培养人肝细胞WRL68使用MEM培养液,人肝癌细胞Huh7和人肝母细胞瘤细胞Huh6使用DMEN培养液,人肝癌细胞HepG2使用RPMI-1640培养液,培养液均含有10% 胎牛血清(FBS)和1% 青霉素、链霉素混合物。细胞放入37 ℃、5% CO2条件的培养箱,倒置显微镜下每日观察细胞形态,每隔2 d更换培养液。
1.2.2 CCK-8法检测PAOA和IDHP对细胞活力的影响各细胞以5 000个每孔的密度接种至96孔板培养24 h,分别加入0、200、400、600、800和1 000 μmol·L-1的PAOA (PA、OA以摩尔比1 ∶ 2配制)或0、10、50、100、150、200、250和300 μmol·L-1的IDHP(由PBS配制),每组设置6个复孔,培养24 h后用无血清培养基清洗2次,每孔加入10 μL的CCK8工作液,培养箱内孵育1 h,设定酶标仪于450 nm处测定各孔的吸光度(A)值。
1.2.3 细胞处理及分组各细胞以2×105/孔的密度接种于6孔板中,孵育24 h后,将其分为正常组(Control)和诱导组,诱导组加入600 μmol·L-1的PAOA诱导细胞脂肪化24 h;之后弃去培养液,更换为含有不同浓度的IDHP(10、50和100 μmol·L-1)培养液,再经孵育24 h后收集细胞,每组均设3个复孔,以经PAOA诱导但未加入IDHP为对照组(IDHP-0)。后续细胞处理均是经过PAOA脂肪化诱导后,再加入药物IDHP进行干预。
1.2.4 细胞内脂滴蓄积检测—Nile RedNile Red染料常用于检测细胞内脂滴,利用流式细胞仪检测Nile Red荧光信号,可有效检测细胞内脂滴蓄积情况。收集处理好细胞后,避光加入Nile Red工作液,室温染色5 min后,离心3 min(800 r·min-1)弃去染色液,加入PBS洗涤细胞,离心收集细胞,最后加入200 μL PBS重悬细胞,采用流式细胞仪,于Ex/Em=530 nm/635 nm下检测。
1.2.5 细胞内TG、TC含量检测采用比色法测定TG、TC含量,收集处理好的细胞,加入2%的Triton X-100置于冰上裂解40 min,每组3孔,随后对照相关试剂盒说明书分别加入其工作液,通过各自OD值计算TG、TC含量。
1.2.6 细胞内ROS水平检测收集经处理的细胞,利用荧光探针DCFH-DA进行活性氧检测,37 ℃避光孵育30 min后,离心弃去染色液加入PBS洗涤细胞,经离心收集细胞加入200 μL PBS重悬细胞,于Ex/Em=488 nm/525 nm下使用流式细胞仪检测。
1.2.7 细胞内GSH活性检测收集经处理的细胞,使用PBS清洗细胞2次,加入1 mL试剂一重悬细胞,反复冻融细胞2~3次,离心10 min(8 000 r·min-1), 收集上清为待测样本,依次加入20 μL样本,140 μL试剂二,40 μL试剂三,混匀后静置2 min检测412 nm处OD值。
1.2.8 细胞内ATP水平检测细胞处理后,于6孔板中加入200 μL ATP裂解液约1 min,离心5 min(12 000 r·min-1,4 ℃),96孔白板内提前加入40 μL ATP检测工作液试剂(ATP检测试剂用ATP检测试剂稀释液稀释,1 ∶ 4),取30 μL上清加至96孔白板内,用化学发光仪测定RLU值。
1.2.9 JC-10染色检测线粒体膜电位细胞接种于96孔黑板中(底部透明),处理细胞后,避光加入JC-10染色液,于37 ℃、5% CO2培养箱内孵育30 min,分别检测JC-10聚合物(Ex/Em=520 nm/590 nm)和JC-10单体(Ex/Em=490 nm/530 nm)的荧光值,以二者的比值(JC-10聚合物/单体)来衡量线粒体膜电位的变化。
1.3 统计分析使用GraphPad Prism 9.3.1软件进行数据处理及绘图,计量资料采用x±s表示,组间差异比较采用单因素方差分析。
2 结果 2.1 PAOA及IDHP浓度筛选为筛选最适的PAOA浓度诱导细胞脂肪化,用CCK-8法检测不同浓度的PAOA对细胞活力的影响。如Fig 1A所示,细胞活力在低于600 μmol·L-1浓度时无明显下降,因此,选用600 μmol·L-1的PAOA作为诱导细胞脂肪化的最适浓度。
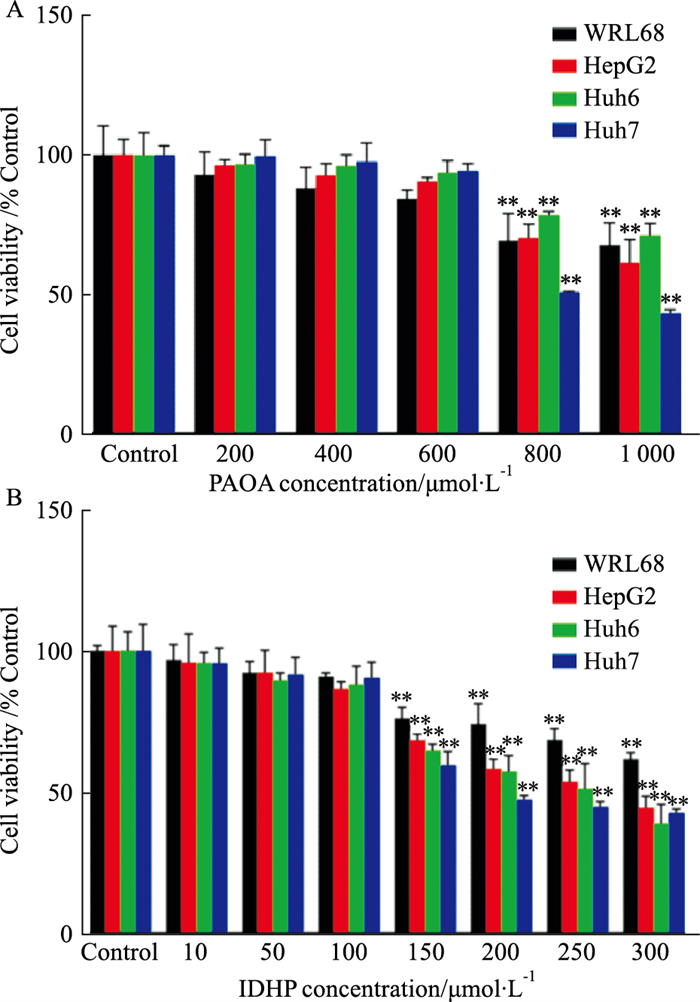
|
| Fig 1 Effect of PAOA and IDHP on cell viability (x±s, n=6) A: The cell viability was detected by CCK-8 assay after 24 hours of induction with different concentrations of PAOA; B: The cell viability was detected by CCK-8 assay after 24 hours of intervention with different concentrations of IDHP. **P < 0.01 vs Control group. |
另外,我们检测了不同浓度的IDHP干预下的细胞存活率,实验结果显示,IDHP在100 μmol·L-1及以下浓度时细胞活力无明显降低(Fig 1B)。
2.2 细胞脂肪化诱导及IDHP的改善作用细胞脂肪化常用脂滴蓄积情况来进行评价,评价指标包括Nile red染色以及细胞内TG、TC含量检测。结果如Fig 2所示,经PAOA诱导细胞24 h后,与正常组相比Nile Red荧光信号明显增强,表明4种细胞内均有大量脂滴蓄积,且Nile Red荧光统计结果与其一致(Fig 2B),由此可见600 μmol·L-1 PAOA可以成功诱导细胞内脂滴蓄积。

|
| Fig 2 IDHP significantly improved intracellular fat accumulation in hepatocytes (x±s, n=3) A: Nile Red fluorescence imaging of cells taken by multi-dimensional panoramic flow cytometry; B: Statistical analysis of Nile Red fluorescence signal detected by flow cytometry. *P < 0.05, **P < 0.01 vs IDHP-0 group. |
之后加入不同浓度(10、50、100 μmol·L-1)的IDHP干预细胞24h后,随着IDHP浓度的增加,Nile Red荧光信号明显减弱,说明IDHP可以有效抑制PAOA诱导的细胞内脂滴蓄积,改善细胞脂肪化。
2.3 IDHP对细胞内TG、TC累计具有抑制作用细胞脂肪化诱导后,对其TG和TC含量进行检测。与正常组相比,PAOA诱导后TG、TC的含量明显增加(Fig 3)。结合“2.2”的结果,表明浓度为600 μmol·L-1的PAOA可以成功诱导细胞脂肪化。
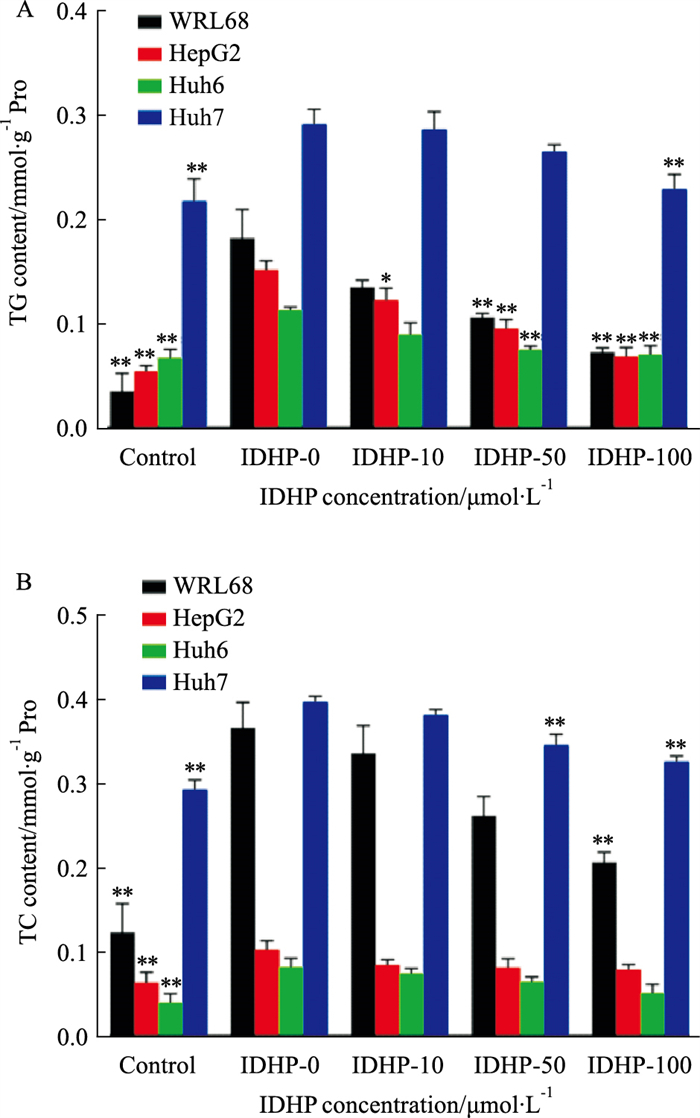
|
| Fig 3 IDHP effectively inhibited accumulation of TG and TC in steatosis cells (x±s, n=3) A: The content of TG in cells; B: The content of TC in cells. *P < 0.05, **P < 0.01 vs IDHP-0 group. |
经IDHP处理后,TG的含量明显降低,浓度达到100 μmol·L-1时效果最佳(Fig 3A);IDHP的干预明显抑制了WRL68和Huh7细胞内的TC累积,对HepG2和Huh6细胞内TC的累积并无明显效果,但仍有下降的趋势(Fig 3B),说明IDHP对TG、TC的累积具有抑制作用。
2.4 IDHP对ROS的抑制作用线粒体是产生ROS的主要场所,过量的活性氧会影响线粒体功能,并可能导致细胞损伤[13]。基于IDHP具有一定的抗氧化应激作用,通过检测ROS评价其抗氧化作用。流式结果如Fig 4A所示,与正常组相比,PAOA诱导后ROS荧光强度明显增强,表明促进了细胞内ROS的产生。而随着IDHP干预浓度的增加,细胞内ROS荧光强度明显降低,说明IDHP明显抑制了PAOA诱导的活性氧产生(Fig 4)。
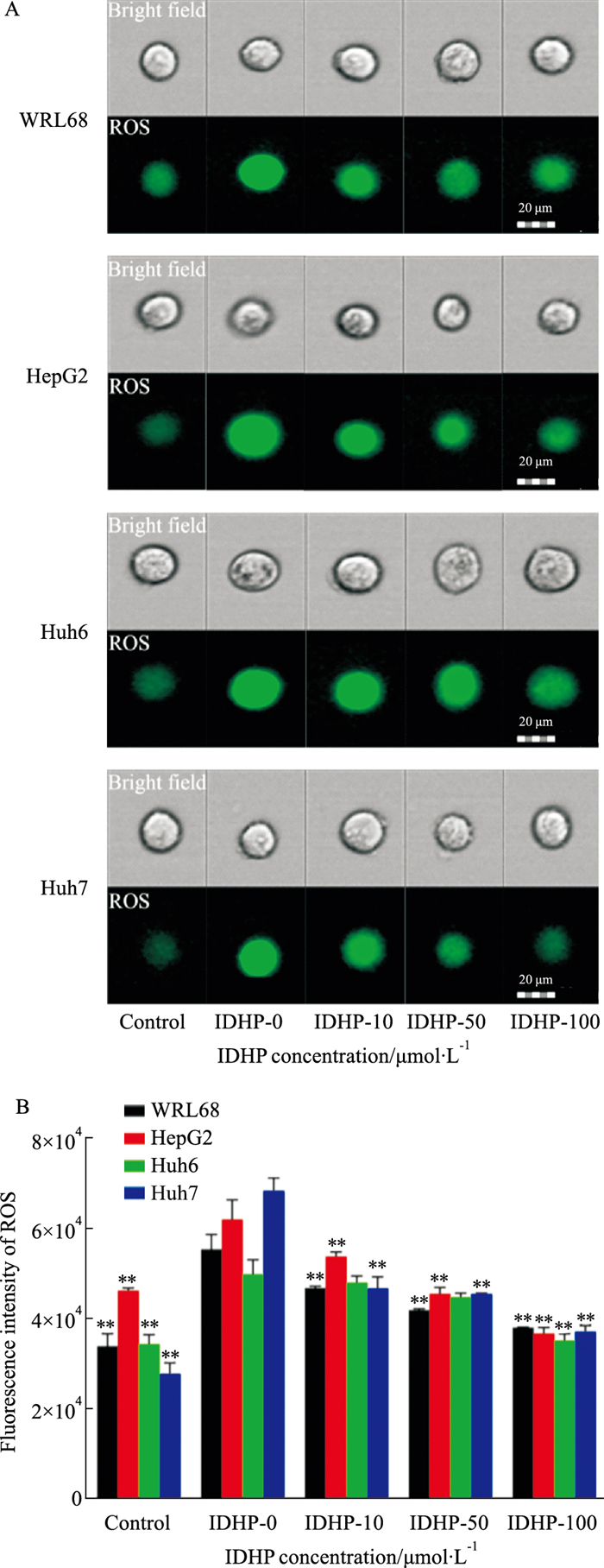
|
| Fig 4 IDHP inhibited ROS production in steatosis cells (x±s, n=3) A: ROS fluorescence imaging of cells taken by multi-dimensional panoramic flow cytometry; B: Statistical analysis of ROS fluorescence signal detected by flow cytometry. **P < 0.01 vs IDHP-0 group. |
GSH是细胞体内一种重要的调节代谢物质,可以促进脂肪代谢,具有清除氧自由基的作用,改善机体内抗氧化化应激水平,防止ROS对细胞重要组分的损害[14]。结果显示,经PAOA诱导后,GSH的活性较正常组明显下降,且ROS水平升高(Fig 4),表明细胞内氧化应激加强,并且线粒体可能受到一定的损伤。IDHP干预后GSH活性逐步升高,尤以Huh6、Huh7细胞最为明显,说明IDHP能明显降低细胞氧化应激反应(Fig 5)。
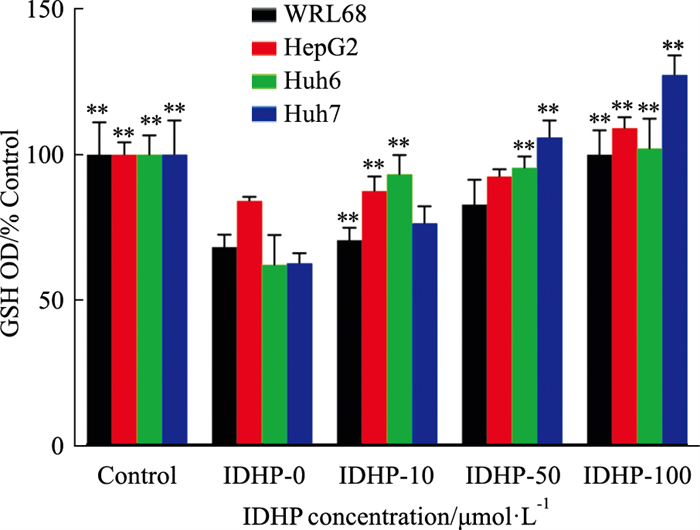
|
| Fig 5 IDHP enhanced activity of GSH in steatosis cells (x±s, n=3) Activity of GSH in cells. **P < 0.01 vs IDHP-0 group. |
线粒体是细胞供能代谢中心,ATP合成的主要场所,因此,过度的氧化应激反应会导致线粒体功能障碍。通过检测细胞内ATP水平发现,经PAOA诱导其含量相对于正常组明显降低(Fig 6A),线粒体功能受损,细胞内能量代谢紊乱;加入IDHP后,ATP含量逐渐提升,浓度为100 μmol·L-1时恢复至与正常组相似,表明线粒体功能得到了一定的改善,能量代谢恢复正常。线粒体膜电位(MMP)的稳定有利于维持线粒体功能,保障细胞的正常生理功能。通过JC-10检测各组细胞的MMP,PAOA诱导后,红绿荧光比值明显降低,表明线粒体膜电位下降,线粒体发生损伤;之后使用不同浓度的IDHP干预,红绿荧光比值明显升高,线粒体膜电位逐渐恢复正常水平(Fig 6B),说明IDHP对线粒体具有保护作用,这一结果与ATP水平测定一致。IDHP可通过抗氧化功能,抑制ROS的产生,缓解氧化应激,同时调节能量代谢,维持MMP的完整,改善线粒体功能和结构,进而抑制肝细胞脂肪变性。
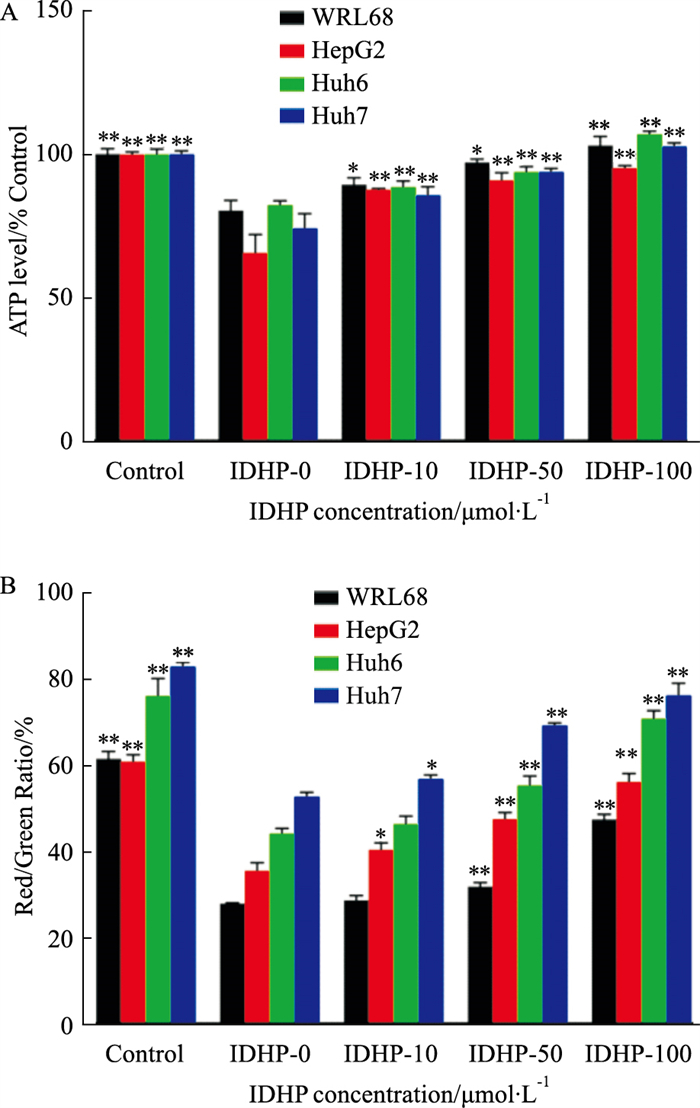
|
| Fig 6 IDHP improved mitochondrial function (x±s, n=3) A: The content of ATP in cells; B: Statistical results of mitochondrial membrane potential (red-green fluorescence ratio). *P < 0.05, **P < 0.01vs IDHP-0 group. |
脂质代谢异常是造成NAFLD发病的重要因素之一,在疾病的发展过程中,大量的脂质在肝脏细胞中发生沉积,增加线粒体负荷,线粒体功能受损致使脂代谢途径减少,进而引起脂肪的过度氧化应激反应,加剧了NAFLD的进展,同时伴随着能量代谢紊乱,造成肝脏细胞持续性损伤。
棕榈酸和油酸是NAFLD患者肝脏中最丰富的游离脂肪酸,本研究为模拟NAFLD肝脏脂肪的过度蓄积情况,采用600 μmol·L-1 PAOA(PA ∶ OA摩尔比=1 ∶ 2)诱导肝细胞脂肪化,并加入不同浓度的IDHP进行干预,用于改善细胞内的脂肪蓄积。通过测定Nile Red荧光信号及TG与TC含量,发现与正常组相比,诱导组脂滴蓄积明显,TG、TC含量明显升高,而随着IDHP干预浓度的增加,明显改善了脂肪蓄积,降低了TG、TC的含量。
前期有研究报道,IDHP具有抗氧化应激作用,能够改善线粒体能量代谢。基于IDHP可以降低脂肪化细胞TG、TC含量,为进一步明确其改善细胞脂肪化的机制,本研究侧重于关注线粒体功能及其能量代谢。通过对细胞内ROS、GSH、ATP含量及MMP的检测,结果显示,IDHP的干预,有助于抑制脂肪化细胞内ROS的生成,提高GSH的活性,保护线粒体膜电位,减轻其对线粒体功能的损伤;同时,ATP合成恢复至正常水平,证实了IDHP能够明显改善脂肪化细胞的能量代谢。
由于NAFLD发病机制的复杂性,尚未有明确治疗NAFLD的临床药物。研究报道,改善线粒体功能是一种潜在治疗NAFLD的手段,索拉非尼是一种多激酶抑制剂,可以抑制活性氧的产生,改善线粒体功能缓解脂质过氧化[15];二甲双胍可以增加ATP合成,逆转线粒体氧化应激改善NAFLD[16]。本研究发现,不管对于正常肝细胞或肝癌细胞,IDHP均可抑制细胞内活性氧的产生,增强还原型谷胱甘肽的活性,调节机体内的氧化应激反应;同时保护了线粒体膜电位的完整,改善线粒体功能,维持机体内正常的能量代谢,进一步改善了肝细胞内脂肪的过度蓄积。
综上所述,IDHP可以通过改善线粒体功能,明显抑制肝细胞内的脂肪蓄积,以期为IDHP治疗NAFLD提供一定的理论基础和研究依据。
| [1] |
Day C P, James O F. Hepatic steatosis: innocent bystander or guilty party?[J]. Hepatology, 1998, 27(6): 1463-6. doi:10.1002/hep.510270601 |
| [2] |
李晓钰, 韩浩. 非酒精性脂肪性肝病中线粒体损伤机制[J]. 卫生研究, 2021, 50(2): 346-52. Li X Y, Han H. Mechanisms of mitochondrial damage in nonalcoholic fatty liver disease[J]. J Hyg Res, 2021, 50(2): 346-52. |
| [3] |
池肇春. 代谢相关脂肪性肝病肝外并发症研究进展与现状[J]. 世界华人消化杂志, 2022, 30(1): 1-16. Chi Z C. Research status and progress of metabolic associated fatty liver disease[J]. World Chin J Dig, 2022, 30(1): 1-16. |
| [4] |
Eslam M, Sanyal A J, George J, et al. MAFLD: a consensus-driven proposed nomenclature for metabolic associated fatty liver disease[J]. Gastroenterology, 2020, 158(7): 1999-2014 e1. |
| [5] |
马琼, 石安华, 赵茜, 等. 中医药调控线粒体功能防治NAFLD的研究进展[J]. 中国中药杂志, 2022, 47(19): 5113-20. Ma Q, Shi A H, Zhao Q, et al. Research progress on prevention and treatment of NAFLD by regulating mitochondrial function withtraditional Chinese medicine[J]. Chin J Chin Mater Med, 2022, 47(19): 5113-20. |
| [6] |
Liu X, Zhang J, Ming Y, et al. The aggravation of mitochondrial dysfunction in nonalcoholic fatty liver disease accompanied with type 2 diabetes mellitus[J]. Scand J Gastroenterol, 2015, 50(9): 1152-9. |
| [7] |
Garcia-Berumen C I, Ortiz-Avila O, Vargas-Vargas M A, et al. The severity of rat liver injury by fructose and high fat depends on thedegree of respiratory dysfunction and oxidative stress induced in mitochondria[J]. Lipids Health Dis, 2019, 18(1): 78. |
| [8] |
邱林, 李美红, 夏洽思, 等. 中医药对线粒体保护机制的研究进展[J]. 湖南中医杂志, 2017, 33(6): 214-5. Qiu L, Li M H, Xia Q S, et al. Research progress on mitochondrial protection mechanism of traditional Chinese medicine[J]. Hunan J Tradit Chin Med, 2017, 33(6): 214-5. |
| [9] |
李艳. 白藜芦醇通过改善氧化应激缓解大鼠牙周炎相关肝损伤的作用机制研究[D]. 长春: 吉林大学, 2021. Li Y. Study on the mechanism of resveratrol in alleviating periodontitis-related liver injury by ameliorating oxidative stress in rats[D]. Changchun: Jilin Univ, 2021. |
| [10] |
刘林. 中药成分复方GC方通过调节线粒体稳态治疗非酒精性脂肪肝机制研究[D]. 上海: 上海中医药大学, 2017. Liu L. Study on the mechanism of traditional Chinese medicine compound GC prescription in the treatment of non-alcoholic fatty liver by regulating mitochondrial homeostasis[D]. Shanghai: Shanghai Univ Tradit Chin Med, 2017. |
| [11] |
卢金清, 梁欢, 戴艺, 等. 丹参素衍生物药理作用研究进展[J]. 中国药业, 2014, 23(11): 1-3. Lu J Q, Liang H, Dai Y, et al. Research progress in pharmacological action of danshensu derivatives[J]. Chin Pharm, 2014, 23(11): 1-3. |
| [12] |
施念, 王志红, 王世祥, 等. 丹参素异丙酯对D-半乳糖致衰老大鼠肾脏的保护作用[J]. 郑州大学学报(医学版), 2022, 57(4): 462-6. Shi N, Wang Z H, Wang S X, et al. Protective effects of isopropyl-3-(3, 4-dihydro-xyphenyl)-2-hydroxypropanoate on kidney in aging rats induced by D-galactose[J]. J Zhengzhou Univ(Med Sci), 2022, 57(4): 462-6. |
| [13] |
段治宇, 王效蕊, 梁婷婷, 等. 青藤碱对有机锡损伤肝HL02细胞的保护作用及其机制[J]. 中国药理学通报, 2022, 38(10): 1535-41. Duan Z Y, Wang X R, Liang T T, et al. The protective effects of sinomenine on organotin-injured liver HL02 cells and its mechanism[J]. Chin Pharmacol Bull, 2022, 38(10): 1535-41. |
| [14] |
邵晓妮, 黑亚南, 孙英凯, 吴美薇. 高尿酸血症认知功能障碍模型大鼠皮层和海马的代谢组学研究[J]. 中国药理学通报, 2021, 37(2): 196-202. Shao X N, Hei Y N, Sun Y K, Wu M W. Metabolomic analysis of cerebral cortex and hippocampus in rats with hyperuricemia-induced cognitive dysfunction[J]. Chin Pharmacol Bull, 2021, 37(2): 196-202. |
| [15] |
Jian C, Fu J, Cheng X, et al. Low-dose sorafenib acts as a mitochondrial uncoupler and ameliorates nonalcoholic steatohepatitis[J]. Cell Metab, 2020, 31(5): 892-908. e11. |
| [16] |
谭璐嫔. 二甲双胍对高尿酸诱导脂肪肝的作用及机制研究[D]. 广州: 南方医科大学, 2021. Tan L P. The effects of metformin on fatty liver disease induced by high uric acid and its potential mechanisms[D]. Guangzhou: Southern Med Univ, 2021. |

