


 ,
XIAN Hao,
BAO Xiu-rong,
ZHANG Han-meng,
SONG Yi-ning,
WEI Fang,
WEI Ying-mei,
WANG Ying
,
XIAN Hao,
BAO Xiu-rong,
ZHANG Han-meng,
SONG Yi-ning,
WEI Fang,
WEI Ying-mei,
WANG Ying

类风湿性关节炎(rheumatoid arthritis,RA)是一种慢性进行性自身免疫性疾病,主要病理特征表现为关节滑膜组织异常增生,长期反复的滑膜炎症最终导致关节破坏和功能障碍[1]。目前,关于RA的发病机制仍不清楚,然而,成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)作为关节滑膜的主要细胞类型,既是参与RA发生发展的靶细胞,也是关键效应细胞。在RA患者的关节滑膜中,异常活化的FLS通过分泌大量的促炎细胞因子和趋化因子引起局部和全身性炎症[2-3]。此外,在FLS中高表达的基质金属蛋白酶MMPs还与关节软骨和骨的侵蚀有关。因此,以FLS作为研究RA发病机制的靶点具有重要意义。
自噬作为一种保护细胞免受细胞内有害功能分子侵害的生理过程,在营养缺乏的条件下能够促进和维持细胞的生存能力。而凋亡是基本的程序性细胞死亡机制,因此这两个过程之间的关系影响着细胞的命运[4]。正常情况下,持续的自噬会引起细胞的凋亡,然而,有研究报道,虽然RA患者FLS的自噬水平明显高于骨关节炎患者,但凋亡水平却明显降低,同时对RA患者滑膜组织的分析结果显示,滑膜细胞的凋亡与自噬水平之间呈负相关,表明自噬参与了RA滑膜细胞的抗凋亡表型[5-6]。过度自噬和凋亡不足导致关节腔FLS的局部积累可能是其异常活化,以及导致RA早期病变的重要原因[7]。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是维持细胞能量代谢平衡、参与细胞凋亡和自噬等多种生理过程中的关键调控因子。当能量供应不足时,细胞能量状态的关键传感器AMP依赖的蛋白激酶(AMP activated protein kinase,AMPK)可以通过磷酸化激活PFK2以及PFKFB3促进糖酵解过程来增加ATP的合成。同时,AMPK活化后还能够通过抑制下游靶点mTOR来促进自噬的发生。3-溴丙酮酸(3-bromopyruvate,3-BrPA)作为丙酮酸的卤化和烷基化类似物,可以与乳酸、丙酮酸竞争阻断多种恶性肿瘤细胞的糖酵解过程,抑制ATP的产生,最终导致肿瘤细胞的凋亡[8]。同时,研究表明,在RA发生发展过程中,FLS的代谢方式会从氧化磷酸化向糖酵解方向转变,给与3-BrPA治疗后得到缓解[9]。但3-BrPA能否通过抑制AMPK/mTOR通路调控FLS凋亡/自噬失衡发挥治疗类风湿性关节炎的作用目前尚不清楚。本研究旨在观察糖酵解抑制剂3-BrPA能否调控FLS凋亡/自噬失衡,并进一步探讨其可能的作用机制。
1 材料与方法 1.1 主要试剂3-BrPA(麦克林1113-59-3);MTT(索莱宝298-93-1);DMEM培养基(Gibco C11965500BT);TNF-α(Peprotech 300-01A);mTOR(Proteintech 20657-1-AP); p-mTOR(5536)、p-AMPK(50081)、β-actin(3770)、Bcl2(3498)、Bax(2772)、caspase-3(9662)、P62(88588)、Beclin1(3495)、LC3B(3868)、AMPK(5831)均购自Cell Signaling Technology;细胞凋亡检测试剂盒(贝博生物BB-4101);mCherry-EGFP-LC3B过表达质粒(吉玛基因);JC-1试剂盒(碧云天C2006)。
1.2 主要仪器二氧化碳培养箱购自赛默飞公司,酶标仪购自BioTKe公司,Fusion FX Spectra多功能凝胶成像仪购自Vilber公司,双光子激光共聚焦显微镜购自Olympus公司,FACS Verse流式细胞仪购自BD公司。
1.3 FLS原代培养超净台内用无菌的手术剪刀将SD大鼠膝关节滑膜组织剪成适当大小后放于预冷的磷酸盐缓冲液中洗净。将组织块吸出,均匀地铺在培养瓶底部。加入1 mL含20%胎牛血清、1%双抗的DMEM培基,轻轻润湿组织块后底部朝上,置于二氧化碳培养箱中培养10 h。组织贴壁后,将瓶子翻转使其底部朝下正常培养,并且培养基每隔1~2 d更换1次。观察到滑膜组织块周边被纺锤形成纤维样滑膜细胞包围,生长到一定密度时,将组织块移到新的培养瓶中继续生长,原先的培养瓶中细胞经胰蛋白酶消化、离心和重悬后重新铺匀于瓶中继续生长,后续实验使用3~5代细胞。
1.4 MTT法检测FLS存活率对数生长期的FLS按照每孔5 000个细胞的密度接种于96孔板后放培养箱中培养4 h至细胞贴壁。按设计好的给药方案进行给药并培养24 h后,加入20 μL MTT试剂,37 ℃培养箱孵育4 h。吸弃旧培养液,并将150 μL DMSO加入各孔中,37 ℃孵育30 min,于酶标仪测量各孔在490 nm波长处的吸光度值。
1.5 划痕实验检测FLS迁移在6孔板底部画出间隔约0.5 cm的横线,作为后续划痕的参照。将FLS调整至合适的细胞密度后接种到6孔板中孵育24 h。用200 μL无菌枪头垂直于6孔板底部的标记线在细胞上划痕,PBS清洗两次,更换新鲜低血清培养基,按照设计好的给药方案进行给药。在给药后0 h和24 h采集图像,划痕图片的观察和划痕面积的定量在ImageJ软件中完成。
1.6 Transwell小室检测FLS侵袭Transwell上室加入50 μL基质胶,放至培养箱直至凝固。上室加入100 μL无血清细胞悬液(1.5×104个细胞),并按照设计好的方案进行给药。下室加入500 μL含20%血清的培养基。24 h后,将小室用4%多聚甲醛固定20 min,结晶紫染色15 min,棉签轻轻擦去上室内表面未侵袭细胞。侵袭至微孔膜下表面的细胞使用显微镜在200倍镜下进行观察,定量分析则任取5个视野来计数。
1.7 Transwell小室检测FLS迁移Transwell上室无需铺基质胶,其余操作与“1.6”中方法相同。
1.8 Western blot接种FLS于直径为100 mm的培养皿中,待细胞达到70%~80%融合度时,按设计好的给药方案进行给药,24 h后收集细胞提取蛋白质。使用BCA法测定蛋白浓度,加入适量上样缓冲液并混合均匀,于95 ℃金属浴中加热5 min,可放置-20 ℃冰箱短期保存。SDS-PAGE电泳时,各组取50 μg样品进行上样。使用PVDF膜经湿法转膜后,于室温条件下在5%新鲜脱脂牛奶中封闭4 h。接着在相应一抗中4 ℃摇床孵育过夜,次日转移至相应二抗中,室温下摇床孵育2 h,经多功能化学发光凝胶成像仪显影曝光后使用ImageJ软件对条带的灰度值进行分析定量。
1.9 流式细胞术检测FLS凋亡于6孔板中培养FLS,待细胞达到70%~80%融合度时,按设计好的给药方案进行给药,24 h后收集细胞。离心8 min(转速为1 500 r·min-1)。使用PBS(预冷)清洗细胞两次后弃上清并加入400 μL Binding Buffer进行重悬。细胞悬液中加入1 μL FITC并混匀,避光条件下在冰上孵育15 min。加入2 μL PI,混匀后继续冰上避光孵育5 min,最后,使用300目纱网过滤至流式管中,1 h内用流式细胞仪检测。
1.10 mCherry-EGFP-LC3B过表达质粒检测FLS自噬流胰蛋白酶消化并收集FLS,以每皿6×104个细胞的密度接种于共聚焦小皿。当生长到约50%融合度时,根据说明书进行转染。培养6 h后,将转染液更换为完全培养基继续孵育48 h。按设计好的给药方案进行处理。使用激光共聚焦显微镜600倍镜下观察并采集图片。正常情况下,自噬小体被标记为红色和绿色荧光叠加在一起的黄色斑点,当红色荧光增强而绿色荧光淬灭时,代表自噬体到自噬溶酶体阶段流通得越顺畅,即此时自噬更强。
1.11 JC-1线粒体膜电位试剂盒检测FLS凋亡收集细胞,以每孔2×105个细胞的密度接种于6孔板,贴壁后按设定好的给药方案处理24 h。原培养液吸除后加入PBS进行洗涤,将1 mL无血清培养基及等量的JC-1染色液混匀后重新打入孔板并孵育20 min。结束后,使用JC-1缓冲液洗涤两次。加入无血清培养基,采集荧光图像。
1.12 统计学分析采用GraphPad Prism 8.3软件进行统计学分析并绘制统计图,以x±s表示各组计量资料,多组间比较采用单因素方差分析。
2 结果 2.1 3-BrPA调控TNF-α刺激下FLS的增殖活性为了评估TNF-α刺激FLS模拟炎症状态的适宜浓度,MTT实验中将TNF-α浓度设置为TNF-α15:15 μg·L-1; TNF-α25:25 μg·L-1; TNF-α35:35 μg·L-1。Fig 1结果显示,TNF-α刺激24 h后,与control组相比,FLS存活率均明显升高,其中25和35 μg·L-1组存活率升高更为明显(P < 0.01),并且这两组间未见明显差异(P > 0.05)。故后续实验选用25 μg·L-1的TNF-α刺激FLS增殖活化。
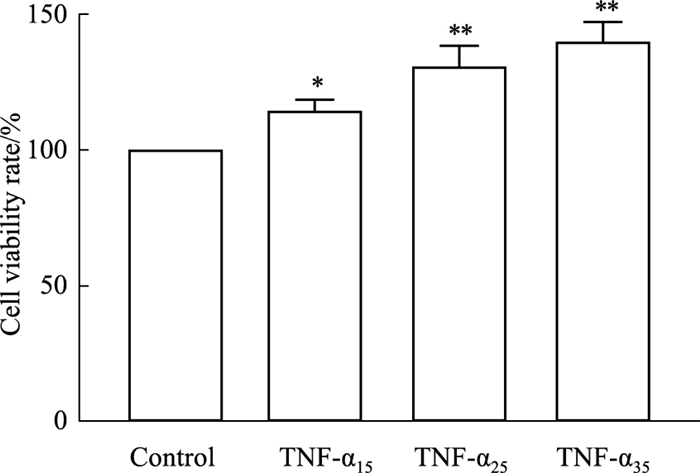
|
| Fig 1 Effects of TNF-α on survival rates of FLS (x±s, n=3) *P < 0.05, **P < 0.01 vs control group. |
同样,为了研究3-BrPA对FLS存活率的影响,通过MTT实验检测在TNF-α(25 μg·L-1)刺激下不同浓度3-BrPA(3-BrPA5:5 μmol·L-1; 3-BrPA10:10 μmol·L-1; 3-BrPA15:15 μmol·L-1; 3-BrPA20:20 μmol·L-1; 3-BrPA25:25 μmol·L-1; )作用24 h后对FLS的作用。Fig 2结果显示,与TNF-α组相比,15 μmol·L-1的3-BrPA对FLS增殖的抑制作用更为明显(P < 0.01),并且与control组相比无明显差异(P > 0.05)。因此,将15 μmol·L-1作为3-BrPA在后续实验中的给药浓度。
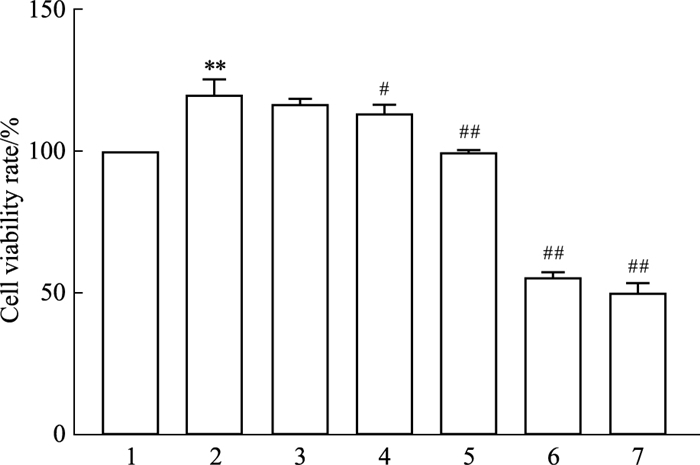
|
| Fig 2 Effects of 3-BrPA on survival rates of FLS stimulated by TNF-α(x±s, n=3) 1:control; 2:TNF-α; 3:TNF-α+3-BrPA5; 4:TNF-α+3-BrPA10; 5:TNF-α+3-BrPA15; 6:TNF-α+3-BrPA20; 7:TNF-α+3-BrPA25; **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs TNF-α group. |
通过细胞划痕实验和Transwell小室评估FLS迁移能力。Fig 3A-D结果显示,TNF-α刺激后FLS迁移能力明显增强,而3-BrPA明显抑制TNF-α刺激下FLS的迁移。同样,Fig 3E,F中,Transwell小室检测FLS的侵袭能力发现,与TNF-α组相比,3-BrPA组中FLS的侵袭能力受到明显抑制(P < 0.05)。
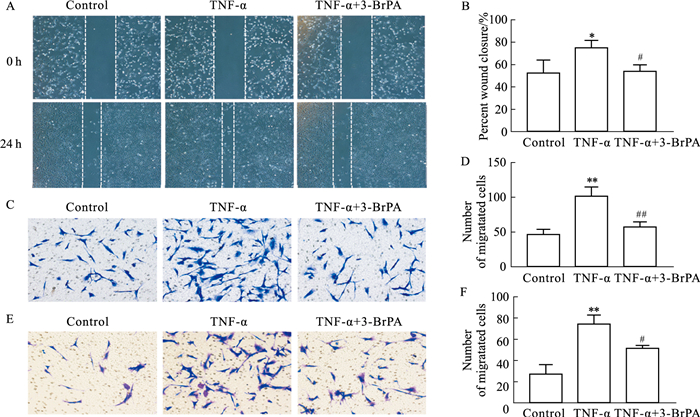
|
| Fig 3 Effects of 3-BrPA on FLS migration ability stimulated by TNF-α(x±s, n=3) A: Representative image of wound healing in each group (×40); C: Representative image of transwell migration in each group (×200); E: Representative image of transwell invasion in each group (×200); B, D, F: Bar graphs were used to quantify the wound healing, migration, and invasion of FLS. *P < 0.05, **P < 0.01 vs Control group; #P < 0.05, ##P < 0.01 vs TNF-α group. |
RA患者FLS存在凋亡/自噬失衡,这与FLS的异常增殖活化和侵袭性表型有关。流式细胞术、JC-1线粒体膜电位试剂盒以及mCherry-EGFP-LC3B过表达质粒转染分别检测不同处理组FLS凋亡和自噬的变化。Fig 4A结果显示,与control组相比,TNF-α刺激后FLS凋亡水平明显降低(P < 0.01),而3-BrPA则明显恢复TNF-α刺激下FLS的凋亡水平(P < 0.01)。在细胞的早期凋亡中通常伴随着线粒体膜电位的破坏,JC-1荧光探针从红色荧光(多聚体形式)到绿色荧光(单体形式)的转变代表线粒体膜电位的下降即发生早期细胞凋亡。Fig 4B图中,我们使用JC-1荧光探针在荧光显微镜下观察到,TNF-α组相比于control组绿色荧光更弱,而3-BrPA处理后则可部分恢复。Fig 4C图中结果显示,与control组相比,TNF-α组绿色荧光减弱而红色荧光增强,3-BrPA处理后则绿色荧光增强,以上表明,3-BrPA可以造成TNF-α刺激下FLS自噬流的阻滞。
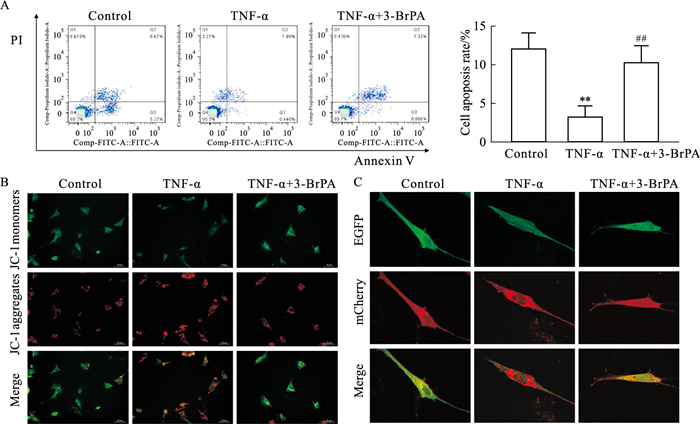
|
| Fig 4 Effects of 3-BrPA on FLS apoptosis and autophagy stimulated by TNF-α(x±s, n=3) A: Representative image and bar graph of FLS apoptosis in each group; B: The fluorescence image of JC-1 staining in each group (×200); C: The fluorescence image of autophagosomes and autolysosomes in each group (×600). **P < 0.01 vs Control group; ##P < 0.01 vs TNF-α group. |
Western blot检测不同给药组凋亡/自噬相关蛋白的表达。Fig 5结果显示,与control组相比,TNF-α刺激后FLS中凋亡调控蛋白caspase-3和Bax的表达下调,而抑凋亡蛋白Bcl-2的表达水平上调;自噬调控蛋白Beclin1和LC3B-Ⅱ的表达上调,而自噬负相关蛋白P62的表达水平下调。3-BrPA处理后则得以缓解。以上提示,3-BrPA可能通过调控FLS凋亡/自噬失衡来抑制FLS的异常增殖活化。
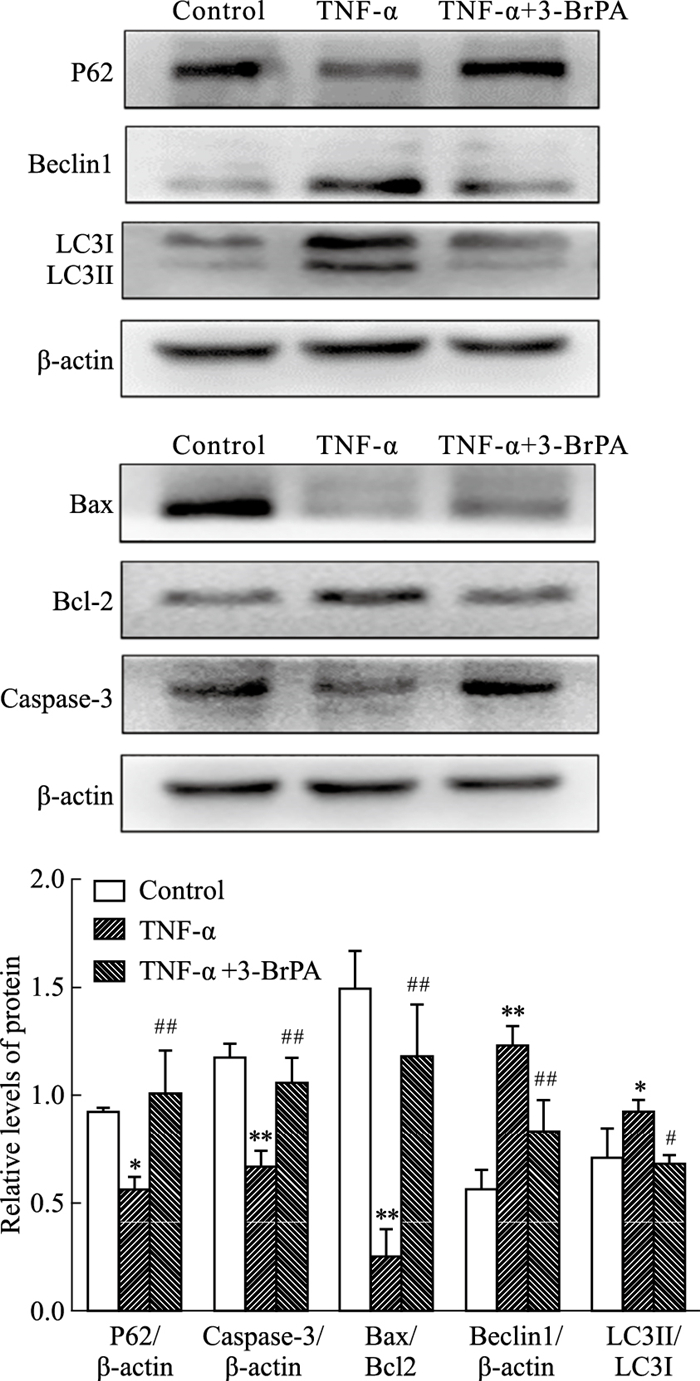
|
| Fig 5 Effects of 3-BrPA on expression of apoptosis/autophagy related proteins on FLS stimulated by TNF-α(x±s, n=3) *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs TNF-α group. |
采用Western blot方法检测AMPK、p-AMPK、mTOR和p-mTOR蛋白的表达以进一步阐明3-BrPA调控FLS凋亡/自噬失衡抑制其异常活化的作用机制。Fig 6结果显示,TNF-α刺激后明显上调了p-AMPK的表达(P < 0.05)并下调了p-mTOR的表达水平(P < 0.01),而3-BrPA处理后则下调p-AMPK的表达(P < 0.05),上调p-mTOR的表达水平(P < 0.01)。提示,3-BrPA可能是通过抑制AMPK、激活mTOR通路发挥调控FLS凋亡/自噬失衡的作用。
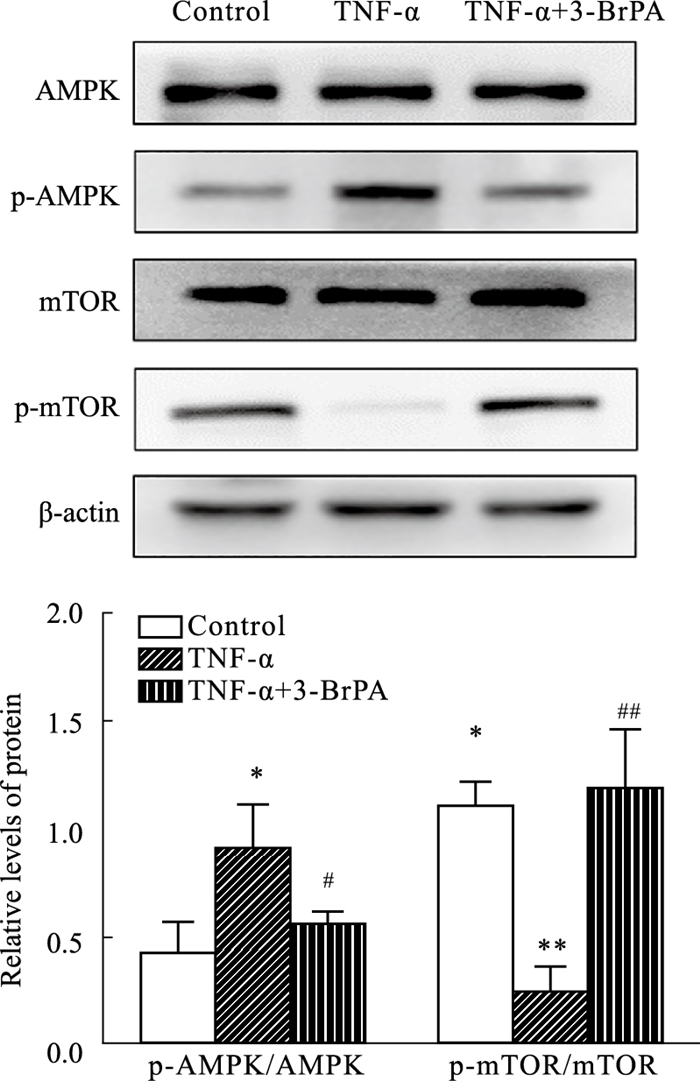
|
| Fig 6 Effects of 3-BrPA on expression of AMPK, p-AMPK, mTOR, and p-mTOR on FLS stimulated by TNF-α(x±s, n=3) *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs TNF-α group. |
RA作为一种全身性的自身免疫性疾病,全球发病率约为1%[10-11]。在RA症状早期的表现通常较为隐匿,不过随着时间的推移逐渐恶化。其病灶可累及全身多个关节,造成患者关节的功能障碍甚至残疾,对患者身心及生活造成极大影响。滑膜组织异常增生是RA的重要病理表现,而FLS作为滑膜组织的主要细胞类型,是研究RA发病机制的关键靶点。
FLS异常增殖及侵袭能力的增强与其凋亡途径被抑制导致的凋亡减少密切相关,而凋亡减少可能由于过度自噬所导致[12]。由于炎性因子TNF-α与RA关节组织微环境密切相关,过表达的TNF-α不仅能够刺激FLS分泌大量细胞因子、趋化因子和基质金属蛋白酶等导致FLS的异常增殖和侵袭性表型,还能够诱导自噬的增加[13]。并且在抗TNF-α药物治疗中也发现,减少自噬和增加凋亡具有良好的临床效果[14]。因此本研究使用TNF-α体外刺激FLS,模拟RA关节腔环境。MTT实验结果显示,TNF-α(25 μg·L-1)刺激FLS 24 h即可明显促进FLS的增殖,而3-BrPA能够明显抑制其增殖。此外3-BrPA还能够明显抑制TNF-α刺激下FLS的迁移及侵袭能力。
如前所述,RA FLS异常增殖活化和侵袭迁移等生物学特性与FLS的过度自噬和凋亡不足有关,因此我们进一步观察了FLS凋亡和自噬流的变化,结果发现3-BrPA能够降低TNF-α处理后FLS的线粒体膜电位、促进FLS凋亡率并阻滞FLS自噬流。Beclin1、LC3B和p62是目前衡量自噬的重要标志物,LC3B-Ⅰ向LC3B-Ⅱ的转化及Beclin1的表达水平通常与自噬成正相关,p62与自噬呈负相关。而经典的凋亡调控因子caspase-3、抗凋亡蛋白Bcl-2和促凋亡蛋白Bax与细胞凋亡的调控密切相关,并且研究认为Bax/Bcl-2的比率越大,促凋亡作用越强[15]。我们的结果发现,3-BrPA能够明显上调FLS刺激下caspase-3和p62的表达水平,明显上调Bax/Bcl-2的比率,并且明显下调Beclin1和LC3B-Ⅱ的表达。推测3-BrPA可能通过调控FLS凋亡/自噬失衡抑制其异常增殖活化。
为了进一步探究3-BrPA调控FLS凋亡/自噬失衡的机制,我们对AMPK/mTOR信号通路进行了检测。事实上,为了满足细胞生存和快速增殖所需要的能量,RA-FLS会进行代谢重编程,AMPK作为能量代谢和细胞存活的关键调节因子,关节腔缺氧微环境和ATP生成受损会导致其激活,进而促进糖酵解过程,同时通过下游靶点mTOR调控细胞自噬。3-BrPA作为糖酵解抑制剂,先前已经发现其阻断FLS糖酵解活性进而抑制FLS疾病状态可能与AMPK通路有关,但具体机制仍不清楚[9]。本研究通过Western blot方法检测发现,TNF-α刺激后,上调了p-AMPK的表达水平,而p-mTOR的表达被下调,即AMPK磷酸化后抑制了下游mTOR的磷酸化,标志着自噬的诱导[16]。而3-BrPA处理后p-AMPK的表达下调,p-mTOR表达上调,提示3-BrPA可能通过抑制AMPK/mTOR通路活化进而调控FLS凋亡/自噬失衡。
综上所述,本研究在细胞水平上,发现3-BrPA能够抑制FLS的异常增殖、迁移和侵袭,并调控FLS凋亡/自噬失衡,其机制可能与抑制AMPK/mTOR通路活化有关。
| [1] |
Brondello J M, Djouad F, Jorgensen C. Where to stand with stromal cells and chronic synovitis in rheumatoid arthritis?[J]. Cells, 2019, 8(10): 1257. doi:10.3390/cells8101257 |
| [2] |
José Alcaraz M. New potential therapeutic approaches targeting synovial fibroblasts in rheumatoid arthritis[J]. Biochem Pharmacol, 2021, 194: 114815. doi:10.1016/j.bcp.2021.114815 |
| [3] |
王言, 吴虹, 邓然, 等. 关节滑膜炎性微环境对类风湿关节炎发生发展作用的研究进展[J]. 中国药理学通报, 2020, 36(6): 754-9. Wang Y, Wu H, Deng R, et al. Research progress of synovial microenvironment in rheumatoid arthritis[J]. Chin Pharmacol Bull, 2020, 36(6): 754-9. doi:10.3969/j.issn.1001-1978.2020.06.004 |
| [4] |
Eisenberg-Lerner A, Bialik S, Simon H U, et al. Life and death partners: apoptosis, autophagy and the cross-talk between them[J]. Cell Death Differ, 2009, 16(7): 966-75. doi:10.1038/cdd.2009.33 |
| [5] |
Kato M, Ospelt C, Gay R E, et al. Dual role of autophagy in stress-induced cell death in rheumatoid arthritis synovial fibroblasts[J]. Arthritis Rheumatol, 2014, 66(1): 40-8. doi:10.1002/art.38190 |
| [6] |
Xu K, Xu P, Yao J F, et al. Reduced apoptosis correlates with enhanced autophagy in synovial tissues of rheumatoid arthritis[J]. Inflamm Res, 2013, 62(2): 229-37. doi:10.1007/s00011-012-0572-1 |
| [7] |
Karami J, Masoumi M, Khorramdelazad H, et al. Role of autophagy in the pathogenesis of rheumatoid arthritis: latest evidence and therapeutic approaches[J]. Life Sci, 2020, 254: 117734. doi:10.1016/j.lfs.2020.117734 |
| [8] |
Yadav S, Pandey S K, Goel Y, et al. Diverse stakeholders of tumor metabolism: an appraisal of the emerging approach of multifaceted metabolic targeting by 3-bromopyruvate[J]. Front Pharmacol, 2019, 10: 728. doi:10.3389/fphar.2019.00728 |
| [9] |
Garcia-Carbonell R, Divakaruni A S, Lodi A, et al. Critical role of glucose metabolism in rheumatoid arthritis fibroblast-like synoviocytes[J]. Arthritis Rheumatol, 2016, 68(7): 1614-26. doi:10.1002/art.39608 |
| [10] |
罗帅, 李小枫, 黄成, 等. 炎症因子在类风湿关节炎中的研究进展[J]. 中国药理学通报, 2022, 38(3): 330-8. Luo S, Li X F, Huang C, et al. Research progress of inflammatory cytokines in rheumatoid arthritis[J]. Chin Pharmacol Bull, 2022, 38(3): 330-8. |
| [11] |
Radu A-F, Bungau S G. Management of rheumatoid arthritis: an overview[J]. Cells, 2021, 10(11): 2857. doi:10.3390/cells10112857 |
| [12] |
Vomero M, Barbati C, Colasanti T, et al. Autophagy and rheumatoid arthritis: current knowledges and future perspectives[J]. Front Immunol, 2018, 9: 1577. doi:10.3389/fimmu.2018.01577 |
| [13] |
Wang Y, Gao W. Effects of TNF-α on autophagy of rheumatoid arthritis fibroblast-like synoviocytes and regulation of the NF-κB signaling pathway[J]. Immunobiology, 2021, 226(2): 152059. doi:10.1016/j.imbio.2021.152059 |
| [14] |
Vomero M, Manganelli V, Barbati C, et al. Reduction of autophagy and increase in apoptosis correlates with a favorable clinical outcome in patients with rheumatoid arthritis treated with anti-TNF drugs[J]. Arthritis Res Ther, 2019, 21(1): 39. doi:10.1186/s13075-019-1818-x |
| [15] |
Zhang K, Chen L, Zhang Z, et al. Ubiquitin-like protein FAT10: A potential cardioprotective factor and novel therapeutic target in cancer[J]. Clin Chim Acta, 2020, 510: 802-11. doi:10.1016/j.cca.2020.09.016 |
| [16] |
Hwang H Y, Shim J S, Kim D, et al. Antidepressant drug sertraline modulates AMPK-MTOR signaling-mediated autophagy via targeting mitochondrial VDAC1 protein[J]. Autophagy, 2021, 17(10): 2783-99. doi:10.1080/15548627.2020.1841953 |