


2. 皖南医学院第一附属医院(弋矶山医院), 神经外科学系, 安徽 芜湖 241001;
3. 皖南医学院神经系统疾病转化医学研究中心, 神经外科学系, 安徽 芜湖 241001
沈杰(1977-),男,博士,研究员,研究方向:临床药理学,通信作者,E-mail: jie_shen23@aliyun.com
 ,
LIU Ran1,
QIU Ben-feng1,
HE Xue-jun1,
CHEN Xin-yan1,
HUANG Yun-zhe1,
JIA Yuan-wei2,
LING Shizhang2,3
,
LIU Ran1,
QIU Ben-feng1,
HE Xue-jun1,
CHEN Xin-yan1,
HUANG Yun-zhe1,
JIA Yuan-wei2,
LING Shizhang2,3
 ,
SHEN Jie2
,
SHEN Jie2

2. The First Affiliated Hospital (Yijishan Hospital) of Wannan Medical College, Dept of Neurosurgery of Wannan Medical College, Wuhu, Anhui 241001, China;
3. The Translational Research Institute for Neurological Disorders, Dept of Neurosurgery of Wannan Medical College, Wuhu, Anhui 241001, China
骨关节炎(osteoarthritis,OA)是一种常见的关节疾病,为世界范围内致残和产生疼痛的主要原因之一,全球超过3亿人受到OA的影响[1]。OA好发人群以老年人为主, 其中60岁以上人群为50%,75岁以上人群为80%,致残率高达53%,并且女性患病率高于男性[2]。OA是一种能够影响所有关节组织的疾病,它的主要特征包括关节持续性疼痛、关节炎症和正常关节功能丧失。关节软骨退变和滑膜炎症反应在OA的进展过程中起到至关重要的作用。膝关节的关节软骨是膝关节最关键的结构部分,膝关节损伤后会导致软骨细胞和滑膜细胞代谢变化,产生的炎性细胞因子,会削弱软骨细胞修复软骨基质的能力,最终影响OA的发展[3]。目前治疗OA的常用药物为非甾体抗炎药,但因其长期服用产生不良反应而受限。对于症状较为严重或者晚期的骨关节炎患者还需要通过关节置换术来治疗,而研究表明,10%~53%的患者在关节置换术后会发生持续性术后疼痛,严重降低患者生活质量[4]。临床上迫切需要发现新的治疗靶点和开发新的OA治疗药物。
Trpv1是周围神经末梢的重要传感器,可以直接或间接地被各种配体激活,引起细胞内Ca2+升高,触发动作电位,传递伤害性信号,因此它在痛觉的产生及痛觉敏感性增强的病理发生过程中都扮演着重要的角色。既往研究发现,关节炎患者的滑膜成纤维细胞[5]表达Trpv1。另有研究发现,原发性盂肱关节骨性关节炎(GHOA)患者的滑膜和关节囊中均存在Trpv1高表达情况[6]。以上结果提示,Trpv1可能与人类OA的发生发展存在的一定相关性,关节组织的Trpv1可能成为治疗OA的新型靶点。
豆腐果苷(helicid,4-甲酰苯基-β-D-阿咯吡喃糖苷)是我国首次分离鉴定的,天然植物来源的民族药物,用于临床治疗神经病理性疼痛及炎性疼痛的药效明确可靠[7]。本课题组对豆腐果苷用于OA治疗的应用开展了初步的探索。课题组前期研究表明,给予大鼠50 mg·kg-1的豆腐果苷可升高碘乙酸钠(MIA)诱导的OA大鼠膝关节的机械疼痛阈值,减轻OA大鼠的痛觉过敏,缓解骨关节炎疼痛,同时观察到大鼠脊髓背根神经节中TrkA-Trpv1表达水平的降低[8]。以上研究结果提示,豆腐果苷可应用于治疗OA,而TrkA-Trpv1通路在豆腐果苷治疗OA机制中扮演重要角色。因此,我们提出豆腐果苷可能通过调控Trpv1水平影响OA进程这个科学假说。本研究拟在关节失稳OA模型上初步探讨豆腐果苷对OA的作用及对膝关节组织Trpv1表达水平的影响,为阐明豆腐果苷治疗OA的作用机制提供参考。
1 材料 1.1 实验动物10周龄雄性SD大鼠,体质量(230-250 g)[济南朋悦实验动物有限公司,SCXK(鲁)20190003]。饲养于常态化实验室环境中(光照12 h暗周期12 h,温度:22±2 ℃)。所有动物进行适应性喂养1周。所有实验操作均获得皖南医学院动物伦理委员会的批准。
1.2 药物豆腐果苷(纯度>98%,批号:QCCYK-GS,TCI Japan公司); 1.25%阿佛丁(批号:2065A,南京爱贝生物科技有限公司); 生理盐水(0.9%氯化钠注射液,批号:220411G04,安徽双鹤药业有限责任公司)。
1.3 主要试剂及仪器EDTA脱钙液(批号:CR2110003, 武汉赛维尔生物科技有限公司);改良番红O-固绿染色液(批号:20211021,北京索莱宝科技公司);Trpv1一抗(批号:GR3408594-1, Abcam);羊抗小鼠IgG-HRP二抗(批号:20211129,江苏凯基生物公司);胰蛋白酶消化液(批号:20220125,北京索莱宝科技有限公司);DAB染色液(批号:210914S412g,福州迈新生物技术开发公司)。
2 方法 2.1 分组与造模将21只健康雄性SD大鼠随机分为假手术(Sham)组、OA模型组、豆腐果苷治疗组,每组7只。参照文献方法,采用内侧半月板切除法建立大鼠OA模型[9]。将大鼠麻醉后,对待手术区域剃毛,并用2%碘伏消毒。在右膝关节中部做1 cm长切口,沿髌腱内缘切开,露出膝关节,然后用显微手术剪刀沿半月板下缘切除部分内侧半月板。注意术中不要损伤软骨面,假手术组仅切开关节囊,然后缝合切口。豆腐果苷治疗组大鼠于术后1 d灌胃豆腐果苷(100 mg·kg-1体质量),每日1次,按同样方法给OA模型组灌胃生理盐水。在实验第7周处死所有动物。
2.2 膝关节组织病理学评价各组大鼠在第7周被处死后,取出膝关节组织,然后放入4%多聚甲醛中固定24 h,再入10% EDTA脱钙液中脱钙1个月后进行常规程序脱水,石蜡包埋,切片和染色后进行组织学观察。取大鼠膝关节连续切片(厚5 μm),分别用番红O-固绿染色观察膝关节软骨面磨损情况,HE染色评价膝关节的磨损程度以及炎症细胞的浸润程度。根据Mankin的评分方法评估膝关节软骨的损伤程度[10]。
2.3 组织收集和Western blot处死大鼠后,取新鲜大鼠膝关节滑膜组织,放入-80 ℃冰箱储存待使用。临用时加入一定体积的裂解液,经超声破碎后,13 000 g离心15 min,得蛋白质上清液。取适量得上清液用BCA试剂盒测定上清液中的蛋白质浓度,然后取适量的上清液(总蛋白质含量为:20 μg)加入蛋白质上样液(Loading buffer)混合后于100 ℃煮沸10 min。采用10%的SDS-PAGE凝胶电泳分离蛋白质,待电泳结束后,取出胶至转膜槽中,以0.3 A电流,转膜时间120 min,将胶中的蛋白质转移到聚偏二氟乙烯(PVDF)膜上。再用5%脱脂牛奶室温封闭2 h,然后与一抗4 ℃孵育过夜。次日,将膜与二抗在室温条件下孵育1 h后,加ECL显影剂,在成像仪采集显影的蛋白质条带。应用ImageJ 1.51k软件对蛋白质条带进行定量分析,以目的蛋白质与β-Tubulin灰度值的比值作为目的蛋白质相对表达量。
2.4 免疫组织化学将预先包埋好的膝关节组织石蜡块进行连续切片,切片厚度为5 μm。经二甲苯脱蜡、梯度乙醇水化后,使用0.1%胰酶修复液在37 ℃处理15 min用来修复抗原,再用3%过氧化氢灭活内源性过氧化氢酶。5% BSA封闭30 min后,Trpv1(1 ∶200)一抗4 ℃孵育过夜。次日与HRP-聚合标记的二抗37 ℃孵育30 min。最后滴加DAB显色,镜下观察显色程度至合适时,自来水中止显色,然后再用苏木精复染细胞核。最后,对膝关节软骨细胞和滑膜组织阳性细胞进行计数,胞浆为棕色或黄色的切片为阳性。从每个切片中随机选择5个典型区域进行观察计数。
2.5 统计学处理计量资料以x±s表示。应用GraphPad Prism 8.0.2软件对实验数据进行统计学分析,以单因素方差分析(ANOVA)分析组间差异,两两比较用t检验。
3 结果 3.1 各组大鼠膝关节软骨和滑膜HE染色结果的比较为了研究豆腐果苷对MMx诱导的OA大鼠膝关节软骨降解的影响,我们采用了HE染色方法观察膝关节软骨形态特征。Sham组大鼠膝关节软骨层较厚且表面光滑,软骨细胞数量较多且排列整齐,软骨潮线完整,软骨层厚度均匀;与Sham相比,OA模型组软骨表面可见明显破坏、软骨细胞的数量明显减少,软骨表面凹凸不平并有明显的软骨退化形态,组织中有大量的炎症细胞浸润;与OA模型组相比,在经豆腐果苷治疗后,豆腐果苷治疗组的大鼠膝关节软骨层较平整,无明显破坏,软骨层厚度更均匀,软骨细胞的数量减少不明显, 组织中炎症细胞浸润数量减少(Fig 1)。
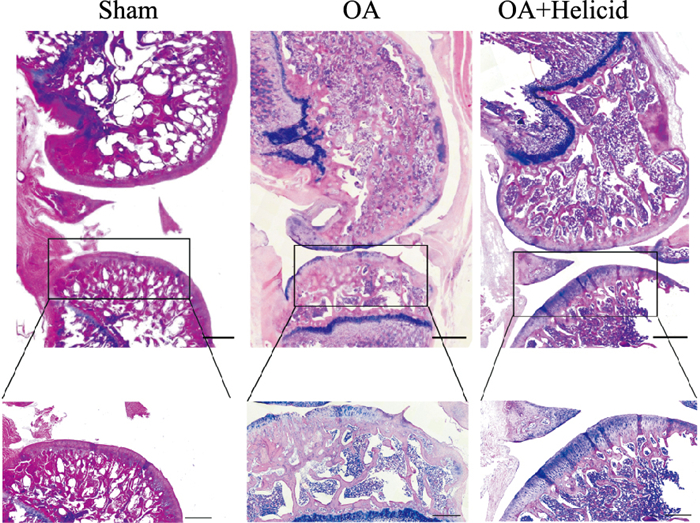
|
| Fig 1 The histopathological changes in articular cartilage after MMx surgery observed by HE staining Representative photomicrographs of HE staining showed the histopathological changes in the articular cartilage of rat knee from sham, OA, and OA + Helicid groups. Sham: sham group, OA: osteoarthritis group, OA+Helicid: osteoarthritis rat treated with Helicid group (scale bar, upper panels: 800 μm; lower panels: 100 μm). |
为了继续观察豆腐果苷对于骨关节炎的疗效,我们采用番红O-固绿染色方法评价各组大鼠的膝关节软骨中蛋白多糖的含量。Sham组膝关节软骨层染色均匀,无软骨基质和蛋白多糖丢失;OA模型组软骨层染色不均匀,蛋白多糖和软骨基质丢失严重;豆腐果苷治疗后,豆腐果苷治疗组的膝关节软骨层染色均匀,可明显减少关节软骨蛋白多糖的丢失,豆腐果苷明显延缓了OA时软骨退变和软骨变薄的情况(Fig 2A)。采用Mankin组织学评分系统对关节软骨进行评分,结果显示OA模型组的Mankin评分明显高于假手术组,豆腐果苷治疗组的评分低于OA模型组(Fig 2B)。以上结果表明,豆腐果苷能保存软骨形态,延缓OA的进程。

|
| Fig 2 Helicid reduced loss of proteoglycans in articular cartilage after MMx surgery(x±s, n=5) A: Representative photomicrographs of Safranin O staining showed the proteoglycans in the articular cartilage of rat knee from sham, OA, and OA+Helicid groups. Sham: sham group, OA: osteoarthritis group, OA+Helicid: osteoarthritis rat treated with helicid group (scale bar, upper panels: 800 μm; lower panels: 100 μm); B: The cartilage Mankin scores of Safranin O staining results from three different groups of panel A. ##P < 0.01 vs Sham group, **P < 0.01 vs OA group. |
为进一步探讨Trpv1的蛋白表达情况,我们采用Western blot方法检测大鼠膝关节滑膜组织中Trpv1的表达情况。结果显示,与Sham组相比,OA模型组Trpv1蛋白表达水平明显增高(P < 0.01);与OA模型组相比,豆腐果苷治疗组Trpv1蛋白表达水平明显降低(P < 0.01)(Fig 3)。
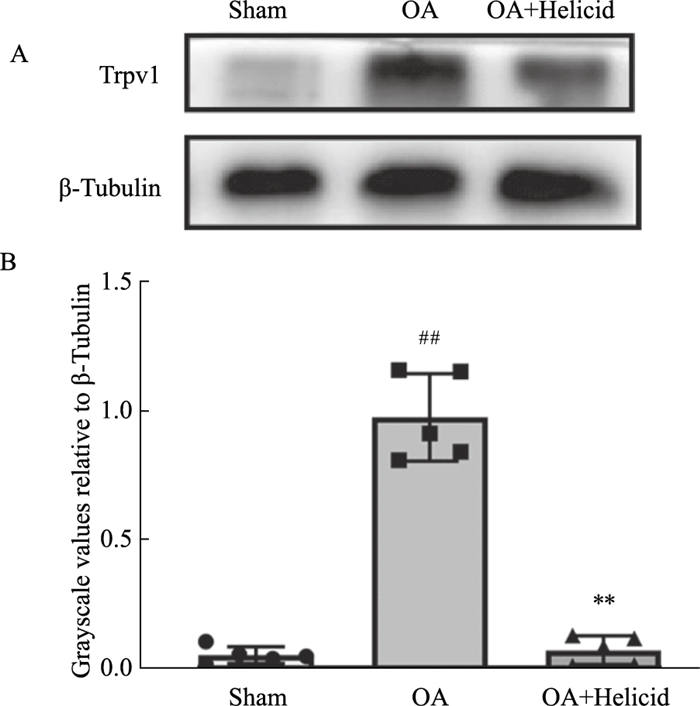
|
| Fig 3 Effect of Helicid on Trpv1 expression level after MMx surgery(x±s, n=5) A: The protein expression level of Trpv1 in rat synovial tissues from Sham, OA, and OA+Helicid groups was assessed by Western blot; B: The quantification of the Trpv1 bands and statistical analysis were shown. Sham: sham group, OA: osteoarthritis group, OA+Helicid: osteoarthritis rat treated with helicid group. ##P < 0.01 vs Sham group, **P < 0.01 vs OA group. |
为了探讨Trpv1是否参与骨关节炎和骨关节炎疼痛的发生发展,豆腐果苷能否通过减少膝关节组织中Trpv1的表达水平,以及大鼠膝关节中表达Trpv1的细胞类型和空间分布情况,我们采用了免疫组化方法检测各组大鼠膝关节软骨和滑膜组织中Trpv1的表达情况。结果发现,与Sham组相比,OA模型组大鼠膝关节软骨和滑膜中的Trpv1表达水平明显上调,并且两组间差异具有统计学意义(P < 0.05)(Fig 4A)。与OA模型组相比,豆腐果苷干预后,豆腐果苷治疗组大鼠的膝关节软骨和滑膜中的Trpv1阳性表达细胞数量明显减少,两组间差异具有统计学意义(P < 0.05)(Fig 4B)。
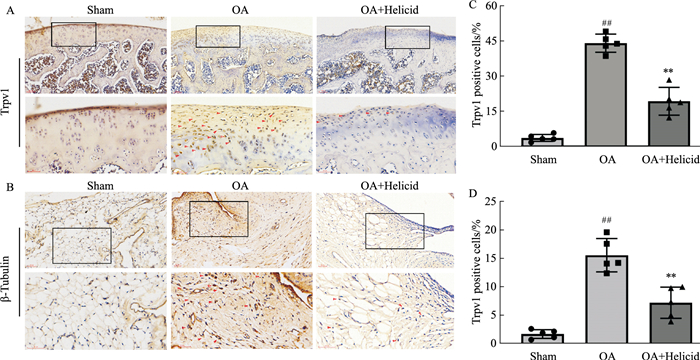
|
| Fig 4 Helicid reduced Trpv1 expression level after MMx surgery A: Representative photomicrographs of immunohistochemical staining showed the expression level of Trpv1 in the articular cartilage of rat knee. Red arrow indicates Trpv1-positive cells (scale bar, upper panels: 100 μm; lower panels: 50 μm); B: Representative photomicrographs of immunohistochemical staining showed Trpv1 expression in the synovial tissues of rat knee. Red arrow indicates Trpv1-positive cells (scale bar: 50 μm); C: The statistical analysis of the number of Trpv1-positive cells in each group of panel A; D: The statistical analysis of the number of Trpv1-positive cells in each group of panel B. Sham: sham group, OA: osteoarthritis group, OA+Helicid: osteoarthritis rat treated with helicid group. ##P < 0.01 vs Sham group, **P < 0.01 vs OA group. |
超重、老龄和激素水平改变等多重因素导致关节失稳和生物力学改变,导致OA的发生。骨关节炎的特征是关节软骨的进行性退变,进而诱发的关节周围骨、滑膜等关键部位的改变。膝关节软骨和滑膜组织是膝骨关节重要组成部分,其损伤和炎症被认为与关节病理学和功能密切相关。到目前为止未能完全阐明OA的发生机制和有效的治疗方法,因此需要寻找新的治疗手段和方法至关重要。
MMx模型是研究骨性关节炎发病过程中广泛使用的动物模型,为了确定豆腐果苷在骨关节炎中的潜在保护作用,我们建立了骨关节炎大鼠模型。和预期结果一致,在本研究中,我们成功地建立了MMx诱导的OA模型。在本研究中,我们观察了豆腐果苷对MMx诱导的OA大鼠的抗炎和镇痛作用。我们发现豆腐果苷有效地减轻了MMx诱导的OA大鼠膝关节软骨磨损和炎症浸润,降低软骨Mankin评分。此外,MMx诱导的大鼠OA可引起膝关节组织中Trpv1表达上调,而豆腐果苷能明显抑制这种上调作用。因此,本研究证明了豆腐果苷能够有效地减缓大鼠的OA进展。本研究仅对探讨了豆腐果功能对早期关节炎的影响,而鉴于骨关节炎的发生发展与时间进程密切相关,本研究今后将继续探究豆腐果苷对中晚期OA的影响。
豆腐果苷是由中国科学院昆明植物研究所从云南山龙眼属植物萝卜树(Helicia nilagirica Beed, 异名Helicia erratica Hook)的果实豆腐果中提取得到[7]。由于豆腐果苷具有镇痛、抗炎和抗抑郁等作用,从1984年起,豆腐果苷被应用于临床,对慢性神经性疼痛产生剂量依赖的镇痛作用,药效明确可靠。既往研究表明,豆腐果苷可以通过抗氧化和抗炎作用减轻大鼠急性化学性肝损伤[11]。本课题组前期工作显示,豆腐果苷可缩小高碘乙酸钠(MIA)诱导的关节直径的增加,减轻关节炎症[8];通过关节腔注射MIA增加大鼠脊髓DRG中Trpv1的荧光强度和阳性细胞数,豆腐果苷给药可以减少DRG中表达Trpv1的细胞数,但是并未明显减少Trpv1荧光强度的增加[8]。此外,豆腐果苷(50 mg·kg-1体质量)仅对早期痛觉过敏有抑制作用,但对中晚期痛觉过敏无影响[8]。因此,在本研究中,我们采用了100 mg·kg-1体质量的剂量探究豆腐果苷对大鼠膝关节OA的影响。在本研究中,首先通过组织病理学染色观察各组大鼠膝关节软骨组织学的改变,初步确定豆腐果苷可以减少软骨中蛋白多糖的丢失,保存关节软骨的完整结构,延缓OA软骨退变。既往研究表明,豆腐果苷有抗炎和抗氧化作用[11],因此,我们猜测豆腐果苷可能通过降低大鼠骨关节炎组织中炎症因子的表达,抑制氧化应激(ROS)等方式改善骨关节炎。Trpv1离子通道蛋白能够被各种刺激非选择性地激活,包括发炎关节中丰富的热刺激和机械刺激等,从而调节疼痛和炎症。
在临床中,OA患者就医的第一主诉往往是强烈的疼痛感,关节软骨和滑膜组织作为关节炎的主要病理改变部位,二者均在关节炎的痛觉过敏和关节炎症中起到关键作用。一方面由于关节软骨磨损引发的疼痛,另一方面是滑膜炎症发生时表现出的肿胀感和疼痛感。在OA病理过程中,组织损伤及炎症的发生会释放一系列炎症介质(如前列腺素、缓激肽和神经生长因子),这些炎症介质会增加感觉神经元对有害热或机械刺激的敏感性。Trpv1作为多种有害刺激的重要检测器,炎症介质的刺激会放大Trpv1的疼痛信号的传导,使疼痛阈值降低和疼痛反应性增强,最终表现为整个膝关节的疼痛。在动物模型中,Trpv1的表达与关节炎疼痛感受有关,Trpv1的表达在膝关节神经支配中与对照动物相比增加[12]。Trpv1基因敲除小鼠在佐剂诱导的关节炎模型中降低了热痛敏感性,减轻小鼠痛觉过敏[14]。Trpv1在关节软骨或者滑膜组织中各自发挥的生理作用尚未完全阐明,但已有研究表明,TRPV1可能作为血液中有害刺激或者继发部位炎症状态的标志物[14]。Rim等[15]强调,在OA的病理过程中,滑膜炎是可以直接引起痛觉过敏的发生的病理部位,Engler等[5]的研究也证实,TRPV1在人骨关节滑膜成纤维细胞中均存在基因水平和蛋白水平高表达。而另一项研究发现,在人骨关节炎软骨细胞中也存在Trpv1水平高表达情况[16],这意味着在整个膝关节中会出现多个病理部位同时表达Trpv1并共同参与OA的发病机制的情况。我们的研究发现,在OA模型组的膝关节软骨和滑膜组织中,Trpv1蛋白表达明显上调,这与先前研究报道的结果一致[17]。据报道,Trpv1拮抗剂可以有效降低MIA诱导OA大鼠的机械痛敏,并通过减少神经元自发性放电,减少脊髓的疼痛信号传导[18]。而本研究进一步发现,豆腐果苷干预明显降低膝关节软骨和滑膜组织Trpv1的蛋白表达水平。以上结果表明,豆腐果苷可以有效缓解OA,可能是通过调节膝关节软骨和滑膜组织中Trpv1表达水平来影响OA实现的。因此,靶向Trpv1是一种潜在治疗OA的方法。
众所周知,炎症作为产生疼痛的关键因素之一,已知炎症过程中的炎症因子,白介素1β(IL-1β)、白介素6(IL-6)和肿瘤坏死因子-α(TNF-α)能够通过激活伤害感觉性神经元,继而活化Trpv1,产生痛觉过敏。本研究不足之处在于没有检测大鼠膝关节组织炎症因子的表达水平,并且缺乏对人体骨性关节炎组织病理学标本的研究。为了更好地阐明Trpv1在骨关节炎中的作用,今后我们将采用ELISA方法检测大鼠膝关节组织和外周血中炎症因子的表达水平,并结合代谢组学方法分析豆腐果苷入血的成分,进一步阐释豆腐果苷调控Trpv1表示在骨性关节炎中的具体机制。
综上所述,我们的结果表明,豆腐果苷可以有效地改善大鼠OA的软骨磨损,并有效地减缓了关节失稳大鼠模型的骨关节炎的进展,豆腐果苷可能是通过调控Trpv1的表达水平而影响OA,这对临床上骨关节炎提供了一种潜在的治疗策略。
| [1] |
Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2018, 392(10159): 1789-858.
|
| [2] |
Zhang Z, Huang C, Jiang Q, et al. Guidelines for the diagnosis and treatment of osteoarthritis in China (2019 edition)[J]. Ann Transl Med, 2020, 8(19): 1213. doi:10.21037/atm-20-4665 |
| [3] |
韩明睿, 刘倩倩, 孙洋. 骨关节炎发病机制及药物调控新进展[J]. 中国药理学通报, 2022, 38(6): 807-12. Han M R, Liu Q Q, Sun Y, et al. The latest research progress on pathogenesis and drug regulation of osteoarthritis[J]. Chin Pharmacol Bull, 2022, 38(6): 807-12. |
| [4] |
Skou S T, Graven-Nielsen T, Rasmussen S, et al. Facilitation of pain sensitization in knee osteoarthritis and persistent post-operative pain: A cross-sectional study[J]. Eur J Pain, 2014, 18(7): 1024-31. doi:10.1002/j.1532-2149.2013.00447.x |
| [5] |
Engler A, Aeschlimann A, Simmen B R, et al. Expression of transient receptor potential vanilloid 1 (TRPV1) in synovial fibroblasts from patients with osteoarthritis and rheumatoid arthritis[J]. Biochem Biophs Res Commun, 2007, 359(4): 884-8. doi:10.1016/j.bbrc.2007.05.178 |
| [6] |
Chainani A, Matson A, Chainani M, et al. Contracture and transient receptor potential channel upregulation in the anterior glenohumeral joint capsule of patients with end-stage osteoarthritis[J]. J Shoulder Elb Surg, 2020, 29(7): e253-68. doi:10.1016/j.jse.2019.11.013 |
| [7] |
樊波, 李家林, 李颖, 等. 2-(4-β-D-吡喃阿洛糖苷-苯基)-4-芳基-2, 3-二氢-1, 5-苯并硫氮杂的合成及镇静活性的研究[J]. 有机化学, 2007, 27(9): 1150-4. Fan B, Li J L, Li Y, et al. Synthesis and calm activity of 2-(4-β-D-Allopyranosyloxyphenyl)-4-aryl-2, 3-dihydro-1, 5-benzothiazepine[J]. Chin J Org Chem, 2007, 27(9): 1150-4. |
| [8] |
项婷, 贾元威, 郭南, 等. 豆腐果苷通过抑制TrkA-TRPV1信号通路减轻大鼠膝骨关节炎疼痛[J]. 天然产物研究与开发, 2020, 32(10): 8. Xiang T, Jia Y W, Guo N, et al. Helicid reduces pain of knee osteoarthritis in rats by inhibiting TrkA-TRPV1 signaling pathway[J]. Nat Prod Res Dev, 2020, 32(10): 8. doi:10.16333/j.1001-6880.2020.10.005 |
| [9] |
Kamekura S, Hoshi K, Shimoaka T, et al. Osteoarthritis development in novel experimental mouse models induced by knee joint instability[J]. Osteoarthr Cartilage, 2005, 13(7): 632-41. doi:10.1016/j.joca.2005.03.004 |
| [10] |
Mankin H J, Lippiello L. Biochemical and metabolic abnormalities in articular cartilage from[J]. J Bone Joint Surg Am, 1970, 52(3): 424-34. doi:10.2106/00004623-197052030-00002 |
| [11] |
Chen S, Zhang C, Zhou X, et al. Anti-inflammatory and antioxidative properties of helicid protect against CCl4 induced acute liver injury in mice[J]. Biotech Histochem, 2020, 95(7): 483-9. doi:10.1080/10520295.2020.1718210 |
| [12] |
Fernihough J, Gentry C, Bevan S, et al. Regulation of calcitonin gene-related peptide and TRPV1 in a rat model of osteoarthritis[J]. Neurosci Lett, 2005, 388(2): 75-80. doi:10.1016/j.neulet.2005.06.044 |
| [13] |
Keeble J, Russell F, Curtis B, et al. Involvement of transient receptor potential vanilloid 1 in the vascular and hyperalgesic components of joint inflammation[J]. Arthritis Rheum-Us, 2005, 52(10): 3248-56. doi:10.1002/art.21297 |
| [14] |
Saunders C I, Kunde D A, Crawford A, et al. Expression of transient receptor potential vanilloid 1 (TRPV1) and 2 (TRPV2) in human peripheral blood[J]. Mol Immunol, 2007, 44(6): 1429-35. doi:10.1016/j.molimm.2006.04.027 |
| [15] |
Rim Y A, Ju J H. The role of fibrosis in osteoarthritis progression[J]. Life-Basel, 2020, 11(1): 3. doi:10.3390/life11010003 |
| [16] |
Gavenis K, Schumacher C, Schneider U, et al. Expression of ion channels of the TRP family in articular chondrocytes from osteoarthritic patients: changes between native and in vitro propagated chondrocytes[J]. Mol Cell Biochem, 2009, 321(1-2): 135-43. doi:10.1007/s11010-008-9927-x |
| [17] |
Ma X, Hao C, Zhang Z, et al. Shenjinhuoxue mixture attenuates inflammation, pain, and cartilage degeneration by inhibiting TLR-4 and NF-κB activation in rats with osteoarthritis: a synergistic combination of multitarget active phytochemicals[J]. Oxid Med Cell Longev, 2021, 2021: 4190098. |
| [18] |
Chu K L, Chandran P, Joshi S K, et al. TRPV1-related modulation of spinal neuronal activity and behavior in a rat model of osteoarthritic pain[J]. Brain Res, 2011, 1369: 158-66. doi:10.1016/j.brainres.2010.10.101 |