


2. 江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023
2. Jiangsu Collaborative Innovation Center of Traditional Chinese Medicine, Prevention and Treatment of Tumor, Nanjing University of Chinese Medicine, Nanjing 210023, China
人参皂苷是人参中的主要活性成分,具有抗多种疾病的药理作用,也是主要的抗肿瘤物质。Rg3是人参皂苷中的一种组成成分,是一种四环三萜皂苷[1]。作为一种甾体皂苷,具有比其他人参皂苷更广泛的药理活性。多项研究表明,Rg3具有多种生物学活性,包括抗癌作用和免疫调节能力。Rg3的抗肿瘤作用已在各种实验中得到证实,并已在临床上应用多年。前期的研究表明,Rg3在结肠癌、肺癌、前列腺癌、卵巢癌等多种癌症中,通过抑制癌细胞增殖、诱导细胞凋亡、抑制血管生成以及癌细胞的侵袭转移活性,产生抗肿瘤作用[2];可增加HLA-ABC、HLA-DR、CD56等分子表达,促进脾淋巴细胞增殖,使Th1/Th2及CD4+ /CD8+向免疫增强方向转移,增强外周淋巴细胞的免疫功能; 还可提高IL-2和NK细胞的活性,并通过IL-2激活T淋巴细胞,产生细胞因子和正向免疫调节作用,提高机体的特异、非特异性免疫和抗肿瘤能力[3]。
丝裂原活化蛋白激酶(MAPK)通路将外部的丝裂原信息传递给免疫细胞,导致细胞分化和代谢机制的调节,使细胞为效应功能做好准备。在肿瘤微环境中,持续的有丝分裂刺激诱导效应细胞过度分裂,产生一种衰竭的表型,显示出效应功能减弱,也损害免疫记忆的产生。据报道,MAPK整合了各种细胞内信号通路,以响应不同的外界刺激,并在NK细胞介导裂解肿瘤细胞中发挥关键作用[4]。
人参皂苷Rg3有很强的免疫增强作用,但其与MAPK通路的关系及其是否可能通过影响MAPK通路进而调节T淋巴细胞的免疫,目前并不清楚。本文将对这一问题展开研究。
1 材料 1.1 细胞小鼠黑色素瘤细胞B16F10细胞株由江苏省中药药效与安全性评价重点实验室细胞库提供,RPMI 1640+10%FBS常规培养,培养箱条件为5% CO2,37 ℃。
1.2 试剂与药物人参皂苷Rg3(上海源叶生物科技有限公司;批号:B21759;纯度≥98%);EdU-555细胞增殖检测试剂盒(碧云天公司,C0075S); Annexin V-FITC细胞凋亡双染试剂盒(碧云天公司,批号:C1062S);APC anti-mouse CD197(CCR7)(Biolegend,120107); APC anti-mouse CD62L(Biolegend,104411); FITC anti-mouse CD95(Biolegend,152605); FITC anti-mouse CD44(Biolegend, 103005); PE anti-mouse CD8a(Biolegend,162304);FITC anti-mouse CD3(Biolegend,100204);GAPDH抗体(32233, Santa);ERK1/2抗体(AF0155,Affinity);Phospho-ERK1/2抗体(AF1015,Affinity);MEK1/2抗体(AF6385,Affinity);p38 MAPK抗体(AF6456,Affinity); Phospho-SAPK/JNK (Thr183/Tyr185) (81E11,CST); c-Jun (60A8,CST); Phospho-p38 MAPK抗体(AF4001,Affinity)。
1.3 实验动物C56BL/6小鼠,雌性,6~8周龄,18~22 g,上海斯莱克实验动物有限责任公司,合格证编号:20170005056292,许可证编号: SCXK(沪)2017-0005。饲养条件:所有小鼠随机分组后饲养于鼠筐中,环境温度保持在(21±2)℃,避免各类环境噪音。另外室内保证12 h白昼/黑夜循环灯光,自由饮水食。同时,实验过程严格遵守动物福利和动物实验伦理。
1.4 仪器电泳仪、转膜仪(美国Bio-Rad公司);Synergy 2多功能酶标仪(美国Biotek公司);ECO超净工作台(美国Thermo Fisher Scientific公司);Real-Time实时定量PCR仪(美国ABI公司);倒置荧光显微镜、体式显微镜(德国Zeiss公司);组织脱水机、组织包埋机、石蜡切片机(德国徕卡公司)。
2 方法 2.1 细胞培养及分组37 ℃水浴加热解冻B16F10细胞,置于RPMI 1640培养基(10%胎牛血清、100 kU·L-1青霉素-链霉素) 中,PBS洗涤后胰酶消化,置于5% CO2、37 ℃饱和湿度培养箱中培养,2 d左右传代1次,共培养2~3代,取对数生长期的细胞进行实验。
2.2 T细胞分离及培养在C57BL/6小鼠侧面皮下注射B16 F10黑色素瘤细胞(1×106 L-1细胞)。1周后处死小鼠。取其外周血脾脏及淋巴结。(无菌取脾,加PBS研磨,1 500 r·min-1离心5 min)消化成单细胞悬液。使用BD FACS AriaII细胞分选机(BD Biosciences, Franklin Lakes, NJ)从外周血单个核细胞和淋巴细胞混合悬液中分选CD8+ T细胞。CD8+ T细胞在2 mg·L-1抗CD3 ε (Biolegend)、1 mg·L-1抗CD28 (Biolegend)和IL- 2(Biolegend)的刺激下活化24 h。其间,将分选后的CD8+ T细胞在RPMI 1640培养基中并置于5% CO2,37 ℃培养箱中培养孵育。
2.3 MTT法检测取分选后的CD8+ T细胞或B16F10细胞,制成细胞悬液,设置对照组(DMSO) 和给药组(Rg3浓度5、10、15、20 μmol·L-1),每孔100 μL细胞悬液(约5×107L-1)接种于96孔板中,加药后置于37 ℃、5% CO2培养箱中培养24 h后,每孔加入200 μL含MTT溶液(纯MTT ∶ RPMI 1640基础培养基=1 ∶ 10),放入培养箱中孵育4 h左右,去上清(T细胞需离心),每孔加入200 μL二甲基亚砜(DMSO)。平板振荡器上振荡10 min。将处理好的培养板置于酶联免疫检测仪中,在450 nm波长处测定吸光度值(A),生长抑制率/%=(1-A给药组/A对照组)×100%。
2.4 Western blot检测MAPK相关调控通路的蛋白表达[5]取“2.3”培养的T细胞,稳定生长时分组给药,对照组(不加Rg3)、Rg3组(5、10 μmol·L-1)继续培养24 h,离心后收集细胞,PBS漂洗3次,加入细胞裂解液RIPA进行细胞裂解,收集细胞总蛋白。取蛋白样品30 μg上样,SDS-PAGE电泳分离后至PVDF上转膜,于3%~5%脱脂牛奶中封闭后,分别加入ERK1/2抗体、Phospho-ERK1/2抗体、MEK1/2抗体、p38 MAPK抗体、Phospho-SAPK/JNK (Thr183/Tyr185)、c-Jun、Phospho-p38 MAPK抗体、GAPDH抗体(1 ∶ 1 000),4 ℃孵育过夜;加入兔二抗体,室温孵育1.5 h,使用ECL化学发光法显像,利用ImageJ软件进行蛋白条带灰度分析,计算蛋白相对表达,并绘制柱状图。
2.5 RNA提取和实时定量PCR(RT-qPCR)取分选出CD8+ T细胞1×106种于6孔板中,随后加入含Rg3的培养基,给药Rg3终浓度为5、10 μmol·L-1,于37 ℃培养箱中培养24 h;离心弃去上清,PBS洗涤后加入1 mL总TRIzol提取RNA,将模板RNA稀释为500 ng,加入2 μL的4×g DNA wiper Mix,再加入RNA-free dd H2O, 用移液枪轻轻吹打混匀,置于PCR仪中,42 ℃条件下加热2 min。使用HiScript Ⅱ qRT SuperMix Ⅱ将提取的RNA反转录得到cDNA,设置条件(15 min→50 ℃,5 s→85 ℃)。随后使用荧光实时定量PCR专用管中沿壁依次加入相应试剂,轻轻吹打混匀,用密封膜封紧板面。将PCR检测板放入ABI StepOnePlus实时荧光定量PCR仪中进行扩增。条件设置如下95 ℃-30 s;95 ℃-10 s; 60 ℃-30 s; 95 ℃-15 s; 60 ℃-60 s; 95 ℃-10 s. 分别读取内参和目的蛋白的CT值。计算相对变化,并进行统计分析。
2.6 流式细胞术分析为了进行流式细胞分析,将分选好的CD8+ T细胞以5×108 L-1的密度接种在24孔板中,加入不同浓度Rg3,在含20% FBS的RPMI 1640培养基中继续培养24 h。每孔收集CD8+ T细胞,1 500 r·min-1离心5 min,PBS洗涤3次,用小鼠流式抗体在4 ℃下染色30 min。细胞内细胞因子染色时,用1 mL·L-1 PMA、1 ml·L-1 ionomycin (Sigma)、1 ml·L-1 brefeledin (Sigma)刺激CD8+ T细胞4 h,然后按照固定/通透性试剂盒(eBioscience)的制作方案进行染色.利用流式细胞仪进行分析。数据由FlowJo软件分析。
2.7 细胞凋亡检测按照Annexin V-FITC/PI细胞凋亡双染试剂盒(碧云天)步骤进行实验。按“2.3”项下方法处理(CD8+ T/B16F10)细胞,给药结束时,离心后弃上清,PBS清洗3遍,加入含5 μL Annexin V-FITC及5 μL PI染色液的500 μL结合缓冲液重悬细胞,室温避光染色20 min,利用流式细胞仪及荧光显微镜检测细胞凋亡情况。
2.8 EDU细胞增殖检测以每孔6×105个细胞接种于6孔板中,置于培养箱中培养24 h,弃去培养液,PBS清洗,在给药组加入已在浓度为5、10 μmol·L-1 Rg3中培养24h后的CD8+ T细胞,另外设置对照组(不加Rg3),设3个复孔,培养箱培养24 h后参照EdU试剂盒(碧云天)步骤进行细胞清洗、固定、EDU染色等操作,结束后将培养板置于倒置荧光显微镜下,观察并随机拍摄荧光图像,运用ImageJ软件进行定量计数。
2.9 酶联免疫吸附试验ELISA将经过筛选的CD8+ T细胞以5×108 L-1的密度接种于24孔板中,并在含有或不含Rg3的RPMI 1640培养基中5% CO2、37 ℃培养箱中培养24 h。每孔收集上清,3 500 r·min-1离心10 min。按照产品说明书使用小鼠IL-2 ELISA试剂盒(南京翼飞雪生物技术有限公司)和小鼠IFN-γ ELISA试剂盒(南京翼飞雪生物技术有限公司)检测CD8+ T细胞分泌的总IL-2和IFN-γ。
2.10 统计学方法使用GraphPad Prism 9软件进行统计学分析,实验数据以x±s表示,先使用单因素方差分析ANOVA),有差异后两组之间的比较使用Student′s-t检验,两组以上比较使用Dunnett′s test检验。
3 结果 3.1 人参皂苷Rg3一定浓度范围内不影响CD8+ T细胞增殖及凋亡体外实验中为了排除Rg3对肿瘤细胞及T淋巴细胞增殖的直接影响,需确定其无影响浓度。经流式细胞术定量分析,结果显示,在5、10、15 μmol·L-1 Rg3处理后诱导的T细胞凋亡,与正常对照组相比差异无统计学意义(Fig 1A)。另一方面,通过MTT实验检测CD8+ T细胞存活率,观察在5、10、15 μmol·L-1 Rg3处理24 h后,Rg3对CD8+ T细胞增殖的无抑制作用(Fig 1B, C)。上述结果表明,此浓度范围内不会诱导T细胞凋亡并且不影响其增殖。因此,我们选取此范围下浓度作为后续研究。
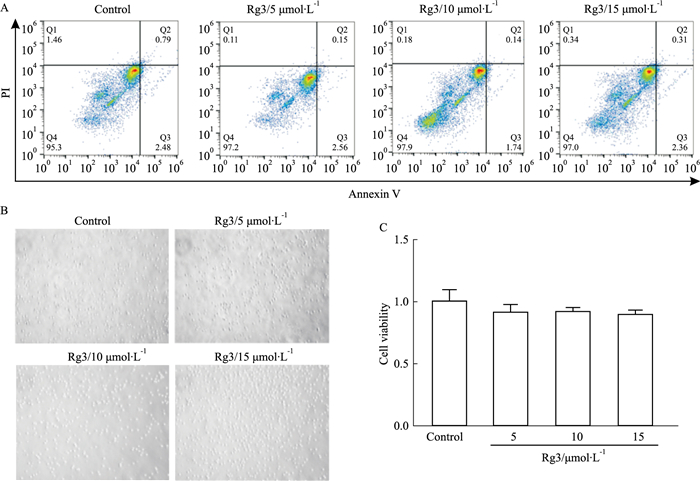
|
| Fig 1 Ginsenoside Rg3 did not affect apoptosis and proliferation of CD8+ T cells within a certain concentration range (x±s, n=3) A: Flow cytometry images showed apoptosis ratio; B: Morphological images of CD8+ T cells were observed microscopically (× 200); C: Effects of Rg3 on proliferation of CD8+ T cells. |
利用MTT检测在5、10、15 μmol·L-1 Rg3处理后的CD8+ T细胞与B16F10共培养24 h,B16F10细胞的生长情况及存活能力,结果显示,Rg3干预下的T细胞明显抑制了B16F10细胞的生长,IC50值为7.43 μmol·L-1(Fig 2A, B)。并且共培养24 h后,利用荧光显微镜拍摄B16F10细胞,观察到对照组绿色及红色荧光显示均较弱,说明细胞维持在正常状态; 5 μmol·L-1 Rg3处理后T细胞共培养下的B16F10细胞,绿色荧光逐步增强,表明开始发生早期凋亡; 10 μmol·L-1Rg3组绿色和红色荧光显示均较强,表明了细胞处于晚期凋亡状态(Fig 2C, D)。另外,EDU增殖检测结果显示,5 μmol·L-1 Rg3处理后T细胞影响B16F10细胞增殖(P<0. 05),而10 μmol·L-1 Rg3处理后T细胞显著抑制了B16F10细胞的增殖(P<0. 01)(Fig 2E, F)。流式细胞术及ELISA检测显示,Rg3处理后的CD8+ T细胞分泌的IL-2和IFN-γ含量升高(Fig 3A, B)。上述结果表明,Rg3处理的的CD8+ T细胞比正常培养的CD8+ T细胞对B16F10细胞具有更强的杀伤能力。
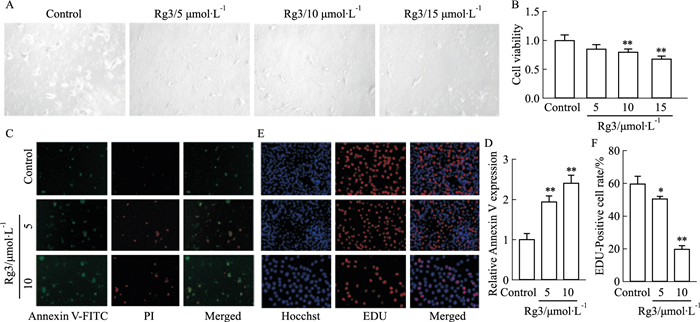
|
| Fig 2 Ginsenoside Rg3 enhanced antitumor effect of CD8+ T cells in vitro (x±s, n=3) A: Microscopic observation of B16F10 cell morphology imaging (×200); B: Inhibition of B16F10 cell proliferation after treatment of CD8+ T cells with different concentrations of Rg3; C: CD8+ T cells were treated with different concentrations of Rg3 and co-cultured with B16F10 cells for 24 h. Apoptosis of B16F10 cells was observed by fluorescence microscope(×200); D: Quantification of fluorescent images; E: CD8+ T cells were treated with different concentrations of Rg3 and co-cultured with B16F10 cells for 24 h. The proliferation of B16F10 cells was observed by fluorescence microscope (×200); F: Quantitative map of positive cells in fluorescence image; *P < 0.05, **P < 0.01 vs Control group. |
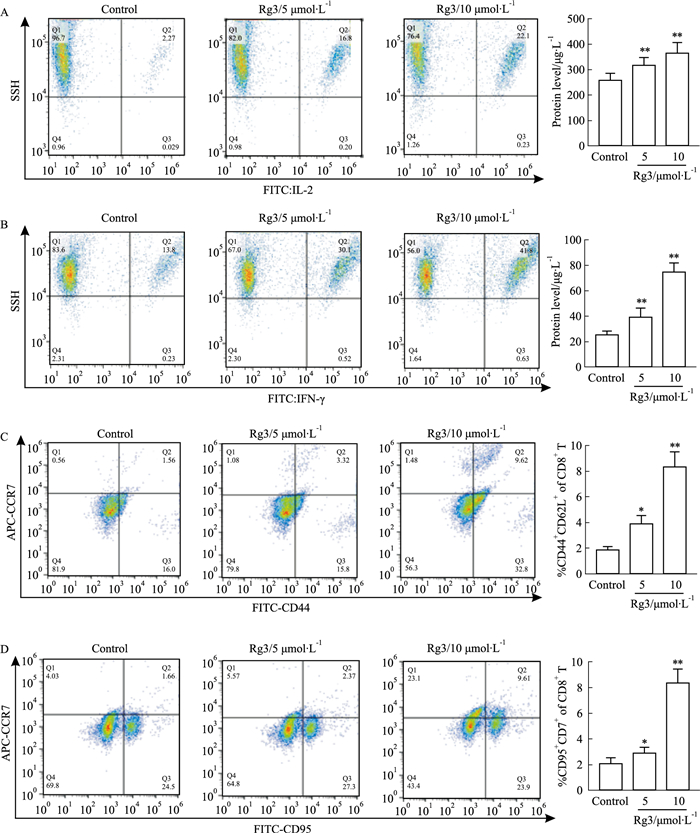
|
| Fig 3 Ginsenoside Rg3 promoted differentiation of CD8+ T cells into memory T cells (x±s, n=3) A: Flow cytometry was used to detect the positive rate of IL-2 and IFN-γ in CD8+ T cells. B: The secretion of IL-2 and IFN-γ in CD8+ T cells treated with Rg3 was detected by ELISA. C: Flow cytometry was used to detect the quantitative analysis of CD44+CD62L+cells (TCM) after 24 h treatment of CD8+ T cells with Rg3. D: Quantitative analysis of CD95+CDR7+cells (TCM) after 24 h treatment with Rg3 by flow cytometry; *P < 0.05, **P < 0.01 vs Control group. |
通过流式细胞术定量分析,CD44、CD62L在T细胞活化后上调,在记忆细胞和效应细胞中均为阳性。分析了5、10 μmol·L-1 Rg3干预和正常培养的CD8+ T细胞,发现Rg3以剂量依赖性的方式增加了CD8+ T细胞中CD44+CD62L+亚群的比例,表明Rg3促进了共表达CD44+和CD62L+的TCM细胞的富集(Fig 3C)。并且,Rg3干预培养诱导CD8+ T细胞表达更高水平的记忆标记物(CCR7和CD95)。结果显示,Rg3以剂量依赖性的方式增加了CD8+ T细胞中CDR7+、CD95+亚群的比例(Fig 3D)。进一步说明人参皂苷Rg3促进记忆性T细胞TCM的产生,由此达到增加抗肿瘤能力的作用。
3.4 人参皂苷Rg3增强CD8+ T细胞的抗肿瘤免疫记忆作用的机制研究Western blot检测人参皂苷Rg3对CD8+ T细胞MAPK通路蛋白表达的影响,结果显示,与对照组相比,5、10 μmol·L-1 Rg3处理后的CD8+ T细胞,虽然MEK、p38MAPK、p-p38MAPK、JNK、p-JNK蛋白表达及mRNA水平均显示无明显变化。但Rg3可以显著影响ERK蛋白磷酸化以及其相关mRNA变化(Fig 4A-C)。并且在使用ERK抑制剂0.1 μmol·L-1 PD0325901后,观察到与对照组相比,Rg3处理后的CD8+ T细胞产生的记忆功能细胞比例无明显变化(Fig 4D)。上述结果推断,人参皂苷Rg3可以通过激活MAPK/ERK促进T细胞记忆功能,增强抗肿瘤效果。
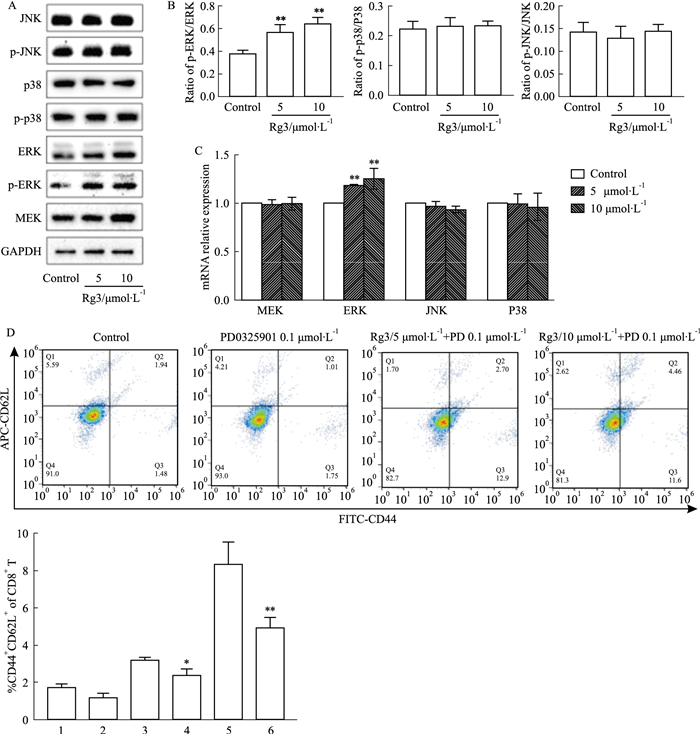
|
| Fig 4 Ginsenoside Rg3 affected memory function of CD8+ T cells through ERK signaling pathway (x±s, n=3) 1:Control; 2:PD0325901 0.1 μmol·L-1; 3:5 μmol·L-1 Rg3; 4:5 μmol·L-1 Rg3+PD 0.1 μmol·L-1; 5:10 μmol·L-1 Rg3; 6:10 μmol·L-1 Rg3+PD 0.1 μmol·L-1. A: Western blot was used to determine the effect of Rg3 on the expression of molecular proteins related to MAPK pathway in CD8+ T cells. B: ImageJ software was used for protein strip gray scale analysis to quantify the ratio of p-ERK /ERK, p-p38/p38 and p-JNK/JNK. C: qRT-PCR was used to detect the effect of Rg3 on mRNA expression levels of related molecules in MAPK pathway of CD8+ T cells. D: Flow cytometry was used to determine the proportion of CD44+CD62L+cells (TCM) in CD8+ T cells treated with PD0325901 0.1 μmol·L-1 and Rg3 for 24 h. *P < 0.05, **P < 0.01 vs Control group. |
T细胞参与许多不同类型的免疫反应,发生在感染、癌症、自身免疫和过敏性疾病中. 细胞毒性CD8+ T细胞和CD4+ T辅助性细胞(TH1)是免疫系统对抗癌症的主要武器.细胞毒性CD8+ T细胞是抗肿瘤免疫的主要效应细胞,在肿瘤的过继细胞免疫治疗(ACT)中通常被用作治疗细胞[6]。通过将CD8+ T细胞转移到荷瘤小鼠体内,发现中枢记忆T细胞(central memory T cell, TCM)比效应记忆T细胞(effect memory T cell, TEM)或分化效应T细胞(differentiation effect T cell, TEF)具有更高的抗肿瘤活性[7]。在早期分化阶段,TCM细胞治疗B16荷瘤小鼠的疗效至少是TEF的100倍。虽然TCM、TEM、TEF能产生效应细胞因子IFN-γ、TNF-α,但只有TCM能产生IL-2, IL-2能促进其在再次暴露于抗原后迅速扩张,具有更有效的免疫力[8]。更重要的是,TCM具有很强的自我更新能力,在体内可以存活一个多月。因此,TCM细胞作为一种具有长期有效抗肿瘤记忆的记忆毒性T细胞亚群,是免疫治疗成功的关键[9]。
Rg3是一种甾体皂苷,具有广泛的药理活性抗癌功效[10]。研究表明,Rg3具有较强的抗癌特性和免疫调节能力等多种生物学活性。并且其抗肿瘤作用已利用实验加以证明,并在临床上得到实践应用。此外,Rg3还通过激活脾细胞增殖和IFN-γ的产生发挥增强免疫功能的作用。有研究证实,Rg3通过Akt/p53通路刺激DDX3表达,通过TBK1/ IKKepsilon/IRF3信号通路激活先天免疫反应和IFN-β的表达[11]。通过MAPK/ERK信号通路增加激活受体表达,增强自然杀伤细胞活性[12]。虽然已有报道表明,Rg3具有抗肿瘤和免疫调节活性,但这些作用的机制以及Rg3是否直接增强CD8+T细胞的功能及抗肿瘤活性仍有待进一步研究。
本研究首先验证了人参皂苷Rg3在一定浓度内对于肿瘤细胞以及T细胞的增殖凋亡没有影响。但可以通过促进细胞毒性T细胞分泌IL-2以及IFN-γ杀伤因子增强其抗肿瘤的能力。而已有研究表明原始的CD8+ T细胞受到抗原刺激后,根据分化状态不同主要分为中央记忆性T细胞(TCM)、效应记忆性T细胞(TEM)、分化效应T细胞(TEF),TCM高表达淋巴归巢分子CD62L,而TEF却不表达[13]。进一步分析发现,TCM、TEM和TEF都可以产生效应细胞因子IFN-γ与TNF-α,但是只有TCM能够生产IL-2。研究证实,IL-2能够使TCM其具有更有效的免疫能力,促进TCM在二次接触抗原时快速扩增。并且IL-2使得TCM具有自我不断的更新与增殖能力,在体内的存活时间显著提高,从而产生更有效的抗肿瘤免疫[14]。
MAPK通路有4种主要的分支路线:ERK、JNK、p38MAPK和ERK5。其中,JNK和p38功能相似,跟炎症、凋亡、生长都有关;ERK主要负责细胞生长、分化,其上游受Ras/Raf蛋白调控。而MEK和ERK1/2都参与广泛的生物过程,如细胞生存、增殖和分化,所有这些过程都分别依赖于MEK和ERK1/2的磷酸化。大多数实体肿瘤的明显特征是信号通路的RAS/RAF/MEK/ERK基因突变。已有研究说明激活ERK信号通路,可促进树突状细胞中IL-12p70的分泌,增强CTL的细胞毒性,从而增强抗肿瘤效果。另外ERK、JNK和p38 MAPK活性的特异性抑制也可降低TNF-α、IFN-γ和IL-6的分泌[15]。研究揭示了ERK信号主要功能是控制激活T细胞表达的转录因子、细胞因子和细胞因子受体。ERK1/2控制的T细胞蛋白,虽然数量相对较少,但包含许多已知的对T细胞分化和获得效应功能至关重要的关键分子[16]。例如ERK2的激活对TCR诱导的T细胞增殖和分化具有重要作用,ERK1/2活性控制活化CD8+ T细胞中效应分子、细胞因子和细胞因子受体的表达[17]。因此,我们研究了Rg3处理后,MAPK/ERK通路在T细胞活性及功能中的作用。研究结果发现,Rg3诱导MAPK/ERK磷酸化; 然而,并不影响p38或JNK通路的磷酸化。这些结果支持Rg3通过激活MAPK/ERK信号通路增加T细胞记忆功能的观点。
综上,本研究通过体外实验研究发现人参皂苷Rg3增加CD8+ T细胞对肿瘤细胞的杀伤能力,通过增加功能性记忆T细胞的转化影响其免疫功能。Rg3增加T细胞释放杀伤因子IL-2及IFN-γ及其mRNA的表达。并且功能性T细胞TCM的比例增加,Rg3通过激活MAPK/ERK通路促进功能性T细胞分化进而促进T细胞杀伤活性增强抗肿瘤效果。
通过中药活性成分对TME中免疫细胞功能进行干预,进而提高体内抗肿瘤活性,是中药成分抗肿瘤免疫方面新的开拓点。同时对利用过继性免疫疗法治疗癌症具有潜在的指导意义。
| [1] |
Song J A, Liu H A, Li Z A, et al. Ginsenoside Rg3 inhibits colon cancer cell migration by suppressing nuclear factor kappa B activity[J]. J Tradit Chin Med, 2015, 35(4): 440-4. doi:10.1016/S0254-6272(15)30122-9 |
| [2] |
Shan X, Fu YS, Aziz F, et al. Ginsenoside Rg3 inhibits melanoma cell proliferation through down-regulation of histone deacetylase 3 (HDAC3) and increase of p53 acetylation[J]. PLoS One, 2014, 9(12): e115401. doi:10.1371/journal.pone.0115401 |
| [3] |
Son K J, Choi K R, Lee S J, et al. Immunogenic cell death induced by Ginsenoside Rg3:significance in dendritic cell-based anti-tumor immunotherapy[J]. Immune Netw, 2016, 16(1): 75-84. doi:10.4110/in.2016.16.1.75 |
| [4] |
Braicu C, Buse M, Busuioc C, et al. A comprehensive review on MAPK: a promising therapeutic target in cancer[J]. Cancers (Basel), 2019, 11(10): 1618. doi:10.3390/cancers11101618 |
| [5] |
Chen W, Liu L, Luo Y, et al. Cryptotanshinone activates p38/JNK and inhibits Erk1/2 leading to Caspase-independent cell death in tumor cells[J]. Cancer Prev Res (Phila), 2012, 5(5): 778-87. doi:10.1158/1940-6207.CAPR-11-0551 |
| [6] |
Pearce E L, Walsh M C, Cejas P J, et al. Enhancing CD8 T-cell memory by modulating fatty acid metabolism[J]. Nature, 2009, 460(7251): 103-7. doi:10.1038/nature08097 |
| [7] |
Kishton R J, Sukumar M, Restifo N P. Metabolic regulation of T cell longevity and function in tumor immunotherapy[J]. Cell Metab, 2017, 26(1): 94-109. doi:10.1016/j.cmet.2017.06.016 |
| [8] |
Abdelsamed H A, Moustaki A, Fan Y, et al. Human memory CD8 T cell effector potential is epigenetically preserved during in vivo homeostasis[J]. J Exp Med, 2017, 214(6): 1593-606. doi:10.1084/jem.20161760 |
| [9] |
Gattinoni L, Speiser D E, Lichterfeld M, et al. T memory stem cells in health and disease[J]. Nat Med, 2017, 23(1): 18-27. doi:10.1038/nm.4241 |
| [10] |
周芳亮, 胡晶, 蔺婷, 等. PI3K/Akt信号通路在小檗碱联合人参皂苷Rg3诱导鼻咽癌细胞凋亡中的调控作用[J]. 中国药理学通报, 2021, 37(1): 43-52. Zhou F L, Hu J, Lin T, et al. Regulation of PI3K/Akt signaling pathway in the apoptosis of nasopharyngeal carcinoma cells induced by Berberine combined with ginsenoside Rg3[J]. Chin Pharmacol Bull, 2021, 37(1): 43-52. |
| [11] |
Sun M, Ye Y, Xiao L, et al. Anticancer effects of ginsenoside Rg3 (Review)[J]. Int J Mol Med, 2017, 39(3): 507-18. doi:10.3892/ijmm.2017.2857 |
| [12] |
Lee Y, Park A, Park Y J, et al. Ginsenoside 20(R)-Rg3 enhances natural killer cell activity by increasing activating receptor expression through the MAPK/ERK signaling pathway[J]. Int Immunopharmacol, 2022, 107: 108618. doi:10.1016/j.intimp.2022.108618 |
| [13] |
Verma V, Jafarzadeh N, Boi S, et al. MEK inhibition reprograms CD8+ T lymphocytes into memory stem cells with potent antitumor effects[J]. Nat Immunol, 2021, 22(1): 53-66. doi:10.1038/s41590-020-00818-9 |
| [14] |
Fan Y, Li Y, Zhang J, et al. Correction to "Alginate enhances memory properties of antitumor CD8+ T cells by promoting cellular antioxidation"[J]. ACS Biomater Sci Eng, 2020, 6(2): 1288-9. doi:10.1021/acsbiomaterials.0c00002 |
| [15] |
Liu J, Guo K, Hu L, et al. ZAP70 deficiency promotes reverse cholesterol transport through MAPK/ERK pathway in Jurkat cell[J]. Mol Immunol, 2019, 107: 21-8. doi:10.1016/j.molimm.2019.01.001 |
| [16] |
Damasio M P, Marchingo J M, Spinelli L, et al. Extracellular signal-regulated kinase (ERK) pathway control of CD8+ T cell differentiation[J]. Biochem J, 2021, 478(1): 79-98. doi:10.1042/BCJ20200661 |
| [17] |
D'Souza W N, Chang C F, Fischer A M, et al. The Erk2 MAPK regulates CD8 T cell proliferation and survival[J]. J Immunol, 2008, 181(11): 7617-29. doi:10.4049/jimmunol.181.11.7617 |

