


2. 济宁医学院临床医学院,山东 济宁 272000;
3. 济宁医学院附属济宁市第一人民医院,山东 济宁 272000
蒋树龙(1979-),男,主任医师,研究生导师,研究方向:中医药抗肿瘤,通信作者,E-mail:jnsljiang@163.com
 ,
WANG Hao-chen2,
ZHANG Yi-ming3,
ZHANG Jia-qi3,
ZHANG Deng-tian2,
YAN Ting-hao1,3,
ZHAO Jing3
,
WANG Hao-chen2,
ZHANG Yi-ming3,
ZHANG Jia-qi3,
ZHANG Deng-tian2,
YAN Ting-hao1,3,
ZHAO Jing3
 ,
JIANG Shu-long1,3
,
JIANG Shu-long1,3

2. Clinical Medical School, Jining Medical University, Jining Shandong 272000, China;
3. Jining First People's Hospital, Jining Medical University, Jining Shandong 272000, China
原发性肝癌是全球第六大最常见癌症,也是癌症致死的第三大原因[1]。2020年统计数据显示,全球新发肝癌90.6万例,死亡83万例。肝细胞癌(Hepatocellular carcinoma,HCC)是原发性肝癌的主要组织学类型,占发病总数的75 %~85 %[1]。HCC具有侵袭性高、转移性强等特点,预后往往较差,患者5年生存率仅为11.7%~14.1%[2]。因此,寻找更为有效的抗肝癌治疗药物是当前研究的热点之一。
HCC属中医“积聚”“肝积”“臌胀”“胁痛”等病范畴。中医认为,肝癌的根本病因在于脏腑气血亏虚,加之情志失调致肝气机疏泄功能失常,气滞血瘀,饮食不节致脾运失健,湿热内生,邪毒内侵,瘀、湿、热、毒相互搏结日久遂成肝癌,其中虚、瘀、毒因素互为因果,贯穿肝癌全过程[3]。历代医家对于肝癌瘀毒致病的病机特点也多有阐发,明·张景岳《类经》记载:“涩以血滞,故病肝积”。清·高秉钧《疡科心得集》记载:“癌瘤者,非阴阳正气所结肿,乃五脏瘀血浊气痰滞而成”。当代医家辨治肝癌注重扶正的同时,十分重视开郁化瘀、破积消癥之法的运用[4]。
越来越多的证据表明,传统中医药或单体制剂能够有效控制肝癌病情进展,延长生存期,狼毒即是其中代表性药物之一[5]。狼毒的主要来源为瑞香科植物瑞香狼毒或大戟科植物狼毒大戟、月腺大戟的干燥根[6]。中医古籍记载狼毒具有破散癥瘕积聚功效。《名医别录》记载:“主治胁下积癖。”《冯氏锦囊秘录》记载:“狼毒,破积聚痰癖癥瘕”。现代研究显示,狼毒大戟及其主要活性成分对包括肝癌在内的多种恶性肿瘤具有明显的抑制作用[7-8]。然而,狼毒大戟治疗肝癌的相关作用机制尚有待深入解析。网络药理学作为一种系统性的医药研究新模式,能够有效建立药物活性成分与疾病作用靶点之间的内在关联,近年来被广泛应用于中医药研究领域[9-10]。基于此,本研究利用网络药理学方法,探讨狼毒大戟醇提物治疗HCC的分子机制,解析关键作用靶点和信号通路,并通过体内和体外实验进行验证,为今后狼毒大戟醇提物治疗HCC的药效和临床深入研究提供借鉴和参考。
1 方法 1.1 网络药理学分析 1.1.1 狼毒大戟醇提物成分和HCC靶点的筛选狼毒大戟醇提物的活性成分根据参考文献获得[11],并进行ADME筛选。ADME筛选条件如下:(1)TCMSP(http://tcmspe.com/tcmsp.php)数据库中满足OB值≥30%,DL值≥0.18%。(2)Swiss Target ADME(http://www.swissadme.ch/index.php)数据库中满足High GI absorption以及两个以上的Druglikeness条件(Lipinski、Ghose、Veber、Egan和Muegge)。筛选后的活性成分通过Swiss Target Prediction(http://www.swisstargetprediction.ch)数据库中获取药物活性成分相关作用靶点。
通过GeneCards(https://www.genecards.org)和DisGeNET(http://www.disgenet.org/home)数据库筛选HCC疾病靶点,搜索关键词为“HCC”和“Hepatocellular carcinoma”。
1.1.2 药物-疾病共同靶点的获得将狼毒大戟醇提物的药物作用靶点和HCC疾病靶点输入Venny 2.1网站,输出Venny图,获得狼毒大戟醇提物的HCC作用靶点。
1.1.3 PPI网络构建将共同靶点上传至STRING 11.5数据库(http://string-db.org),筛选物种为“Homo Sapiens”,利用Cytoscape3.9.1软件进行PPI可视化分析。
1.1.4 GO和KEGG富集分析将共同靶点导入DAVID(https://david.ncifcrf.gov/home.jsp)数据库进行狼毒大戟醇提物抗HCC作用靶点的基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析(P < 0.05)。
1.1.5 分子对接利用Protein Data Bank数据库(http://www.rcsb.org),根据度值确定前3个核心靶点蛋白的相关分子结构。利用PubChem数据库(https://pubchem.ncbi.nlm.nih.gov),检索主要活性成分的化学结构并上传到AutoDockTools。使用PyMol软件来对蛋白质进行必要的调整,包括去除配体和水分子并调整蛋白质结构。利用AutoDockTools软件进行分子对接,并对对接结果进一步分析。
1.2 实验验证 1.2.1 细胞系和动物人肝癌BEL-7402细胞和小鼠肝癌H22细胞,购自南京科佰生物科技有限公司。5-6周龄Balb/C小鼠,体质量(20±5)g,购于济南朋悦实验动物繁育有限公司(许可证号:SCXK(鲁)20190003),动物实验获得济宁医学院实验动物伦理委员会批准,伦理批号2018-RM-014。
1.2.2 药物提取取干燥的狼毒大戟根部约2 kg加入到提取罐中,加无水乙醇8 L回流提取2次,第1次4 h,第2次2 h,合并提取液,旋转蒸发仪60 ℃回收乙醇,所得浸膏烘箱70 ℃烘干,灭菌双蒸水溶解备用。
1.2.3 细胞活力测定将处于对数生长期的BEL-7402细胞,以每孔3×104个细胞的密度接种于96孔板,根据前期预实验结果,分别给与0、2、4、6、8 g·L-1狼毒大戟醇提物干预细胞24 h、48 h,CCK-8法进行细胞活力检测。
1.2.4 EdU-488细胞增殖检测将肝癌细胞BEL-7402接种于6孔板(1×109个·L-1),待细胞贴壁后,给与含狼毒大戟醇提物0、1、5、10 g·L-1培养基孵育24 h,利用EdU法检测细胞增殖,正置荧光显微镜下观察拍照。
1.2.5 Annexin V/7-AAD凋亡测定不同浓度的狼毒大戟醇提物(0、1、5、10 g·L-1)处理BEL-7402细胞24 h后,进行Annexin V和7-AAD荧光双染,利用流式细胞仪检测分析细胞凋亡情况。
1.2.6 蛋白免疫印迹法细胞干预方法同“1.2.3”。24 h后提取总蛋白,BCA法检测蛋白浓度,将等量蛋白上样SDS-PAGE (10%)电泳,PVDF膜电转。5%脱脂奶粉封闭PVDF膜1 h后加入相应的一抗4 ℃孵育过夜。次日TBST洗膜后室温二抗孵育1 h,洗膜后使用ECL成像系统检测蛋白表达。
1.2.7 动物模型制备与给药浓度为5×106个·mL-1的H22肝癌细胞悬液无菌条件下皮下接种到Balb/c小鼠右侧腋下,每只0.2 mL。待小鼠皮下肉眼可见黄豆粒大小肿块时,随机分为4组:模型组(生理盐水200 μL·d-1, 灌胃)、索拉非尼组(20 mg·kg-1·d-1, 灌胃)、狼毒大戟醇提物组(0.2 g·kg-1·d-1, 灌胃)和联合干预组(索拉非尼20 mg·kg-1·d-1 +狼毒大戟醇提物0.2 g·kg-1·d-1, 灌胃)。给药14 d后,脱颈处死小鼠。剥取肿瘤组织拍照,并计算肿瘤体积(体积公式为V=(长*宽2)/2), 4%多聚甲醛固定备用。
1.2.7.1 免疫组化染色将4%多聚甲醛固定后的瘤组织石蜡包埋,切片后梯度酒精脱蜡。微波炉内进行高压抗原修复。经内源性酶灭活,5% BSA封闭,一抗4 ℃孵育过夜,PBS清洗后,聚合HRP标记抗山羊IgG二抗37 ℃孵育30 min,清洗后进行DAB显色、苏木精复染,蒸馏水充分冲洗、梯度酒精脱水、透明后中性树胶封片,正置显微镜下观察拍照。
1.2.7.2 HE染色石蜡切片常规梯度酒精脱蜡后,苏木精染色3 min。自来水清洗后,将石蜡切片浸入返蓝液中返蓝60 s左右。返蓝完成后,浸泡至95%酒精30 s后滴加伊红染色液,染色30 s左右。充分清洗后进行常规酒精梯度脱水,透明后中性树胶封片。
1.2.8 统计学方法使用GraphPad Prism 8软件进行统计学分析,两组间数据比较采用Student’s test检验。
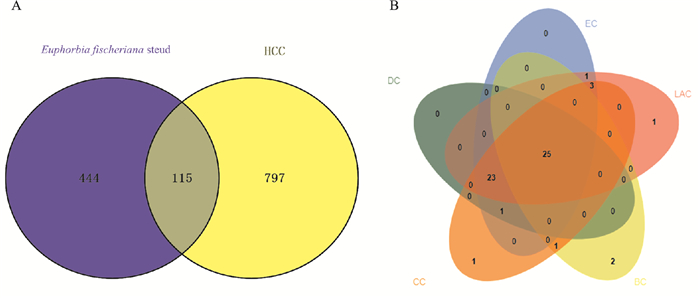
2 结果 2.1 药物-疾病靶点的筛选根据参考文献共获得狼毒大戟醇提物活性成分33个,经ADME筛选得到30种活性成分,见Tab 1。通过Swiss Target Prediction数据库筛选,获得30种活性成分相对应的靶点567个。运用GeneCards和DisGeNET数据库,共获得HCC疾病靶点912个。利用Venny平台绘制韦恩图,得到药物-疾病共同靶点115个,见Fig 1A。
| No | Active ingredients |
| 1 | 11-oxo-ebracteolatanolide B |
| 2 | Jolkinolide A |
| 3 | 17-hydroxyjolkinolide B |
| 4 | Jolkinolide B |
| 5 | Methyl-8, 11-3-dihydroxy-12-oxo-ent-abietadi-13, 15(17)-ene-16-oate |
| 6 | Abieta-8, 11, 13-triene |
| 7 | 15-hydroxydehydroabietic acid |
| 8 | (4αS, 10αS)-1, 2, 3, 4, 4α, 10α-hexahydro-1, 1, 4α-trimethyl-7-(1-methyl) phenanthrene |
| 9 | Isopimara-7, 15-dien-3-one |
| 10 | 2-phenanthrenyl]ethanone |
| 11 | (4βS, 8αS)- 2-phenanthrenecarboxylic acid, 4β, 5, 6, 7, 8, 8α, 9, 10-Octahydro-3-hydroxy-4β, 8, 8-trimethyl-methyl ester |
| 12 | Isopimara-7, 15-dien-3-one |
| 13 | Araucarol |
| 14 | Araucarone |
| 15 | Ent-3β, (13S)-dihydroxyatis-16-en-14-one |
| 16 | Ent-atis-16-ene-3, 14-dione |
| 17 | Ent-(13R, 14R)-13, 14-dihydroxyatis-16-en-3-one |
| 18 | Ent-(13S)-13-hydro xyatis-16-ene-3, 14-dione |
| 19 | 3-oxoatisane-16α, 17-diol |
| 20 | 3α-hydroxy-ent-16-kauren |
| 21 | Ent-kaurane-3β, 16β, 17-trio1 |
| 22 | Ent-16β-H-3-ox okauran-17-ol |
| 23 | Euphonoid A |
| 24 | Euphonoid B |
| 25 | Euphonoid C |
| 26 | Euphonoid D |
| 27 | Euphonoid E |
| 28 | Euphonoid G |
| 29 | Euphonoid F |
| 30 | Fischeriabietane A |
|
| Fig 1 (A) Venn analysis of intersection targets between alcohol extracts of Euphorbia fischeriana steud and HCC; (B) Venn diagram of hub genes |
通过STRING数据库分析获得PPI网络,共有115个节点、1374条边组成。将PPI网络中DC、BC、CC、EC、LAC高于相应平均值的节点视为关键目标,共得到25个核心靶点蛋白,分别为TP53、TNF、STAT3、HIF1A、JUN、EGFR、MAPK3、SRC、ESR1、MTOR、PPARG、BCL2L1、MAPK1、MMP9、PTGS2、CXCL8、MDM2、MAPK14、AR、CREBBP、PPARA、NR3C1、HNF4A、CDK1、PTPN1, 见Fig 1B。提示狼毒大戟醇提物通过多靶点抑制HCC进展。
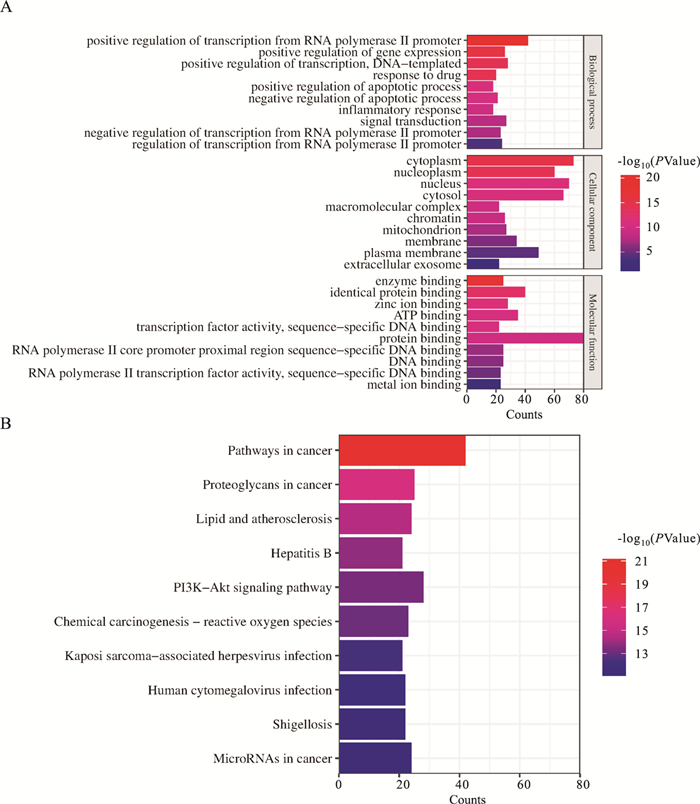
2.3 Go和KEGG分析GO分析结果见Fig 2A,狼毒大戟醇提物治疗HCC生物过程主要涉及蛋白结合,RNA聚合酶II启动子转录的阳性调控、转录的正调控等。KEGG分析结果见Fig 2B,共同靶点富集显著性最高的通路为癌症相关通路,富集了42个相关基因。根据进一步的富集结果结合筛选得到的核心靶点蛋白,我们选择JAK2/STAT3癌症相关通路进行后续研究。
|
| Fig 2 (A)GO enrichment analysis of targets; (B) KEGG enrichment analysis of targets |
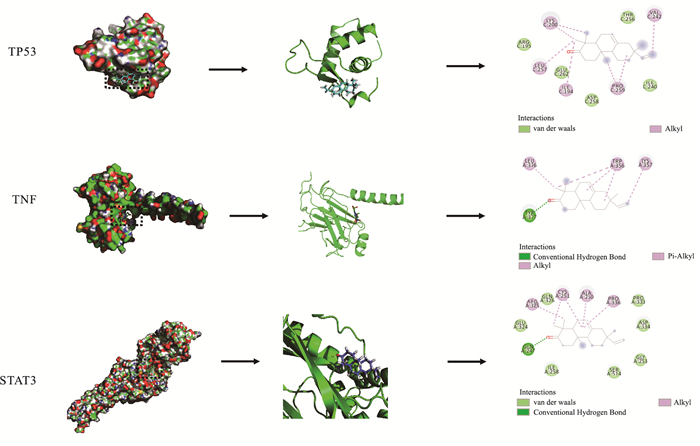
根据度值我们选择将Isopimara-7, 15-dien-3-one与核心靶点蛋白进行分子对接。为了评估网络药理学预测结果的准确性,我们使用AutoDockTools软件评估主要生物活性成分与治疗靶点之间的结合活性。结合能越低表示结合效力越强。根据文献研究,结合能小于-5代表结合力显著。我们的研究发现,TP53、TNF和STAT3的结合能分别为-6.69、-6.91和-7.93,说明主要成分与关键靶点分子结合作用显著。分子对接的结果见Fig 3。
|
| Fig 3 Results of molecular docking |
CCK-8结果显示,与对照组相比,随着狼毒大戟醇提物浓度的上升,BEL-7402细胞生存率逐渐降低,其抑制效应呈现浓度依赖和时间依赖性,具体见Tab 2。狼毒大戟醇提物24 h和48 h的IC50值分别为5.444 g·L-1和4.210 g·L-1。
| Group | Concentration g·L-1 |
Cell survival rate/% | |
| 24 h | 48 h | ||
| Control group | 100.00±2.53 | 101.52±3.25 | |
| Euphorbia fischeriana steud alcohol extracts | 2 | 89.50±1.53 | 80.98±2.97 |
| 4 | 76.02±1.33 | 52.09±2.90 | |
| 6 | 43.60±2.38 | 33.79±2.08 | |
| 8 | 43.30±2.45 | 22.71±0.86 | |
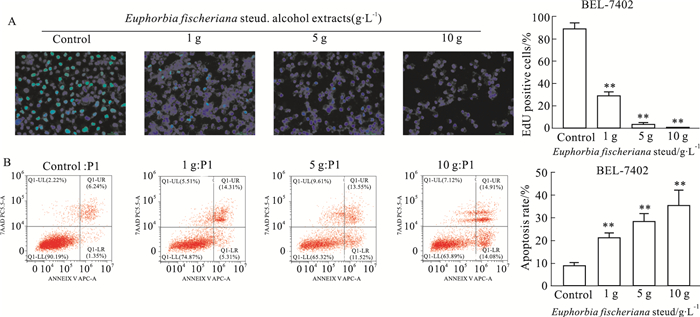
EdU-488实验结果显示,与对照组细胞相比,狼毒大戟醇提物处理的EdU阳性细胞数明显减少,且呈浓度依赖性(P均 < 0.01),见Fig 4A。此外,Annexin V/7-AAD检测显示,狼毒大戟醇提物呈浓度依赖性增加BEL-7402细胞凋亡比例(P均 < 0.01),见Fig 4B。
|
| Fig 4 (A) Effects of Euphorbia fischeriana steud alcohol extracts on proliferation of BEL-7402 cells by EdU assay; (B)Effects of Euphorbia fischeriana steud alcohol extracts on apoptosis of BEL-7402 cells by Annexin V/7-AAD Scale bar: 20 μm; **P < 0.01 vs control. |
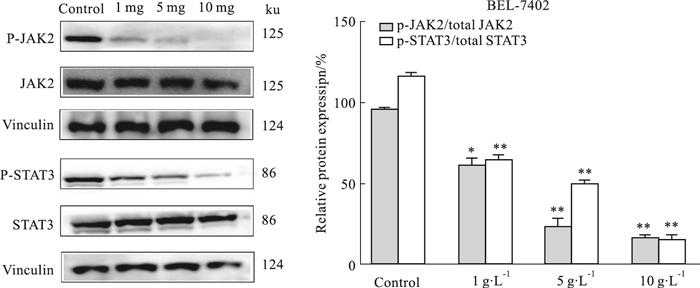
与对照组相比,狼毒大戟醇提物显著下调p-JAK2和p-STAT3的表达水平,抑制效应呈浓度依赖性(P均 < 0.05),见Fig 5,差异具有统计学意义。提示狼毒大戟醇提物通过调控JAK2/STAT3信号通路发挥抑癌作用。
|
| Fig 5 Alcohol extracts of Euphorbia fischeriana steud on expressions of p-JAK2 and p-STAT3 in BEL-7402 cells *P < 0.05, **P < 0.01 vs control |
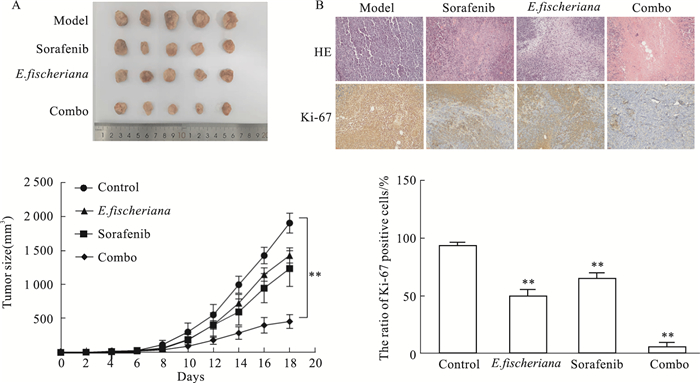
结果显示,与模型组相比,狼毒大戟醇提物干预组小鼠肿瘤体积明显缩小,联合索拉非尼干预后,抑瘤效果更加明显(P均 < 0.01),见Fig 6A。HE染色见模型组肿瘤细胞排列不规则, 呈多层排列,出现大小不等的腺样结构。而各干预组可见不同程度的肿瘤组织坏死, 瘤细胞分布不均,偶见炎细胞浸润。此外,狼毒大戟醇提物可以抑制肝癌细胞增殖指标Ki-67的表达,与索拉非尼联用后效果更加明显(P均 < 0.01),见Fig 6B。
|
| Fig 6 In vivo results of Euphorbia fischeriana steud alcohol extracts Scale bar: 100μm, **P < 0.01 vs control |
中医药在预防HCC术后复发、改善预后、提高生存率等方面具有一定优势[12-13]。既往研究表明,狼毒大戟具有良好的的抗肿瘤活性,特别是二萜类化学成分,能够有效抑制肝癌、乳腺癌、黑色素瘤细胞增殖[14-15]。为进一步明确狼毒大戟对HCC抑癌作用的主要活性成分和相关分子机制, 本研究通过网络药理学以及体外和体内实验对狼毒大戟醇提物治疗HCC的药理学机制进行探索。
本研究通过ADME条件筛选共得到狼毒大戟活性成分30个,其中多种主要成分的抗癌活性此前已有相关文献报道,如Jolkinolide A、Jolkinolide B、Fischeriabietane A以及17-hydroxyjolkinolide B等可通过多种机制在多种恶性肿瘤中发挥抗癌作用[15]。通过PPI网络拓扑分析获得TP53、TNF、STAT3、HIF1A、JUN、EGFR等25个核心靶点,且分子对接结果显示主要成分与TP53,TNF以及STAT3能较稳定的结合,这些核心靶点涉及肿瘤细胞增殖、凋亡、缺氧微环境、上皮间质转化、细胞周期调控等多个生物学过程,提示狼毒大戟醇提物可通过等多靶点、多途径调节发挥治疗作用。
KEGG分析显示富集程度最高的通路为癌症相关通路,而JAK2/STAT3为富集最为完整的一条重要癌症相关通路,STAT3也是狼毒大戟醇提物的核心作用靶点,说明JAK2/STAT3信号通路与狼毒大戟醇提物作用机制密切相关。JAK2是非受体型酪氨酸激酶JAK家族一员,可磷酸化STAT3形成同源或异源二聚体入核发挥转录活性,是STAT3最重要的上游信号因子,而STAT3的过度激活是多种实体瘤的重要特征之一[16]。研究发现,JAK2/STAT3信号通路与肿瘤细胞增殖、干细胞分化、诱导血管生成等多种恶性生物学行为密切相关[17-18],提示JAK2/STAT3信号通路可以作为癌症治疗药物研究的重要作用靶标。因此,本研究选取JAK2/STAT3信号通路通过体内和体外实验进行进一步分析验证狼毒大戟醇提物治疗肝癌的分子机制。
体外实验中,我们通过CCK-8,EdU,流式细胞术等方法验证后发现,狼毒大戟醇提物能够明显减弱肝癌细胞BEL-7402的活性,抑制BEL-7402增殖,并促进凋亡。此外,我们通过Western blot实验评估了狼毒大戟醇提物对JAK2/STAT3信号通路的影响,结果发现狼毒大戟醇提物能够通过浓度依赖性下调p-JAK2和p-STAT3表达,表明抑制JAK2/STAT3信号通路活性是狼毒大戟醇提物发挥抗癌作用的重要机制之一。应用H22肝癌细胞移植瘤小鼠模型研究显示,经过狼毒大戟醇提物治疗后,小鼠瘤体体积显著缩小,联合索拉非尼共同干预后,抑瘤效果更加明显。以上结果提示狼毒大戟醇提物能够有效抑制肝肿瘤的生长,且对索拉非尼具有增敏作用。
综上所述,本研究应用网络药理学和实验验证解析了狼毒大戟醇提物治疗HCC的相关分子作用机制,阐明狼毒大戟醇提物抗肝癌作用具有多成分、多靶点、多途径的特点,抑制JAK2/STAT3信号通路活性是狼毒大戟醇提物发挥抗肝癌治疗作用的重要机制。本研究丰富了狼毒大戟抗癌作用的现代科学内涵,也为今后狼毒大戟醇提物抗肝癌机制的深入研究提供了新的基础和依据。
| [1] |
Sung H, Ferlay J, Siegel R L, et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49. doi:10.3322/caac.21660 |
| [2] |
Park J W, Chen M, Colombo M, et al. Global patterns of hepatocellular carcinoma management from diagnosis to death: the bridge study[J]. Liver Int, 2015, 35(9): 2155-66. doi:10.1111/liv.12818 |
| [3] |
蒋益兰, 潘敏求, 黄钢. 原发性肝癌中西医结合诊疗专家共识[J]. 中医药导报, 2021, 27(9): 101-7. Jiang Y L, Pan M Q, Huang G. Consensus on diagnosis and treatment of primary liver cancer with integrated traditional chinese and western medicine[J]. Guid J Tradit Chin Med Pharm, 2021, 27(9): 101-7. |
| [4] |
林小林, 唐林, 陈宝贵. 原发性肝癌的中医药治疗研究进展[J]. 江西中医药, 2021, 52(6): 77-80. Lin X L, Tang L, Chen B G. Research progress of traditional Chinese medicine treatment of primary liver cancer[J]. Guid J Tradit Chin Med Pharm, 2021, 52(6): 77-80. |
| [5] |
杨德全, 付正丰, 杨勤. 狼毒二鳖消积汤治疗原发性肝癌25例[J]. 实用中医药杂志, 2018, 34(8): 927. Yang D Q, Fu Z F, Yang Q. Langdu erbixiaoji decoction for treating 25 cases of primary liver cancer[J]. J Pract Trad Chin Med, 2018, 34(8): 927. |
| [6] |
Li D W, Deng X P, He X, et al. Eupholides A-H, abietane diterpenoids from the roots of Euphorbia fischeriana, and their bioactivities[J]. Phytochemistry, 2021, 183: 112593. doi:10.1016/j.phytochem.2020.112593 |
| [7] |
Wang H, Chen X, Li T, et al. A myrsinol diterpene isolated from a traditional herbal medicine, LANGDU reverses multidrug resistance in breast cancer cells[J]. J Ethnopharmacol, 2016, 194: 1-5. doi:10.1016/j.jep.2016.08.041 |
| [8] |
何华红, 刘肃, 李薇, 等. 月腺大戟及狼毒大戟体外抗肿瘤药理活性对比研究[J]. 中药材, 2011, 34(6): 950-2. He H H, Liu S, Li W, et al. A comparative study on antitumor pharmacological activity of Euphorbia lunata and Euphorbia lunata in vitro[J]. Chin Med Mater, 2011, 34(6): 950-2. |
| [9] |
杨辉, 王文君, 徐泽荣, 等. 基于网络药理学和分子对接研究紫藤瘤对胃癌的作用机制及初步验证[J]. 中国药理学通报, 2022, 38(11): 1739-47. Yang H, Wang W J, Xu Z R, et al. Study on anti-gastric cancer mechanism of Wisteria sinensis tumor based on network pharmacologymolecular docking technology and experimental verification[J]. Chin Pharmacolo Bull, 2022, 38(11): 1739-47. |
| [10] |
陈苹苹, 潘永梅, 李梦, 等. 雷公藤治疗乳腺癌主要活性成分筛选及分子机制探讨[J]. 中国药理学通报, 2022, 28(10): 1565-72. Chen P P, Pan Y M, Li M, et al. Mechanism and main active ingredients of Radix Et Rhizoma Tripterygii Wilfordii for breast cancer[J]. Chin Pharmacolo Bull, 2022, 28(10): 1565-72. |
| [11] |
Yan X L, Zhang J S, Huang J L, et al. Euphonoids A-G, cytotoxic diterpenoids from Euphorbia fischeriana[J]. Phytochemistry, 2019, 166: 112064. |
| [12] |
Li Y, Li Y, Zhang J, et al. Current perspective of traditional Chinese medicines and active ingredients in the therapy of hepatocellular carcinoma[J]. J Hepatocell Carcinoma, 2022, 9: 41-56. |
| [13] |
Li Y, Zhang J, Zhang K, et al. Scutellaria barbata inhibits hepatocellular carcinoma tumorigenicity by inducing ferroptosis of hepatocellular carcinoma cells[J]. Front Oncol, 2022, 12: 693395. |
| [14] |
夏青, 徐柯心, 张文婷, 等. 中药狼毒化学成分与药理作用概述[J]. 环球中医药, 2017, 10(8): 1027-32. Xia Q, Xu K X, Zhang W T, et al. Overview on chemical compounds and pharmacological effects of radix euphorbiae lantu[J]. Global Tradit Chin Med, 2017, 10(8): 1027-32. |
| [15] |
王晓阳, 康廷国, 孟宪生. 狼毒大戟萜类化学成分及抗肿瘤活性研究进展[J]. 中华中医药学刊, 2021, 39(8): 30-5. Wang X Y, Kang T G, Meng X S. Research progress on terpenoids of Langdu Daji (Euphorbia fischeriana) and antitumor activity[J]. Chin Arch Tradit Chin Med, 2021, 39(8): 30-5. |
| [16] |
Shawky A M, Almalki F A, Abdalla A N, et al. A comprehensive overview of globally approved JAK inhibitors[J]. Pharmaceutics, 2022, 14(5): 1001. |
| [17] |
Owen K L, Brockwell N K, Parker B S. JAK-STAT signaling: A double-edged sword of immune regulation and cancer progression[J]. Cancers (Basel), 2019, 11(12): 2002. |
| [18] |
Zhuang M, Ding X, Song W, et al. Correlation of IL-6 and JAK2/STAT3 signaling pathway with prognosis of nasopharyngeal carcinoma patients[J]. Aging (Albany NY), 2021, 13(12): 16667-83. |