


2. 山东中医药大学实验中心;
3. 中医药经典理论教育部重点实验室;
4. 中医药基础研究山东省重点实验室;
5. 山东省中医药抗病毒工程研究中心,山东 济南 250355
容蓉(1970-),女,博士,教授,博士生导师,研究方向:中药及复方活性成分与质量控制,通信作者,E-mail:rosierong@163.com
 ,
ZHAO Liang-xin1,
LIU Yan-liang1,
SUN Qi-hui1,5,
LIU Xiao-yun2,3,4,5,
YE Dong-xue2,3,4,5,
YANG Yong2,3,4,5
,
ZHAO Liang-xin1,
LIU Yan-liang1,
SUN Qi-hui1,5,
LIU Xiao-yun2,3,4,5,
YE Dong-xue2,3,4,5,
YANG Yong2,3,4,5
 ,
RONG Rong1,2
,
RONG Rong1,2

2. Experimental Center, Shandong University of Traditional Chinese Medicine;
3. Key Laboratory of Traditional Chinese Medicine Classical Theory, Ministry of Education;
4. Shandong Provincial Key Laboratory of Traditional Chinese Medicine for Basic Research;
5. Shandong Antiviral Engineering Research Center of Traditional Chinese Medicine, Jinan 250355, China
流感病毒是一种具有高度传染性的病原体,属于正黏病毒科,分为A、B、C和D型。其中,A型流感具有潜伏期相对较短、突然爆发、扩散迅速等特点,感染后主要表现为咳嗽、咽喉肿痛、肌肉酸痛、头痛、畏寒发热、乏力等症状,严重时会引起中耳炎,鼻窦炎、支气管炎、肺炎等并发症,甚至威胁生命[1]。目前,临床治疗流感的抗病毒药物主要包括神经氨酸酶抑制剂、血凝素抑制剂、M2离子通道阻滞剂等。磷酸奥司他韦(达菲)是目前临床上治疗A型流感的主要药物,它通过作用于神经氨酸酶(NA)抑制病毒从宿主细胞的释放而表现出较强的抗病毒作用。流感病毒感染宿主有4~5 d的潜伏期[2-3],临床上患者大都是出现流行性感冒症状后开始用药。然而,目前采用的抗流感药效评价体内实验研究,药物干预通常选择感染流感病毒后当日[4-5]或次日[6-7],干预的时间点均偏早,与真实世界感染患者的药物使用时间节点不符。在没有出现临床症状时就进行了药物干预,会影响受试药物实际疗效的判断,其给药时间的合理性有待商榷。因此,本研究以达菲作为工具药,研究A型H1N1/PR8流感病毒感染小鼠后d 1(常规给药时间点)、d 4(体质量开始下降时)分别给药干预,比较不同时序的药效差异和对机体炎症因子影响,探讨跨过病毒感染潜伏期待宿主出现症状后再给药干预的合理性,为抗病毒药物基础研究中选择合理的模型干预时间点提供依据和参考。
1 材料与方法 1.1 药品与试剂动物组织总RNA提取试剂盒、FastKing cDNA第一链合成试剂盒、SuperReal荧光定量预混试剂(天根公司);多因子试剂盒(Mouse Inflammation Panel with Filter Plate,美国Biolegend);DNA引物(生工生物工程(上海)股份有限公司);A型流感病毒H1N1/PR8株,保存于山东中医药大学抗病毒协同创新中心,在9日龄SPF鸡胚中扩增得到尿囊液,测定血凝效价为1 ∶320,CPE法检测的病毒滴度为1×109 TCID50·L-1,使用前用生理盐水稀释至相应浓度;达菲(上海罗氏制药有限公司,批号:M1050)。
1.2 仪器超微量分光光度计(赛默飞世尔科技有限公司,型号:NanoDrop One),荧光定量PCR仪(美国伯乐公司,型号:CFX Connect),呼吸麻醉机(深圳瑞沃德生命科技有限公司,型号:R583S),流式细胞仪(美国BD公司,型号:Accri C6)。
1.3 动物SPF级雄性Balb/c小鼠36只(北京维通利华实验动物技术有限公司,生产许可证号为SCXK(京)2021-0006),体质量均为(19.0±1.0)g,6-7周龄,适应性喂养3 d后随机分组,体质量基线数据见Tab 1。所有小鼠均在抗病毒协同创新中心SYXK(鲁)2017-0022、温度(20~25)℃、相对湿度40%~70%、每12 h昼夜交替的环境下饲养,并自由饮水、进食。普通饲料(济南朋悦实验动物繁育有限公司,生产许可证:SCXK(鲁)2018-0003)。本实验所有操作均符合动物实验伦理要求。
| Weight/g | Control-1 | Model-1 | Tamiflu-1 | Control-2 | Model-2 | Tamiflu-2 |
| Day 0 | 20.5±0.6 | 20.4±0.9 | 20.3±0.8 | 20.7±0.8 | 20.6±1.0 | 20.6±1.0 |
| Day 8 | 21.4±0.9 | 19.7±1.0*# | 20.3±1.4# | 21.8±0.9 | 19.0±1.1*# | 19.7±1.8*# |
| *P < 0.05 vs Control-1. #P < 0.05 vs Control-2,n=6. | ||||||
将小鼠按体重随机分成6组,分别为空白对照-1组、模型-1组、达菲-1组、空白对照-2组、模型-2组、达菲-2组,每组6只。模型组和达菲组小鼠在d 0滴鼻A型流感病毒H1N1/PR8(0.25 TCID50,20 μL·只-1),建立流感病毒感染模型,空白对照组滴鼻等量的生理盐水。
1.4.1.1 方案1(染毒后d 1给药)达菲-1组在感染流感病毒后d 1灌胃给药(达菲,19.5 mg·kg-1),1次/天,连续7 d,空白对照-1组、模型-1组灌胃等量的生理盐水。
1.4.1.2 方案2(染毒后d 4给药)达菲-2组在感染流感病毒后d 4灌胃给药(达菲,19.5 mg·kg-1),1次/天,连续7 d,空白对照-2组、模型-2组灌胃等量的生理盐水。
期间测量小鼠的体质量和生存率,末次给药24 h后摘眼球取抗肝素钠凝血待用;脱颈椎处死小鼠,解剖取肺、脾、胸腺组织,计算脏器指数(脏器鲜重/小鼠体质量×100%)(Fig 1)。

|
| Fig 1 Flow chart of Tamiflu intervention on influenza infection in different time sequences |
15~20 mg肺组织加入300 μL RL裂解液,研成匀浆,按照动物组织总RNA提取试剂盒方法操作,测定所提总RNA浓度,反转录得到cDNA。建立20 μL的RT-qPCR反应体系,放入荧光定量PCR仪中扩增,反应程序为:95 ℃预变性15 min;95 ℃变性10 s,40个循环;66 ℃退火/延伸32 s,40个循环。实验后记录Ct值并分析溶解曲线、扩增曲线,通过计算2-ΔΔCt比较流感病毒M基因的相对表达量,流感病毒M基因引物序列F:5′-CTTCTAACCGAGGTCGAAAC-3′,R:5′-CGTCTACGCTGCAGTCCTC-3′,产物长度227 bp。内参基因PPIA引物序列F:5′-CGCTTGCTGCAGCCATGGTC-3′,R:5′-CAGCTCG AAGGAGACGCGGC-3′,产物长度86 bp。
1.4.3 流式多因子技术检测炎症因子的含量将小鼠抗凝血以4 000 r·min-1离心10 min,收集血浆用于后续实验。根据小鼠炎症因子试剂盒(Mouse Inflammation Panel with Filter Plate,Biolegend)所示步骤,在EP管中分别加入25 μL含有捕获抗体的微球粒子,25 μL的反应缓冲液,25 μL的样品(样品管),25 μL的标准品(标准品管),构建75 μL的反应体系,室温避光震荡孵育2 h,Assay Buffer清洗重悬。同法孵育检测抗体1 h,PE染料30 min,清洗重悬后上机检测。通过Biolegend官网在线数据分析获取样本炎症因子含量。
1.4.4 数据处理各样本数据均以x±s表示,数据使用GraphPad Prism 9.0软件进行分析制图。用SPSS 26.0软件进行单因素方差分析及LSD组间比较。
2 结果 2.1 不同时间点药物干预对流感病毒感染小鼠一般状况的影响空白对照组小鼠反应灵敏,毛发光滑有光泽,饮食、饮水、排便正常,粪便呈麦粒状,体质量呈持续上升;在d 4模型组小鼠体质量开始下降,在d 8,方案1小鼠全部处死,方案1小鼠和方案2小鼠饮食饮水量均下降,活动减少、精神倦怠,毛色暗淡无光泽。模型-2组小鼠死亡1只,存活率为83.33%。与空白对照-1组相比,模型-1组、模型-2组、达菲-2组体重降低,差异有显著性(P < 0.05);与空白对照-2组相比,模型-1组、模型-2组、达菲-1组、达菲-2组体质量降低差异具有显著性(P < 0.05);模型-1组和模型-2小鼠的体质量相比无明显差异。达菲2组干预小鼠在d 8体质量开始回升。实验结束模型-2组小鼠生存率为66.67%。
胸腺指数结果显示,模型-2组小鼠胸腺指数极明显下降(P < 0.05),模型1组变化不明显,与模型-2组相比,达菲-2组小鼠胸腺指数极明显升高(P < 0.05);各染毒组与相应的空白对照组比较,肺指数差异均有显著性(P < 0.05),且模型-2组肺指数为模型-1组168.76%。各达菲组与相应的染毒组相比较,肺指数差异均有显著性(P < 0.05);与空白对照-1组相比,模型-1组脾指数明显上升(P < 0.05)(Fig 2)。
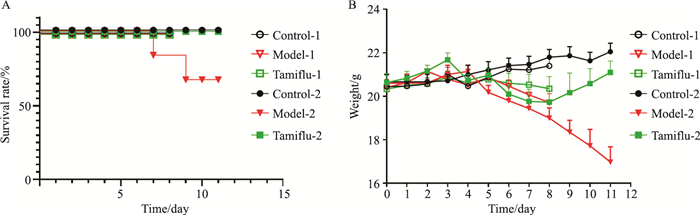
|
| Fig 2 Changes in survival rate and body mass of mice after exposure |
M基因相对表达量结果显示,感染等量病毒后,模型-2组病毒载量为模型-1组的15.15倍,达菲-1组的病毒载量为模型-1组的0.54倍;达菲-2组的病毒载量为模型-2组的0.03倍,提示随着染毒时间的延长,小鼠整体抗病毒能力下降,病毒复制的相对表达量增多,达菲-2组干预可以起到较好的抗病毒作用(Fig 4)。
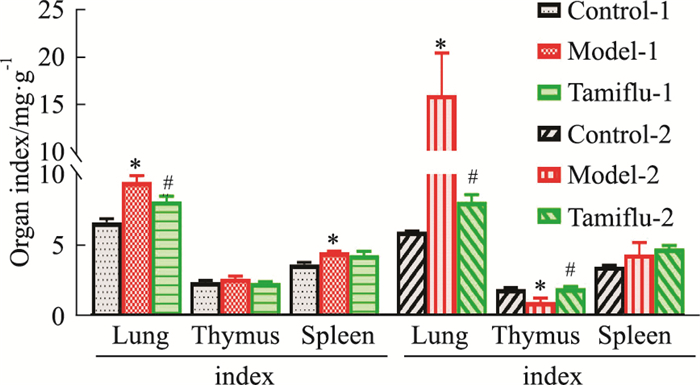
|
| Fig 3 Changes of organ index of mice after exposure(n≥4) *P < 0.05 vs Control group; #P < 0.05 vs Model group. |
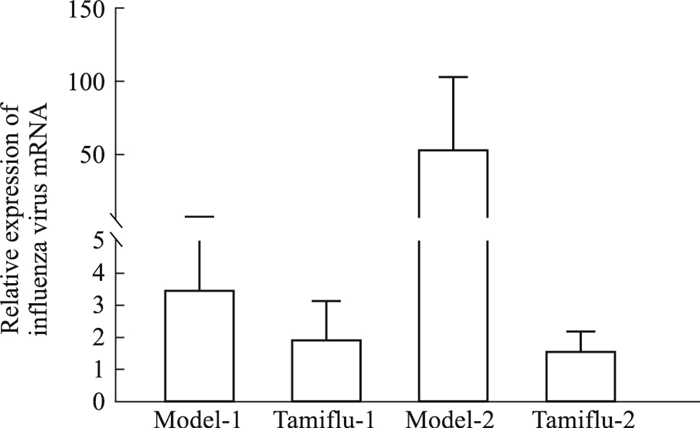
|
| Fig 4 Comparison of relative expression of influenza virus M gene in lung tissue of mice after exposure |
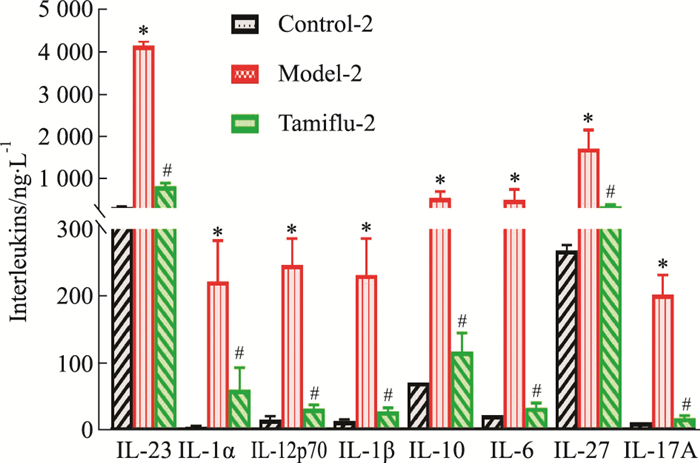
实验结果显示,末次给药24 h后,模型-2组小鼠血浆白介素类因子含量明显增加,与空白对照-2组小鼠比较,差异有显著性(P < 0.05);模型-1组上述因子含量相比增加略少,仅IL-23与空白对照-1组小鼠差异有显著性(P < 0.05);与模型-2组小鼠相比,达菲-2组白介素类因子含量均明显降低(P < 0.05)(Fig 6)。本研究显示,病毒感染能升高小鼠体内白介素类因子的分泌水平,达菲-2组干预后白介素类因子的分泌水平明显降低。
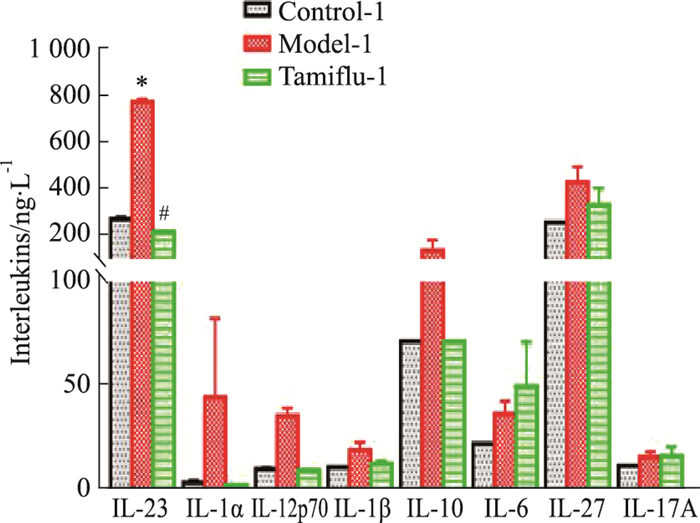
|
| Fig 5 Changes of interleukins in administration scheme of mice on 1st day after exposure(n≥4) *P < 0.05 vs Control-1 group; #P < 0.05 vs Model-1 group. |
|
| Fig 6 Changes of interleukins in administration scheme of mice on 4th day after exposure(n≥4) *P < 0.05 vs Control-4 group; #P < 0.05 vs Model-4 group. |
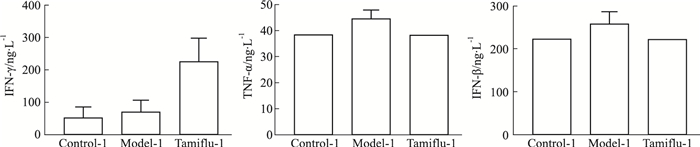
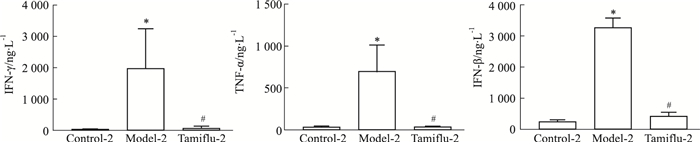
与部分白介素类因子分泌情况类似,模型2组小鼠体内IFN-γ、TNF-α、IFN-β含量急剧上升,明显高于空白对照-2组(P < 0.05),模型1组小鼠体内干扰素含量变化相对较小,染毒前后无差异,与模型-2组相比达菲-2组IFN-γ、TNF-α、IFN-β水平有明显下降(P < 0.05)(Fig 7,8)。
|
| Fig 7 Changes of Interferon in the administration scheme of mice on the first day after exposure |
|
| Fig 8 Changes of interferon in administration scheme of mice on 4th day after exposure(n≥4) *P < 0.05 vs Control-4 group; #P < 0.05 vs Model-4 group. |
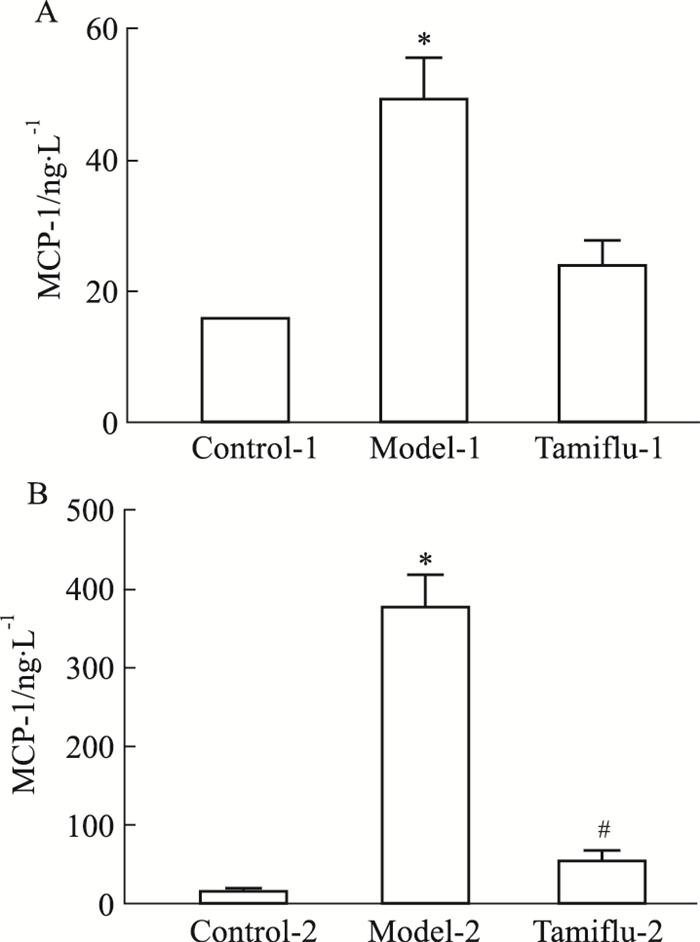
病毒感染对小鼠体内MCP-1分泌水平影响较大,模型1组小鼠与模型2组相比,均表现出较高的MCP-1含量(Fig 9)。
|
| Fig 9 Changes of MCP-1 in mice after exposure(n≥4) A: Administration plan on 1st day; B: Administration plan on 4th day. *P < 0.05 vs Control group; #P < 0.05 vs Model group. |
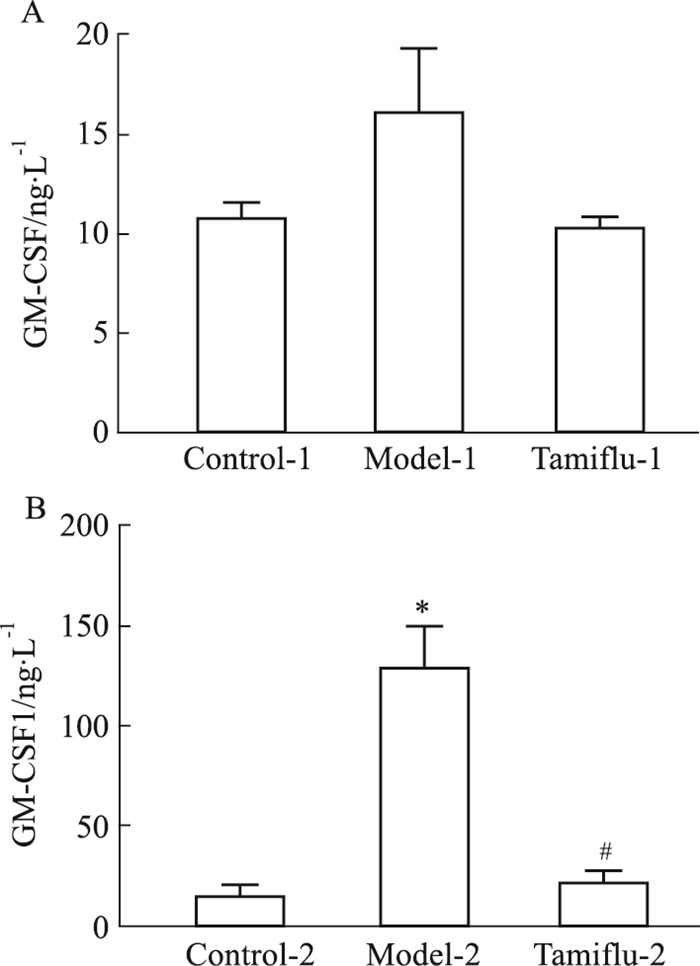
集落刺激因子(GM-CSF)能将成熟的髓系细胞极化为促炎表型,引起炎症[8]。模型2组小鼠在染毒后,GM-CSF分泌明显升高,与空白对照-2组相比,差异有统计学意义(P < 0.05),达菲-2组干预后GM-CSF分泌明显降低(P < 0.05),模型1组小鼠增加不明显(Fig 10)。
|
| Fig 10 Changes of CM-CSF in mice after exposure (n≥4) A: Administration plan on 1st day; B: Administration plan on 4th day. *P < 0.05 vs Control group; #P < 0.05 vs Model group. |
采用正向化法对生存率、体质量、胸腺指数,逆向化法对脾指数、肺指数、病毒载量进行归一化处理,用GraphPad Prism 9.0对各组间归一化数据做箱式图综合分析。Y轴越接近1表明越接近空白对照组的正常小鼠,越接近0表明模型损伤越严重。箱式图结果显示,与空白对照-1组、空白对照-2组比较,感染后模型-2组小鼠主要药理指标明显降低(P < 0.05),表明宿主存在较严重的损伤,病理模型整体指征差异明显。达菲-2组干预后可以明显地回调,与模型-2组相比差异有显著性(P < 0.05),表明达菲-2组发挥明显的治疗作用;模型-1组与空白对照组之间、达菲-1组与模型-1组差异均无显著性。

|
| Fig 11 Box diagram comparison of main pharmacological indexes of mice after exposure(n≥4) *P < 0.05 vs Control group; #P < 0.05 vs Model-2 group. |
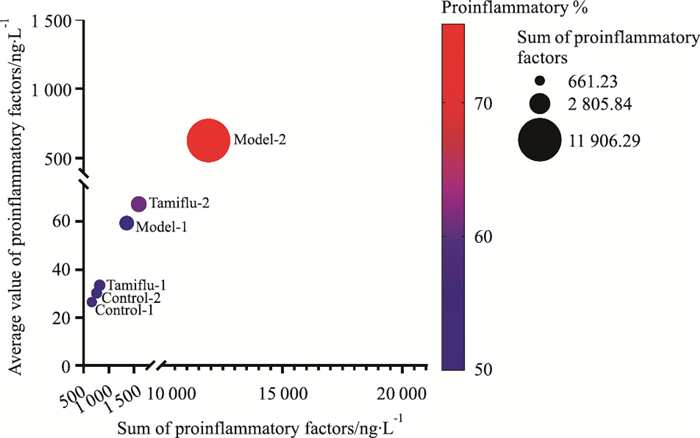
对每组10个炎症细胞因子(除IL-10和IL-27GM-CSF之外)进行几何平均值计算,得到每组促炎细胞因子平均值(Y轴),X轴是促炎细胞因子之和。以IL-10作为抗炎因子参照,以“空白对照-1”作为“促炎/抗炎=1”的平衡状态参比,分别计算其他各组的“促炎%”。气泡图结果显示,模型-1组与空白对照-1组比较,促炎因子的几何平均值只升高了1.2倍;药物干预后,达菲-1与模型-1比较,促炎因子的几何平均值只下降了0.8倍。模型-2组与空白对照-2组比较,促炎因子的几何平均值明显变化,升高了19.7倍;药物干预后,达菲-2组与模型-2组比较,促炎因子的几何平均值明显降低,下降了8.3倍。感染后,模型-2组小鼠体内促炎症因子的平均值,以及促炎因子之和都远远高于其他各组,表明宿主存在较严重的炎症反应,达菲-2组干预后可以明显地回调,起到较好的干预作用;模型-1组小鼠染毒后机体炎症反应强度很低,达菲-1组与模型-1的总炎症因子分布差别较小。
3 讨论 3.1 不同时序给药(达菲)对流感小鼠主要药理指标影响呼吸道类病毒感染作为常见感染人类的病毒性疾病,其感染宿主后大都有潜伏期,有文献报道腺病毒的中位潜伏期为5.6 d(95% CI 4.8~6.3),人类冠状病毒中位潜伏期为3.2 d(95% CI 2.8~3.7),严重急性呼吸综合征冠状病毒中位潜伏期为4.0 d(95% CI 3.6~4.4),呼吸道合胞病毒中位潜伏期为4.4 d(95% CI 3.9~4.9)[9],甲型流感病毒的中位潜伏期位3.4 d(95% CI 2.25~4.5)[10]等。这期间由于感染者尚未出现症状,通常不会就医和用药。因此,针对这类呼吸道病毒的体内抗病毒药效研究就需要考虑病毒感染的潜伏期,这与真实世界人群感染状况相接近。
|
| Fig 12 Comparison of bubble chart of comprehensive inflammatory factors of mice in each group |
流感是一种传染性强、发病率高的急性呼吸道感染性疾病,现有的抗流感药物研究通常选择感染病毒当日[4-5]或次日[6-7]作为给药时间点,未考虑病毒在宿主潜伏期问题,这必然会影响疾病模型的评估以及药物抗病毒药效评价。本研究选用较小滴度(0.25 TCID50)的流感病毒感染,用来模拟普通流感状况,选择达菲作为工具药,药物干预时间选择常规给药(方案1):染毒后次日灌胃达菲;以及出现症状给药(方案2):染毒后模型小鼠平均体重出现下降时灌胃达菲,通常是染毒后d 3-4。结果显示,随着感染时间的延长,小鼠的损伤不同,与模型-1组相比,模型-2组体质量下降比例大,肺指数升高,肺组织M基因相对表达较高,胸腺指数明显下降,炎症因子大量分泌,并出现死亡情况。达菲-2组干预后肺指数明显降低(P < 0.05),能减轻肺组织损伤,胸腺指数明显升高(P < 0.05),可降低病毒载量,下调炎症因子的表达。结合小鼠染毒后主要药理指标归一化处理后综合分析可知,方案1(染毒后d 1给药)的模型症状轻微,与空白对照组之前无明显差别,染毒后达菲d 1给药与模型-1组也无明显差异,没有表现出有效的治疗作用。方案2(染毒后d 4给药)显示模型组出现明显下调,染毒后待动物出现症状(体质量下降)达菲给药,能明显地回调综合药理指标,能清晰、准确地反映出达菲抗流感作用。
3.2 不同时序给药(达菲)对小鼠体内炎症因子的影响炎症因子高表达是病毒感染宿主后激发的主要继发效应,对病毒性疾病的恶化或转归产生重要影响[11]。流感病毒侵入呼吸道上皮细胞和巨噬细胞后首先诱导促炎症因子TNF-α、MCP-1等表达,随后IL-6水平升高,促进炎症反应,导致组织损伤,加重病情[12]。与空白对照-2组相比,模型-2组TNF-α、IL-6、MCP-1的表达升高(P < 0.05);与模型-2组相比,达菲-2组TNF-α、IL-6、MCP-1(P < 0.05)的表达降低,d 1给药方案各组之间无差异。IL-1主要由活化的巨噬细胞、中性粒细胞、上皮细胞和内皮细胞产生,在调节免疫应答中起到核心作用[13];IFN-β作为抗病毒因子,也是一种有着广泛的免疫调节作用的细胞因子[14]。与空白对照-2组相比,模型-2组IL-1α、IFN-β的表达升高(P < 0.05);与模型-2组相比,达菲-2组IL-1α、IFN-β的表达降低(P < 0.05);d 1给药方案各组之间无差异。IL-12p70和IL-23是抗原呈递释放的细胞因子,IL-23作用于记忆T细胞,促进其它炎症因子的分泌和增殖[15]。与空白对照-2组相比,模型-2组IL-12p70、IL-23的表达升高(P < 0.05);与模型-2组相比,达菲-2组IL-12p70、IL-23的表达(P < 0.05)降低;上述模型-2组促炎性细胞因子水平急剧升高,致使免疫系统在清除病原体的同时对机体造成损伤,达菲-2组干预后可以明显降低促炎性细胞因子的分泌,降低机体损伤。由小鼠染毒后的炎症因子汇总气泡图可知,与空白对照组相比,无论是炎症因子明显上升(模型-2组),还是治疗后明显回调(达菲-2组),方案2的模型损伤更明显,药物治疗药效评价更明确。
综上所述,本研究比较不同时序的磷酸奥司他韦(达菲)干预对流感病毒感染模型影响,证明了待动物出现症状(体重开始下降)时作为药物干预时间起点的方法是充分考虑到了病毒感染后的潜伏期,这更符合真实世界病毒感染者的实际状况,无论是在疾病模型评估还是抗病毒药物的药效评价将更合适和准确。本研究将为抗流感病毒及其它抗呼吸道类病毒药效评价中合理地选择模型干预时间点提供依据和参考。
| [1] |
Pleschka S. Overview of influenza viruses[J]. Curr Top Microbiol Immunol, 2013, 370: 1-20. |
| [2] |
陈雄飞, 李铁钢, 柳洋, 等. 新型甲型H1N1流感潜伏期及其影响因素分析[J]. 中国卫生统计, 2011, 28(4): 357-60. Chen X F, Li T G, Liu Y, et al. Analysis of incubation period of new type A H1N1 influenza and its influencing factors[J]. Chin J Health Stati, 2011, 28(4): 357-60. doi:10.3969/j.issn.1002-3674.2011.04.002 |
| [3] |
Mardones F, Perez A, Sanchez J, et al. Parameterization of the duration of infection stages of serotype O foot-and-mouth disease virus: an analytical review and meta-analysis with application to simulation models[J]. Vet Res, 2010, 41(4): 45. doi:10.1051/vetres/2010017 |
| [4] |
Yan Y Q, Fu Y J, Wu S, et al. Anti-influenza activity of berberine improves prognosis by reducing viral replication in mice[J]. Phytother Res, 2018, 32(12): 2560-7. doi:10.1002/ptr.6196 |
| [5] |
Hong E H, Song J H, Kim S R, et al. Morin hydrate inhibits influenza virus entry into host cells and has anti-inflammatory effect in influenza-infected mice[J]. Immune Netw, 2020, 20(4): e32. doi:10.4110/in.2020.20.e32 |
| [6] |
Qu X Y, Li Q J, Zhang H M, et al. Protective effects of phillyrin against influenza A virus in vivo[J]. Arch Pharm Res, 2016, 39(7): 998-1005. doi:10.1007/s12272-016-0775-z |
| [7] |
杨佳, 付业佩, 杜宝香, 等. 细辛多糖对流感病毒H1N1型感染的保护作用及对炎症因子表达水平的影响[J]. 中国中药杂志, 2021, 46(2): 412-9. Yang J, Fu Y P, Du B X, et al. The protective effect of asarum polysaccharide on influenza virus H1N1 infection and its influence on the expression level of inflammatory factors[J]. Chin J Chin Mater Med, 2021, 46(2): 412-9. |
| [8] |
Bianconi V, Sahebkar A, Atkin S L, et al. The regulation and importance of monocyte chemoattractant protein-1[J]. Curr Opin Hematol, 2018, 25(1): 44-51. doi:10.1097/MOH.0000000000000389 |
| [9] |
Lessler J, Reich N G, Brookmeyer R, et al. Incubation periods of acute respiratory viral infections: A systematic review[J]. Lancet Infect Dis, 2009, 9(5): 291-300. doi:10.1016/S1473-3099(09)70069-6 |
| [10] |
Pormohammad A, Ghorbani S, Khatami A, et al. Comparison of influenza type A and B with COVID-19:A global systematic review and meta-analysis on clinical, laboratory and radiographic findings[J]. Rev Med Virol, 2021, 31(3): e2179. |
| [11] |
杨晨茜, 瞿娇, 刘怡彤, 等. 新型冠状病毒肺炎的免疫失衡及干预策略[J]. 中国药理学通报, 2020, 36(4): 445-53. Yang C X, Qu J, Liu Y T, et al. Immune imbalance and intervention strategy of novel coronavirus pneumonia[J]. Chin Pharmacol Bull, 2020, 36(4): 445-53. doi:10.3969/j.issn.1001-1978.2020.04.001 |
| [12] |
陈金凤, 何军, 徐涛. 基于流感发病机制的药物研究进展[J]. 中国药理学通报, 2021, 37(5): 606-12. Chen J F, He J, Xu T. Advances in drug research based on the pathogenesis of influenza[J]. Chin Pharmacol Bull, 2021, 37(5): 606-12. doi:10.3969/j.issn.1001-1978.2021.05.004 |
| [13] |
王涛, 林琴, 刘凤婷, 等. IL-1, TNF-α在免疫性肝损伤过程中对代谢酶CYP2E1的调控作用[J]. 中国药理学通报, 2019, 35(8): 1160-4. Wang T, Lin Q, Liu F T, et al. IL-1, TNF-α Regulation of metabolic enzyme CYP2E1 in immune liver injury[J]. Chin Pharmacol Bull, 2019, 35(8): 1160-4. doi:10.3969/j.issn.1001-1978.2019.08.024 |
| [14] |
Major J, Crotta S, Llorian M, et al. Type Ⅰ and Ⅲ interferons disrupt lung epithelial repair during recovery from viral infection[J]. Science, 2020, 369(6504): 712-7. doi:10.1126/science.abc2061 |
| [15] |
Loughran S T, Power P A, Maguire P T, et al. Influenza infection directly alters innate IL-23 and IL-12p70 and subsequent IL-17A and IFN-gamma responses to pneumococcus in vitro in human monocytes[J]. PLoS One, 2018, 13(9): e203521. |