

2型糖尿病(type 2 diabetes mellitus,T2DM)是一种以胰岛素抵抗、胰岛素分泌受损和胰高血糖素水平升高为特征的代谢性疾病,其伴随的葡萄糖稳态失衡导致空腹血糖升高,进而使得胰岛素敏感性恶化形成慢性高血糖症[1]。近年来,T2DM的发病率逐年上升,造成医疗保健系统的财政负担。葡萄糖是哺乳动物的主要能量来源,而糖异生是人体在缺乏葡萄糖供应时,即饥饿或空腹期间,由非碳水化合物前体(如氨基酸、丙酸盐、甘油和乳酸)形成葡萄糖,维持血浆葡萄糖浓度的重要生理功能[2-3]。胰高血糖素是由胰岛α细胞分泌的一种多肽类激素,在实验动物和人类研究中,即使是基础水平的门静脉胰高血糖素也足以调节3/4的空腹血糖生成[4],并且有研究证明,缺乏胰高血糖素受体的小鼠呈现出低血糖的症状,而缺乏胰高血糖素受体的糖尿病小鼠(db/db)不表现出高血糖症状[5-6]。由此可见,胰高血糖素水平升高及其介导的糖异生紊乱是导致糖尿病患者空腹血糖升高的主要原因,因此,通过抑制胰高血糖素介导的糖异生来有效的控制空腹血糖水平是应对T2DM高血糖的新思路。
早在19世纪,Claude Bernard摒弃了当时动物体内不能合成多糖的认知,向科学界证明了肝脏可以合成糖原储存起来,肝糖原也可以分解为葡萄糖进入血液维持血糖水平。葡萄糖-6-磷酸酶(glucose-6-phosphatase, G6Pase)和磷酸烯醇式丙酮酸羧激酶(phosphoenol pyruvate carboxykinase, PEPCK)是糖异生途径中的关键限速酶。近年来,人们发现不止肝脏可以进行糖异生,肾脏和肠道也可以[7-8]。然而,肝脏、肾脏和肠道三者对胰高血糖素的反应性尚未见报道,基于此,本研究旨在探究不同空腹时间段胰高血糖素对肝脏、肾脏和肠道糖异生的调节作用及机制,为胰高血糖素介导的不同脏器糖异生的基础研究提供理论指导和有益借鉴。
1 材料与方法 1.1 动物SPF级C57BL/6J雄性小鼠36只购自北京华阜康生物科技股份有限公司,合格证号为SCXK(京)2019-0008。体质量(20~25) g,8周龄。昼夜更替时间12 h,普通饲料喂养。
1.2 药品与试剂胰高血糖素(Glucagon)(货号HY-P0082)购自MCE公司;葡萄糖(Glucose)(货号A154-1-1)、甘油三酯(Triglyceride, TG)(货号A110-1-1)、游离脂肪酸(Free fatty acids, FFAs)(货号A042-2-1)、肝/肌糖原测试盒(货号A043-1-1)均购自南京建成生物工程研究所;PAS染色试剂盒(货号C0142S)购买自上海碧云天生物技术有限公司;β-actin(货号ab8226)、p-PKA(货号ab32390)、PKA(货号ab32514)、p-CREB(货号ab32096)和CREB(货号ab32515)抗体均购自Abcam公司;PGC-1α(货号sc-518025)、G6Pase(货号sc-25840)和PEPCK(货号sc-271029)抗体均购自Santa Cruz Biotechnology公司;PGC-1α、G6Pase、PEPCK引物以及总RNA提取试剂(货号9109)、反转录(货号RR047A)、扩增试剂(货号RR820A)均购自日本TaKaRa公司;BCA试剂盒(货号AR0197)购自武汉博士德生物工程有限公司。
1.3 仪器高速冷冻离心机(美国贝克曼库尔公司),荧光显微镜(日本Olympus公司),全自动酶标仪(深圳雷杜TR6000),LightCycler®96 Real-Time PCR系统(美国Roche公司),垂直凝胶电泳仪(美国Bio-Rad),化学发光成像系统(美国Bio-Rad)。
1.4 实验方法 1.4.1 动物样本采集将小鼠随机分为6组:空白对照组(N)、空白对照+胰高血糖素组(NG)、禁食18 h组(F18)、禁食18 h+胰高血糖素组(F18G)、禁食36 h组(F36)、禁食36 h+胰高血糖素组(F36G),其中空白对照组小鼠禁食2 h以排除饮食对小鼠血清生化指标的影响。胰高血糖素组小鼠腹腔注射胰高血糖素2 mg·kg-1、20 min后进行手术取材。各组均采用异氟烷气体麻醉,取血后室温离心取血清,置于-80 ℃保存,取肝脏、双侧肾脏以及肠道空肠段用生理盐水清洗后于-80 ℃保存备用。
1.4.2 血清葡萄糖、甘油三酯(TG)、游离脂肪酸(FFAs)以及肝糖原水平的测定按照“1.4.1”步骤获得各组小鼠血清,根据南京建成生物工程研究所葡萄糖、甘油三酯(TG)、游离脂肪酸(FFAs)和肝/肌糖原测试盒的操作说明测定其血清水平。
1.4.3 肝脏组织糖原染色取小鼠新鲜肝脏组织,4%多聚甲醛固定48 h后, 依次经过梯度酒精脱水、二甲苯透明,石蜡包埋后切成4 μm厚度的石蜡切片,根据PAS染色试剂盒说明书进行染色,用中性树胶封片,于显微镜下观察并拍照。
1.4.4 Western blot取各组小鼠肝脏0.3 g,加入裂解混合液300 μL(裂解液∶PMSF ∶磷酸酶抑制剂=100 ∶1 ∶1),用组织研磨仪低温匀浆。静置2 h后12 000 r·min-1离心20 min,吸取上层液体得到蛋白溶液。BCA试剂盒测定蛋白浓度,统一每孔样本上样量为25 μg。加loading buffer后,100 ℃金属浴加热5 min使蛋白变性,冷却后-40 ℃保存备用。SDS-PAGE凝胶电泳后转膜至PVDF膜,用5% BSA或脱脂奶粉封闭3 h,4 ℃孵育一抗过夜,抗体浓度均以1 ∶1 000稀释。次日用辣根过氧化物酶标记的二抗(1 ∶1 000)孵育1 h后曝光。ImageJ软件用于分析曝光条带灰度值,β-actin作为内参。
1.4.5 Real-time PCR 1.4.5.1 RNA提取与反转取各组小鼠肝脏、肾脏和肠道组织各0.03 g,加入600 μL TRIzol提取mRNA;Nanodrop One测定mRNA浓度;统一浓度后根据RNA反转录试剂盒说明书反转为cDNA,-40 ℃保存备用。
1.4.5.2 扩增根据RNA扩增试剂盒的操作说明,用荧光定量PCR仪扩增。引物序列见Tab 1。
| Gene | Forward primer (5′-3′) | Reverse primer (5′-3′) |
| G6Pase | CAGCAACAGCTCCGTGCCTA | ATCCCAACCACAAGCTGACGTTC |
| PEPCK | TCTTTGGTGGCCGTAGACCTG | GCCAGGTATTTGCCGAAGTTGTAG |
| PGC-1α | GGACATGTGCAGCCAAGACTCT | CACTTCAATCCACCCAGAAAGCT |
| β-actin | CACTATTGGCAACGAGCGGTTCCG | ACGGATGTCAACGTCACACT |
所有实验结果用GraphPad Prism 8软件进行统计分析,数据均以x±s表示,多组分析采用单因素方差分析(One-way ANOVA)。
2 结果 2.1 胰高血糖素对小鼠血清葡萄糖、甘油三酯、游离脂肪酸水平及肝脏糖原含量的影响检测血清中葡萄糖、甘油三酯、游离脂肪酸浓度以及肝脏糖原水平。随着禁食时间延长,血清中葡萄糖浓度逐渐降低,并且与对照组和禁食组相比,腹腔注射胰高血糖素后葡萄糖浓度明显升高(Fig 1A);与未注射胰高血糖素的小鼠相比,注射胰高血糖素后血清中甘油三酯及游离脂肪酸浓度均降低(Fig 1B-C),且肝糖原含量也降低(Fig 1D),采用PAS染色进一步证实胰高血糖素能够减少肝脏糖原含量(Fig 1E)。结果提示胰高血糖素促进肝糖原分解进而升高血糖,且促进脂肪分解及氧化为糖异生而增加底物供应。
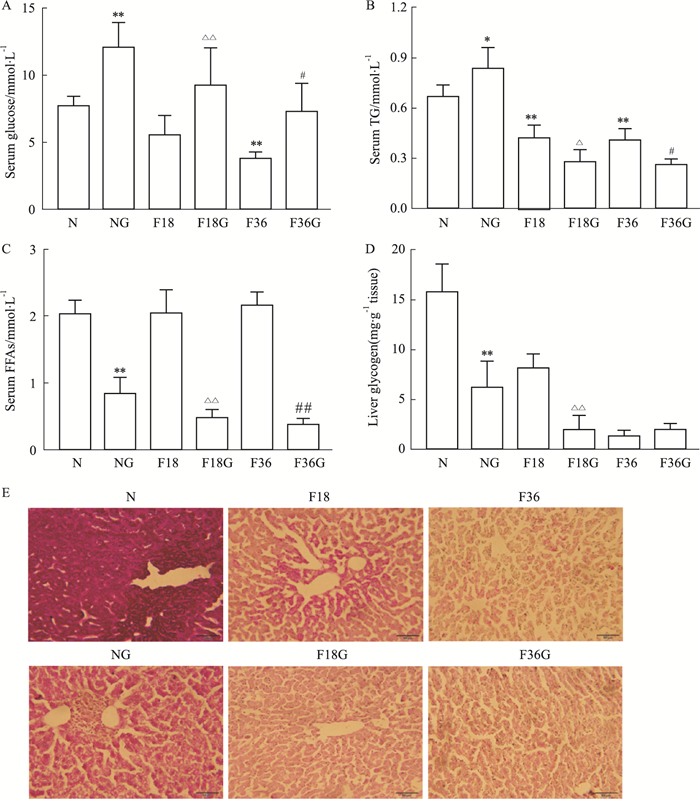
|
| Fig 1 Glucagon increased serum glucose level (A), reduced triglyceride (B) and free fatty acids (C) levels, and reduced hepatic glycogen content in mice (D-E) (n=6) *P < 0.05, **P < 0.01 vs N group; △P < 0.05, △△P < 0.01 vs F18 group; #P < 0.05, ##P < 0.01 vs F36 group. |
分别用Real-time PCR和Western blot检测肝脏、肾脏和肠道组织中PGC-1α基因和蛋白表达,结果如Fig 2所示,在胰高血糖素的刺激下,肝脏中PGC-1α基因表达和蛋白表达在禁食18 h与禁食36 h时均有明显增加,肾脏在禁食18 h增加,而肠道则在禁食36 h才明显增加。结果提示肝脏、肾脏、肠道3个脏器对胰高血糖素的响应时间不同。
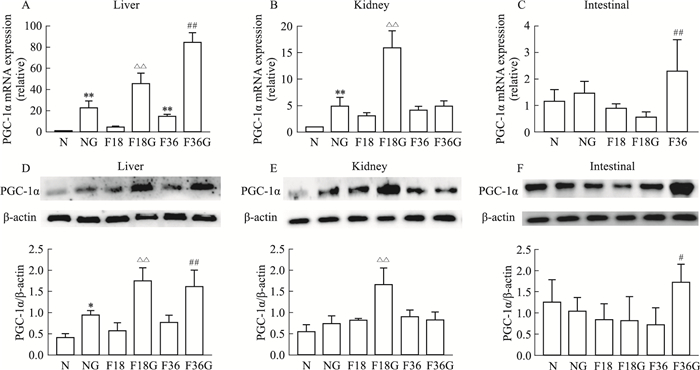
|
| Fig 2 Gene and protein expression of PGC-1α in liver significantly increased by stimulation with glucagon at both 18 h and 36 h fasting (A, D); PGC-1α gene and protein expression in kidney increased by glucagon at 18 h fasting (B, E); gene and protein expression of PGC-1α in intestine significantly increased by glucagon at 36 h fasting (C, F) (n=5) *P < 0.05, **P < 0.01 vs N group; △△P < 0.01 vs F18 group; #P < 0.05, ##P < 0.01 vs F36 group. |
因和蛋白表达均有不同程度的增加,并且腹腔注射胰高血糖素能够进一步增加二者的基因和蛋白表达(Fig 3),提示胰高血糖素促进小鼠糖异生。
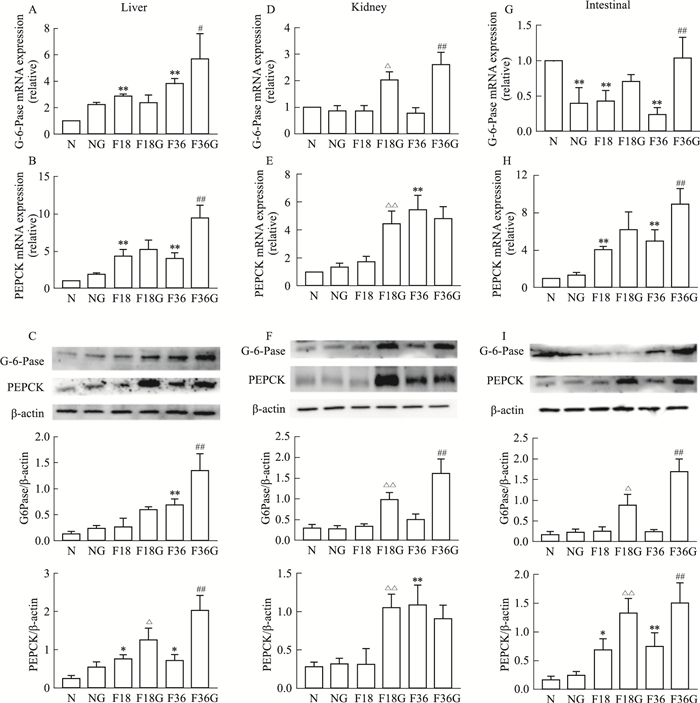
|
| Fig 3 The gene and protein expressions of G6Pase and PEPCK in liver (A-C), kidney (D-F) and intestinal (G-I) increased after fasting, and further increased by intraperitoneal injection of glucagon (n=4) *P < 0.05, **P < 0.01 vs N group; ΔP < 0.05, ΔΔP < 0.01 vs F18 group; #P < 0.05, ##P < 0.01 vs F36 group. |
肝脏Western blot结果显示,与未注射胰高血糖组相比,注射胰高血糖素组小鼠肝脏中p-PKA以及p- CREB的蛋白表达均明显增加(Fig 4);而肾脏与肠道中这两种蛋白都不表达,提示肝脏在胰高血糖素的刺激下可通过PKA-CREB通路增加糖异生的作用。
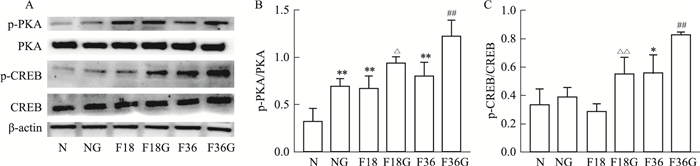
|
| Fig 4 Glucagon upregulated ratio of p-PKA/PKA and p-CREB/CREB in liver(x±s, n=4) *P < 0.05, **P < 0.01 vs N group; △P < 0.05, △△P < 0.01 vs F18 group; ##P < 0.01 vs F36 group. |
维持机体血糖在一定的正常水平有助于预防或延缓糖尿病及其并发症。日常饮食中,70%~75%的内源性葡萄糖产量由肝脏合成,15%~20%由肾脏合成,仅有5%~7%由肠道合成,而在空腹24 h后,由肝脏合成的内源性葡萄糖产量下降至50%~55%,肾脏提高至20%~25%,肠道大幅度提高至20%[9]。本研究发现,在胰高血糖素的刺激下,肝脏、肾脏与肠道三者促进糖异生的方式不同,且对胰高血糖素的响应时间也不相同(Fig 2A-C)。
体内胰高血糖素浓度的增高可以刺激短时间的糖原分解升高血糖,同时通过糖异生持续调节葡萄糖的产生。本研究结果显示,随着禁食时间的延长,肝脏糖原含量逐渐减少,胰高血糖素刺激能够明显减少对照组与禁食18 h组小鼠肝脏糖原含量,而并不影响禁食36 h组小鼠肝糖原含量(Fig 1)。空腹时胰高血糖素结合胰高血糖素受体并激活cAMP信号,通过cAMP依赖的蛋白激酶A(PKA)促进糖异生关键酶的表达[10]。此外,胰高血糖素可直接激活过氧化物酶体增殖物激活受体γ辅激活因子α(PGC-1α),从而启动G6Pase和PEPCK的基因转录[11]。肝脏是机体进行糖异生的主要场所,通过调节葡萄糖的摄取、储存、生成以及释放来控制血液循环和肝细胞间葡萄糖水平的平衡。二甲双胍作为一线首选口服降糖药物在临床上广泛应用,其降糖作用主要通过抑制肝糖异生实现[12]。本实验研究结果表明,肝脏一方面通过PKA-CREB通路升高糖异生关键酶的表达(Fig 4),一方面通过诱导PGC-1α高表达进一步增加肝脏糖异生(Fig 2);而肾脏与肠道并不调控PKA-CREB通路,而是通过增加PGC-1α促进糖异生。
肝脏、肾脏和肠道糖异生对胰高血糖素的响应时间不同,肝脏在空腹18 h和36 h时对胰高血糖素敏感,而肾脏和肠道分别在空腹18 h和36 h时对胰高血糖素敏感。肝脏、肾脏和肠道糖异生具有明确的底物选择性,以乳酸和丙氨酸为底物的肝脏糖异生需要消耗能量,而以谷氨酰胺和甘油为底物的肾脏和肠道糖异生产生能量,合成1摩尔葡萄糖会产生4 ATP [13-14]。当机体空腹过夜后,由谷氨酰胺和丙氨酸产生的葡萄糖大致相等[15],而人的肾脏所含的氨基酸中,谷氨酰胺约占60%,几乎80%的全身性谷氨酰胺糖异生发生在肾脏[16]。肾脏参与葡萄糖的生产和利用,可能与葡萄糖的反调节、餐后葡萄糖处理、尿毒症的胰岛素抵抗和糖尿病高血糖的发病机制密切相关。而肠道糖异生是通过启动肠脑神经信号触发脑依赖的外周代谢调节,将葡萄糖释放到门静脉[17]。此外,肝脏葡萄糖生成不足会导致肾脏和肠道糖异生的上调,而肠道糖异生的上调会通过神经-脑-肝轴降低肝脏葡萄糖的产生[18]。
综上所述,胰高血糖素促进空腹条件下肝脏、肾脏和肠道糖异生,并且三者促进糖异生的方式及对胰高血糖素的响应时间不同。糖异生最重要的生理意义是在空腹或饥饿情况下维持血糖浓度的相对稳定,使机体免于低血糖导致的休克或死亡。肝脏是通过糖异生或糖原分解产生内源性葡萄糖的主要部位,但是肾脏和肠道糖异生不仅应被视为空腹葡萄糖的关键来源,而且还应被视为葡萄糖和能量稳态中央控制的关键信号。因此,在特殊情况下,如糖尿病、肥胖等疾病,糖异生器官的重新分配是治疗糖尿病的一个新思路。
| [1] |
Leung P S. The potential protective action of vitamin D in hepatic insulin resistance and pancreatic islet dysfunction in type 2 diabetes mellitus[J]. Nutrients, 2016, 5;8 (3): 147.
|
| [2] |
Corssmit E P, Romijn J A, Sauerwein H P. Review article: Regulation of glucose production with special attention to nonclassical regulatory mechanisms: A review[J]. Metabolism, 2001, 50(7): 742-55. doi:10.1053/meta.2001.24195 |
| [3] |
Van Sinderen M L, Steinberg G R, Jorgensen S B, et al. Effects of estrogens on adipokines and glucose homeostasis in female aromatase knockout mice[J]. PLoS One, 2015, 10(8): e136143. |
| [4] |
Liljenquist J E, Mueller G L, Cherrington A D, et al. Evidence for an important role of glucagon in the regulation of hepatic glucose production in normal man[J]. J Clin Inves, 1977, 59(2): 369-74. doi:10.1172/JCI108649 |
| [5] |
Lee Y, Berglund E D, Yu X, et al. Hyperglycemia in rodent models of type 2 diabetes requires insulin-resistant alpha cells[J]. Proc Natl Acad Sci USA, 2014, 111(36): 13217-22. doi:10.1073/pnas.1409638111 |
| [6] |
Longuet C, Robledo A M, Dean E D, et al. Liver-specific disruption of the. murine glucagon receptor produces alpha-cell hyperplasia: Evidence for a circulating alphacell growth factor[J]. Diabetes, 2013, 62(4): 1196-205. doi:10.2337/db11-1605 |
| [7] |
Croset M, RajasF, Zitoun C, et al. Rat small intestine is an. insulin-sensitive gluconeogenic organ[J]. Diabetes, 2006, 50: 740-6. |
| [8] |
Chatelain F, Pe′gorier J P, Minassian C, et al. Development. and regulation of glucose-6-phosphatase gene expression in rat liver, intestine, and kidney: In vivo and in vitro studies in cultured fetal hepatocytes[J]. Diabetes, 1998, 47: 882-9. doi:10.2337/diabetes.47.6.882 |
| [9] |
Mutel E, Gautier-Stein A, Abdul-Wahed A, et al. Control of blood glucose in the absence of hepatic glucose production during prolonged fasting in mice: induction of renal and intestinal gluconeogenesis by glucagon[J]. Diabetes, 2011, 60(12): 3121-31. doi:10.2337/db11-0571 |
| [10] |
Finan B, Capozzi M E, Campbell J E. Repositioning glucagon action in the physiology and pharmacology of diabetes[J]. Diabetes, 2020, 69(4): 532-41. doi:10.2337/dbi19-0004 |
| [11] |
Wolfrum C, Asilmaz E, Luca E, et al. Foxa2 regulates lipid metabolism and ketogenesis. in the liver during fasting and in diabetes[J]. Nature, 2004, 432: 1027-32. doi:10.1038/nature03047 |
| [12] |
曾晓会, 卓俊城, 谢凯枫, 等. 二甲双胍治疗Ⅱ型糖尿病大鼠的代谢组学研究[J]. 中国药理学通报, 2019, 35(9): 1212-20. Zeng X H, Zhuo J C, Xie K F, et al. Metabonomic study of metformin in type Ⅱ diabetic rats[J]. Chin Pharmacol Bull, 2019, 35(9): 1212-20. doi:10.3969/j.issn.1001-1978.2019.09.007 |
| [13] |
Gerich J E, Meyer C, Woerle H J, et al. Renal gluconeogenesis: Its importance in human glucose homeostasis[J]. Diabetes Care, 2001, 24(2): 382-91. doi:10.2337/diacare.24.2.382 |
| [14] |
Mithieux G. The new functions of the gut in the control of glucose homeostasis[J]. Curr Opin Clin Nutr Metab Care, 2005, 8(4): 445-9. doi:10.1097/01.mco.0000172587.17385.aa |
| [15] |
Nurjhan N, Bucci A, Perriello G, et al. Glutamine: A major gluconeogenic precursor and vehicle for. interorgan carbon transport in man[J]. J Clin Invest, 1995, 95(1): 272-7. doi:10.1172/JCI117651 |
| [16] |
Lochs H, Roth E, Gasic S, et al. Splanchnic, renal, and muscle clearance of alanylglutamine in man and. organ fluxes of alanine and glutamine when infused in free and peptide forms[J]. Metabolism, 1990, 39(8): 833-6. doi:10.1016/0026-0495(90)90128-Y |
| [17] |
Soty M, Gautier-Stein A, Rajas F, et al. Gut-brain glucose signaling in energy homeostasis[J]. Cell Metab, 2017, 25(6): 1231-2. doi:10.1016/j.cmet.2017.04.032 |
| [18] |
Devadder F, Kovatcheva-Datchary P, Zitoun C, et al. Microbiota-produced succinate improves glucose homeostasis via intestinal gluconeogenesis[J]. Cell Metabolism, 2016, 24(1): 151-7. doi:10.1016/j.cmet.2016.06.013 |

