


铜绿假单胞菌(Pseudomonas aeruginosa,PA)是一种具有很强的环境适应能力且无处不在的机会性致病菌,是引起医院获得性肺炎的主要病因,尤其是在免疫功能低下的患者中(如已有肺部疾病、重度烧伤和机械通气等患者)[1]。研究表明绿脓菌素(pyocyanin,PCN)是铜绿假单胞菌分泌的重要毒力因子之一,具有氧化还原能力,可诱导细胞产生氧化应激反应从而增加细胞内活性氧(reactive oxidant species,ROS)的水平。细胞内高水平的ROS引起宿主细胞中氧化还原反应失衡,从而导致细胞的损伤和死亡[2]。近些年来研究证实,PCN可通过先天免疫和氧化应激诱导改变宿主的免疫反应,增加体内细胞炎症因子的产生,如IL-8、IL-6、IL-1β和TNF-α等[3]。
芳香烃受体(aryl hydrocarbon receptor,AhR)是一种配体激活的转录因子,可以被许多内源性配体如6-甲酰基吲哚并[3,2-b]咔唑(6-formylindolo[3,2-b]carbazole,FICZ)和外源性配体如四氯二苯-P-二噁英(tetrachlorodibenzo- P-dioxin,TCDD)激活,在其结合配体之后细胞质中无活性的AhR与热休克蛋白90(HSP90)等结合形成的复合体解离,然后入核与芳香烃受体核转位蛋白(ARNT)组成异源二聚体,其与二噁英反应元件(DRE)结合后启动基因转录,在机体炎症免疫调节、细胞增殖和细胞凋亡等生理过程中发挥重要作用[4]。巨噬细胞(macrophage)是先天免疫和适应性免疫的重要效应细胞,被病原体激活的巨噬细胞在宿主炎症防御反应中具有关键作用[5]。近年来越来越多的研究证明,AhR在免疫调节和炎症反应过程中发挥着重要作用,且AhR对树突状细胞(DC)、中性粒细胞和自然杀伤细胞(NK)等先天免疫细胞具有调节作用[6],但AhR在巨噬细胞功能中的确切作用仍处在探索阶段。
研究表明,PCN与AhR具有较高的亲和力,这提示AhR在PA感染的免疫调节中可能发挥重要作用。然而,目前AhR对PCN诱导产生的免疫反应的影响和机制并不明确,因此对这一途径的研究可能对未来PA感染的临床治疗提供新的思路和潜在的治疗靶点。
1 材料与方法 1.1 材料 1.1.1 细胞小鼠单核巨噬细胞株RAW264.7购自武汉普诺赛公司,用含10% 胎牛血清的DMEM培养基,培养于37 ℃、5% CO2培养箱中,待细胞融合至80%~90% 时传代并进行后续实验。
1.1.2 药物与试剂绿脓菌素(pyocyanin PCN)(美国Sigma-Aldrich公司,R9532);AhR抑制剂CH223191(A8609)、CCK8检测试剂盒(K1018),购自美国APExBIO公司;AhR激动剂FICZ(美国Target Mol公司,TQ0257);胎牛血清FBS(德国Serapro公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术,P0010S);ECL化学发光底物(北京兰杰柯科技有限公司,BL520A);p-p38MAPK一抗(sc-166182)、p-p65NF-κB一抗(sc-136548)、AhR一抗(sc-133088),购自美国Santa Cruz Biotechnology公司,货号:sc-133088);β-actin一抗(北京博奥森生物技术公司,货号:bs-0061R);山羊抗兔二抗(德国Cell Signaling Technology公司,货号:7074P2);山羊抗小鼠二抗(德国Cell Signaling Technology公司,货号:7074P6);Alexa Fluor 594山羊抗小鼠IgG(美国Thermo Fisher Scientific公司,A-11005);DAPI(美国Sigma-Aldrich公司,D9542);Elisa试剂盒:小鼠IL-6 (EM3201S-96T)、小鼠TNF-α(EM3311S-96T)、小鼠IL-1β试剂盒(EM3184M-96T),购自上海威奥生物公司。
1.1.3 主要仪器超净工作台(中国重庆艺思特有限公司),CO2培养箱(美国Thermo Fisher公司),全波长酶标仪(美国Thermo Fisher公司)、高速冷冻离心机(美国Thermo Fisher公司); 超纯水处理系统(Heal Force公司); 化学发光成像系统(美国Bio-Rad公司);倒置荧光显微镜(日本OLYMPUS公司)。
1.2 方法 1.2.1 细胞培养和处理RAW 264.7细胞在10% FBS的DMEM培养基中于37 ℃、5% CO2条件下培养,每天更换培养基,待细胞生长至对数生长期后加入不同浓度PCN(0、10、25、50 μmol·L-1)制造感染模型,并用PCN(50 μmol·L-1)、CH223191(10 μmol·L-1)和FICZ(100 nmol·L-1)处理细胞24 h。在加入FICZ和PCN之前1 h将CCH223191加到细胞培养基中。
1.2.2 细胞活力的测定将RAW264.7细胞(6×103个/孔)接种到96孔板中,分为空白组(只含培养基)、对照组(含细胞和0.1% DMSO的培养基)、药物处理组(含细胞、培养基和待测药物),每组设5个平行孔。孵育24 h后,用相应浓度的PCN(0、10、25、50、100、200 μmol·L-1)和CH223191(10 μmol·L-1)、FICZ(100 nmol·L-1)分别处理RAW264.7细胞。孵育24 h后更换培养基并向每孔中加入10 μl CCK8溶液,继续孵育2 h。酶标仪设定波长为570 nm检测各孔的吸光度值,以光密度(optical density,OD)值反映RAW264.7细胞活力。使用以下公式计算细胞存活率:细胞存活率/%=[OD药物组-OD空白组]/[OD对照组-OD空白组]×100%。
1.2.3 免疫荧光将RAW264.7细胞接种于12孔板中,按预定实验分组处理细胞。经4% 多聚甲醛固定细胞形态后用1% 的Tritonx-100室温孵育细胞30 min,然后用5% 牛血清蛋白封闭30 min。封闭后的细胞与AhR抗体(1 ∶ 200)4 ℃共同孵育过夜,将一抗孵育的细胞洗涤后与荧光二抗在室温避光条件下孵育1 h。然后再用DAPI染色细胞核10 min,最后在荧光显微镜下观察AhR的表达情况。
1.2.4 蛋白印记分析已按照既定实验条件处理后的RAW264.7细胞经PBS洗涤后加入细胞裂解缓冲液(RIPA ∶ PMSF=100 ∶ 1),在冰上裂解30 min,使用BCA蛋白质定量试剂盒测定蛋白质浓度。用10% SDS-PAGE凝胶电泳分离蛋白质并将蛋白质转印到PVDF膜上,将PVDF膜在室温下用5%牛血清蛋白(BSA)封闭2 h。然后与相应一抗AhR(1 ∶ 500)、p-p38MAPK(1 ∶ 800)、p- p65NF-κB(1 ∶ 800)、β-actin(1 ∶ 10 000)、在4 ℃条件下共同孵育过夜。用TBST洗涤后将PVDF膜与HRP-IgG(1 ∶ 5 000)室温下共同孵育1.5 h。最后通过化学发光系统ECL显影,再用ImageJ进行分析。
1.2.5 酶联免疫吸附测定(Elisa)将RAW264.7细胞用相应实验条件处理24 h后,收集细胞培养上清液并离心去除细胞碎屑,保存于-80 ℃中备用。最后使用相应的小鼠ELISA试剂盒,按照说明书测量IL-6、IL-1β和TNF-α的浓度。
1.3 统计分析采用GraphPad Prism 8.0统计软件进行统计分析,符合正太分布的计量资料以x±s表示,多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较方差齐时采用LSD检验,方差不齐时采用Dunnett′s T检验。
2 结果 2.1 细胞活力RAW264.7细胞在不同浓度的PCN和CH223191、FICZ处理24 h后,通过CCK-8法进行细胞活力测定。与对照组相比,PCN浓度为10、25、50 μmol·L-1时对细胞无活力影响;当PCN浓度为100 μmol·L-1时,有6%左右细胞活力丧失;当PCN浓度为200 μmol·L-1时有10%-20% 细胞丧失活力(Fig 1A)。故选取终浓度为10、25、50 μmol·L-1制造感染模型。CH223191浓度为10 μmol·L-1和FICZ浓度为100 nmol·L-1时对细胞活力无影响(Fig 1B)。
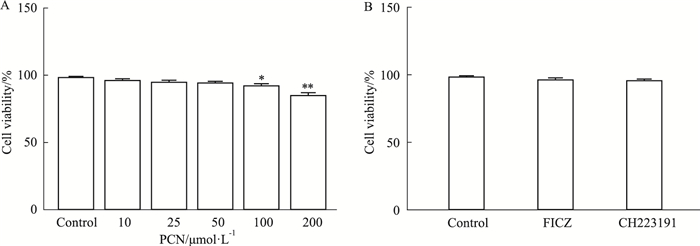
|
| Fig 1 Effect of PCN, CH223191, and FICZ on viability of RAW264.7 cells A: RAW264.7 cells were treated with different concentrations of PCN (0, 10, 25, 50, 100, 200 μmol·L-1) for 24 hours; B: CH223191 10 μmol·L-1and FICZ 100 nmol·L-1 treated cells for 24 hours. Relative percentages were calculated based on the absorbance at 450 nm for each treatment group, and cells cultured in a medium containing 0.1 % DMSO were used as controls. *P < 0.05, **P < 0.01 vs Control group (x±s, n=6). |
不同浓度PCN(0、10、25、50 μmol·L-1)处理细胞24 h后,应用Western blot和免疫荧光检测AhR的表达,结果提示(Fig 2):AhR可以被PCN激活,随着PCN浓度的增加AhR的表达也增加。其中,当PCN浓度为50 μmol·L-1时PCN的表达量最为显著。因此,选择PCN浓度50 μmol·L-1作为激活AhR的最佳浓度用于后续实验。
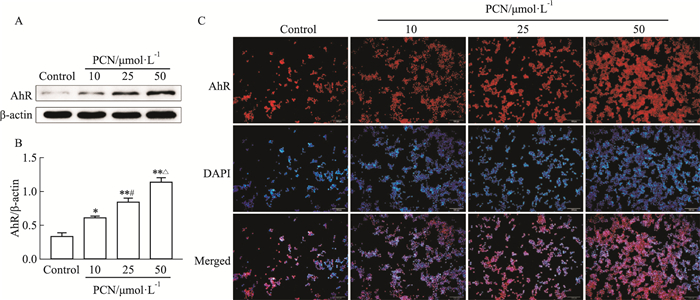
|
| Fig 2 Effect of PCN on AhR content in RAW264.7 cells (x±s, n=3) A, B: Expression of AhR protein content by Western blot; C: Qualitative assessment of AhR expression by immunofluorescence. *P < 0.05, **P < 0.01 vs Control group (Containing 0.1% DMSO); #P < 0.05 vs 10 μmol·L-1 PCN; △P < 0.05 vs 25 μmol·L-1 PCN. |
为了探究AhR对PCN诱导的RAW264.7细胞中炎症因子表达的影响,我们应用AhR抑制剂CH223191(10 μmol·L-1)预处理细胞1 h后建立感染模型。通过Western blot检测AhR蛋白的表达水平(Fig 3A, B):被AhR抑制剂CH223191处理后的细胞中AhR的表达明显减少;用ELISA检测方法分析AhR被抑制后RAW264.7细胞中炎症因子的表达情况。ELISA结果表明(Fig 3C-E):PCN刺激细胞中炎症因子IL-6、IL-1β和TNF-α的产生,而CH223191进一步增加了PCN诱导的炎症因子IL-6、IL-1β和TNF-α的产生。说明抑制AhR后使PCN诱导的RAW264.7细胞中炎症因子IL-6、IL-1β和TNF-α的表达量增加了。
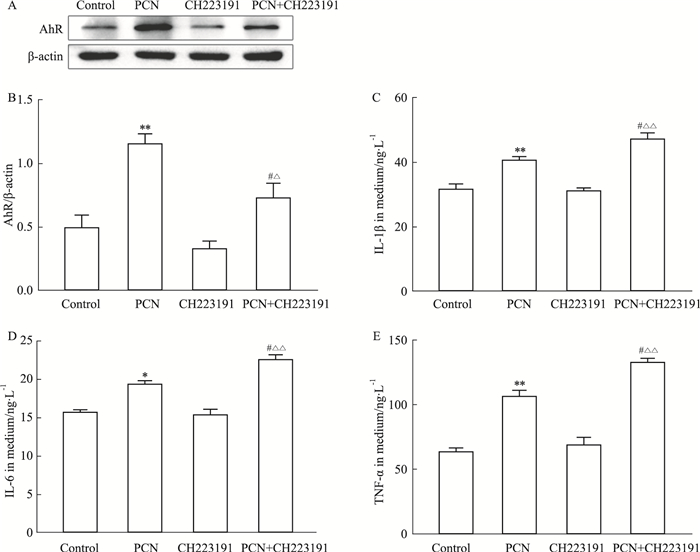
|
| Fig 3 Effect of aryl hydrocarbon receptor inhibitor CH223191 on PCN-induced inflammatory factors in RAW264.7 cells (x±s, n=3) A, B: Western blot to detect the effect of CH223191 on AhR protein expression; C-E: ELISA to detect the expression of inflammatory factors IL-6, IL-1β, and TNF-α in cell culture supernatant. *P < 0.05, **P < 0.01 vs Control group (Containing 0.1% DMSO); #P < 0.05 vs PCN; △P < 0.05, △△P < 0.01 vs CH223191. |
RAW264.7细胞用PCN(50 μmol·L-1)和AhR激动剂FICZ(100 nmol·L-1)共同处理24 h,通过Western blot检测到的数据表明(Fig 4A):与单独应用PCN处理组相比FICZ与PCN联合处理组的AhR的表达明显增加。通过ELISA检测结果显示(Fig 4C-E):FICZ与PCN联合处理组诱导RAW264.7细胞分泌的IL-6、IL-1β和TNF-α蛋白含量较单独使用PCN组降低。说明AhR激动剂可以使PCN诱导的RAW264.7细胞中L-6、IL-1β和TNF-α的表达水平下调。
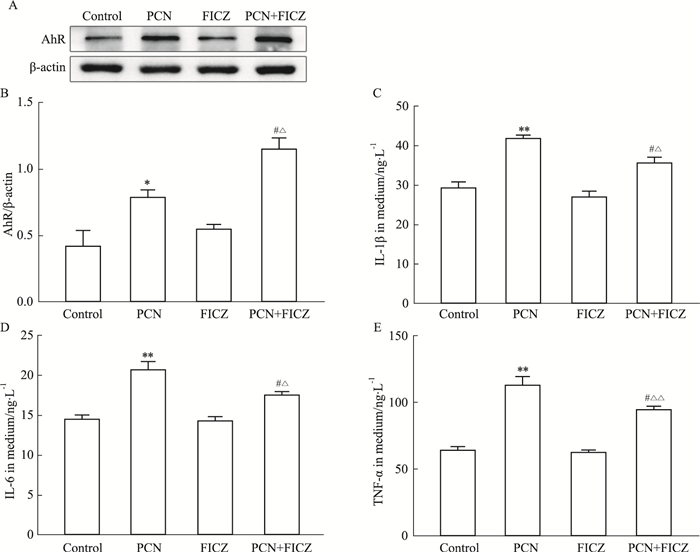
|
| Fig 4 Effect of aryl hydrocarbon receptor agonist FICZ on PCN-induced inflammatory factors in RAW264.7 cells (x±s, n=3) A, B: Analysis of AhR expression levels by Western blot; C-E: ELISA assay for IL-6, IL-1β and TNF-α expression in cell culture supernatants; *P < 0.05, **P < 0.01 vs Control (Containing 0.1% DMSO); #P < 0.05 vs PCN; △ P < 0.05, △△P < 0.01 vs FICZ. |
MAPK和NF-κB信号通路可以调控PCN诱导的炎症介质的表达,PCN可以激活巨噬细胞中的p38MAPK和p65NF-κB通路,为了阐明AhR对PCN激活的巨噬细胞中信号通路的影响,将RAW264.7细胞用CH223191(10 μmol·L-1)和PCN(50 μmol·L-1)处理后,采用Western blot法检测p38MAPK和p65NF-κB的磷酸化水平。结果表明(Fig 5):AhR抑制剂CH223191使p38MAPK和p65NF-κB的磷酸化水平增加,而PCN与CH223191联合处理的细胞中这种作用更强。这些数据表明,AhR受抑制后导致p38MAPK和p65NF-κB的磷酸化水平升高。
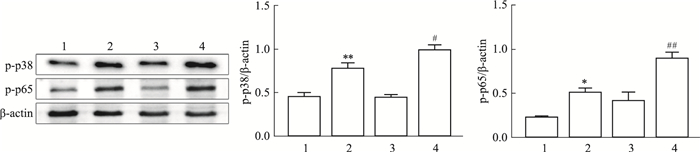
|
| Fig 5 Effect of aryl hydrocarbon receptor inhibitor CH223191 on PCN-induced phosphorylation capacity of p38MAPK and p65NF-κB (x±s, n=3) 1:Control; 2:PCN; 3:CH223191; 4:PCN+CH223191. Analysis of the phosphorylation capacity of p38MAPK and p65NF-κB expression levels by Western blot. *P < 0.05, **P < 0.01 vs Control group (containing 0.1% DMSO); #P < 0.05, ##P < 0.01 vs PCN. |
为了进一步了解AhR对PCN激活的巨噬细胞中信号通路的影响,将RAW264.7细胞用PCN(50 μmol·L-1)、CH22319(10 μmol·L-1)和FICZ(100 nmol·L-1)处理后,通过Western blot评估p38MAPK和p65NF-κB的磷酸化表达。结果所示(Fig 6):FICZ可以抑制p38MAPK和p65NF-κB的磷酸化,且这种抑制作用可以被CH223191消除。这提示AhR在PCN诱导的RAW264.7细胞炎症反应中可能发挥着重要作用。
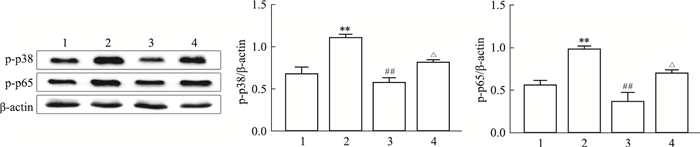
|
| Fig 6 Effect of aryl hydrocarbon receptor agonist FICZ on PCN-induced phosphorylation capacity of p38MAPK and p65NF-κB (x±s, n=3) 1:Control; 2:PCN; 3:PCN+FICZ; 4:PCN+FICZ+CH223191. Analysis of the phosphorylation capacity of p38MAPK and p65NF-κB expression levels by Western blot. **P < 0.01 vs Control group (containing 0.1% DMSO); ##P < 0.01 vs PCN; △P < 0.05 vs PCN+FICZ. |
PA感染现已成为院内感染的主要原因,因其对多种抗生素都有很强的耐药性,所以为临床治疗工作带来了巨大的困难。然而炎症反应是PA感染后的主要免疫反应,对于免疫力低下的患者,机体不能对入侵病原体做出相应的免疫反应,因此导致促炎和抗炎因子及其相关可溶性介子之间的平衡被打破,引起组织破坏和疾病[7]。研究表明,PCN在PA感染的致病性中发挥重要的毒性作用[8],PCN的氧化还原能力诱导细胞内ROS水平增加,从而引起自由基损伤,且通过氧化应激反应可以使细胞抗氧化剂还原性谷胱甘肽(GSH)被氧化成二聚体氧化谷胱甘肽(GSSG),从而介导细胞的损伤[9]。除此之外,PCN还诱导嗜中性粒细胞凋亡,从而损伤中性粒细胞的细菌杀伤作用,导致巨噬细胞产生促炎因子增多[10]。
近些年研究中,AhR已成为调节免疫系统的重要因素,AhR在大多数组织(如皮肤、肠道、肺)和免疫细胞(如T细胞、B细胞、单核细胞、树突状细胞)中均有表达[11]。最近研究阐述了AhR与炎症因子之间的相互作用关系,AhR被激活后,可以抑制炎症性肠病中IL-6、IL-1β和TNF-α等炎症因子的表达[12],这与我们的研究结果一致。在本研究中,我们选用FICZ作为AhR激动剂和CH223191作为AhR抑制剂,深入探究了AhR对PCN诱导的RAW264.7细胞中炎症因子的调控作用。应用AhR抑制剂CH223191后炎症因子IL-6、IL-1β和TNF-α较之前显著增加;而加入AhR激动剂后炎症因子则明显下降,说明AhR的表达可以调控PCN诱导的RAW264.7细胞中炎症因子的表达。已有研究表明,PCN可以通过蛋白激酶C(protein kinase C,PKC)、丝裂原活化蛋白激酶家(mitogen-activatedprotein kinases,MAPKs)及核因子κB(nuclear facttor κB,NF-κB)信号通路调控炎症因子的表达[13]。但是AhR对PCN诱导的炎症因子表达的调控机制尚不清楚,因此,我们推测AhR可能也通过MAPKs和NF-κB信号通路调节PCN诱导的巨噬细胞中炎症因子的表达。我们的研究结果显示AhR抑制剂CH223191可以使PCN诱导的RAW264.7细胞中p38MAPK和p65NF-κB的磷酸化能力增加;而p38MAPK和p65NF-κB的磷酸化能力则会被AhR激动剂FICZ所抑制。这些研究结果表明,AhR可能通过p38MAPK/p65NF-κB信号转导途径调控PCN诱导的RAW264.7细胞中炎症因子IL-6、IL-1β和TNF-α的表达。
然而,这项研究具有一定的局限性,我们仅选用了部分AhR的配体进行实验,而且实际上研究最多的AhR配体是TCDD[14],但因其特殊的毒理特性,既限制了实验条件又不适合用于临床实践,所以我们选择了具有低分子量、高亲和力的内源性配体FICZ[15],下一步可以采用更多的AhR配体探究其对PCN介导的炎症因子表达的影响。而且我们的实验结果也有一定的局限性,众所周知,目前AhR相关的信号通路有两类[16]:基因组与非基因组信号通路。基因组信号通路:AhR被配体活化后与胞浆蛋白复合体解离,然后入核与ARNT形成转录复合物再与DRE序列结合,从而调控基因表达[17]。非基因组信号通路:无需AhR的核转位及与靶基因结合,其调控点在细胞浆或细胞膜上[18]。由于试剂和时间限制的原因,我们此次实验并没有阐明AhR调节PCN介导的巨噬细胞中炎症因子的表达与基因组和非基因组信号通路之间的关系。因此,在后续实验中,我们需要进一步探究此间关系。
综上所述,我们的实验结果表明,AhR可能通过p38MAPK/p65NF-κB信号通路调控PCN诱导的RAW264.7细胞中炎症因子的表达,提示AhR可能是PA感染后免疫反应的潜在治疗靶点,并为PA感染的临床治疗提供新的思路。
| [1] |
Hardy K S, Tessmer M H, Frank D W, et al. Perspectives on the pseudomonas aeruginosa type Ⅲ secretion system effector exoU and its subversion of the host innate immune response to infection[J]. Toxins (Basel), 2021, 13(12): 880. doi:10.3390/toxins13120880 |
| [2] |
刘梦茹, 王雅琪, 柴文戍, 等. Krupple样因子6及诱导型一氧化氮合酶在铜绿假单胞菌上清液感染RAW264.7凋亡过程中的表达[J]. 中国药理学通报, 2019, 35(7): 940-4. Liu M R, Wang Y Q, Chai W S, et al. Expression of Krupple-like factor 6 and inducible nitric oxide synthase in apoptosis of RAW264. 7 infected by pseudomonas aeruginosa supernatant[J]. Chin Pharmacol Bull, 2019, 35(7): 940-4. doi:10.3969/j.issn.1001-1978.2019.07.011 |
| [3] |
Rada B, Gardina P, Myers T G, et al. Reactive oxygen species mediate inflammatory cytokine release and EGFR-dependent mucin secretion in airway epithelial cells exposed to Pseudomonas pyocyanin[J]. Mucosal Immunol, 2011, 4(2): 158-71. doi:10.1038/mi.2010.62 |
| [4] |
Kawajiri K, Fujii-Kuriyama Y. The aryl hydrocarbon receptor: A multifunctional chemical sensor for host defense and homeostatic maintenance[J]. Exp Anim, 2017, 66(2): 75-89. doi:10.1538/expanim.16-0092 |
| [5] |
Lee J W, Chun W, Lee H J, et al. The role of macrophages in the development of acute and chronic inflammatory lung diseases[J]. Cells, 2021, 10(4): 897. doi:10.3390/cells10040897 |
| [6] |
Neavin D R, Liu D, Ray B, et al. The role of the Aryl hydrocarbon Receptor (AHR) in immune and inflammatory diseases[J]. Intl J Mol Sci, 2018, 19(12): 3851. doi:10.3390/ijms19123851 |
| [7] |
Faure E, Kwong K, Nguyen D. Pseudomonas aeruginosa in chronic lung infections: How to adapt within the host[J]. Front Immunol, 2018, 9: 2416. doi:10.3389/fimmu.2018.02416 |
| [8] |
Hall S, Mcdermott C, Anoopkumar-Dukie S, et al. Cellular effects of pyocyanin, a secreted virulence factor of pseudomonas aeruginosa[J]. Toxins (Basel), 2016, 8(8): 236. doi:10.3390/toxins8080236 |
| [9] |
O'malley Y Q, Reszka K J, Spitz D R, et al. Pseudomonas aeruginosa pyocyanin directly oxidizes glutathione and decreases its levels in airway epithelial cells[J]. Am J Physiol Lung Cell Mol Physiol, 2004, 287(1): L94-103. doi:10.1152/ajplung.00025.2004 |
| [10] |
Usher L R, Lawson R A, Geary I, et al. Induction of neutrophil apoptosis by the Pseudomonas aeruginosa exotoxin pyocyanin: a potential mechanism of persistent infection[J]. J Immunol, 2002, 168(4): 1861-8. doi:10.4049/jimmunol.168.4.1861 |
| [11] |
Stockinger B, Di Meglio P, Gialitakis M, et al. The Aryl hydrocarbon receptor: Multitasking in the immune system[J]. Annu Rev Immunol, 2014, 32: 403-32. doi:10.1146/annurev-immunol-032713-120245 |
| [12] |
Peng C T, Wu C S, Xu X L, et al. Indole-3-carbinol ameliorates necroptosis and inflammation of intestinal epithelial cells in mice with ulcerative colitis by activating aryl hydrocarbon receptor[J]. Exp Cell Res, 2021, 404(2): 3176. |
| [13] |
Chai W, Zhang J, Zhu Z, et al. Pyocyanin from Pseudomonas induces IL-8 production through the PKC and NF-kappaB pathways in U937 cells[J]. Mol Med Rep, 2013, 8(5): 1404-10. doi:10.3892/mmr.2013.1662 |
| [14] |
Nguyen L P, Bradfield C A. The search for endogenous activators of the aryl hydrocarbon receptor[J]. Chem Res Toxicol, 2008, 21(1): 102-16. doi:10.1021/tx7001965 |
| [15] |
Rannug A, Rannug U. The tryptophan derivative 6-formylindolo[3, 2-b]carbazole, FICZ, a dynamic mediator of endogenous aryl hydrocarbon receptor signaling, balances cell growth and differentiation[J]. Crit Rev Toxicol, 2018, 48(7): 555-74. doi:10.1080/10408444.2018.1493086 |
| [16] |
Shivanna B, Chu C, Moorthy B. The Aryl Hydrocarbon Receptor (AHR): A novel therapeutic target for pulmonary diseases[J]. Int J Mol Sci, 2022, 23(3): 1516. doi:10.3390/ijms23031516 |
| [17] |
Soshilov A A, Motta S, Bonati L, et al. Transitional states in ligand-dependent transformation of the Aryl Hydrocarbon Receptor into its DNA-binding form[J]. Int J Mol Sci, 2020, 21(7): 2474. doi:10.3390/ijms21072474 |
| [18] |
Sciullo E M, Dong B, Vogel C F A, et al. Characterization of the pattern of the nongenomic signaling pathway through which TCDD-induces early inflammatory responses in U937 human macrophages[J]. Chemosphere, 2009, 74(11): 1531-7. doi:10.1016/j.chemosphere.2008.11.010 |

