

2. 川北医学院, 药剂科,四川 南充 637000;
3. 川北医学院, 检验科,四川 南充 637000
2. Dept of Pharmacy, Affiliated Hospital of North Sichuan Medical College, Nanchong, Sichuan 637000, China;
3. Dept of Clinic Laboratory, Affiliated Hospital of North Sichuan Medical College, Nanchong, Sichuan 637000, China
长期以来,急性心梗是中老年人突发死亡的常见原因之一,严重危害人们的身体健康。现在逐渐呈年轻化趋势,发生率和死亡率一直居高不下[1]。由于冠脉痉挛等原因,心脏突然出现缺血缺氧状态,心肌细胞代谢状态发生变化,能量供应受损,导致心肌坏死,收缩功能下降,发展为心力衰竭,威胁患者生命[2]。急性心梗预防和治疗研究一直占据心血管疾病研究课题的重要地位,找寻疾病发生发展重要病因机制并开发相应药物是极其关键的[3]。目前,体外筛选抗缺氧药物的方式主要有物理缺氧和化学缺氧两种。以二氯化钴(CoCl2)为代表的化学缺氧具有方便快捷、结果可靠稳定的优势。
Irisin是运动后由体内肌肉分泌的激素样因子,参与机体的多种生理和代谢过程[4]。据报道,Irisin可以调节白色脂肪棕化,在寒冷刺激下,增加产热[5]。最近的发现表明,Irisin在骨骼重塑和大脑中神经的生成具有潜在作用,可用于阿尔茨海默病的治疗[6-7]。已被证明Irisin对血管炎症、内皮功能损伤等血管病变也有重要的调节作用[8]。本课题探讨Irisin在心肌细胞中对CoCl2化学方法诱导的缺氧模型是否具有保护作用,并研究其相应机制,为Irisin应用于临床心梗的治疗提供实验依据。
1 材料与方法 1.1 实验药物和试剂Irisin(货号:11451)购自Cayman;心肌细胞系H9c2购自美国种质保藏中心;DMEM(货号:SH30022.01B)培养基购自Hyclone;胎牛血清(货号:ST30-3302)购自PAN;青霉素-链霉素(货号:C0222)、胰蛋白酶(货号:15090046)购自Thermo Fisher;ROS检测试剂盒(货号:S0033M)、线粒体膜电位检测试剂盒(货号:C2006)均购自碧云天;CoCl2(货号:60818)购自Sigma;CCK-8检测试剂盒(货号:B34304)购自Bimake公司,AnnexinV-FITC/PI凋亡检测试剂盒购自四正柏;一抗cleaved-caspase3(货号:9664)、Bax(货号:2772)、Sirt1(货号:9475)购自CST;UCP2(货号:A4178)、Bcl-2(货号:A19693)、GAPDH(货号:A19056)购自Abclonal。
1.2 仪器SYNERGYH1多功能酶标仪(美国Bio Tek公司);Cytoflex流式分析仪(美国Beckman公司);OBSERVERD1/AX10cam HRC倒置荧光显微镜(德国Zeiss公司);小型垂直蛋白电泳仪(美国Bio-Rad公司)。
1.3 方法 1.3.1 细胞培养H9c2心肌细胞系37 ℃平衡2 h,稳定后传代细胞,转移至10 cm大培养皿中继续培养,每2天换1次液,后续实验采用对数生长期的H9c2心肌细胞。
1.3.2 给药分组分为对照组(Control);Irisin组(5、10、20 nmol·L-1处理24 h);CoCl2模型组(500 μmol·L-1 CoCl2处理24 h);Irisin治疗组(5、10、20 nmol·L-1预保护处理30 min后,500 μmol·L-1 CoCl2持续处理24 h)。
1.3.3 CCK-8法测细胞存活率按照“1.2.2”分组所示接种细胞于96孔板中,接种密度5×103个/孔,孵箱继续培养24 h。按“1.3.2”药物分组给药处理,实验终点,吸走96孔板中的液体,加入1/10稀释比例的CCK-8工作液(每孔体积100 μL),孵育1 h,可见颜色变黄,设定检测波长450 nm于酶标仪中检测每孔的吸光度值,根据细胞越多,吸光度值越高的原理计算每组细胞的存活率,根据细胞存活率选取Irisin实验浓度为10 nmol·L-1和20 nmol·L-1。
1.3.4 细胞凋亡检测根据“1.3.3”细胞活力检测结果,确定后续实验分组为:对照组(Control);Irisin低浓度组(10 nmol·L-1);Irisin高浓度组(20 nmol·L-1);CoCl2模型组(500 μmol·L-1 CoCl2);Irisin低浓度治疗组(10 nmol·L-1 + 500 μmol·L-1 CoCl2);Irisin高浓度治疗组(20 nmol·L-1 + 500 μmol·L-1 CoCl2)。在6孔板中接种H9c2心肌细胞(1.5×105个/孔),进行实验给药。实验终点用不含EDTA的0.25% Trypsin消化细胞,收集上清和细胞,1 000 r·min-1,3 min平角离心,得到细胞沉淀,PBS洗1次,1 000 r·min-1 3 min离心,吸出上清(不要触碰到细胞沉淀),加入200 μL结合缓冲液,缓慢吹匀,转移到干净的流式管中,做好标记。AnnexinV- FITC染液5 μL/管,枪尖吹匀,室温孵育5 min,再加入10 μL/管的PI染液,枪尖吹匀。流式细胞仪上机检测,CytExpert软件分析数据。
1.3.5 ROS测定避光环境下,用无FBS培养基稀释DCFH-DA储存液(终浓度10 μmol·L-1)。按“1.3.2”方式药物处理后,吸除液体,PBS洗1次,加入DCFH-DA工作液1.0 mL/孔,在孵箱中孵育30 min,吸出染液,无FBS培养基洗2~3次,将孔板放置于荧光显微镜下检测细胞内ROS水平。
1.3.6 线粒体膜电位检测按“1.3.2”分组给药24 h后,除去培养基,PBS洗1次后,装载荧光探针JC-1,避光环境下转移孔板至孵箱孵育20 min,吸出液体,用预冷的缓冲液洗2次,流式细胞仪上机检测,处理数据采用CytExpert软件。
1.3.7 Western blot按“1.3.2”方式处理药物后,收集细胞,每20 μL细胞沉淀加入100 μL RIPA裂解液(含蛋白酶抑制剂NaF,Na2VO3,Cocktail),冰上裂解20 min,每5 min涡旋震荡20 s。12 000 r·min-1离心10 min,吸取上清,加入至1.5 mL EP管中,做好组别标记。采用BCA法测定每组蛋白的浓度,定量出每孔35 μg蛋白进行上样。配置10% SDS-PAGE凝胶,恒流电泳分离不同分子量蛋白,采用0.22 μm的PVDF膜进行恒压转膜,快速封闭液封闭15 min,用TBS/T配制特异性一抗(1 ∶1 000),4 ℃孵育过夜,二抗(1 ∶3 000)室温摇床上孵育1 h,超敏ECL显色液显示条带位置以及深浅。采用ImageJ软件分析蛋白表达量。
1.3.8 统计学方法采用GraphPad Prism 7统计软件处理所得数据。多组统计显著性检验采用One-way ANOVA下的Newman-Keuls的多重比较试验分析。
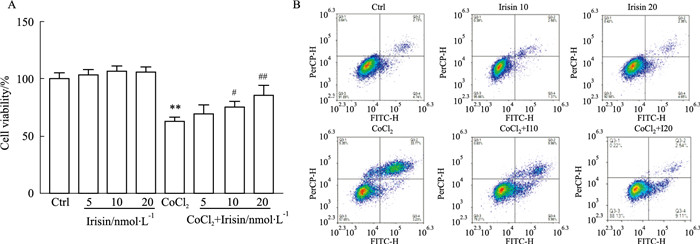
2 结果 2.1 Irisin呈浓度依赖性抑制CoCl2对H9c2细胞的缺氧损伤CoCl2(500 μmol·L-1)处理H9c2细胞的模型组中,相比对照组,细胞活力下降47%(P<0.01);而治疗组中,随着Irisin浓度增加,细胞活力逐渐改善,10 nmol·L-1 Irisin预保护治疗组相对CoCl2模型组差异有统计学意义(P<0.05),20 nmol·L-1 Irisin保护作用更加明显(P<0.01),见Fig 1A。因此,后续采用10 nmol·L-1和20 nmol·L-1 Irisin进行实验,流式细胞术检测结果表明Irisin对照组不影响H9c2细胞的凋亡,而CoCl2模型组引起H9c2细胞的凋亡水平明显增加,Irisin低浓度(10 nmol·L-1)预保护治疗组降低CoCl2引起的细胞凋亡,Irisin高浓度(20 nmol·L-1)预保护治疗组抵抗CoCl2引起的细胞凋亡效果更加明显,见Fig 1B。
|
| Fig 1 The cell viability and apoptosis level of H9c2 cells A: Cell viability of H9c2 cells measured by CCK-8; B: The cell apoptosis results analyzed by flow cytometry. **P<0.01 vs Control group; #P<0.05, ##P<0.01 vs CoCl2 group. |
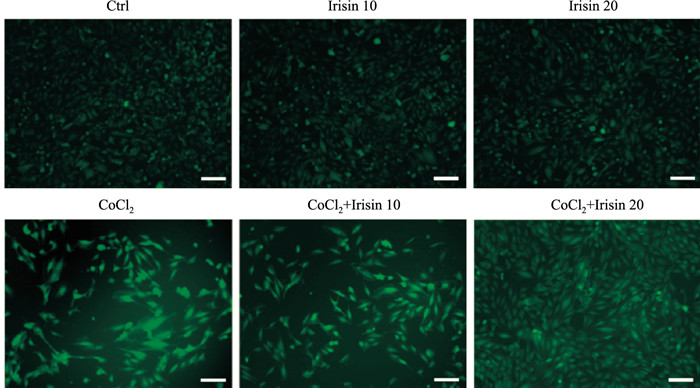
正常心肌细胞内的ROS维持在较低水平,保障胞内正常生理过程的顺利进行,不同浓度Irisin单独处理不影响胞内的ROS水平。但在缺氧模型组中采用荧光显微镜检测到胞内ROS含量明显升高,可见细胞内的氧化应激损伤明显增强,而不同浓度Irisin预保护均下调CoCl2引起的ROS剧增,且高浓度Irisin(20 nmol·L-1)的保护作用更明显,可有效抑制化学缺氧引起的ROS损伤,见Fig 2。
|
| Fig 2 Changes of ROS in H9c2 cells treated with Irisin (10, 20 nmol·L-1) and CoCl2 (500 μmol·L-1) |
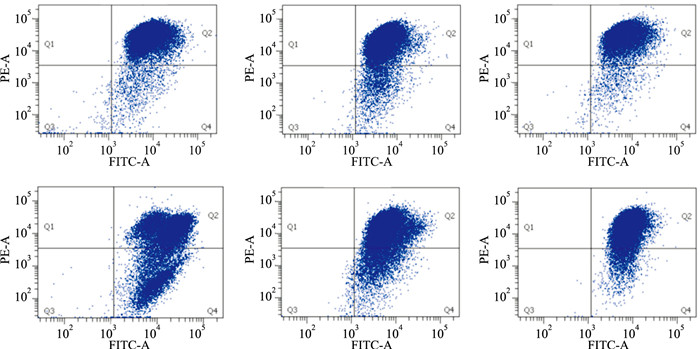
线粒体是细胞的能量工厂,维持着较高的膜电位,膜电位的破坏会导致细胞的凋亡。正常情况下,细胞中线粒体膜电位较高,且Irisin单独处理不会影响心肌细胞的线粒体膜电位水平。CoCl2处理H9c2细胞24 h后,H9c2心肌细胞内的线粒体膜电位大幅下降,与Fig 1中细胞凋亡水平增加的结果相符。而不同浓度Irisin预保护后可有效升高细胞内线粒体膜电位,且高浓度的Irisin(20 nmol·L-1)保护作用更加明显,见Fig 3。
|
| Fig 3 Changes of mitochondiral membrane potential in H9c2 cells treated with Irisin (10, 20 nmol·L-1) and CoCl2 (500 μmol·L-1) |
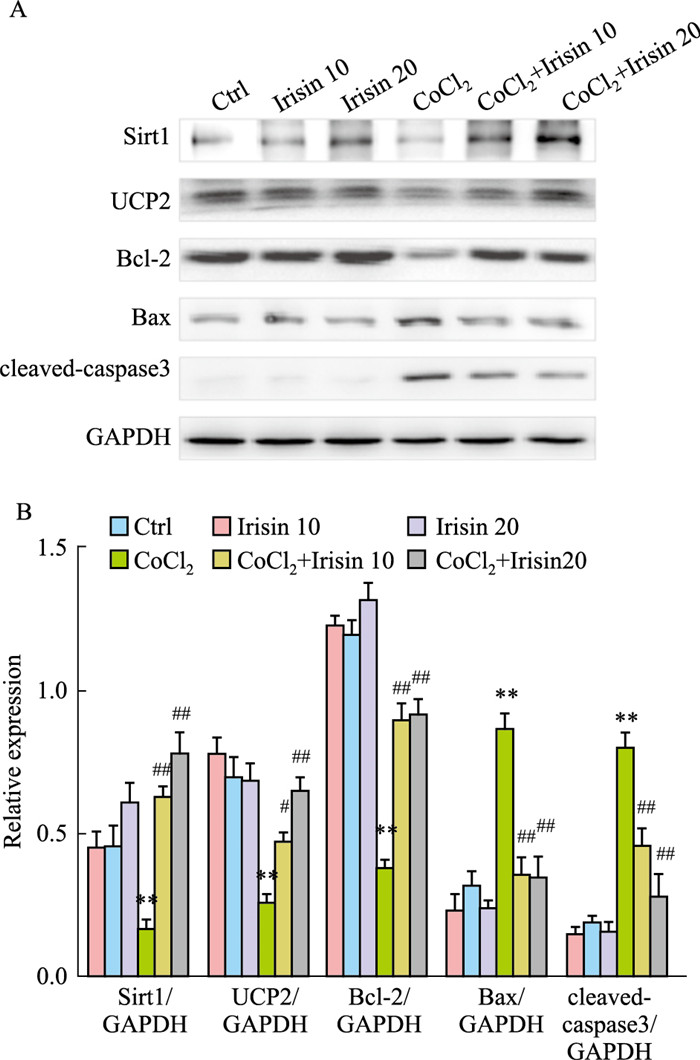
通过Western blot检测细胞内不同蛋白的表达水平反应细胞内通路的变化,结果表明,CoCl2处理下调H9c2细胞内保护蛋白Sirt1、UCP2和抗凋亡蛋白Bcl-2的表达,而明显上调了凋亡相关蛋白cleaved-caspase3和Bax,与流式凋亡结果一致;Irisin(10 nmol·L-1,20 nmol·L-1)预保护治疗组明显增加Sirt1、UCP2和Bcl-2蛋白的表达量,下调Bax、cleaved-caspase3表达量,见Fig 4。
|
| Fig 4 Changes of protein levels of H9c2 cells treated with Irisin (10, 20 nmol·L-1) and CoCl2 (500 μmol·L-1) (n=3) **P<0.01 vs Control; #P<0.05, ##P<0.01 vs CoCl2 group. |
当今社会,心血管疾病仍然威胁着人们的生命健康,而高发的心肌梗死的治疗依旧是一大难题[1]。心肌梗死的防治除了积极倡导健康的生活方式,了解其发病机制、积极寻求治疗策略也很重要。冠状动脉持续性缺氧缺血,或吸入化学有毒试剂引起心肌细胞无法正常有效的利用血氧维持能量供应,导致心肌细胞发生凋亡,心脏功能紊乱,收缩力下降,最终发展为心衰[2]。在此过程中心肌细胞对心脏的功能起着非常重要的作用,因此积极寻找拮抗心肌细胞发生损伤凋亡的靶点和药物是心梗治疗的重要途径[9]。
物理性缺氧模型和化学性缺氧模型是两大心肌细胞的体外建立缺氧的有效模型[10]。物理性缺氧模型需要缺氧孵箱辅助,而化学性缺氧简便易行、重复性好。CoCl2处理可引起典型的化学性缺氧,查阅文献CoCl2引起缺氧的有效浓度范围广,在H9c2细胞上500 μmol·L-1可明显降低细胞活力,建立稳定的缺氧模型[11]。在本研究中,使用500 μmol·L-1 CoCl2处理H9c2细胞建立缺氧模型。处理24 h后,心肌细胞活力明显下降,凋亡水平增加,细胞内ROS水平增加,线粒体膜电位遭到严重破坏,由此可推断此浓度下CoCl2处理的H9c2心肌细胞发生化学缺氧,能量代谢障碍,细胞损伤严重,模型建立成功。此外,检测细胞内蛋白表达,结果表明细胞内抗凋亡稳态已被破坏,体现在抗凋亡蛋白Bcl-2表达量明显下降,而诱导凋亡途径已被激活,Bax、cleaved-caspase3表达量明显上调,与模型表现一致。
Irisin是一种激素样多肽,可由运动产生,且参与多种生理和代谢途径[4]。以前的研究表明,Irisin可调节骨代谢、拮抗心肌肥大和神经损伤等[4-8, 12-13]。本研究中不同浓度的Irisin进行预保护呈浓度依赖的抵抗CoCl2引起的H9c2细胞损伤,恢复心肌细胞活力。此外通过流式细胞术检测凋亡发现Irisin可明显降低CoCl2引起的H9c2细胞凋亡水平;Western blot法检测表明Irisin可明显下调CoCl2诱导的细胞凋亡相关蛋白Bax,cleaved-caspase3,上调抗凋亡蛋白Bcl-2表达增加。因此推断出Irisin对CoCl2诱导的心肌细胞缺氧损伤有保护作用。
ROS检测证明Irisin单独处理不影响细胞内的ROS水平,表明Irisin作为一个机体内存在的激素样因子,不会产生异源性反应,正常情况下不影响细胞的生理功能。而CoCl2处理明显升高细胞内ROS,表明细胞内氧化还原稳态被打破,而这种CoCl2诱导破坏的稳态能被Irisin预保护处理恢复。ROS水平高低与细胞的氧化应激损伤程度密切相关,反映线粒体能量代谢障碍情况。作为以剧烈反应为基础,为细胞输出能量的主要细胞器的线粒体,内外生物膜两侧的膜电位是保障其发挥正常生理功能的重要条件,且线粒体膜电位降低会影响细胞的存活[14]。本研究中,Irisin的预保护明显抑制CoCl2诱导的H9c2心肌细胞中线粒体的损伤。
线粒体氧化磷酸化是不完全耦合的,因为被电子传递链的特定呼吸复合体转移到膜间空间的质子可以独立于ATP合酶返回线粒体基质—这一过程被称为质子泄漏(产生热量而不是ATP)[15]。线粒体内膜的质子泄漏增加了呼吸速率,降低了电化学质子梯度(Δp),是能量耗散的重要机制,占基础代谢率的25%。在分离的线粒体中,线粒体超氧化物的产生高度依赖Δp,相应地,线粒体解偶联已被确定为氧化应激条件下的细胞保护策略。线粒体解偶联蛋白(UCPs)能够降低氧化磷酸化的效率,并参与控制线粒体ROS的产生[15]。有证据表明,解偶联蛋白2(UCP2)参与减少ROS的产生和线粒体ROS的清除来保护线粒体免受氧化损伤,同时,发现UCP2可以预防中风和脑外伤后的神经元凋亡、缺血/再灌注损伤或衰老[16]。而Irisin抑制CoCl2引起的细胞内氧化应激损伤和细胞凋亡是否通过调节UCP2的表达发挥作用还未可知,因此,我们采用Western blot法检测了细胞内UCP2的蛋白表达水平。结果显示缺氧模型组中UCP2的蛋白表达明显下调,与细胞内的ROS水平增加,线粒体膜电位降低,细胞凋亡增多的表型相符,而相比缺氧模型组,Irisin预保护治疗组有效逆转了CoCl2所诱导的UCP2蛋白的变化,阻止了H9c2心肌细胞ROS的过量产生以及线粒体功能障碍的发生。
Sirt1是一种普遍表达的蛋白质,在多种疾病的病理学进展和治疗中具有复杂的作用。Sirt1是一种NAD+依赖性去乙酰化酶,通过组蛋白去乙酰化调节基因表达[17]。文献表明Sirt1可减少细胞内ROS的产生,预防氧化应激。此外有证据表明Sirt1可通过调控PGC-1α调节UCP2的表达,进而减轻氧化应激介导的神经元细胞凋亡[18]。在CoCl2引起的缺氧环境下,Irisin对UCP2的调节是否与Irisin对Sirt1蛋白的调节相关联?我们检测了细胞内Sirt1蛋白的表达水平,结果表明在CoCl2诱导的缺氧模型中,细胞内保护蛋白Sirt1的表达明显下调,Irisin的预保护可明显上调Sirt1蛋白的表达,与UCP2的表达变化一致。因此,Irisin拮抗CoCl2引起的H9c2细胞损伤可能通过激活细胞内的Sirt1和UCP2信号途径的调节。
综上所述,Irisin作为参与机体多种生理过程的激素样因子,对CoCl2诱导引起的H9c2心肌细胞缺氧损伤具有明显的保护作用,其机制是通过激活Sirt1/UCP2信号调节轴抑制CoCl2诱导的ROS增加、线粒体膜电位破坏,阻止细胞凋亡,改善细胞存活率。本项研究阐明了Irisin对心肌细胞缺氧损伤保护机制的具体实验依据,同时,Irisin作为一个体内肌肉因子,其安全性有一定保障,这也为进一步开发Irisin临床治疗心血管疾病奠定了良好的基础。
| [1] |
Gulati R, Behfar A, Narula J, et al. Acute myocardial infarction in young individuals[J]. Mayo Clin Proc, 2020, 95(1): 136-56. doi:10.1016/j.mayocp.2019.05.001 |
| [2] |
Reed G W, Rossi J E, Cannon C P. Acute myocardial infarction[J]. Lancet, 2017, 389(10065): 197-210. doi:10.1016/S0140-6736(16)30677-8 |
| [3] |
Zeymer U, Bueno H, Granger C B, et al. Acute cardiovascular care association position statement for the diagnosis and treatment of patients with acute myocardial infarction complicated by cardiogenic shock: A document of the acute cardiovascular care association of the european society of cardiology[J]. Eur Heart J Acute Cardiovasc Care, 2020, 9(2): 183-97. doi:10.1177/2048872619894254 |
| [4] |
Crujeiras AB, Pardo M, Casanueva F F. Irisin: 'fat' or artefact[J]. Clin Endocrinol (Oxf), 2015, 82(4): 467-74. doi:10.1111/cen.12627 |
| [5] |
Boström P, Wu J, Jedrychowski M P, et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis[J]. Nature, 2012, 481(7382): 463-8. doi:10.1038/nature10777 |
| [6] |
Kim O Y, Song J. The role of irisin in Alzheimer's disease[J]. J Clin Med, 2018, 7(11): 407. doi:10.3390/jcm7110407 |
| [7] |
Colaianni G, Cinti S, Colucci S, et al. Irisin and musculoskeletal health[J]. Ann N Y Acad Sci, 2017, 1402(1): 5-9. doi:10.1111/nyas.13345 |
| [8] |
Restuccia R, Perani F, Ficarra G, et al. Irisin and vascular inflammation: beneficial effects of a healthy lifestyle beyond physical activity[J]. Curr Pharm Des, 2021, 27(18): 2151-5. doi:10.2174/1381612827666210208154105 |
| [9] |
Ramachandra C J A, Hernandez-Resendiz S, Crespo-Avilan G E, et al. Mitochondria in acute myocardial infarction and cardioprotection[J]. E Bio Medicine, 2020, 57: 102884. |
| [10] |
Muñoz-Sánchez J, Chánez-Cárdenas M E. The use of cobalt chloride as a chemical hypoxia model[J]. J Appl Toxicol, 2019, 39(4): 556-70. doi:10.1002/jat.3749 |
| [11] |
Cheng C I, Lee Y H, Chen P H, et al. Cobalt chloride induces RhoA/ROCK activation and remodeling effect in H9c2 cardiomyoblasts: involvement of PI3K/Akt and MAPK pathways[J]. Cell Signal, 2017, 36: 25-33. doi:10.1016/j.cellsig.2017.04.013 |
| [12] |
Briganti S I, Gaspa G, Tabacco G, et al. Irisin as a regulator of bone and glucose metabolism[J]. Minerva Endocrinol, 2018, 43(4): 489-500. |
| [13] |
Li R L, Wu S S, Wu Y, et al. Irisin alleviates pressure overload-induced cardiac hypertrophy by inducing protective autophagy via mTOR-independent activation of the AMPK-ULK1 pathway[J]. J Mol Cell Cardiol, 2018, 121: 242-55. doi:10.1016/j.yjmcc.2018.07.250 |
| [14] |
Ma Z J, Lu L, Yang J J, et al. Lariciresinol induces apoptosis in HepG2 cells via mitochondrial-mediated apoptosis pathway[J]. Eur J Pharmacol, 2018, 821: 1-10. doi:10.1016/j.ejphar.2017.12.027 |
| [15] |
Cadenas S. Mitochondrial uncoupling, ROS generation and cardioprotection[J]. Biochim Biophys Acta Bioenerg, 2018, 1859(9): 940-50. doi:10.1016/j.bbabio.2018.05.019 |
| [16] |
Hass D T, Barnstable C J. Uncoupling proteins in the mitochondrial defense against oxidative stress[J]. Prog Retin Eye Res, 2021, 83: 100941. doi:10.1016/j.preteyeres.2021.100941 |
| [17] |
黄春辉, 张在军. 激活AMPK/SIRT1/PGC-1α信号通路调控线粒体能量代谢在肌萎缩性侧索硬化症治疗中的潜力[J]. 中国药理学通报, 2022, 38(3): 325-9. Huang C H, Zhang Z J. Therapeutic potential for amyotrophic lateral sclerosis through regulating mitochondrial energy metabolism via activating AMPK/SIRT1/PGC-1α signaling pathway[J]. Chin Pharmacol Bull, 2022, 38(3): 325-9. |
| [18] |
Huang J, Liu W, Doycheva D M, et al. Ghrelin attenuates oxidative stress and neuronal apoptosis via GHSR-1α/AMPK/Sirt1/PGC-1α/UCP2 pathway in a rat model of neonatal HIE[J]. Free Radic Biol Med, 2019, 141: 322-37. doi:10.1016/j.freeradbiomed.2019.07.001 |

