

2. 成都医学院检验医学院,四川 成都 610083
2. School of Laboratory Medicine, Chengdu Medical College, Chengdu 610083, China
槐定碱(sophoridine,SRI)主要存在于多种豆科植物中,包括苦豆子Sophora alopecuroides L.、苦参Sophora flavescentis Ait.和白刺花Sophora davidii(Franch.) skeels.等植物。苦豆子曾被收载于1977年版的《中国药典》中,性寒、味苦,具有清肠、燥湿功效,用于急性菌痢、肠炎[1],主要含有苦参类生物碱。苦参始载于我国最早药学专著《神农本草经》,性寒、味苦,具有清热解毒、杀虫、利尿等功效,用于热痢、便血、黄疸尿闭、湿疹、湿疮、皮肤瘙痒等病证,主要含黄酮类及生物碱类成分,其中生物碱类主要是喹诺里西啶生物碱,包括苦参碱、槐果碱、槐定碱等[2]。白刺花记载于《中药大辞典》,性味苦、寒,具有清热燥湿、凉血解毒、利湿消肿等功效,用于湿热痢疾、肝炎、皮肤瘙痒、滴虫性阴道炎、尿血、热毒痈疡、咽喉肿痛等病证[3],主要含有生物碱类和黄酮类化合物,生物碱包括氧化苦参碱、槐果碱、槐定碱、槐胺碱等。现代研究表明上述3味药材均有抗炎、抗菌和抗病毒作用,是其清热燥湿解毒功效的药理学基础。
SRI又名异苦参碱或苦参次碱-15-酮,是一种喹诺里西啶生物碱,分子式为C15H24N2O,分子量248.37 u,为2个三价氮原子稠合双哌啶环的基本结构(是其发挥生物活性的关键结构,见Fig 1)。SRI为白色或浅黄色结晶生物碱单体,通常可溶于水、甲醇、乙醇和四氯化碳等溶剂中。研究表明,SRI具有抗肿瘤、抗炎、抗心律失常、抗病毒和镇痛等多种药理活性[4]。本文通过查阅、分析近15年来有关SRI的抗病毒活性及机制研究报道,对其进行归纳总结(见Fig 1)。
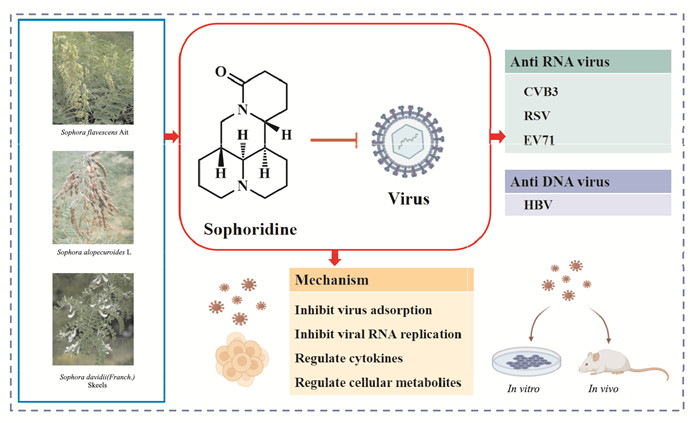
|
| Fig 1 Source, structure, antiviral activity and mechanism of sophoridine |
近年来,学者们对中药提取物抗病毒作用的研究逐渐成为热点,SRI的抗病毒作用亦受到关注。目前,SRI抗病毒作用研究主要集中在柯萨奇病毒(coxsackievirus,CV)B3、呼吸道合胞病毒(respiratory syncytial virus,RSV)、肠道病毒71(enterovirus 71,EV71)和乙型肝炎病毒(hepatitis B virus,HBV)的预防和治疗方面。
1.1 CVB3CV是一种单股正链RNA病毒,属于微小核糖核酸病毒科肠道病毒属,可分为A(coxsackievirus group A,CVA)和B(coxsackievirus group B,CVB)两组。柯萨奇病毒侵入机体后,轻者引起上呼吸道感染,出现咳嗽、发热等感冒症状,严重感染可引起病毒性心肌炎、心包炎、肝炎和脑膜炎等疾病。其中,CVB3是引起儿童和青年人急慢性病毒性心肌炎的重要病原体之一。
杨志伟等[5]运用光学显微镜观察及MTT法研究SRI抗CVB3的作用,发现SRI在0.125、0.25 g·L-1浓度时能抑制CVB3感染后的HeLa细胞病变。若预防性给药,药物对细胞保护率分别为40.3%和41.8%,且两种浓度的药物对CVB3病毒所致细胞病变效应(cytopathic effect,CPE)的抑制作用明显强于阳性药盐酸胍(0.125 g·L-1);若CVB3感染后给药,药物对细胞保护率则分别为88.4%和88.43%;若将药物与CVB3同时加入细胞,两种浓度药物的细胞保护率分别为61.2%和55.2%;若药物与CVB3预先培养2 h,再加入单层细胞,SRI的细胞保护率分别为87.3%和89.5%。上述结果表明SRI有抗CVB3病毒作用,且感染后给药及药物与病毒先作用2 h后再加入细胞的组别抗病毒作用较强(>87%),推测其抗病毒作用机制可能是药物直接灭活游离病毒或进入细胞内影响病毒的复制。
刘晓玲等[6]在Vero细胞和SD新生乳鼠原代心肌细胞中建立CVB3感染模型,MTT法和病毒繁殖抑制法探究了SRI对CVB3的抑制作用。结果显示,SRI浓度在15.6、31.3、62.5 mg·L-1时,对CVB3引起的上述两种细胞的CPE有明显的量-效关系抑制作用,提高心肌细胞存活率。此外,苦参系列生物碱对CVB3引起的Vero细胞和原代心肌细胞的CPE抑制作用的强弱顺序为:槐果碱>苦参碱>SRI>氧化槐果碱、苦豆碱、槐胺碱、槐醇碱。Zhang等[7]用SRI(1、5 mg·L-1)处理感染CVB3的原代心肌细胞,发现药物可使病毒滴度明显下降。
体内实验中,Zhang等[7]采用腹腔接种CVB3诱导的BALB/c小鼠轻度心肌炎模型,每天灌胃SRI(20、40 mg·kg-1),连续7 d,发现两种剂量的药物均明显提高小鼠存活率。与病毒组小鼠相比,药物组心脏体质量比(HW/BW)、病毒滴度和心肌切片病理学评分均明显降低。CVB3引起的心脏组织坏死和单核细胞浸润感染明显降低,表明SRI能抑制CVB3,从而减轻其引起的小鼠心肌炎。
1.2 RSVRSV是一种RNA病毒,属于肺炎病毒属成员之一,其感染是通过病毒糖蛋白(G)附着到细胞表面引起。该病毒感染可引起新生儿、幼儿、免疫缺陷个体和老年人发生严重的细支气管炎和肺炎,其中1岁以下的婴儿感染此病毒的发生率高达70%,且几乎所有3周岁以下的儿童均易感染该病毒,引起急性下呼吸道感染。RSV严重威胁人类健康,但目前尚无疫苗或有效的抗病毒疗法。研究者在筛选抗RSV药物时,发现苦参中的活性成分SRI能抑制RSV复制。采用RSV感染Hep-2细胞建立病毒感染模型,发现SRI对病毒50%抑制浓度(50% inhibitory concentration,IC50)为0.042 g·L-1,对Hep-2细胞增殖活性的CC50为0.25 g·L-1,选择指数SI(SI=CC50/IC50)为6.0,表明SRI有一定抗RVS活性[8]。
1.3 EV71EV71是单股、正链RNA病毒,属于小RNA核糖核酸病毒科肠道病毒属。EV71是引起5岁以下儿童患手足口病流行的主要病原体之一,可感染中枢神经系统,导致严重甚至危及生命的神经系统疾病,严重时可引起肌肉痉挛、肺水肿及心肺衰竭等并发症。尽管近年来许多国家研究手足口病疫苗和药物,但目前尚无药物可直接用于临床治疗EV71感染。因此,迫切需要研究能减少手足口病传播方面的药物。欧阳刘健等[9]报道,SRI能抑制引起手足口病的EV71的感染,在Vero细胞中SRI的IC50为0.354 g·L-1,CC50为1.414 g·L-1,SI为3.99,表明SRI是细胞毒性较低,安全性较高的药物。此外,研究发现SRI自0.031 3 g·L-1开始能浓度依赖性地抑制EV71吸附,自0.062 5 g·L-1开始能浓度依赖性地抑制EV71的RNA复制,但对病毒穿入细胞的抑制作用很弱,提示SRI主要是通过抑制EV71吸附和复制阶段,产生抗EV71作用。
1.4 HBVHBV感染是由嗜肝DNA病毒引起的一个严重的全球性健康问题。长期感染该病毒会导致慢性肝炎和晚期肝病,包括肝硬化和肝细胞癌,严重威胁人类健康[10]。在HBV感染的HepG2.2.15细胞模型中,Chen等[11]通过用0.1~0.4 g·L-1浓度苦参类生物碱处理感染细胞,发现SRI能通过降低HBsAg、HBeAg和细胞内HBV DNA,表现出抗HBV的活性。值得注意的是,SRI抗HBV病毒的机制可能与下调p38 MAPK、TRAF6、ERK1、NLRP10和caspase-1等潜在靶点有关。氧化苦参碱对拉米夫定耐药乙型肝炎病毒株表现出良好的抗病毒作用,而Chen等[11]的研究表明,SRI的体外抗HBV作用优于氧化苦参碱,尤其在降低HBV DNA滴度方面。在HepG2.A64细胞中,陈佳欣[12]对耐药HBV进行SRI和恩替卡韦联合治疗,结果发现,SRI(0.04、0.08 mmol·L-1)和恩替卡韦(0.01 mmol·L-1)两种药物联合使用对耐药HBV效果增强,明显优于两种药物单独使用的效果。
综上,SRI对上述4种病毒的体外抑制活性表现见Tab 1。
| Virus | Cell line | TD0/g·L-1 | IC50/g·L-1 | CC50/g·L-1 | SI | References |
| CVB3 | Hela cells | 0.500 | NA | 1.000 | NA | [5] |
| Vero cells | 0.156 | NA | 0.387 | NA | [6] | |
| Primary myocardial cells | 0.075 | NA | 0.187 | NA | [6] | |
| RSV | Hep-2 cells | NA | 0.042 | 0.250 | 6.00 | [8] |
| EV71 | Vero cells | NA | 0.354 | 1.414 | 3.99 | [9] |
| HBV | HepG2.A64 cells | NA | 0.463 | 1.037 | 2.24 | [12] |
| TD0: maximum non-toxic concentration; IC50: 50% inhibitory concentration; CC50: 50% cytotoxic concentration; SI: selection index, CC50/IC50; NA: Not available. | ||||||
宿主感染病毒后,药物可通过直接和间接方式发挥抗病毒作用。文献报道,SRI可通过多种途径抑制病毒,包括抑制病毒吸附、调节细胞因子和代谢产物。
2.1 抑制病毒吸附SRI能明显抑制EV71在Vero细胞上的吸附。研究者运用MTT法探究SRI对EV71病毒吸附和渗透的影响,结果发现,SRI明显抑制EV71的吸附过程,250 mg·L-1的SRI可观察到50%的细胞活力;在EV71渗透过程中,1 000 mg·L-1的SRI仅观察到29.7%的细胞活力,提示SRI能通过抑制EV71吸附从而发挥抗病毒作用[13]。
2.2 调节细胞因子SRI明显降低原代培养心肌细胞中CVB3的病毒滴度,表明其对CVB3具有较强的抗病毒活性,为病毒性心肌炎的潜在治疗药物。相关机制研究表明,SRI明显提高γ干扰素(interferon γ,IFN-γ)和白细胞介素10(interleukin 10,IL-10)的mRNA表达,降低肿瘤坏死因子α(tumor necrosis factor α,TNF-α)mRNA表达,提示SRI可通过提高IFN-γ和IL-10的表达抑制炎症反应,增强宿主抵抗病毒感染的能力,通过抑制TNF-α表达来抑制心肌细胞凋亡和心肌功能障碍,预防CVB3感染引起的小鼠心肌坏死和单核细胞浸润。综上,SRI通过调节细胞因子的表达,对CVB3发挥抗病毒作用[7]。
2.3 调节细胞代谢产物SRI可通过调节细胞的代谢产物,干扰病毒复制。研究者基于HBV感染HepG2.2.15细胞模型,利用代谢组学筛选了SRI调节的代谢产物,发现环亮氨酸和植物鞘氨醇可能参与抗HBV作用。环亮氨酸是甲硫氨酸腺苷转移酶的竞争性抑制剂,它的下调能增加甲硫氨酸腺苷转移酶的活性,促进S-腺苷甲硫氨酸的形成,从而促进DNA或蛋白质的甲基化。HBV感染可减少肝癌细胞中S-腺苷甲硫氨酸产生,给予SRI后能引起环亮氨酸水平降低,S-腺苷甲硫氨酸水平升高,从而促使病毒DNA或蛋白质的甲基化。因此,推测SRI的抗HBV作用可能与升高HBV DNA甲基化水平相关,致使HBV病毒蛋白表达的下调[11]。植物鞘氨醇是一种代谢物,可诱导p38 MAPK磷酸化增加,有研究证实p38 MAPK磷酸化有助于HBV抗原分泌和病毒DNA的复制。研究者发现用SRI处理感染细胞,细胞中植物鞘氨醇和p38 MAPK的水平下调,推测SRI可能通过下调植物鞘氨醇,致使p38 MAPK磷酸化水平降低,从而抑制HBV抗原分泌和病毒DNA的复制,表现出抗HBV作用[11]。环亮氨酸和植物鞘氨醇水平降低在SRI抗HBV活性中的作用尚需进一步研究来阐明。
3 SRI结构类似物的抗病毒作用机制由前文所述可知,针对SRI的抗病毒研究报道较少,但其结构类似物如苦参碱(matrine)、氧化苦参碱(oxymatrine)、槐果碱(sophocarpine)和氧化槐果碱(oxysophocarpine)的抗病毒研究报道则较丰富,而几种化合物的结构具有相似性(见Fig 2)。基于上述结构类似物的文献报道,可发现这些生物碱具有广谱的抗病毒作用,包括HBV、CVB3、RSV、EV71、猪繁殖与呼吸综合征病毒(porcine reproductive respiratory syndrome virus,PRRSV)、流感病毒(FLU)、牛乳头状瘤病毒(HPV)等。因此,本文同时对SRI结构类似物的抗病毒机制研究进行归纳、总结,为SRI抗病毒作用机制的深入研究提供借鉴,亦可推测其潜在的作用机制。据文献报道,这些生物碱结构类似物抗病毒机制可能为直接干扰病毒感染,包括阻滞病毒吸附和抑制病毒在宿主细胞内复制;或通过提高宿主的抗病毒能力间接抑制病毒,如增强宿主免疫功能、抗炎、抑制氧化应激等。
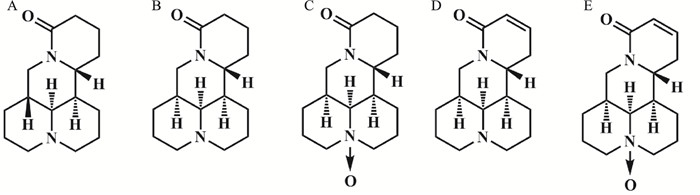
|
| Fig 2 Structure of sophoridine and its structural analogues: sophoridine (A), matrine (B), oxymatrine (C), sophocarpine (D) and oxysophocarpine (E) |
病毒进入宿主细胞释放其遗传物质至细胞质,然后利用宿主细胞的氨基酸、核苷酸和其他营养物质完成病毒复制,产生新的病毒。病毒的复制周期涉及到RNA中间体的逆转录途径和成熟后病毒颗粒分泌到体外,这一过程中会产生几个重要的复制中间体,包括共价闭合环状DNA(covalently closed circular DNA,cccDNA)、前基因组RNA(pregenomic RNA,pgRNA)和病毒松弛环状DNA(relaxed circular DNA,rcDNA)。抗病毒药物可针对病毒复制周期的1个或多个特定位点,产生抗病毒作用。Xu等[14]在HepG2.2.15细胞系上发现氧化苦参碱能抑制感染细胞分泌HBsAg和HBeAg,降低cccDNA和rcDNA,但增加pgRNA。进一步研究认为氧化苦参碱可能干扰pgRNA包装入核衣壳的过程,使pgRNA在肝细胞的细胞核或细胞质中积累,而减少核心颗粒中DNA的合成及形成核cccDNA,减少病毒复制;亦有可能是pgRNA被正常包裹入核衣壳,而氧化苦参碱能抑制病毒DNA聚合酶活性,从而干扰了pgRNA逆转录为病毒负链DNA的扩增过程,使pgRNA降解受阻[15]。综上,认为氧化苦参碱可能通过干扰pgRNA包装入核衣壳的过程,或抑制病毒DNA聚合酶的活性,来发挥抗病毒作用。另有研究表明,苦参碱能通过抑制病毒的N蛋白,阻碍病毒核衣壳的组装过程中与病毒RNA的相互作用,从而抑制病毒复制[16]。
3.2 增强免疫功能病毒侵入宿主后能触发宿主机体的免疫应答,包括先天性免疫和适应性免疫。先天性免疫是机体的第一道免疫防线,机体通过自然杀伤(natural killer, NK)细胞产生的细胞毒素和巨噬细胞介导的吞噬功能,消灭病毒和其他病原体,且巨噬细胞尚可通过释放多种可溶性细胞因子来调节免疫功能。在适应性免疫中,多种免疫细胞(T淋巴细胞、B淋巴细胞)产生的细胞因子和抗体,通过多种途径作用于病毒等病原体。陈曙霞等[17]在一项600例病毒性心肌炎患者的临床试验中发现,NK细胞活性在给予槐果碱后明显升高(治疗前6.20% vs治疗后17.14%),CD3+、CD4+、CD8+及CD4+/CD8+调节至接近正常水平,表明槐果碱可通过调节机体免疫功能,对抗病毒,改善心功能,有效治疗病毒性心肌炎。
樊宏伟等[18]开展苦参类生物碱体外抑菌和抗病毒研究,发现苦参类生物碱能通过诱生IFN-α,进而激活宿主细胞先天免疫机制,抵抗病毒感染。张明发等[19]发现,苦参类生物碱还可通过激活肝细胞IFN-α和microRNA-122的表达,进而抑制病毒对肝细胞的损害,产生抗HBV作用。氧化苦参碱除能抑制病毒复制外,还可通过上调Th1/Th2细胞因子(IFN-γ、IL-2、IL-4、IL-10)来增强特异性免疫反应,发挥抗病毒作用[20]。此外,槐果碱能提高CVB3病毒性心肌炎模型小鼠的IFN活性,抑制TNF活性,表明槐果碱在体内可能通过调节免疫发挥抗CVB3作用[21]。综上,提示在SRI抗病毒作用的进一步研究中,可从增强机体免疫功能方面着手,探究其是否可通过作用于免疫细胞,如巨噬细胞、淋巴细胞、中性粒细胞等,进而激活并调节机体免疫系统,发挥或增强抗病毒作用。
3.3 抗氧化正常生理条件下,机体抗氧化系统与活性氧(reactive oxygen species,ROS)产生二者处于动态平衡状态,协同调节机体信号的转导和细胞增殖等生理过程。氧化应激和炎症相互影响,共同维持机体内部的稳定状态[22]。氧化应激产生的ROS可激活机体信号通路,引起多种炎症因子的释放。反之,炎症因子的大量释放导致机体产生强烈的氧化应激反应,甚至造成机体组织损伤。生物碱可以通过调节多种炎症因子、缓解氧化应激来发挥抗炎、抗氧化作用。氧化槐果碱能抑制RSV的复制,提高RSV感染的肺上皮A549细胞的活力,作用发挥与其抑制RSV诱导的A549细胞促炎细胞因子(TNF-α、IL-6、IL-8)和趋化因子(RANTES、MIP-1α、MCP-1)的产生和释放,以及减少ROS产生,促进Nrf2激活从而增强RSV感染细胞中抗氧化酶(SOD、CAT、GPx、GST)的活性有关。结果表明,氧化槐果碱通过抑制氧化应激和炎症反应,减轻病毒感染引起的损伤[23]。
3.4 抗炎PRRSV感染能引起体外和体内IL-1β的释放增加。研究者发现,苦参碱在体外可通过抑制MyD88/NF-κB及NLRP3炎性小体激活来减少IL-1β的产生,抑制炎症反应,从而抑制PRRSV感染[24]。Sun等[25]在猪肺泡巨噬细胞(PAM细胞)上建立了PRRSV和2型猪圆环病毒(porcine circovirus type 2,PCV2)双重病毒共感染模型,发现苦参碱可抑制PRRSV/PCV2共感染,机制可能与抑制TLR3, 4/NF-κB/TNF-α信号通路有关。
陈小璇等[26]报道,氧化苦参碱抑制流感病毒在犬肾细胞(MDCK细胞)内复制,选择指数739.35,安全性较高。氧化苦参碱明显降低流感病毒诱导的TLR4、MyD88和TRAF6表达,抑制炎症因子(IL-1β、IL-6、IL-8、TNF-α)释放,其抗流感病毒作用与抑制病毒激活的TLR4-MyD88-TRAF6-NF-κB信号通路,减少炎症因子表达和释放有关。Dai等[27]发现, 氧化苦参碱可明显降低TLR3、TLR4、TLR7、MyD88和TRAF6基因启动子活性,抑制甲型流感病毒诱导的Akt、ERK1/2、p38 MAPK和NF-κB信号通路的激活,抑制炎症细胞因子(IL-1β、IL-6、IL-8、TNF-α)和MMP-2/MMP-9的表达,表现出抗炎和抗病毒作用。
4 小结病毒引起的传染病,其特点是传染性强、传播快及后果严重。因此,除研究疫苗外,抗病毒药物在治疗病毒性感染疾病中也发挥重要作用,但抗病毒药物治疗也面临严峻挑战,如耐药性、新病毒的出现等问题,因此抗病毒新药的研发至关重要。SRI作为一种来源于豆科槐属植物的生物碱,有丰富的生物活性,体外其对多种病毒表现出一定抑制作用。目前研究已证明了SRI具有抗CV、RSV、HBV及EV71的作用。药物抗病毒的作用机制主要涉及靶向病毒的直接途径和靶向宿主的间接途径两个方面。一方面,药物可通过直接干扰病毒本身来治疗病毒感染,如直接抑制或杀死病毒、干扰病毒吸附、防止病毒穿入细胞,以及抑制病毒的生物合成和病毒释放。另一方面,药物可提高宿主的抗病毒能力,间接抑制病毒,主要包括调控宿主免疫功能、调控病毒诱导的细胞自噬、抑制氧化应激、诱导宿主细胞调亡和调控PI3K-Akt-mTOR等信号通路等机制。然而截至目前,针对SRI抗病毒机制的相关研究较少,主要涉及抑制病毒吸附和RNA复制、调节细胞因子和代谢产物3方面。但SRI结构类似物的抗病毒机制研究则较丰富,主要有抑制病毒复制[14]、增强免疫功能[17]、抗氧化应激[23]和抗炎[27]等途径,为SRI抗病毒的深入研究提供了一定研究思路。
此外,抗病毒感染治疗中,药物的联合应用亦是一条有效的治疗途径,受到学者们的关注。如核苷类似物是HBV治疗最常用的药物,但长期且单一疗法使用可能会导致病毒耐药性和一些副反应的出现,由此不断有新的病毒感染治疗方法的探索,一些研究者建议将天然产物与核苷类似物联合使用以增强其疗效,缩短疗程。研究报道,植物源的氧化苦参碱与拉米夫定的临床组合能提高拉米夫定对HBV感染的疗效,与单独使用拉米夫定相比,二者联用可促进患者HBV-DNA和HBeAg的转阴,认为与氧化苦参碱提高机体免疫功能,配合拉米夫定作用于HBV聚合酶,抑制HBV复制而减少病毒繁殖[28]。氧化苦参碱还能延缓病毒对拉米夫定耐药性的发生。赵珊等[29]发现,苦参碱与拉米夫定联合运用可有效降低慢性HBV患者的肝纤维化程度,利于恢复肝功能。此外,苦参碱、氧化苦参碱、SRI和槐果碱联合胸腺多肽可抑制HepG2.2.15细胞中HBsAg和HBeAg的分泌及HBV DNA复制,同时通过促进IFN-α的表达来提高胸腺多肽的抗病毒作用[30]。
由此,基于SRI已有的抗病毒活性,为促进其发展和未来的临床应用,笔者认为今后的研究可从以下几方面开展:①目前SRI抗病毒活性研究多数是体外细胞水平的实验研究,其整体动物模型实验尚需进一步深入探究,尤其在开展其通过间接途径抗病毒机制研究方面,如影响免疫功能、抗炎、抗氧化应激作用;②运用药理学和/或代谢组学方法,探究SRI在体内内源性代谢产物的变化,直接反映出机体内生物化学的过程和状态的变化,进而阐明SRI作用过程和靶点,进一步揭示SRI抗病毒活性的机制;③目前文献报道SRI的抗病毒作用研究仅局限于CV、RSV、HBV及EV71 4种病毒,对其他病毒的药理活性尚未见报道,可通过高通量筛选技术,探究SRI对其他病毒株的抗病毒活性研究;④开展SRI与临床有效抗病毒化学药物联合用药的基础研究,从提高疗效、延缓耐药性产生等方面,进一步全面阐释其抗病毒作用的潜在应用价值。
| [1] |
Wang R Z, Deng X X, Gao Q, et al. Sophora alopecuroides L: an ethnopharmacological, phytochemical, and pharmacological review[J]. J Ethnopharmacol, 2020, 248: 112172. doi:10.1016/j.jep.2019.112172 |
| [2] |
Wu Y J, Shao Q, Zhen Z Q, et al. Determination of quinolizidine alkaloids in Sophora flavescens and its preparation using capillary electrophoresis[J]. Biomed Chromatogr, 2006, 20(5): 446-50. doi:10.1002/bmc.581 |
| [3] |
毛晓健, 陈海丰, 温敏. 白刺花不同极性提取部分的主要药效学研究[J]. 中华中医药杂志, 2009, 24(S1): 23-5. Mao X J, Chen H F, Win M. Pharmacodynamics of different polar extracts from Sophora davidii (Franch.) skeels[J]. China J Tradit Chin Med Pharm, 2009, 24(S1): 23-5. |
| [4] |
Tang Q, Liu Y, Peng X, et al. Research progress in the pharmacological activities, toxicities, and pharmacokinetics of sophoridine and its derivatives[J]. Drug Des Devel Ther, 2022, 16: 191-212. doi:10.2147/DDDT.S339555 |
| [5] |
杨志伟, 周娅, 曹秀琴. 苦豆子生物碱体外抗柯萨奇B3病毒的作用[J]. 四川中医, 2003, 21(3): 14-6. Yang Z W, Zhou Y, Cao X Q. Effect of sophora alopecuroides alkaloids against coxsackie B3 virus in vitro[J]. J Sichuan Tradit Chin Med, 2003, 21(3): 14-6. doi:10.3969/j.issn.1000-3649.2003.03.009 |
| [6] |
刘晓玲, 张勇, 刘小雷. 苦参系列生物碱体外抗CVB3病毒活性[J]. 沈阳药科大学学报, 2006, 23(11): 724-30. Liu X L, Zhang Y, Liu X L. Anti-coxsackievirus B3 effects of sophora flavescens alkaloids in vitro[J]. J Shenyang Pharm Univ, 2006, 23(11): 724-30. doi:10.3969/j.issn.1006-2858.2006.11.012 |
| [7] |
Zhang Y Y, Zhu H Y, Ye G, et al. Antiviral effects of sophoridine against coxsackievirus B3 and its pharmacokinetics in rats[J]. Life Sci, 2006, 78(17): 1998-2005. doi:10.1016/j.lfs.2005.09.034 |
| [8] |
Ma S C, Du J, But P P H, et al. Antiviral Chinese medicinal herbs against respiratory syncytial virus[J]. J Ethnopharmacol, 2002, 79(2): 205-11. doi:10.1016/S0378-8741(01)00389-0 |
| [9] |
欧阳刘健, 魏昌瑛. 培养细胞体系中槐定碱抗EV71病毒的作用[J]. 甘肃科技, 2016, 32(23): 130-4, 104. Ou-yang L J, Wei C Y. Effect of sophoridine against EV71 virus in cultured cell system[J]. Gansu Sci Technol, 2016, 32(23): 130-4, 104. doi:10.3969/j.issn.1000-0952.2016.23.047 |
| [10] |
相佳瑶, 许敏, 冯阳. 抗HBV天然化合物作用机制的研究进展[J]. 中国药理学通报, 2021, 37(10): 1346-51. Xiang J Y, Xu M, Feng Y. Research advance in anti-HBV natural products and their mechanism of ation[J]. Chin Pharmacol Bull, 2021, 37(10): 1346-51. |
| [11] |
Chen J X, Shen H H, Niu M, et al. Anti-hepatitis B virus effect of matrine-type alkaloid and involvement of p38 mitogen-activated protein kinase and tumor necrosis factor receptor-associated factor 6[J]. Virus Res, 2016, 215: 104-13. doi:10.1016/j.virusres.2015.12.005 |
| [12] |
陈佳欣. 苦参碱类生物碱抗乙型肝炎病毒作用及其机制研究[D]. 成都: 成都中医药大学, 2016. Chen J X. The research of the anti-hepatitis B virus effect and mechanism of matrine alkaloids[D]. Chengdu: Chengdu Univ Tradit Chin Med, 2016. |
| [13] |
Gang R, Ding G T, Zhang H Y, et al. Antiviral activity of sophoridine against enterovirus 71 in vitro[J]. J Ethnopharmacol, 2019, 236: 124-8. doi:10.1016/j.jep.2019.02.045 |
| [14] |
Xu W S, Zhao K K, Miao X H, et al. Effect of oxymatrine on the replication cycle of hepatitis B virus in vitro[J]. World J Gastroenterol, 2010, 16(16): 2028-37. doi:10.3748/wjg.v16.i16.2028 |
| [15] |
Jeong J H, Kwak D S, Rho H M, et al. The catalytic properties of human hepatitis B virus polymerase[J]. Biochem Biophys Res Commun, 1996, 223(2): 264-71. doi:10.1006/bbrc.1996.0882 |
| [16] |
Sun N, Wang Z W, Wu C H, et al. Antiviral activity and underlying molecular mechanisms of matrine against porcine reproductive and respiratory syndrome virus in vitro[J]. Res Vet Sci, 2014, 96(2): 323-7. doi:10.1016/j.rvsc.2013.12.009 |
| [17] |
陈曙霞, 陈美芳, 钱富荣, 等. 槐果碱注射液治疗病毒性心肌炎的临床研究[J]. 临床心血管病杂志, 2005, 21(10): 608-11. Chen S X, Chen M F, Qian F R, et al. A clinical research of sophocapine in the treatment of viral myocarditis[J]. J Clin Cardiol, 2005, 21(10): 608-11. |
| [18] |
樊宏伟, 卢继红, 张蓉. 苦参碱类生物碱的体外抑菌、抑病毒及诱生干扰素的实验研究[J]. 中医药信息, 2000(4): 75-6. Fan H W, Lu J H, Zhang R. Experimental study on bacteriostasis, virus inhibition and interferon induction of matrine alkaloids in vitro[J]. Inf Tradit Chin Med, 2000(4): 75-6. |
| [19] |
张明发, 沈雅琴. 苦参碱类生物碱抗乙型肝炎病毒的临床药理作用研究进展[J]. 抗感染药学, 2018, 15(1): 1-6. Zhang M F, Shen Y Q. Research progress on clinical pharmacological action of anti-hepatitis B virus of matrine-type alkaloids[J]. Anti-Infect Pharm, 2018, 15(1): 1-6. |
| [20] |
Dong Y H, Xi H L, Yu Y Y, et al. Effects of oxymatrine on the serum levels of T helper cell 1 and 2 cytokines and the expression of the S gene in hepatitis B virus S gene transgenic mice: a study on the anti-hepatitis B virus mechanism of oxymatrine[J]. J Gastroenterol Hepatol, 2002, 17(12): 1299-306. doi:10.1046/j.1440-1746.2002.02885.x |
| [21] |
杨志伟, 周娅, 曹秀琴. 槐果碱对感染CVB-3小鼠干扰素和肿瘤坏死因子水平的影响[J]. 山东中医药大学学报, 2003, 27(2): 146-9. Yang Z W, Zhou Y, Cao X Q. Effects of sophocarpine on activities of IFN and TNF in murine model with coxsackie virus B3-induced viral myocarditis[J]. J Shandong Univ Tradit Chin Med, 2003, 27(2): 146-9. |
| [22] |
杨君, 沙前坤, 李玉先, 等. 白藜芦醇苷通过MAPK和Nrf2/HO-1通路减轻LPS引起的炎症反应[J]. 中国药理学通报, 2021, 37(12): 1674-9. Yang J, Sha Q K, Li Y X, et al. Piceid reduces inflammatiory response caused by LPS through MAPK and Nrf2/HO-1 pathways[J]. Chin Pharmacol Bull, 2021, 37(12): 1674-9. |
| [23] |
Gao J, Li Y, Wang Q W, et al. Oxysophocarpine inhibits lung injury induced by respiratory syncytial virus[J]. Am J Transl Res, 2017, 9(9): 4083-93. |
| [24] |
Sun P P, Sun N, Yin W, et al. Matrine inhibits IL-1β secretion in primary porcine alveolar macrophages through the MyD88/NF-κB pathway and NLRP3 inflammasome[J]. Vet Res, 2019, 50(1): 53. |
| [25] |
Sun N, Sun P P, Lv H P, et al. Matrine displayed antiviral activity in porcine alveolar macrophages co-infected by porcine reproductive and respiratory syndrome virus and porcine circovirus type 2[J]. Sci Rep, 2016, 6(1): 24401. |
| [26] |
陈小璇, 代剑平, 万倩英. 氧化苦参碱抗流感病毒药效及机制研究[J]. 癌变·畸变·突变, 2014, 26(3): 175-9. Chen X X, Dai J P, Wan Q Y, et al. The effects and mechanisms of oxymatrine on anti-influenza A virus activity[J]. Carcino Terato Muta, 2014, 26(3): 175-9. |
| [27] |
Dai J P, Wang Q W, Su Y, et al. Oxymatrine inhibits influenza A virus replication and inflammation via TLR4, p38 MAPK and NF-κB pathways[J]. Int J Mol Sci, 2018, 19(4): 965. |
| [28] |
雷一凡, 李海华, 邓炳修, 等. 氧化苦参碱联合拉米夫定治疗慢性乙型肝炎临床观察[J]. 中国血液流变学杂志, 2005, 15(3): 422-3, 426. Lei Y F, Li H H, Deng B X, et al. Clinical study on oxymatrine /lamivudine combination in the treatment of chronic hepatitis B[J]. Chin J Hemorh, 2005, 15(3): 422-3, 426. |
| [29] |
赵珊, 于桂青, 徐瑞峰. 苦参碱联合拉米夫定治疗慢性乙型病毒性肝炎临床疗效及对肝纤维化指标的影响[J]. 新中医, 2021, 53(6): 59-62. Zhao S, Yu G Q, Xu R F. Clinical effect of matrine combined with lamivudine for chronic hepatitis B and its effect on liver fibrosis indexes[J]. J New Chin Med, 2021, 53(6): 59-62. |
| [30] |
刘晓琼, 沈宏辉, 陈佳欣, 等. 苦参碱类生物碱联合胸腺肽抗HBV作用研究[J]. 中国中药杂志, 2016, 41(7): 1275-81. Liu X Q, Shen H H, Chen J X, et al. Thymopolypeptides combined with matrine type alkaloids suppress HBV replication[J]. China J Chin Mater Med, 2016, 41(7): 1275-81. |

