

2. 长春中医药大学附属医院,吉林 长春 130021
2. Affiliated Hospital of Changchun University of Traditional Chinese Medicine, Changchun 130021, China
急性心肌梗死是导致心脏病患者发病和死亡的重要原因之一,发生心梗时可通过经皮冠状动脉介入术治疗再通堵塞的冠状动脉,但恢复冠脉血流过程中反而会加重心肌损伤,即为心肌缺血/再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)[1],现代医学对其发病机制暂无明确定论,有研究认为与细胞凋亡、细胞内钙离子超载及氧自由基的作用等有关。当心肌组织缺氧缺血时,线粒体代谢功能异常及心肌细胞膜受损,使内膜形成斑块,导致心肌梗死面积增大,大量氧自由基及炎症因子释放,加重心肌组织损伤。目前减轻MIRI的用药包括他汀类药物、降压药、促红细胞生成素等[2],这些药物虽能缓解MIRI患者的部分症状,但特异性差且副作用明显。近年来,中药因其活性成分及作用靶点丰富,作用途径多样,且疗效明显和副作用少等特点在心血管疾病的防治中受到关注。
MIRI的中医病机为心气虚损,心阳渐衰,并受到寒邪、七情内伤及饮食不节等因素影响,导致气虚血瘀,痰浊阻于心脉而致病。人参-红景天是参红通络方的君药药对,参红通络方是长春中医药大学附属医院心病科在本校已故国医大师任继学教授的“痰瘀伏邪”学说指导下创制的中药复方,对冠心病和急性心梗患者PCI术后症状的疗效显著[3],人参大补元气,益气养阴,气顺则血通,红景天益气活血化瘀。据现代药理学研究发现,人参皂苷可抑制心肌肥大,使血管再生速度加快,减少心肌细胞凋亡,红景天苷促使钙离子回到肌浆网,缓解因钙离子过载引起的心肌损伤,减轻心肌缺血等[4-5],人参-红景天是参红通络方产生显著疗效的核心,但其作用机制和涉及的生物过程目前尚不明确。
近几年,网络药理学的应用为中药的作用机制研究提供了方法和思路,它结合系统生物学、医学等多学科理论,使用计算机科学对生物系统进行网络数据分析,揭示了药物-活性成分-靶点-疾病之间互相作用网络,从而预测药物的作用机制,其系统性、综合性及整体性与中药的特点类似[6]。本研究拟通过网络药理学方法分析人参-红景天治疗MIRI潜在的作用靶点及机制,并通过分子对接技术和实验研究进行初步验证,为后续研究及临床应用提供理论基础。
1 方法 1.1 人参-红景天有效活性成分与靶点的收集与筛选人参:在TCMSP数据库(http://tcmspw.com/tcmsp.php)中以“人参”为关键词搜索,将参数中的口服生物利用度(oral bioavailability,OB)阈值及类药性阈值(drug-likeness,DL)设定为≥30%和≥0.18,得到人参的有效活性成分及蛋白靶点。
红景天:查阅红景天的相关文献[7-9],整合后得到红景天有效活性成分,在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)检索,确定成分的Canonical SMILES结构(注:因部分成分PubChem数据库尚未记录,则根据其成分命名和相关文献得出可能性最大的SMILES结构),输入Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/index.php),挑选可能性大于10%的作用靶点。使用Uniprot数据库(https://www.uniprot.org/),将“organisms”设置为“Human”,对人参和红景天的蛋白靶点进行Gene Symbol转换。
1.2 MIRI靶点的筛选在GeneCards(https://www.genecards.org/)、Disgenet(https://www.disgenet.org/home/)及DRUGBANK(https://go.drugbank.com/)数据库中以“Myocardial ischemia-reperfusion injury”为关键词搜索MIRI的蛋白靶点,合并以上3个疾病数据库结果并移除重复项后得到最终靶点。
1.3 药物与疾病共同靶点筛选为明确人参-红景天的活性成分及其靶点与疾病之间的相互作用,使用Venny2.1软件(https://bioinfogp.cnb.csic.es/tools/venny/)获得两者的交集靶点。
1.4 “药物-活性成分-靶点-疾病”网络构建将人参-红景天的有效活性成分及对应的靶点和MIRI靶点输入CytoScape3.7.2软件,构造药物-成分-靶点-疾病网络,并借助Network Analyzer网络分析插件,关注节点的连接度值(Degree),度值大表示涉及的生物功能多,重要性比较高。
1.5 人参-红景天与MIRI靶点PPI网络构建把交集靶点导入STRING11.0数据库(https://string-db.org/cgi/input.pl),将物种选为“Homo sapiens”,最低交互阈值为“highest confidence≥0.9”,得到蛋白相互作用网络(PPI)结果,用CytoScape3.7.2软件将PPI网络可视化,利用MCODE插件进一步分析,筛选出核心网络模块。
1.6 GO基因功能与KEGG信号通路富集分析在DAVID数据库(https://david.ncifcrf.gov/tools.jsp)中进行GO基因功能和KEGG信号通路富集分析,选择“Functional Annotation”功能,物种设为“Homo sapiens”,获取人参-红景天治疗MIRI的生物学过程与代谢通路数据,将所得数据导入“bioinformatics online tool” (http://www.bioinformatics.com.cn)制图,以气泡图形式呈现结果。
1.7 分子对接在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中下载人参-红景天活性成分的结构并转化为mol2格式保存,关键靶点蛋白来自于蛋白质数据库(https://www.rcsb.org/),将所得靶点蛋白导入AutoDockTools-1.5.6软件,删除水分子、添加氢原子并设置原子类型后,保存为PDBQT格式文件,通过AutoDock4.2.6进行分子对接,借助Pymol2.1软件对分子对接结果进行可视化。
1.8 动物实验 1.8.1 试验动物及药物选择28只健康的SD大鼠,体质量为(220~250) g,购自北京维通利华实验动物公司,动物许可证号:SCXK(京)2016-0006,动物实验经长春中医药大学动物伦理委员会批准(编号:2021201)。人参及红景天颗粒剂购自长春中医药大学附属医院制剂中心,3-MA抑制剂购自上海阿拉丁试剂公司。
1.8.2 试剂TNF-α(tumor necrosis factor-α,TNF-α)试剂盒(202103)、IL-6(interleukin-6,IL-6)试剂盒(202103)购自上海优选生物科技公司。
1.8.3 分组及给药将大鼠随机分为假手术组、MIRI模型组、人参-红景天组、3-MA组,每组各7只。参红通络方中剂量为人参9 g,红景天10 g,按人与大鼠体表面积折算的等效剂量比值0.018及草药与浓缩颗粒浓度比换算后,给药剂量是人参0.35 kg·d-1,红景天0.39 kg·d-1,腹腔注射3-MA,注射浓度为15 mg·kg-1·d-1,连续灌胃给药28 d。
1.8.4 实验造模及取材腹腔注射5%水合氯醛,麻醉固定大鼠,连接心电图,气管插管,连接小动物呼吸机,从左胸4、5肋间切开暴露心脏,用6-0缝合线结扎冠状动脉左前降支30 min,左侧心肌壁紫绀,心尖变白,心电图示Ⅱ导联ST段抬高0.2 mV,再灌注120 min后,ST段下降且紫绀消失即造模成功,假手术组仅穿线不结扎。结束后腹主动脉取血,4 ℃离心10 min后取血清保存,固定心脏组织。
1.8.5 HE染色法观察大鼠心肌组织损伤情况将固定后的心脏组织,脱水石蜡包埋切片,将切片依次放入二甲苯Ⅰ、Ⅱ及乙醇中,使用苏木精、伊红水溶液进行染色,脱水封片,在光学显微镜(×400)下观察各组大鼠心肌组织的病理学情况。
1.8.6 ELISA法测定大鼠TNF-α及IL-6的表达水平按ELISA试剂盒说明书步骤,检测各组大鼠TNF-α及IL-6的表达水平。
1.8.7 统计学分析使用SPSS 22.0软件分析所得数据,结果用x±s表示,检验正态分布,两两比较用t检验,多组比较用单因素方差分析(analysis of variance,ANOVA)。
2 结果 2.1 人参-红景天有效活性成分及靶点人参-红景天有效活性成分共43种,见Tab 1,作用靶点944个,将靶点经Uniprot数据库转换去重后得到人参作用靶点90个,红景天作用靶点258个,共348个。
| Number | Molecule name | Number | Molecule name | Number | Molecule name |
| HJT1 | Gallic acid | HJT15 | Quercetin-3-O-glucuronide | RS2 | Stigmasterol |
| HJT2 | Protocatechuic acid | HJT16 | Rhodionin | RS3 | Inermin |
| HJT3 | Salidroside | HJT17 | Quercitrin | RS4 | Aposiopolamine |
| HJT4 | Tyrosol | HJT18 | Eriodictyol | RS5 | Deoxyharringtonine |
| HJT5 | Caffeic acid | HJT19 | Crenuloside | RS6 | Dianthramine |
| HJT6 | Procyanidin B2 | HJT20 | Quercetin | RS7 | arachidonate |
| HJT7 | p-coumaric acid | HJT21 | Kenposide A | RS8 | Frutinone A |
| HJT8 | Ferulic acid | HJT22 | Creoside V | RS9 | Ginsenoside rh2 |
| HJT9 | Epicatechin gallate | HJT23 | Eicosyl ferulate | RS10 | Ginsenoside-Rh4_qt |
| HJT10 | Catechin gallate | HJT24 | beta-Sitosterol | RS11 | Girinimbin |
| HJT11 | 1,2,3,4,6-O-Pentagalloyl glucopyranoside | HJT25 | Hexacosanoic acid | RS12 | Panaxadiol |
| HJT12 | Afzelin | HJT26 | Stearic acid | RS13 | Suchilactone |
| HJT13 | Quercetin-3-glucoside | HJT27 | Nonadecane | RS14 | Alexandrin_qt |
| HJT14 | Rhodiosin | RS1 | Diop | RS15 | Fumarine |
将Disgenet数据库中Score设为0.3,得到MIRI靶点85个;将Genecards数据库中设定Relevance score>20,得到MIRI靶点173个,结合DRUGBANK数据库补充MIRI相关靶点,合并以上3个数据库结果并删去重复值,获得258个MIRI蛋白靶点。
2.3 人参-红景天与MIRI交集靶点筛选将人参-红景天的348个靶点和MIRI的258个靶点取交集并作图,见Fig 1,得到红景天与MIRI的靶点34个,人参与MIRI的共有靶点28个,人参-红景天与MIRI的交集靶点共有55个,此为人参-红景天治疗MIRI的关键性蛋白靶点。
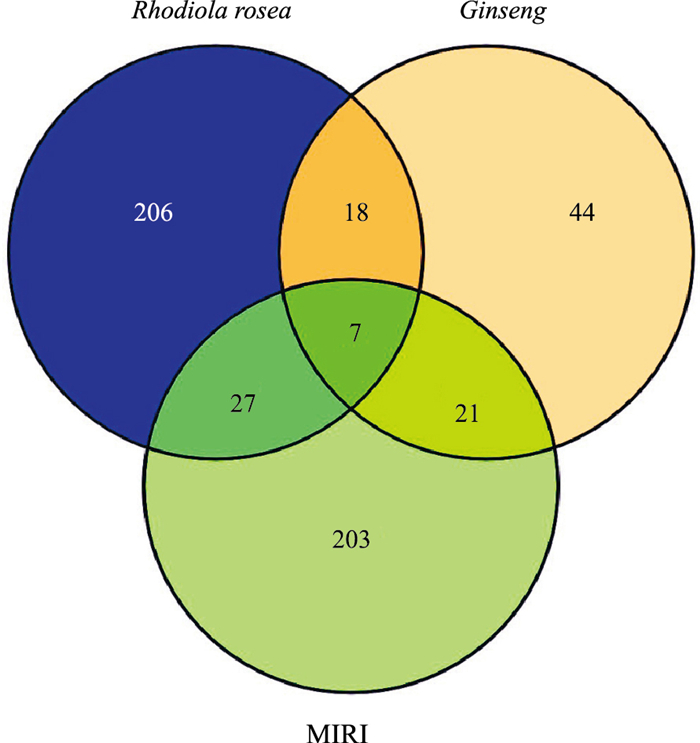
|
| Fig 1 Ginseng-Rhodiola rosea and MIRI intersection targets |
在“药物-活性成分-靶点-疾病”网络中,度值排名前10的有效活性成分为hexacosanoic acid、p-coumaric acid、stigmasterol、fumarine、stearic acid、caffeic acid、epicatechin gallate、beta-Sitosterol、ginsenoside rh2、salidroside,以上活性成分可能在人参-红景天治疗MIRI中起到关键性作用,因所获靶点较多,故以大于节点度值中位数2倍作为筛选条件,展示部分候选靶点,见Tab 2。
| Uniprot ID | Symbol | Target name |
| P35354 | PTGS2 | Prostaglandin G/H synthase 2 |
| P00918 | CA2 | Carbonic anhydrase 2 |
| Q15596 | NCOA2 | Nuclear receptor coactivator 2 |
| P00915 | CA1 | Carbonic anhydrase 1 |
| P06401 | PGR | Progesterone receptor |
| P42574 | CASP3 | Caspase-3 |
| P19793 | RXRA | Retinoic acid receptor RXR-alpha |
| P11229 | CHRM1 | Muscarinic acetylcholine receptor M1 |
| P14780 | MMP9 | Matrix metalloproteinase-9 |
| P03956 | MMP1 | Interstitial collagenase |
| P23975 | SLC6A2 | Sodium-dependent noradrenaline transporter |
| P35368 | ADRA1B | Alpha-1B adrenergic receptor |
| P08253 | MMP2 | 72 kDa type Ⅳ collagenase |
| P14867 | GABRA1 | Gamma-aminobutyric acid receptor subunit alpha-1 |
| Q14524 | SCN5A | Sodium channel protein type 5 subunit alpha |
| P07550 | ADRB2 | Beta-2 adrenergic receptor |
| P23219 | PTGS1 | Prostaglandin G/H synthase 1 |
| P20309 | CHRM3 | Muscarinic acetylcholine receptor M3 |
| P10275 | AR | Androgen receptor |
| Q07812 | BAX | Apoptosis regulator BAX |
PPI网络中共有节点73个,见Fig 2,节点连线越多表示其在蛋白调控中越重要,可视为PPI网络中的核心调控蛋白,该网络中蛋白互作频次排名前11的为TNF-α、IL-6、VEGFA、MAPK1、CASPASE-3、PTGS2、TP53、JUN、TLR4、IL-10、MAPK8,见Fig 3。

|
| Fig 2 PPI network diagram of Ginseng-Rhodiola Rosea and MIRI targets |
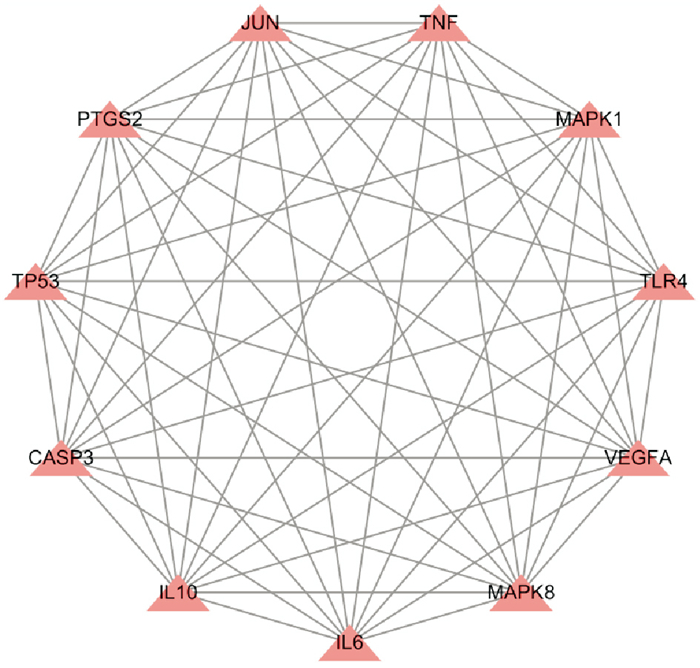
|
| Fig 3 Top 11 target proteins in PPI network graph in terms of frequency of interactions |
GO功能分析结果显示,生物学过程(biological process,BP)318个,分子生物学功能(molecular function,MF)55个、细胞组成过程(cellular components,CC)34个,KEGG信号通路89条,将Log10 P值排名前20的结果进行可视化,见Fig 4。
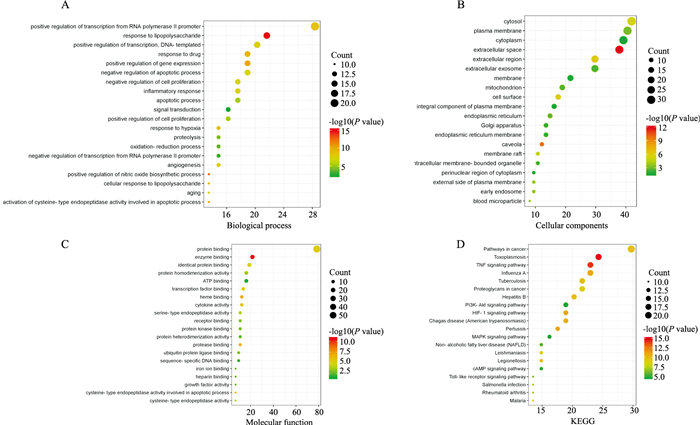
|
| Fig 4 GO gene function and KEGG signaling pathway enrichment results for Ginseng-Rhodiola rosea and MIRI intersection targets A:Biological process;B:Cellular component;C:Molecular function;D:KEGG signaling pathway |
人参-红景天治疗MIRI涉及的生物过程包括RNA聚合酶Ⅱ转录因子的正调控、对脂多糖的应答、凋亡过程的负调控、炎症应答、血管再生等,涉及的通路则包括TNF-α、HIF-1、PI3K-Akt及MAPK信号通路等,通路具体结果见Tab 3,涉及的细胞过程主要集中在转录因子结合、蛋白质结合、酶结合、蛋白激酶结合、血红素结合上,其交集蛋白靶点主要富集于胞质、浆膜、细胞质、线粒体、细胞核中,此外,人参-红景天还具有抗甲型流感,抗乙肝病毒,调治非酒精性脂肪肝及调治类风湿性关节炎的作用。
| GO | Description | Count | -Log10 P | Hits |
| hsa05200 | Pathways in cancer | 22 | 2.41E-10 | JUN,NOS2,MMP1,MMP2,F2R,STAT3,PTGS2,FGF2,HIF1A,MMP9,PIK3CG,VEGFA,CASP9,IL-6,MAPK8,CASP8,CASP3,BCL-2,BAX,MAPK1,PPARG,TP53 |
| hsa05145 | Toxoplasmosis | 18 | 5.17E-16 | IL-10,HSPA8,NOS2,STAT3,MAPK14,TNF-α,CASP9,MAPK8,CASP8,CD40LG,IFNG,CASP3,ALOX5,BCL-2,MAPK1,JAK2,TLR4,HSPA1A |
| hsa04668 | TNF-α signaling pathway | 17 | 7.47E-15 | JUN,EDN1,VCAM1,PTGS2,MAPK14,SELE,TNF-α,MMP9,PIK3CG,ICAM1,CASP7,IL-6,MAPK8,CASP8,IL-1β,CASP3,MAPK1 |
| hsa05164 | Influenza A | 17 | 1.69E-11 | HSPA8,JUN,PLG,MAPK14,TNF-α,PIK3CG,ICAM1,CASP9,IL-6,MAPK8,IFNG,IL-1β,CASP1,MAPK1,JAK2,TLR4,HSPA1A |
| hsa05152 | Tuberculosis | 16 | 2.55E-10 | IL-10,NOS2,MAPK14,TNF-α,CASP9,IL-6,MAPK8,CASP8,IFNG,IL-1β,CASP3,BCL-2,BAX,MAPK1,JAK2,TLR4 |
| hsa05205 | Proteoglycans in cancer | 16 | 1.43E-09 | ITGB3,MMP2,STAT3,MAPK14,FGF2,HIF1A,ESR1,TNF-α,MMP9,PIK3CG,VEGFA,CASP3,KDR,MAPK1,TP53,TLR4 |
| hsa05161 | Hepatitis B | 15 | 1.91E-10 | JUN,STAT3,TNF-α,MMP9,PIK3CG,CASP9,IL-6,MAPK8,CASP8,CASP3,BCL-2,BAX,MAPK1,TP53,TLR4 |
| hsa04066 | HIF-1 signaling pathway | 14 | 1.20E-11 | EDN1,FLT1,NOS2,STAT3,SERPINE1,HIF1A,PIK3CG,VEGFA,IL-6,IFNG,BCL-2,HMOX1,MAPK1,TLR4 |
| hsa05142 | Chagas disease (American try- panosomiasis) | 14 | 3.40E-11 | IL-10,JUN,NOS2,SERPINE1,MAPK14,TNF-α,PIK3CG,IL-6,MAPK8,CASP8,IFNG,IL-1β,MAPK1,TLR4 |
| hsa04151 | PI3K-Akt signaling pathway | 14 | 4.87E-05 | FLT1,ITGB3,F2R,FGF2,PIK3CG,VEGFA,CASP9,IL-6,KDR,BCL-2,MAPK1,JAK2,TP53,TLR4 |
| hsa05133 | Pertussis | 13 | 1.04E-11 | IL-10,JUN,NOS2,MAPK14,TNF-α,CASP7,IL-6,MAPK8,IL-1β,CASP3,CASP1,MAPK1,TLR4 |
| hsa04010 | MAPK signaling pathway | 12 | 5.53E-05 | HSPA8,JUN,MAPK8,IL-1β,CASP3,PLA2G4A,MAPK1,MAPK14,TNF-α,TP53,FGF2,HSPA1A |
| hsa05134 | Legionellosis | 11 | 1.37E-10 | CASP9,HSPA8,IL-6,CASP7,CASP8,IL-1β,CASP3,CASP1,TNF-α,TLR4,HSPA1A |
| hsa05140 | Leishmaniasis | 11 | 2.30E-09 | IL-10,JUN,IFNG,NOS2,IL-1β,MAPK1,JAK2,MAPK14,PTGS2,TNF-α,TLR4 |
| hsa04932 | Non-alcoholic fatty liver disease (NAFLD) | 11 | 3.22E-06 | IL-6,CASP7,JUN,MAPK8,CASP8,IL-1β,CASP3,BAX,PPARA,TNF-α,PIK3CG |
| hsa04024 | cAMP signaling pathway | 11 | 3.52E-05 | JUN,MAPK8,F2R,PDE3A,ADORA1,MAPK1,ADRB1,ADRB2,ATP1A1,PPARA,PIK3CG |
| hsa05144 | Malaria | 10 | 1.33E-09 | IL-10,IL-6,VCAM1,CD40LG,IFNG,IL-1β,SELE,TNF-α,TLR4,ICAM1 |
| hsa05132 | Salmonella infection | 10 | 1.60E-07 | IL-6,JUN,MAPK8,IFNG,NOS2,IL-1β,CASP1,MAPK1,MAPK14,TLR4 |
| hsa05323 | Rheumatoid arthritis | 10 | 2.67E-07 | IL-6,JUN,FLT1,IFNG,MMP1,IL-1β,TNF-α,TLR4,ICAM1,VEGFA |
| hsa04620 | Toll-like receptor signaling pathway | 10 | 1.32E-06 | IL-6,JUN,MAPK8,CASP8,IL-1β,MAPK1,MAPK14,TNF-α,TLR4,PIK3CG |
依据“2.4”及“2.5”项的结果,将度值前5的有效活性成分与蛋白互作频次前5的核心蛋白靶点分别进行分子对接,其配体及蛋白质信息见Tab 4,对接结合力结果见Tab 5。
| Gene | Protein name | PDB ID |
| TNF | Tumor necrosis factor | 7KPA |
| IL-6 | Interleukin-6 | 4O9H |
| VEGFA | Vascular endothelial growth factor A | 5DN2 |
| MAPK1 | Mitogen-activated protein kinase 1 | 4QP2 |
| CASP-3 | CASPASE-3 | 1NMS |
| Name | CASP-3 | IL-6 | MAPK1 | TNF | VEGFA |
| Beta-Sitosterol | -6.90 | -6.20 | -7.20 | -12.60 | -6.80 |
| Ginsenoside-rh2 | -8.00 | -6.40 | -7.50 | -11.60 | -6.80 |
| p-coumaric-acid | -5.10 | -5.50 | -5.70 | -7.80 | -6.00 |
| Salidroside | -6.00 | -6.00 | -6.40 | -9.00 | -6.60 |
| Stigmasterol | -7.50 | -6.70 | -8.80 | -13.20 | -7.10 |
其中与5个蛋白靶点对接打分及结合模式均有较好表现的活性成分是豆甾醇,人参皂苷rh2与CASP-3蛋白有相互作用的活性氨基酸残基包括TYR-204、PHE-256、GLU-248、PHE-247、TRP-214、ANS-208等,人参皂苷rh2的一端含有疏水链,一端含有亲水糖环,糖环及疏水链上的氧均能与氨基酸(TYR-204、GLU-248)的质子形成很强的氢键相互作用,氢键距离较短,结合能力强,这对锚定配体分子有着重要意义,并且其疏水链和疏水性氨基酸(TYR-204、PHE-256、PHE-247、TRP-214)形成了很强的疏水作用,可稳定小分子。人参皂苷rh2与蛋白口袋匹配度较高,且每一部分能够与口袋的凹槽形成较好的相互作用。综上所述,人参皂苷rh2与CASP-3蛋白靶点的结合力及对接打分表现最好,其他活性成分与5个靶点均能够与位点氨基酸形成氢键,与蛋白靶点匹配度较好,也是人参-红景天治疗MIRI过程中发挥疗效的关键成分。
最后将有效活性成分与蛋白靶点对接后形成的复合物利用Pymol2.1软件进行可视化,得到结合模型图,选择结合性好且匹配度高的进行展示,见Fig 5。
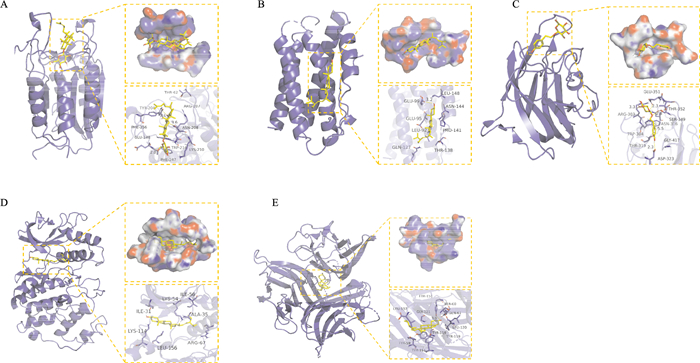
|
| Fig 5 Molecular docking of core active ingredients of Ginseng-Rhodiola rosea with key targets A:The binding mode of CASP-3 protein with ginsenoside rh2; B:The binding mode of IL-6 protein with stigmasterol; C:The binding mode of VEGFA protein with salidroside; D:The binding mode of MAPK1 protein with stigmasterol; E:The binding mode of TNF protein with stigmasterol |
假手术组大鼠的心肌组织无明显异常,MIRI模型组血管充血严重,心肌纤维坏死断裂,伴有炎性细胞点状浸润,心肌细胞水肿且排列紊乱;与MIRI模型组相比,人参-红景天组对大鼠心肌纤维坏死,炎性细胞浸润,心肌细胞水肿及血管充血情况有一定程度减轻,说明人参-红景天可以减轻大鼠心肌缺血/再灌注引起的心肌损伤,见Fig 6。

|
| Fig 6 Effect of Ginseng-Rhodiola rosea on myocardial tissues of MIRI rats (HE staining,×400) A:Sham-operated group; B:MIRI model group; C:Ginseng-Rhodiola group; D:3-MA group |
与假手术组相比,MIRI模型组的TNF-α及IL-6表达量均明显升高(P<0.05);与MIRI模型组对比,人参-红景天组及3-MA组的大鼠TNF-α及IL-6表达量降低(P<0.05或P<0.01);与3-MA组相比,人参-红景天组的TNF-α及IL-6表达量明显降低(P<0.01),见Tab 6。
| Group | IL-6/μg·L-1 | TNF-α/μg·L-1 |
| Sham | 32.39±2.2 | 55.09±1.75 |
| MIRI | 38.09±3.08# | 108.37±3.24# |
| Ginseng-Rhodiola | 32.99±4.55** | 64.29±8.73** |
| 3-MA | 34.23±1.68* | 84.04±8.26* |
| #P<0.05 vs sham,*P<0.05,**P<0.01 vs MIRI. | ||
中医根据MIRI临床症状可将其归为“胸痹”、“真心痛”、“心悸”范畴,病机包括痰瘀及气虚,为本虚标实证,治疗以益气化痰通络为主,人参及红景天均有益气活血化瘀之效。
研究结果显示,豆甾醇、β-谷甾醇、人参皂苷rh2及红景天苷等活性成分与MIRI蛋白靶点相互作用最多,提示其可能在治疗MIRI过程中起到关键作用。现代药理学研究发现,豆甾醇可借助AMPK-mTOR和JNK途径减轻氧化应激反应[10]。β-谷甾醇上调谷胱甘肽氧化还原循环保护受损心肌,具有抗凝血活性[11]。人参皂苷rh2可提升心肌细胞活力,缓解心肌纤维化,并具有抗氧化应激及抗炎作用[12]。红景天苷能提升MIRI大鼠心肌组织中Akt/GSK-3β蛋白表达,减少心肌炎性浸润,促进血管内皮修复[13]。
PPI网络显示,TNF-α、IL-6、VEGFA、MAPK1等可能是治疗MIRI的核心靶点,参与了炎症反应、免疫代谢及细胞增殖的相关通路。TNF-α及IL-6在心肌缺血缺氧后,表达水平升高,促进炎症产生,致使心肌功能障碍;VEGFA是血管生成、伤口愈合及癌症的调节因子;MAPK1可调节炎症反应并参与细胞增殖代谢[14]。
分子对接验证后显示,豆甾醇与IL-6、MAPK1及TNF-α等蛋白靶点的配体结合度均较好,其结合力分别为-6.70、-8.80及-13.20 kcal·mol-1。人参皂苷rh2与CASP-3蛋白靶点的结合力及对接打分表现最好,说明人参皂苷rh2、红景天苷及豆甾醇等活性成分在治疗MIRI中起到关键作用。动物实验结果显示,人参-红景天能减轻MIRI大鼠心肌纤维坏死,缓解心肌细胞水肿及浸润情况,降低MIRI大鼠TNF-α及IL-6的表达水平,表明人参-红景天可能通过调控TNF-α、IL-6等核心蛋白靶点,减轻炎症反应,保护心肌细胞,从而减轻缺血心肌损伤。
GO生物功能及KEGG通路富集分析结果显示,人参-红景天通过调节蛋白质结合、酶结合、转录因子结合等过程参与MIRI的炎症和免疫反应,主要涉及TNF-α、HIF-1、PI3K-Akt、MAPK等信号通路。TNF信号通路上的TNF-α与TNF-R1结合后募集蛋白FADD,富集caspase-8前体,激活并活化下游的caspase-3,将底物割裂促使心肌细胞凋亡[15]。在机体缺氧时,HIF-1信号通路上调与血管相关的蛋白表达水平,增加血流,重构细胞的代谢途径,保护心脏功能,是机体氧稳态的主要调节者[16]。PI3K-Akt信号通路激活PI3K,结合并磷酸化Akt,启动靶基因转录,作用于GSK-3β时减少心肌细胞凋亡,作用于mTOR可减轻炎症反应[17]。MAPK信号通路在细胞增殖凋亡和炎症反应中起重要作用,心肌缺氧时产生的活性氧激活p38MAPK,使细胞色素C释放,加重细胞凋亡[18]。
综上所述,本研究采用了网络药理学方法探究人参-红景天的有效活性成分及其治疗MIRI的潜在靶点和信号通路,并利用分子对接技术验证核心活性成分与潜在蛋白靶点的结合能力和匹配度,实验验证人参-红景天对MIRI的部分治疗作用及相关蛋白的表达水平,发现在人参-红景天治疗MIRI过程中,豆甾醇、人参皂苷rh2及红景天苷等活性成分可能作用于TNF-α、IL-6、MAPK1、CASPASE-3、VEGFA等核心蛋白靶点,通过TNF-α、HIF-1、PI3K-Akt等信号通路参与了炎症及免疫反应,保护心肌细胞,减轻心肌损伤,这为临床应用提供了新的理论支撑,也为阐明人参-红景天治疗MIRI的潜在作用机制提供了新的方向和思路,后期将继续通过实验研究对关键信号通路加以验证。
| [1] |
Hausenloy D, Botker H, Engstrom T, et al. Targeting reperfusion injury in patients with ST-segment elevation myocardial infarction:Trials and tribulations[J]. Eur Heart, 2017, 38: 935-41. |
| [2] |
刘瑞, 刘璐, 郭鹏. 心肌缺血/再灌注损伤的发病机制及其防治策略[J]. 世界最新医学信息文摘, 2019, 19(6): 73-4. Liu R, Liu L, Guo P. Pathogenesis of myocardial ischemia-reperfusion injury and its prevention and treatment strategies[J]. World Latest Med Information, 2019, 19(6): 73-4. |
| [3] |
常立萍, 尹金珠, 王义强, 等. 参红通络颗粒治疗冠心病稳定型心绞痛[J]. 吉林中医药, 2013, 33(12): 1226-8. Chang L P, Yin J Z, Wang Y Q, et al. Treatment of stable angina pectoris in coronary artery disease with Ginseng Hong Tong Luo Granules[J]. Jilin J Chin Med, 2013, 33(12): 1226-8. |
| [4] |
叶晓莉, 李晓峰. 人参皂苷Rg1对1-甲基-4-苯基吡啶离子诱导的PC12细胞凋亡的保护作用[J]. 海军军医大学学报, 2011, 32(9): 965-8. Ye X L, Li X F. Protective effect of ginsenoside Rg1 on 1-methyl-4-phenylpyridinium ion-induced apoptosis in PC12 cells[J]. Academic J Naval Med Univ, 2011, 32(9): 965-8. |
| [5] |
姚伟锋, 黑子清. 红景天及其有效成分防治器官缺血/再灌注损伤的研究进展[J]. 实用医学杂志, 2015, 31(3): 498-501. Yao W F, Hei Z Q. Research progress of Rhodiola rosea and its active ingredients in preventing organ ischemia-reperfusion injury[J]. J Practical Med, 2015, 31(3): 498-501. |
| [6] |
段贤春, 黄石, 彭代银, 等. 网络药理学在中药复方研究中的应用[J]. 中国药理学通报, 2020, 36(3): 303-8. Duan X C, Huang S, Peng D Y, et al. Application of network pharmacology in the study of Chinese medicine compounding[J]. Chin Pharmacol Bull, 2020, 36(3): 303-8. |
| [7] |
吕祎彤. 近十年红景天植物化学成分研究概况[J]. 化工设计通讯, 2018, 44(3): 249. Lyu Y T. Overview of the research on phytochemical composition of Rhodiola rosea in the last decade[J]. Chemical Engineering Design Communications, 2018, 44(3): 249. |
| [8] |
于浩楠, 马丽娟, 黄坚, 等. 基于HPLC-Q-TOF-MS技术分析红景天颗粒的化学成分及大鼠口服后的入血成分[J]. 上海中医药大学学报, 2021, 35(1): 61-73. Yu H N, Ma L J, Huang J, et al. Analysis of the chemical composition of Rhodiola rosea granules based on HPLC-Q-TOF-MS technique and the blood entry components of rats after oral administration[J]. Academic J Shanghai Univ Tradit Chin Med, 2021, 35(1): 61-73. |
| [9] |
王峥, 王亚君, 满晓静, 等. 红景天治疗心血管疾病研究进展[J]. 创伤与急危重病医学, 2019, 7(4): 258-62. Wang Z, Wang Y J, Man X J, et al. Research progress of Rhodiola rosea in the treatment of cardiovascular diseases[J]. Trauma Critical Care Med, 2019, 7(4): 258-62. |
| [10] |
Sun J, Li X, Liu J, et al. Stigmasterol exerts neuro-protective effect against ischemic/reperfusion injury through reduction of oxidative stress and inactivation of autophagy[J]. Neuropsychiatr Dis Treat, 2019, 15: 2991-3001. |
| [11] |
Gogoi D, Pal A, Chattopadhyay P, et al. First report of plant-derived β-sitosterol with antithrombotic, in vivo anticoagulant, and thrombus-preventing activities in a mouse model[J]. J Nat Prod, 2018, 81(11): 2521-30. |
| [12] |
LO S, SU C, NIU H, et al. Ginsenoside rh2 improves cardiac fibrosis via PPARδ-STAT3 signaling in type 1-like diabetic rats[J]. Int J Mol Sci, 2017, 18(7): 1364. |
| [13] |
戎浩, 马辉, 朱敏侠. 藏药红景天苷对心肌缺血/再灌注损伤的保护机制研究进展[J]. 中国民族医药杂志, 2018, 24(8): 59-60. Rong H, Ma F, Zhu M M. Progress of research on the protective mechanism of tibetan medicine rhodiol glycosides against myocardial ischemia-reperfusion injury[J]. J Med Pharm Chin Minorities, 2018, 24(8): 59-60. |
| [14] |
Kumar A, Singh U, Kini S, et al. JNK pathway signaling: A novel and smarter therapeutic targets for various biological diseases[J]. Future Med Chem, 2015, 7(15): 2065-86. |
| [15] |
刘媛媛, 田学峰, 霍红, 等. 心肌缺血/再灌注损伤患者血清TNF-α和IL-10水平变化及意义[J]. 中国医学前沿杂志(电子版), 2018, 10(1): 79-82. Liu Y Y, Tian X F, Huo H, et al. Changes and significance of serum TNF-α and IL-10 levels in patients with myocardial ischemia-reperfusion injury[J]. Chin J Frontiers Med Sci(Electronic Version), 2018, 10(1): 79-82. |
| [16] |
王文香, 张妞妞, 曾先燕, 等. HIF-1α抗心肌缺血/再灌注炎性损伤的作用[J]. 中国病理生理杂志, 2018, 34(7): 1201-5. Wang W X, Zhang N N, Zeng X Y, et al. Role of HIF-1α against myocardial ischemia-reperfusion inflammatory injury[J]. Chin J Pathophysiology, 2018, 34(7): 1201-5. |
| [17] |
Sciarretta S, Forte M, Frati G, et al. New insights into the role of mTOR signaling in the cardiovascular system[J]. Circ Res, 2018, 122(3): 489-505. |
| [18] |
Yu D, Li M, Tian Y, et al. Luteolin inhibits ROS-activated MAPK pathway in myocardial ischemia-reperfusion injury[J]. Life Sci, 2015, 122: 15-25. |

