

糖尿病是以高血糖为特征的代谢性疾病,位列全球慢性疾病患者的十大死亡原因之一。2019年的一项临床调查报告显示,中国糖尿病患者高达1.29亿人,患者数量和死亡病例皆居全球首位[1]。心血管疾病是糖尿病患者的主要死因。糖尿病性心肌病(diabetic cardiomyopathy,DCM)是一种特发于糖尿病患者群体的独立于高血压、冠心病及血管并发症的特异性心肌病,是导致糖尿病患者死亡的最主要原因之一[2],其特点是在没有高血压和瓣膜病等传统心衰危险因素的情况下,心脏结构和功能发生改变,临床上主要表现为左心室功能障碍、心肌间质纤维化和心肌细胞肥大,其发病率呈现逐年增高的趋势[3]。检测心功能是研究临床治疗DCM药物的重要方法之一。目前,DCM确切机制尚未完全阐明,也缺乏针对性的干预手段和药物。因此,深入研究DCM的病理机制、寻找新的治疗靶点,对DCM的临床防控具有重要指导意义。
随着系统生物学的发展,由转录组学、蛋白质组学、基因组学和代谢组学等技术组成的组学技术已被广泛应用到基础研究中。转录组学最早由Velculescu等[4]提出,是一门在整体水平上研究细胞中所有基因转录调控规律的学科[5],广义的转录组学是指细胞或组织在特定功能状态或生长发育阶段的所有转录产物,其中包括编码蛋白质的mRNA和非编码RNA,如rRNA、RNA以及snoRNA、snRNA、microRNA等[6]。狭义的转录组学是指所有编码蛋白质的RNA总和[7]。通过发掘转录调控规律,转录组学已成为基因组遗传信息和生物功能的重要桥梁,在解读基因组的功能构成、揭示机体发育和疾病机制等方面具有重要意义,目前已被广泛应用于糖尿病研究领域。蛋白质组学以基因组或组织细胞编码的全部蛋白质为研究对象,在蛋白水平上对细胞模式、功能状态、病生病理等方面进行整体研究,可以从整体水平研究蛋白质在机体的表达、修饰、功能和相互作用,从而可以更好地了解细胞生命活动规律、机体内部组织器官的变化,掌握疾病发生发展机制。因此,蛋白质组学和转录组学的联合应用更有助于全面了解DCM相关基因和蛋白差异表达情况,为寻找新的DCM治疗靶点的研究提供了机遇。
在本研究中,我们结合使用GEO RNA测序(RNA-seq)数据库和定量蛋白质组学数据分析,研究DCM病理过程中心肌的损伤机制,筛选有望用于其治疗的潜在基因靶点,为DCM及其伴发的慢性心衰的防治提供新的干预策略。
1 材料与方法 1.1 材料C57BL/6L-db/db健康小鼠,雄性,6~7周龄,体质量(30.0±1.5) g,购自广东省实验动物中心。动物饲养于广东药科大学实验动物中心屏障环境,设施内温度恒定在23 ℃左右,湿度控制在40%~70%,动物照度实现12 h/12 h明暗交替。本动物实验方案经广东药科大学实验动物伦理委员会批准。动物使用许可证号为SYXK(粤)2017-0125。
戊二醛(Sigma公司,104239);去甲二氢愈创木酸(nordihydroguaiaretic acid,NDGA) (Sigma公司,74540);异氟醚(Sigma公司,792632);RIPA裂解液(碧云天公司,P0013E);BCA蛋白定量试剂盒(Thermo Fisher公司,美国,23225);TBST (武汉博士德公司,ST673);PVDF膜(Millipore公司,ISEQ00010);抗α-tubulin抗体(武汉三鹰生物技术公司,11224-1-AP);抗ACOT2抗体(Santa Cruz公司,SC373917);抗ACOT1抗体(Abcam公司,AB100915);二抗(Abcam公司,150077)。
超高频高分辨小动物超声影像系统(Vevo 2100);全自动酶标仪(BioTek公司,ELX808,美国);化学发光成像分析系统(Tanon5200,中国)。
1.2 方法 1.2.1 实验动物造模、分组及给药C57BL/6L-db/db小鼠适应性喂养1周,根据体质量随机选取10只为正常组,给予正常维持饲料喂养;造模组小鼠给予高糖高脂饲料喂养4周后,禁食不禁水12 h,腹腔注射35 mg·kg-1 1%链脲佐菌素(streptozotocin,STZ)柠檬酸钠缓冲液,正常组腹腔注射等量1%柠檬酸钠缓冲液,于注射后的d 7、8测定空腹血糖值,以两次血糖均≥11.1 mmol·L-1为成模标准,剔除不合格小鼠。
将成模小鼠按血糖、体质量进行随机分组:正常对照组(Control组)、正常对照组+NDGA (2.5 g·kg-1)、2型糖尿病(Type 2 diabetes,T2DM) 组、T2DM+NDGA组(2.5 g·kg-1),每组12只,持续12周灌胃。给药结束后,测量体质量、超声心动图评估心功能,收集血清和心脏组织,将组织固定在戊二醛中,测量心肌损伤指数,总游离脂肪酸(T-FFA)含量和其他生理指标。筛选出左心室射血分数(left ventricular ejection fraction,EF) ≤60%,且二尖瓣血流早期舒张充盈与心房充盈速度之比(VE/VA ratio)≤1.6的糖尿病小鼠诊断为DCM,剔除不合格小鼠。
1.2.2 超声心动图采用25 mHZ超声换能器经胸超声心动图评估心功能。小鼠用2%异氟醚诱导镇静,并用11.5%异氟醚维持镇静。获得胸骨旁长轴视图,测量心脏结构和功能。从左心室开始,在乳头中部水平采用m型示踪法测量舒张期左室后壁厚度(diastolic left ventricular posterior wall thickness,LVPWD)、收缩期左室后壁厚度(systole left ventricular posterior wall thickness,LVPWS)、左室收缩末期容积(left ventricular end systolic volume,LV VOL; s) 和左室收缩期内径(left ventricular internal diameter,LVIDs)。计算EF和缩短分数(left ventricular fractional shortening,LVFS)。此外,在心尖四腔面二尖瓣多普勒血流图像中获得了被动左心室充盈峰值速度(VE,mm/s)和心房收缩峰值速度(VA,mm/s)。计算VE/VA ratio。
1.2.3 基因表达谱标准化和DEG识别通过GEO网站下载正常样品和糖尿病性心肌病转录组RNA测序数据(GSE161931),并对其进行标准化处理。使用limma软件包计算上述表达谱的差异表达基因(differentially expressed gene,DEG)(log FC>1.5,P < 0.05),并运用ggplot包和cowplot包绘制出火山图。
1.2.4 蛋白组分析分别提取Control组(4只)和T2DM组(4只)小鼠心脏组织总蛋白,对其进行非标定量蛋白组学检测,设置假阳性率FDR<1%,当蛋白丰度差异倍数>2倍,且经统计学检验其P < 0.05时(T-Test),视为差异蛋白。
1.2.5 差异基因的GO、KEGG分析采用R语言对差异基因GO功能富集分析和KEGG通路富集分析,以解释其生物学功能。以-log10 p值为基础,鉴定了富集前23位的GO条目和6位显著的KEGG通路。运用STRING网站(STRING:functional protein association networks (string-db.org))绘制PPI蛋白相互作用网络图。
1.2.6 Western blot采用RIPA裂解液裂解小鼠的心肌细胞或组织,提取总蛋白并定量。经SDS-PAGE分离后,将蛋白条带电转到PVDF膜上。采用TBST清洗PVDF膜3次,每次10 min。将清洗后的PVDF膜放入5% 脱脂牛奶中,室温下封闭1 h。再次清洗PVDF膜后,将膜放入抗ACOT2抗体(1 ∶ 1 000)或ACOT1抗体(1 ∶ 1 000) 或ACOT3抗体(1 ∶ 1 000) 溶液中,4 ℃孵育过夜。清洗PVDF膜,将其置于二抗(1 ∶ 1 000)溶液中室温孵育1 h,取出PVDF膜并采用TBST洗膜3次。最后,以α-tubulin为内参蛋白,采用Tanon 5200成像系统、Quantity one软件对蛋白条带进行分析。
1.2.7 数据分析使用SPSS 22.0统计软件进行数据分析,结果以x±s表示。数据若服从正态分布,采用One-way ANOVA进行均数比较分析;根据方差是否齐性,组间比较分别采用LSD或者DUNETT′s T3。若不服从正态分布,均数及组间比较则采用非参数检验。
2 结果 2.1 GEO数据和非定量蛋白质组学关联分析首先,对T2DM模型小鼠的心肌功能进行评价。结果显示,与Control组相比,T2DM小鼠的心脏明显增大,心脏指数(HW/BW)明显增加(Fig 1A)。超声心动指标表明,与Control组相比,T2DM小鼠LVEF、LVFS和LVPWD值均明显增加(Fig 1B-D),提示T2DM组小鼠显示出明显的DCM症状。
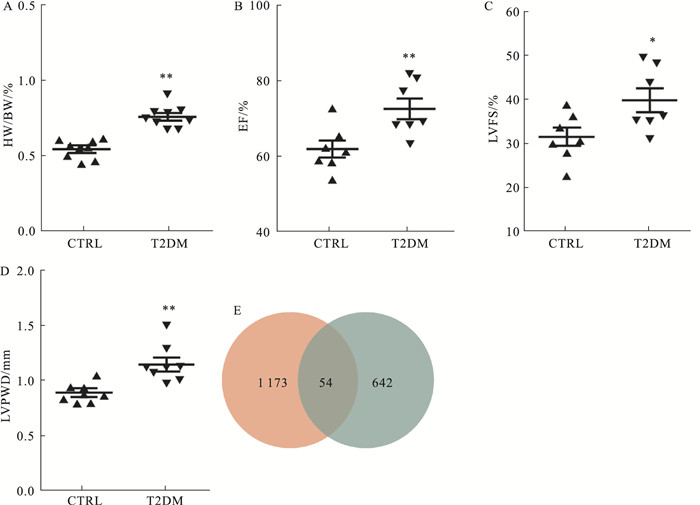
|
| Fig 1 Establishment of diabetic cardiomyopathy model and differential gene screening in mice (x±s, n=8) A: Heart weight-to-body weight (HW/BW) ratio; B-D: The left ventricular ejection fraction (EF), left ventricular fractional shortening (LVFS) and left vetricular posterior wall thickness in the diastolic phases (LVPW) were measured by echocardiography; E: Intersection analysis of differential gene expression (DEG) analysis and proteomic analysis. *P < 0.05 vs CTRL; **P < 0.01 vs CTRL. |
采用蛋白组学对Control组(n=5)和T2DM组小鼠心脏组织(n=5)进行检测分析,筛选出差异蛋白1 128个。将GEO数据中GSE161931数据集中初步获得的DEG绘制火山图,与蛋白质组学分析中获取的趋势相同的蛋白进行汇集筛选。交集分析结果显示,T2DM模型组共检测到DEG共54个,其中显著升高的蛋白19个、降低的基因35个(Fig 1E)。
2.2 GO和KEGG富集分析为研究差异表达基因在疾病中的可能作用,我们对差异基因进行功能和通路富集分析。X轴为富集比例(rich ratio,RR),Y轴为数据库中所富集的term,气泡的大小表示注释到某个Term上的差异差异基因数目,颜色代表富集显著性值。GO功能富集分析结果表明,这些差异表达基因主要参与细胞内代谢分解过程:止血、凝血、补体的激活、体液免疫反应的调节、激活蛋白级联等(Fig 2A),且差异蛋白主要定位在内质网、高尔基体、细胞外基质中(Fig 2B)。进一步分析功能富集结果提示,差异蛋白具有内肽酶调控、蛋白调控及结合活性(Fig 2C)。KEGG通路富集分析结果提示,差异蛋白主要参与调控了补体和凝血级联反应、冠状病毒疾病、系统性红斑狼疮、金黄色葡萄球菌感染等(Fig 2D)。
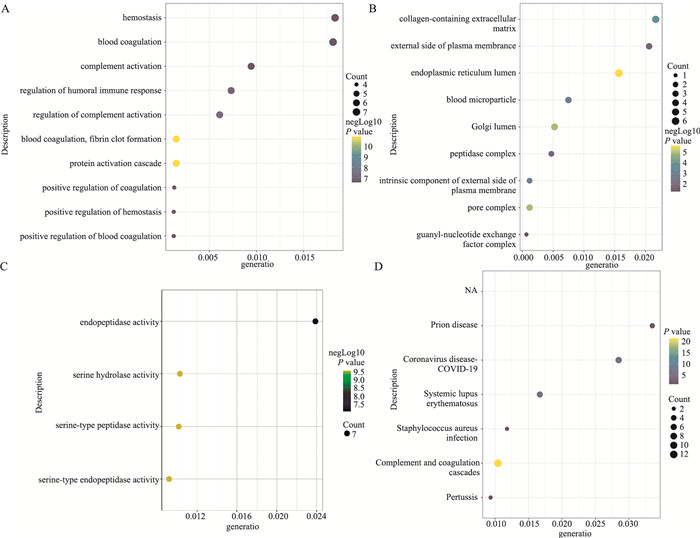
|
| Fig 2 Go and KEGG enrichment analysis results of differential proteins A: Biological Process; B: Cellular component; C: Molecular function; D: KEGG enriched results. |
蛋白-蛋白相互作用(protein-protein interaction network,PPI)是细胞生化反应网络的主要组成部分之一,对调控细胞及其信号有重要意义。因此,我们利用STRING分析PPI,推测可能在DCM中起主导作用的蛋白。如Fig 3A所示,SCD、SCD5和TECR虽然在PPI网络中节点较多,但是多分布在细胞外。而细胞内蛋白酰基辅酶A硫酯酶1(acyl-CoA thioesterase 1,ACOT1)、酰基辅酶A硫酯酶2 (acyl-CoA thioesterase 2,ACOT2)、酰基辅酶A硫酯酶4(acyl-CoA thioesterase 4,ACOT4)、酰基辅酶A硫酯酶7(acyl-CoA thioesterase 7,ACOT7)、酰基辅酶A硫酯酶8 (acyl-CoA thioesterase 8,ACOT8)在PPI网络中节点较多,可进一步研究。ACOT1、ACOT2、ACOT4、ACOT7和ACOT8属于酰基辅酶A硫酯酶(Acyl-CoA thioesterases,ACOTs) 家族,该家族可催化脂肪酸脂酰辅酶A水解为辅酶A - SH和游离脂肪酸的水解,其中ACOT1位于胞浆中,ACOT2位于线粒体。进一步利用火山图和热图对差异蛋白的表达进行可视化分析。如Fig 3B所示,火山图中,X轴为log2(fold change),即差异表达倍数,Y轴为-log10 P-value,即对P值进行-log10的转化,值越大就表示差异越显著。红色的点表示上调的基因,蓝色的点表示下调的基因。如Fig 3C所示,热图中,X轴为样本的log2(FPKM值+1),纵轴为基因。图中颜色代表基因表达水平,红色表示基因表达水平高,绿色表示基因表达水平低。结果表明,ACOT1、ACOT2在糖尿病心肌病模型小鼠心肌组织中含量明显升高。
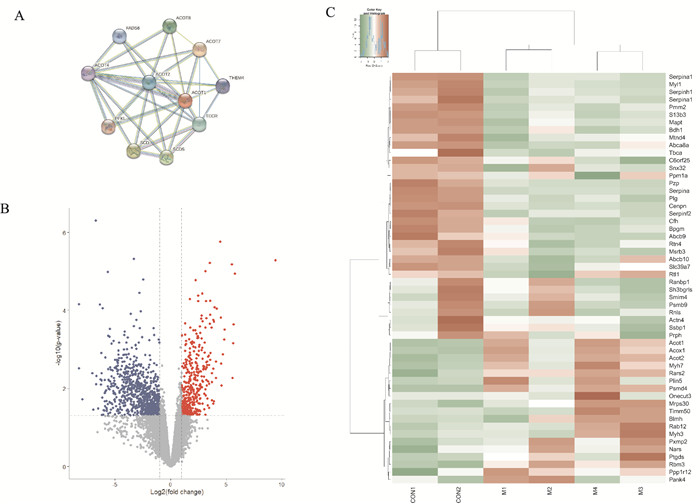
|
| Fig 3 Visualizing and interaction analysis of differential proteins A: Protein-protein interaction (PPI) network was obtained from STRING database. Network nodes represent proteins. Edges represent protein-protein associations; B: The Volcano Plot was used to analysis the significant expression of different proteins; C: The differentially expressed proteins to be exhibited in heatmap graph with |log2 FC| ≥1 and P≤0.05. |
在T2DM模型小鼠中,验证ACOTs家族在DCM中作用。Western blot结果显示,DCM小鼠心肌组织线粒体内的ACOT2蛋白表达上调,上调水平依赖于DCM进展的天数,但ACOT1蛋白表达基本不变(Fig 4A)。进一步分析小鼠心脏组织中的FFA水平,结果表明,T2DM小鼠心脏组织的FFA水平明显高于Control组(Fig 4B),提示其高FFA水平于DCM症状潜在的相关性。
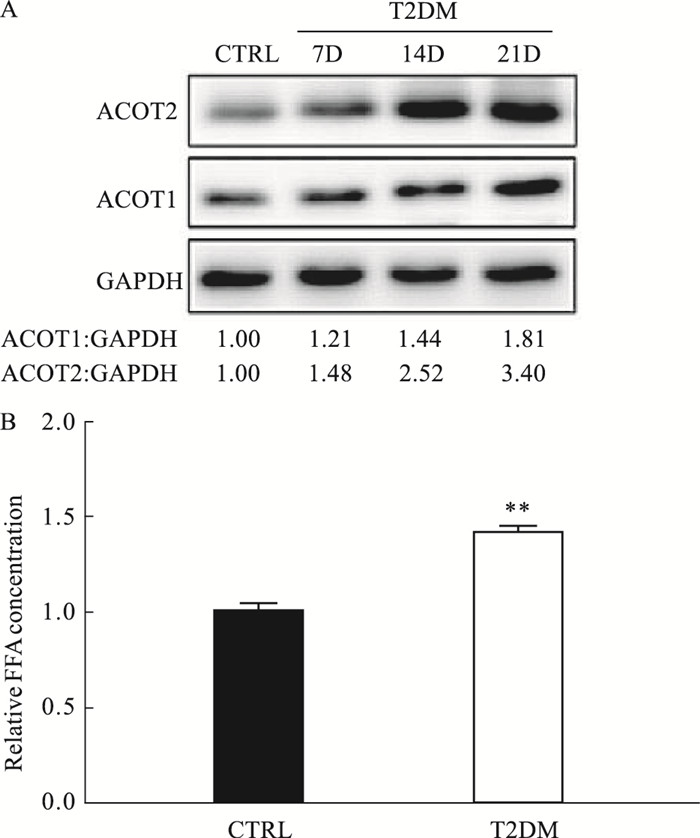
|
| Fig 4 Up-regulation of ACOT2 results in FFA elevation in diabetic cardiomyopathy models (x±s, n=3) A: Relative expression level of ACOT2 and ACOT1 in T2DM mouse model at various time frames; B: Relative expression level of FFA in T2DM mouse model. **P < 0.01 vs CTRL. |
NDGA是一种脂氧合酶ACOT2强烈的抑制剂,能够通过ACOT2途径抑制花生四烯酸的代谢。利用NDGA处理Control组和T2DM组模型小鼠,随后对小鼠的心肌功能进行评价。结果表明,给予NDGA能有效降低各组小鼠ACOT2表达水平(Fig 5A)。此外,NDGA处理对正常小鼠心脏的整体形态和超声心动各项指标无明显影响,但其能明显改善T2DM介导的HW/BW增加(Fig 5B),明显下调由T2DM引起的EF(Fig 5C)、LVFS(Fig 5D)升高以及LVPWD(Fig 5E)和LVPWS(Fig 5F)的增加,同时可以恢复LV VOL; s(Fig 5G)和LVIDs(Fig 5H)至正常水平,有效缓解T2DM小鼠DCM症状。
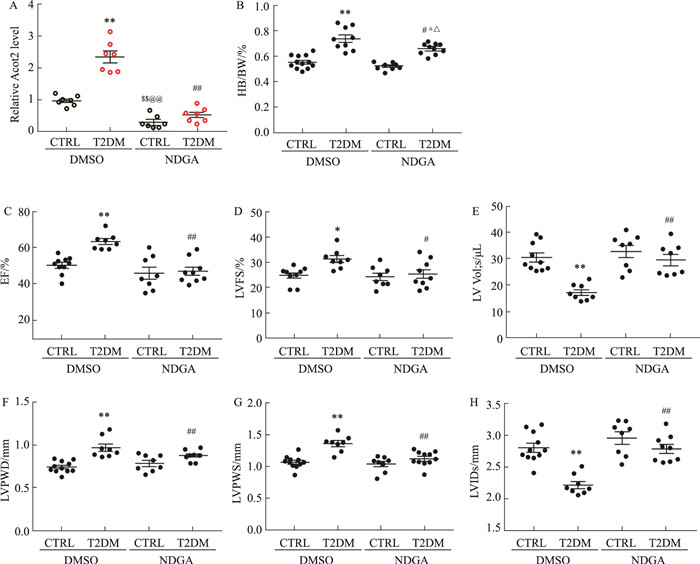
|
| Fig 5 Inhibition of ACOT2 effectively alleviated DCM symptoms in T2DM mice (x±s, n=8) A: Expression level of ACOT2; B: The HW/BW ratio; C-H: Echocardiographic parameters. *P < 0.05, **P < 0.01 vs CTRL(DMSO); #P < 0.05, ##P < 0.01 vs T2DM(DMSO); $$P < 0.01 vs CTRL(DMSO); @@P < 0.01 vs T2DM(DMSO); △△P < 0.01 vs CTRL(NDGA). |
最近研究表明,作为一种特发于糖尿病患者群体的特异性心肌病,DCM患者机体发生胰岛素分泌不足或胰岛素抵抗,诱发机体糖脂代谢改变,使得心肌细胞的葡萄糖摄取减少、糖酵解和葡萄糖氧化明显降低和游离脂肪酸(free fat acid,FFA)吸收增加,最终导致FFA几乎成了心肌细胞的唯一能源[8-11]。但是,DCM患者的心肌细胞依然存在能量产生障碍,提示FFA不能被其有效利用。有研究报道[12-13],糖尿病患者心肌细胞FFA的摄取超过了脂肪酸氧化速率,导致脂肪酸中间体(如神经酰胺和二酰基甘油等)的积累,加剧了心肌细胞线粒体功能障碍,被认为是DCM患者产生心肌“脂肪酸毒性”,发生心功能障碍和心力衰竭等的重要原因。因此,合理调控心肌脂肪酸代谢,减少心肌细胞内FFA及其毒性中间体的积累,可能是改善DCM心肌损伤的关键。
约有2/3的糖尿病死亡病例是糖尿病心血管并发症引起的[11-14]。几项大型临床研究证实,糖尿病患者心衰风险加大,其发病率为非糖尿病患者的4~8倍[15-16],Hippisley等[17]在2016年开展了接近47万T2DM病人的大型临床回顾性研究,发现在65岁以上的T2DM患者中,一旦被确诊为慢性心衰,患者的死亡风险将会增加10倍,5年生存率将会降低到12.5%。这表明DCM是一种亟需关注的糖尿病并发症。然而,DCM的确切发病机制仍未阐明,且缺乏有效的干预措施及治疗药物[14]。本研究通过综合基因表达谱和蛋白组分析,筛选后发现DCM组较正常组有19个差异上调蛋白和35个差异下调蛋白。利用GO和KEGG富集分析发现这些差异表达基因主要参与细胞内代谢分解过程:止血、凝血、补体的激活、体液免疫反应的调节、激活蛋白级联等,且差异蛋白主要定位在内质网、高尔基体、细胞外基质中。进一步分析功能富集结果提示,差异蛋白具有内肽酶调控、蛋白调控及结合活性。KEGG通路富集分析结果提示,差异蛋白主要参与调控了补体和凝血级联反应、冠状病毒疾病、系统性红斑狼疮、金黄色葡萄球菌感染等。
ACOTs家族广泛分布于具有高脂肪酸氧化能力的组织中,如肝脏、心脏、肾脏、大脑、棕色脂肪组织及骨骼肌中。ACOTs家族通过将脂酰CoA水解成FFA和CoA,在维持胞内脂酰CoA、FFA和CoA的水平及比率中起关键作用[18]。由于ACOT2主要定位于线粒体,对位于线粒体的脂酰CoA、β-氧化代谢具有直接的调控作用,然而,ACOT2基因对DCM的潜在调控作用尚未完全揭示。本研究发现,在DCM患者的心肌细胞中,ACOT2高表达,导致心肌细胞FFA堆积而产能降低。实验结果显示,抑制ACOT2能明显减轻DCM症状,推测ACOT2可能是DCM心肌功能障碍治疗的潜在靶点。
综上所述,本研究通过转录组学和代谢组学发现糖尿病心肌病的关键靶点。但本文仍存在不足之处,主要在于仅在小鼠模型上初步验证抑制ACOT2可以减轻DCM症状,没有进行更深一步的机制探究。在今后的研究中,将通过动物实验结合体外细胞实验,进一步探究ACOT2影响糖尿病心肌病的作用机制。
| [1] |
Saeedi P, Salpea P, Karuranga S, et al. Mortality attributable to diabetes in 20-79 years old adults, 2019 estimates: Results from the International Diabetes Federation Diabetes Atlas, 9(th) edition[J]. Diabetes Res Clin Practi, 2020, 162: 108086. doi:10.1016/j.diabres.2020.108086 |
| [2] |
Abbott R D, Donahue R P, Kannel W B, et al. The impact of diabetes on survival following myocardial infarction in men vs women. The Framingham Study[J]. JAMA, 1988, 260(23): 3456-60. doi:10.1001/jama.1988.03410230074031 |
| [3] |
崔艺璇, 周翔, 刘宽, 等. 瞬时受体电位通道蛋白5对糖尿病性心肌病炎症的调节作用[J]. 中国药理学通报, 2022, 38(2): 201-8. Cui Y X, Zhou X, Liu K, et al. Regulation of transient receptor potential channal protein 5 in inflammation in diabetic cardiomyopathy[J]. Chin Pharmacol Bull, 2022, 38(2): 201-8. |
| [4] |
Velculescu V E, Zhang L, Zhou W, et al. Characterization of the yeast transcriptome[J]. Cell, 1997, 88(2): 243-51. doi:10.1016/S0092-8674(00)81845-0 |
| [5] |
Wang Z, Gerstein M, Snyder M. RNA-Seq: A revolutionary tool for transcriptomics[J]. Nat Rev Genet, 2009, 10(1): 57-63. doi:10.1038/nrg2484 |
| [6] |
曹霖, 生高凡, 江诗琴, 等. 基于转录组学探讨铁死亡相关基因在奥希替尼获得性耐药NSCLC细胞中的表达及意义[J]. 中国药理学通报, 2022, 38(4): 569-76. Cao L, Sheng G F, Jiang S Q, et al. Study on expression and significance of ferroptosis related genes in osimertinib acquired-resistant NSCLC cells based on transcriptomics[J]. Chin Pharmacol Bull, 2022, 38(4): 569-76. |
| [7] |
Costa V, Angelini C, De Feis I, et al. Uncovering the complexity of transcriptomes with RNA-Seq[J]. J Biomed Biotechnol, 2010, 2010: 853916. |
| [8] |
Sowton A P, Grifin J L, Murray A J, et al. Metabolic profiling of the diabetic heart: Toward a richer picture[J]. Front Physiol, 2019, 10: 639. doi:10.3389/fphys.2019.00639 |
| [9] |
Athithan L, Gulsin G S, Mccann G P, et al. Diabetic cardiomyopathy: Pathophysiology, theories and evidence to date[J]. World J Diabetes, 2019, 10(10): 490-510. doi:10.4239/wjd.v10.i10.490 |
| [10] |
Steensels S, Qiao J, Zhang Y, et al. Acyl-Coenzyme a thioesterase 9 traffics mitochondrial short-chain fatty acids toward de novo lipogenesis and glucose production in the liver[J]. Hepatology, 2020, 72(3): 857-72. doi:10.1002/hep.31409 |
| [11] |
Sun Y, Zhou S, Guo H, et al. Protective effects of sulforaphane on type 2 diabetes-induced cardiomyopathy via AMPK-mediated activation of lipid metabolic pathways and NRF2 function[J]. Metabolism, 2020, 102: 154002. doi:10.1016/j.metabol.2019.154002 |
| [12] |
Coort S L, Hasselbaink D M, Koonen D P, et al. Enhanced sarcolemmal FAT/CD36 content and triacylglycerol storage in cardiac myocytes from obese zucker rats[J]. Diabetes, 2004, 53(7): 1655-63. doi:10.2337/diabetes.53.7.1655 |
| [13] |
Yosefy C, Pery M, Nevzorov R, et al. Difference in left atrial appendage remodeling between diabetic and nondiabetic patients with atrial fibrillation[J]. Clinic Cardiol, 2020, 43(1): 71-7. doi:10.1002/clc.23292 |
| [14] |
Tan Y, Zhang Z, Zheng C, et al. Mechanisms of diabetic cardiomyopathy and potential therapeutic strategies: Preclinical and clinical evidence[J]. Nat Rev Cardiol, 2020, 17(9): 585-607. doi:10.1038/s41569-020-0339-2 |
| [15] |
Bertoni A G, Tsai A, Kasper E K, et al. Diabetes and idiopathic cardiomyopathy: A nationwide case-control study[J]. Diabetes Care, 2003, 26(10): 2791-5. doi:10.2337/diacare.26.10.2791 |
| [16] |
Rawshani A, Franzen S, Sattar N, et al. Risk factors, mortality, and cardiovascular outcomes in patients with type 2 diabetes[J]. N Engl J Med, 2018, 379(7): 633-44. doi:10.1056/NEJMoa1800256 |
| [17] |
Hippisley-Cox J, Coupland C. Diabetes treatments and risk of heart failure, cardiovascular disease, and all cause mortality: Cohort study in primary care[J]. BMJ, 2016, 354: i3477. |
| [18] |
Kirkby B, Roman N, Kobe B, et al. Functional and structural properties of mammalian acyl-coenzyme A thioesterases[J]. Prog Lipid Res, 2010, 49(4): 366-77. doi:10.1016/j.plipres.2010.04.001 |

