

2. 厦门大学医学院胃肠肿瘤研究所,福建 厦门 361102;
3. 南京医科大学无锡人民医院肿瘤科,江苏 无锡 214000
华东(1967-),男,博士,教授,研究方向:肿瘤药理与肿瘤精准治疗,通信作者,E-mail:wx89211@163.com
2. Institute of Gastrointestinal Oncology, Medical College of Xiamen University, Xiamen, Fujian 361102, China;
3. Dept of Oncology, Wuxi People's Hospital of Nanjing Medical University, Wuxi, Jiangsu 214000, China
肺癌是全球癌症相关死亡的主要原因[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌整体发病的85%,5年生存率仅为15%[2]。化疗是肺癌治疗的主要方式之一,但大多数肺癌患者早期对化疗敏感,晚期表现出耐药性,导致临床预后极差[3]。因此,发展新的药物治疗靶点和理解治疗机制对肺癌的治疗具有重要临床意义。
铁死亡是近年来备受关注的一种新型细胞死亡方式,其与细胞凋亡等传统细胞死亡方式不同[4-5]。铁死亡是由细胞内铁离子累积并催化产生活性氧(reactive oxygen species,ROS)驱动的,ROS能够氧化膜脂质,产生大量脂质过氧化物(lipid peroxides,LPO),并进一步导致细胞死亡[6]。铁死亡过程中线粒体展现出独特形态学变化,如膜密度增高、嵴消失等[6]。铁(Fe)等必需过渡金属离子在肿瘤细胞代谢、增殖、血管生成和肿瘤转移中发挥重要作用[7-8],逐步成为新的治疗靶点。近期,开发新型铁螯合剂已成为一种有前景的抗癌策略。Triapine是一种缩氨基硫脲类铁螯合剂,具有广谱抗肿瘤活性,并在多项临床Ⅰ/Ⅱ期实验中进行研究[9]。Triapine能够与核糖核苷酸还原酶活性中心的铁离子结合而使酶失活,从而抑制DNA合成。然而,铁死亡在Triapine发挥抗肿瘤活性中的作用目前仍不明确。本研究探究了Triapine诱导非小细胞肺癌A549细胞发生铁死亡的作用,为肺癌治疗提供了新的方案。
1 材料与方法 1.1 材料 1.1.1 细胞与试剂A549细胞和PC9细胞来自中国科学院干细胞库。RPMI-1640(货号:31870074,厂家:赛默飞世尔,产地:中国)、胰酶(规格:0.25%,货号:15090046,厂家:赛默飞世尔,产地:中国)、FBS(货号:10091155,厂家:赛默飞世尔,产地:中国)。MTT(货号:M8180,厂家:索莱宝,产地:北京),结晶紫(C8470,厂家:索莱宝,产地:北京)。DCFH-DA(货号:S0033S,厂家:碧云天,产地:上海)、GSH试剂盒(S0053,厂家:碧云天,产地:上海)、MDA试剂盒(S0131S,厂家:碧云天,产地:上海)、BCA试剂盒(P0010S,厂家:碧云天,产地:上海)。N-乙酰-L-半胱氨酸(NAC,货号:N800425,厂家:麦克林,产地:上海)。GPX4抗体(货号:ab41787,厂家:Abcam,产地:英国)、Vinculin抗体(ab219649,厂家:Abcam,产地:英国)、山羊抗兔IgG(货号:ab97051,厂家:Abcam,产地:英国)。
1.1.2 仪器多功能酶标仪(型号:synergy H4,厂家:Bio TeK,产地:美国)。倒置显微镜(型号:尼康Ti-E,厂家:尼康株式会社,产地:日本)、激光共聚焦显微镜(型号:TCS SP8,厂家:徕卡,产地:德国)。
1.2 方法 1.2.1 MTT实验向96孔板中每孔加入100 μL A549细胞(5 000个)悬液,待A549细胞呈现出完整细胞形态后,将培养基更换为含有不同浓度Triapine(0~100 mg·L-1)的培养基处理48 h。根据MTT实验方案,每孔加入10 μL MTT,常温培养2~4 h后,小心吸取出孔内染液,加入100 μL DMSO并震荡溶解产物,利用酶标仪(Ex:490 nm)测定吸光度(OD)值。
1.2.2 克隆形成实验在6孔板中每孔加入2 mL A549细胞(500个)悬液,待细胞呈现出完整细胞形态后吸取出培养基,加入2 mL含有Triapine的培养基药物稀释液的处理A549细胞24 h,Triapine终浓度为4 mg·L-1。Triapine处理结束后,每孔加入2 mL新鲜培养基。观察14 d后,细胞固定并染色,PBS小心清洗,拍照,计数。
1.2.3 DCFH-DA探针法检测ROS取1 mL A549细胞悬液(5×104个)加入到共聚焦小皿(35 mm)中,待细胞密度达到90%后,用2、4、6 mg·L-1的Triapine分别处理细胞12 h。随后加入1 mL含有DCFH-DA探针(1 × 10-5 mol·L-1)的PBS缓冲液,常温孵育30 min,在激光共聚焦显微镜(Ex:488 nm,Em:525 nm)下进行观察拍照。
1.2.4 GSH水平检测在6孔板中加入2 mL A549细胞悬液(5×104个/孔),待细胞密度达到90%后,分别加入含2、4、6 mg·L-1的Triapine培养基处理12 h。随后收集细胞,按照GSH检测试剂盒的说明,测定空白对照组与不同浓度的Triapine处理组细胞内GSH的水平。
1.2.5 MDA实验在6孔板中加入2 mL A549细胞悬液(5×104个/孔),待细胞密度达到90%后,分别加入含2、4、6 g·L-1的Triapine培养基处理12 h。随后收集细胞,按照MDA检测试剂盒的说明,测定空白对照组与不同浓度的Triapine处理组细胞内MDA的水平。
1.2.6 C11 BODIPY581/591染色实验取1 mL A549细胞悬液(5×104个)加入到共聚焦小皿(35 mm)中,待细胞密度达到90%后,加入Triapine(4 mg·L-1)处理12 h。随后加入1 mL含有C11 BODIPY581/591(5×10-6 mol·L-1)的PBS缓冲液。常温孵育10 min,用PBS清洗细胞,在激光共聚焦显微镜(Ex:581 nm(Reduced)/500 nm(Oxidized),Em:591 nm(Reduced)/510 nm(Oxidized)下进行观察拍照。
1.2.7 线粒体形态分析将细胞(5×104个/皿)接种于无菌细胞培养皿(10 cm),待细胞密度达到90%后,加入Triapine(4 mg·L-1)处理12 h,收集细胞沉淀,将细胞沉淀置于2.5%戊二醛溶液(电镜级)中固定。随后将固定好的细胞进行渗透处理,并在70 ℃下包埋过夜。细胞包埋块切片,用乙酸双氧铀(规格:1%)和柠檬酸铅(规格0.4%)对细胞染色,然后进行透射电镜观察。
1.2.8 Western blot实验将用Triapine(4 mg·L-1)处理的A549细胞消化,离心(500 g,4 ℃,10 min)。小心吸弃掉上清,低温震荡裂解细胞,时间为20 min,离心(12 000 g,4 ℃,15 min)。Triapine处理的样品蛋白浓度用BCA试剂盒测定。将上样缓冲液(1×)加入到蛋白样品中,变性(100 ℃)后上样,分离转膜,随后室温封闭(5% BSA,TBST配制),GPX4(1 mg·L-1)、Vinculin(1 ∶ 1 000)一抗孵育过夜。TBST洗膜,二抗(1 ∶ 10 000)孵育2 h。TBST洗膜,ECL曝光检测。
1.2.9 统计学处理数据分析用GraphPad Prism 7.0软件,呈正态分布的计量数据以x±s表示,采用t检验分析两组间比较。
2 结果 2.1 Triapine抑制A549细胞增殖MTT实验结果显示,Triapine对A549细胞的半抑制浓度,即IC50值为(3.7±0.08) mg·L-1(Fig 1A)。克隆形成结果显示,Triapine处理后A549细胞形成的克隆数目(17.0±1.6)明显少于对照组(72.6±2.1)(P < 0.01),表明Triapine有效抑制了A549细胞的增殖(Fig 1B)。
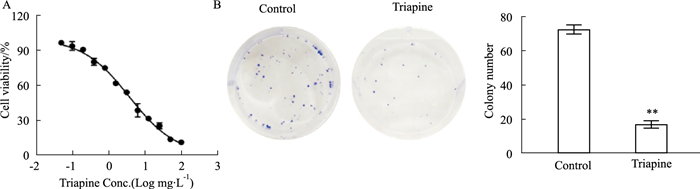
|
| Fig 1 Effect of Triapine on proliferation of A549 cells (x±s, n=3) A: The cell viability of A549 cells in Triapine concentration gradient was analyzed by MTT assay; B: The inhibitory effect of Triapine on A549 cells in 14 days was assessed by colony formation assay. **P < 0.01 vs Control group. |
Triapine能够与细胞内铁离子结合,并催化ROS产生。因此,通过ROS探针观察了不同浓度(2~6 mg·L-1)Tripaine处理后细胞内ROS的变化。与对照组相比,Triapine组细胞内荧光信号强度增强,表示细胞内ROS水平升高。相同作用时间下,6 mg·L-1的Triapine作用后细胞内荧光强度明显高于其他组,表明细胞内ROS水平与Triapine作用浓度呈正相关(Fig 2)。
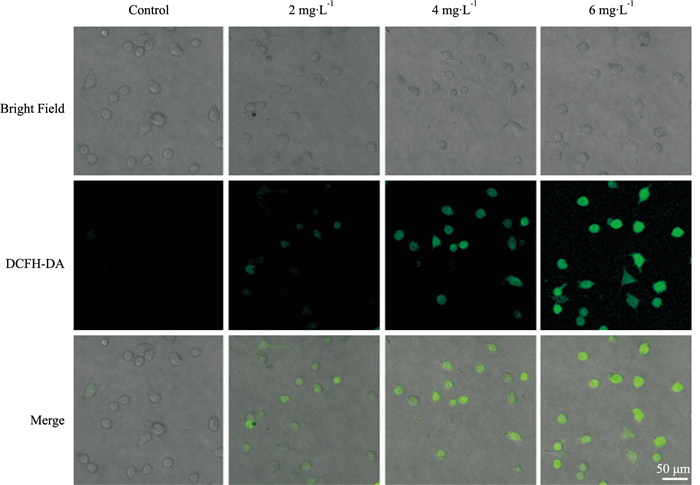
|
| Fig 2 ROS level of A549 cells detected by DCFH-DA probe |
GSH构成了细胞内主要的抗氧化系统,进一步检测Triapine对细胞内GSH水平的影响。如Fig 3A所示,Triapine处理后,A549细胞内GSH水平较对照组降低,并且GSH下降水平与Triapine浓度相关(P < 0.01)。细胞内LPO异常累积是铁死亡发生的关键。采用丙二醛(malonaldehyole, MDA)检测试剂盒对不同处理的A549细胞内LPO水平进行评估。结果显示(Fig 3B),对照组细胞内LPO水平明显低于Triapine组,且细胞中LPO含量与Triapine作用浓度呈正相关(P < 0.05),初步表明Triapine能够引起细胞铁死亡。
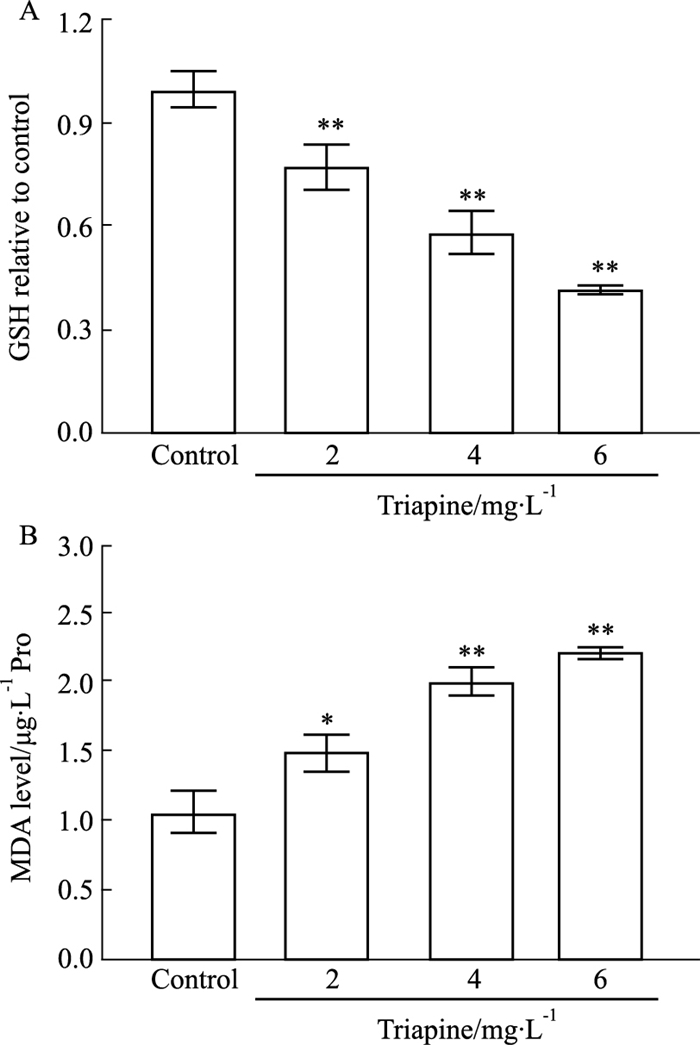
|
| Fig 3 Effect of Triapine on GSH and LPO levels of A549 cells (x±s,n=3) A: GSH levels of A549 cells were detected by GSH kit; B: The LPO levels of A549 cells were analyzed by MDA assay. *P < 0.05, **P < 0.01 vs Control group. |
前期实验证明,Triapine导致细胞内LPO水平升高,而LPO累积是细胞发生铁死亡的重要标志。为进一步分析细胞内的膜脂质过氧化反应,采用C11 BODIPY581/591探针评估细胞内膜脂质过氧化情况。激光共聚焦结果显示,Triapine组细胞中红色荧光信号明显弱于对照组,而与对照组相比,Triapine组细胞中观察到较强的绿色荧光信号,这表明在Triapine作用下细胞内发生了脂质过氧化反应,并造成LPO的累积(Fig 4)。
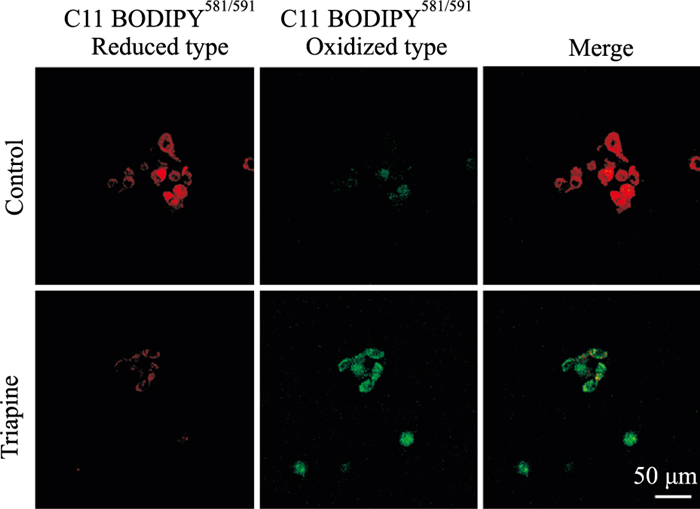
|
| Fig 4 C11 BODIPY581/591 probe detected intracellular lipid peroxidation levels |
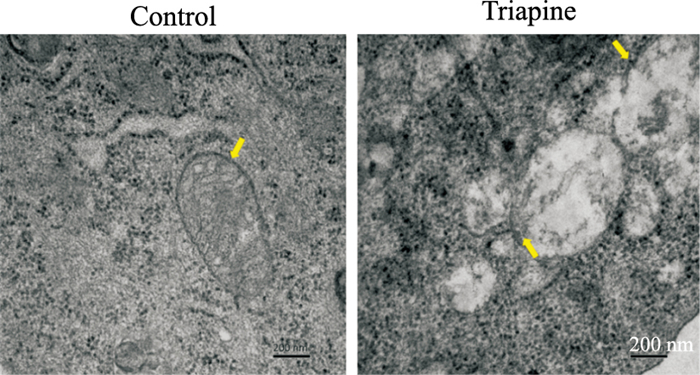
为验证Triapine诱导的A549细胞铁死亡,采用透射电镜对细胞线粒体的形态进行观察。如图Fig 5,Triapine处理后细胞的线粒体嵴出现明显减少现象,并且线粒体膜密度升高,且膜完整性较差,进一步证明Triapine导致细胞发生了铁死亡。
|
| Fig 5 Observation of mitochondrial morphology by transmission electron microscope |
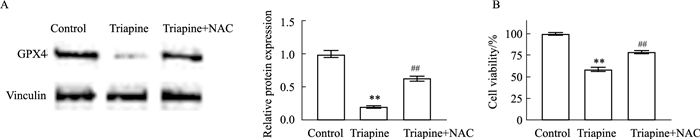
为探究Triapine诱导A549细胞发生铁死亡的机制,采用Western blot分析铁死亡相关蛋白GPX4蛋白的表达。如Fig 6A,Triapine处理后细胞内GPX4蛋白表达明显低于对照组(P < 0.01)。N-乙酰基-L-半胱氨酸(N-acetylcysteine,NAC)是ROS清除剂,Triapine与NAC共同处理A549细胞后,细胞内GPX4蛋白表达高于单独Triapine处理组(P < 0.01)。同时,MTT结果显示,Triapine与NAC共孵育组细胞活性高于Triapine组(P < 0.01)(Fig 6B)。
|
| Fig 6 Recovery of ROS inhibitors on GPX4 protein expression and cell viability (x±s, n=3) A: The GPX4 expression of A549 cells was analyzed by Western blot; B: MTT assay analyzed the cell viability of A549 cells. **P < 0.01 vs Control group, ##P < 0.01 vs Triapine group. |
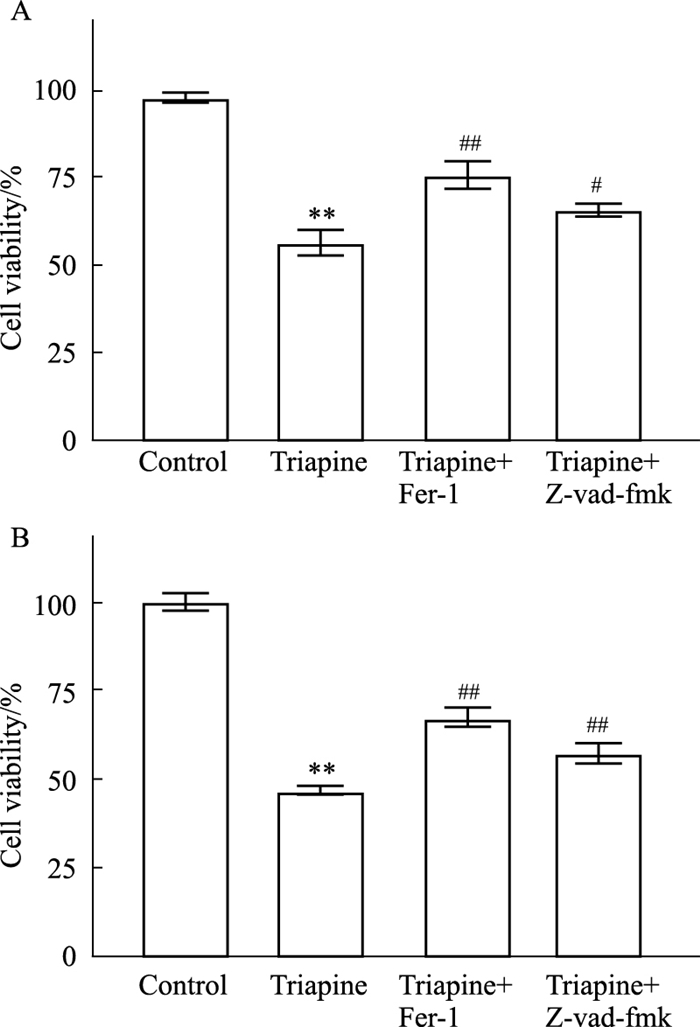
Fig 7A显示,铁死亡抑制剂(Fer-1)和凋亡抑制剂(Z-vad-fmk)能够抑制Triapine引起的A549细胞活性下降,并且Fer-1对细胞活性的恢复作用强于Z-vad-fmk(P < 0.05),进一步表明Triapine引起了A549细胞铁死亡。同时,Fer-1能够减弱Triapine引起的PC9细胞活性下降(P < 0.01),表明Triapine也有诱导PC9细胞铁死亡的作用(Fig 7B)。
|
| Fig 7 Cell viability of A549 cells (A) and PC9 cells (B) after incubating with Fer-1 and Z-vad-fmk, respectively (x±s, n=3) **P < 0.01 vs Control group; #P < 0.05, ##P < 0.01 vs Triapine group. |
铁死亡是一种铁依赖性的细胞死亡形式,主要特征为铁依赖性ROS和LPO累积并达到致死水平。研究发现,铁死亡的发生过程涉及细胞内铁代谢、ROS的生成与清除以及氨基酸和脂质代谢等多方面的异常[10]。由于铁死亡对改善传统肿瘤治疗耐受现象具有独特优势,近年来逐步成为研究热点。
铁对于维持细胞的正常生理机能起着关键的作用,比如DNA的合成与复制。肿瘤细胞对铁离子具有依赖性,调控肿瘤细胞内铁代谢是潜在的肿瘤治疗靶点。Triapine可以通过抑制肿瘤细胞内的核糖核酸还原酶M2(ribonucleotide reductase regulatory subunit M2,RRM2)发挥抗肿瘤活性[11]。Triapine能够螯合RRM2活性中心的铁离子,形成Fe(Ⅱ)-(Triapine)复合物,通过类芬顿反应(Fenton-like reaction)产生ROS[11]。ROS水平升高不仅会导致细胞氧化损伤,还是铁死亡的重要参与者[12-13]。本研究证实,Triapine作用后能明显降低A549细胞的增殖,引起细胞死亡。同时,Triapine能够催化A549细胞内产生大量ROS,提示其具有潜在的铁死亡诱导活性。
文献报道,Triapine具有诱导细胞凋亡的活性。Robert等[14]发现Triapine能够通过促进内质网应激诱导肿瘤细胞凋亡。此外,Triapine可以通过抑制RRM2的表达诱导细胞凋亡发生,这主要是通过调控凋亡相关蛋白Bcl-2表达实现的[15]。近期研究发现,RRM2参与了铁死亡过程。RRM2过表达能促进细胞内GSH的合成,进而抑制肝癌细胞发生铁死亡[16]。本研究证实,Triapine处理后肺癌细胞活性下降,而铁死亡抑制剂(Fer-1)和凋亡抑制剂(Z-vad-fmk)能够逆转这一现象。以上结果表明,Triapine可能具有同时诱导细胞凋亡和铁死亡的作用,这一发现进一步丰富了对Triapine抗肿瘤机制的认识。
GSH是一种细胞内主要的抗氧化物质。GPX4作为内源性抑制铁死亡的脂质过氧化物酶,可以将毒性脂质过氧化氢(L-OOH)转化为无毒的脂质醇(L-OH)[17]。GPX4在铁死亡过程中的表达和活性依赖于GSH的存在[17]。因此,消耗细胞内的GSH会间接抑制GPX4的活性,GPX4表达降低是铁死亡发生的重要标志[18]。本研究发现,Triapine能够引起A549细胞GSH水平降低,GPX4蛋白表达水平下降。此外,NAC能够使细胞内GPX4的表达和细胞活性得到恢复。以上结果表明,Triapine可能通过ROS/GSH/GPX4信号轴诱导A549细胞铁死亡发生。
免疫治疗是近年来肿瘤治疗的热点,研究表明,抑制铁死亡会导致肿瘤细胞对免疫治疗的敏感性降低。因此,采用Triapine等铁死亡诱导剂与免疫治疗药物的联合应用可能为降低肺癌死亡率提供了一种有前景的策略。同时,随着纳米技术的发展,纳米药物递送系统与Triapine的联合将有助于Triapine发挥药理活性,提升Triapine的靶向性,达到增效减毒的效果。综上所述,本文指出Triapine可能通过提升A549细胞内ROS水平,导致GSH消耗和GPX4表达下降,诱导铁死亡发生。
( 致谢: 本研究工作在江南大学生命科学与健康工程学院实验平台与厦门大学医学院胃肠肿瘤研究所实验平台完成,感谢指导老师和各位同学的帮助。)
| [1] |
Siegel R L, Miller K D, Fuchs H E, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. doi:10.3322/caac.21654 |
| [2] |
Gridelli C, Rossi A, Carbone D P, et al. Non-small-cell lung cancer[J]. Nat Rev Dis Primers, 2015, 1: 15009. doi:10.1038/nrdp.2015.9 |
| [3] |
Zappa C, Mousa S A. Non-small cell lung cancer: Current treatment and future advances[J]. Transl Lung Cancer Res, 2016, 5(3): 288-300. doi:10.21037/tlcr.2016.06.07 |
| [4] |
Chen X, Kang R, Kroemer G, et al. Broadening horizons: The role of ferroptosis in cancer[J]. Nat Rev Clin Oncol, 2021, 18(5): 280-96. doi:10.1038/s41571-020-00462-0 |
| [5] |
宣文婷, 杨泽勇, 季雅茹, 等. p53抑制铁死亡抵抗HT22细胞谷氨酸神经毒性[J]. 中国药理学通报, 2019, 35(5): 654-60. Xuan W T, Yang Z Y, Ji Y R, et al. Neuroprotection of p53 againstglutamate oxidative damage by inhibiting ferroptosis[J]. Chin Pharmacol Bull, 2019, 35(5): 654-60. doi:10.3969/j.issn.1001-1978.2019.05.014 |
| [6] |
Lu B, Chen X B, Ying M D, et al. The role of ferroptosis in cancer development and treatment response[J]. Front Pharmacol, 2017, 8: 992. |
| [7] |
Torti S V, Manz D H, Paul B T, et al. Iron and cancer[J]. Annu Rev Nutr, 2018, 38: 97-125. doi:10.1146/annurev-nutr-082117-051732 |
| [8] |
Torti S V, Torti F M. Iron and cancer: More ore to be mined[J]. Nat Rev Cancer, 2013, 13(5): 342-55. doi:10.1038/nrc3495 |
| [9] |
Trondl R, Flocke L S, Kowol C R, et al. Triapine and a more potent dimethyl derivative induce endoplasmic reticulum stress in cancer cells[J]. Mol Pharmacol, 2014, 85(3): 451-9. doi:10.1124/mol.113.090605 |
| [10] |
Xu T, Ding W, Ji X, et al. Molecular mechanisms of ferroptosis and its role in cancer therapy[J]. J Cell Mol Med, 2019, 23(8): 4900-12. doi:10.1111/jcmm.14511 |
| [11] |
Shao J, Zhou B, Di Bilio A J, et al. A Ferrous-Triapine complex mediates formation of reactive oxygen species that inactivate human ribonucleotide reductase[J]. Mol Cancer Ther, 2006, 5(3): 586-92. doi:10.1158/1535-7163.MCT-05-0384 |
| [12] |
Su L J, Zhang J H, Gomez H, et al. Reactive oxygen species-induced lipid peroxidation in apoptosis, autophagy, and ferroptosis[J]. Oxid Med Cell Longev, 2019, 2019: 5080843. |
| [13] |
Latunde-dada G O. Ferroptosis: Role of lipid peroxidation, iron and ferritinophagy[J]. Biochim Biophys Acta Gen Subj, 2017, 1861(8): 1893-900. doi:10.1016/j.bbagen.2017.05.019 |
| [14] |
Robert T, Lea S F, Christian R K, et al. Triapine and a more potent dimethyl derivative induce endoplasmic reticulum stress in cancer cells[J]. Mol Pharmacol, 2014, 85(3): 451-9. doi:10.1124/mol.113.090605 |
| [15] |
Rahman M A, Amin A R, Wang D, et al. RRM2 regulates Bcl-2 in head and neck and lung cancers: A potential target for cancer therapy[J]. Clin Cancer Res, 2013, 19(13): 3416-28. doi:10.1158/1078-0432.CCR-13-0073 |
| [16] |
Yang Y, Lin J, Guo S, et al. RRM2 protects against ferroptosis and is a tumor biomarker for liver cancer[J]. Cancer Cell Int, 2020, 20(1): 587. doi:10.1186/s12935-020-01689-8 |
| [17] |
Yang W S, Sriramaratnam R, Welsch M E, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156(1-2): 317-31. doi:10.1016/j.cell.2013.12.010 |
| [18] |
关锡梅, 解勇圣, 倪伟建, 等. Nrf2/HO1/GPX4对高糖诱导足细胞铁死亡的影响及小檗碱的干预机制研究[J]. 中国药理学通报, 2021, 37(3): 396-403. Guan X M, Xie Y S, Ni W J, et al. Influence of Nrf2/HO-1/GPX4 signaling pathway on high glucose-induced podocyte ferroptosis and intervention of berberine[J]. Chin Pharmacol Bull, 2021, 37(3): 396-403. |

