

2. 河北经贸大学数学与统计学院,河北 石家庄 050061;
3. 北京小汤山医院中西医结合慢性病康复研究室,北京 102211;
4. 河北省科学院生物研究所,河北 石家庄 050081;
5. 中国中医科学院中药研究所,北京 100700;
6. 中央民族大学生命与环境科学学院,北京 100081
2. Dept of Mathematics and Statistics, Hebei University of Economics and Business, Shijiazhuang 050061, China;
3. Chronic Disease Rehabilitation Laboratory of Integrated Traditional Chinese and Western Medicine, Beijing Xiaotangshan Hospital, Beijing 102211, China;
4. Institute of Biology, Hebei Academy of Science, Shijiazhuang 050081, China;
5. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China;
6. College of Life and Environmental Sciences, Minzu University of China, Beijing 100081, China
大白桩菇(Leucopaxillus giganteus)又称雷蘑等,属于白蘑科桩菇属,在内蒙古、河北等北方地区广泛分布。此菌是一种食药用真菌,其个体大、肉肥厚、味鲜美[1],并含有抗肿瘤活性物质,如:从此食用菌中分离的克力托辛能促进体外人宫颈癌细胞(HeLa细胞)的凋亡[2]、(R)-4-乙氧基-2-羟基-4-氧代丁酸能明显抑制肺癌细胞A549中Axl和PD-L2的表达[3]。
网络药理学是通过筛选活性物质、预测靶标蛋白、寻找信号通路,从而揭示疾病-靶蛋白-药物之间的密切关联,对深入研究多途径、多靶点、多成分的动植物药用资源提供了借鉴和思路[4]。且目前还未见到关于基于网络药理学大白桩菇抗癌机制分析的研究报道。
为了寻找活性物质,开发利用该菌,本研究从大白桩菇的乙醇提取物中分离到13个化合物,除了麦角甾-5,7,22-三烯-3β-醇、胆甾-7-烯-3β-醇、克力托辛、(R)-4-乙氧基-2-羟基-4-氧代丁酸和麦角甾-5,7-三烯-3β-醇,其余均为首次从该菌中分离得到。对大白桩菇乙醇提取物进行了抗肿瘤活性研究,并通过网络药理学,结合分子对接技术和体外验证揭示大白桩菇抗乳腺癌的潜在作用机制,为大白桩菇抗乳腺癌药研究提供科学参考。
1 材料与方法 1.1 材料、仪器与试剂大白桩菇采自内蒙古克什克腾旗,经河北经贸大学张香美教授鉴定,标本(ZYMZDX121729)放在中央民族大学生命科学与环境学院。MDA-MB-231(人乳腺癌细胞),BG-803(人胃癌细胞)和NCI-H502(人肺鳞状上皮细胞癌)由中国医学科学院基础所细胞中心提供,绿原酸购自上海源叶生物科技有限公司(质量分数≥98%),Annexin V-FITC细胞凋亡检测试剂盒(碧云天)。
Agilent 6890N-5975N质谱仪;Bruker DRX 500超导核磁共振波谱仪;Thermo Lab systems全自动酶标仪;流式细胞仪(BD美国)、MTT、DMSO等为美国Sigma公司生产;薄层色谱硅胶(GF254)与柱色谱硅胶(200~300目)均为青岛海洋化工厂产品;Sephadex LH-20为Pharmacia Biotech公司产品;其余试剂均为国产分析纯试剂。
1.2 提取与分离大白桩菇子实体(干重2.0 kg),用95%乙醇浸提4次,每次7 d,合并减压蒸干得540 g粗提物,分别用石油醚、乙酸乙酯、正丁醇进行萃取。乙酸乙酯层(30g)以石油醚-丙酮(3 ∶1,2 ∶1,1 ∶1,0 ∶1)为洗脱剂进行梯度洗脱,经薄层层析检测,合并相同部分,得4个组分(Fr.A-Fr.D)。Fr.A组分经硅胶柱层析进行分离,以石油醚-丙酮(1 ∶1)为洗脱剂进行洗脱,得2个亚组分(Fr.A1和Fr.A2)。Fr.A1亚组分经Sephadex LH-20色谱柱层析,再经TLC制备色谱(GF254,石油醚-乙酸乙酯2 ∶1,展2次),得化合物1(4.4 mg)和2(2.3 mg)。Fr.A2组分经重结晶得化合物3(5.7 mg)。Fr.B组分经Sephadex LH-20色谱柱层析,得2个亚组分(Fr.B1和Fr.B2)。Fr.B1亚组分经TLC制备色谱(GF254,石油醚-乙酸乙酯2 ∶1,展2次),得化合物4(3.4 mg)和5(3.6 mg)。Fr.B2亚组分经Sephadex LH-20色谱柱层析,再经硅胶柱层析进行分离,以氯仿-丙酮(1 ∶1)为洗脱剂进行洗脱,得化合物6(2.2 mg)、7(3.1 mg)。Fr.C组分经硅胶柱层析进行分离,以石油醚-丙酮(2 ∶1)为洗脱剂进行洗脱,得2个亚组分(Fr.C1和Fr.C2)。Fr.C1亚组分经Sephadex LH-20色谱柱层析,得化合物8(3.1 mg)。Fr.C2亚组分经Sephadex LH-20色谱柱层析,再经硅胶柱层析进行分离,以氯仿-甲醇(5 ∶1)为洗脱剂进行洗脱,得化合物9(2.2 mg)和10(2.4 mg)。Fr.D组分经硅胶柱层析进行分离,以石油醚-丙酮(1 ∶1)为洗脱剂进行洗脱,重结晶得化合物11(4.1 mg)。正丁醇层(24 g)经硅胶柱层析进行分离,以氯仿-甲醇(9 ∶1)为洗脱剂进行洗脱,得2个组分(FrA,FrB),FrA经Sephadex LH-20色谱柱层析,得化合物12(3.3 mg)和13(3.1 mg)。
1.3 乙醇提取物抗肿瘤活性分析参照作者以前的实验方法[5](MTT法)测定大白桩菇乙醇提取物(Ethanol extract of Leucopaxillus giganteus,LGEE)对肿瘤细胞NCI-H502、BG-803和MDA-MB-231增殖的抑制活性,样品浓度为6.25、12.5、25、50、100、200 mg·L-1,处理时间为48 h。570 nm检测OD吸光值,阳性药物为紫杉醇(沈阳天峰生物制药有限公司)。
| $ \text { 抑制率 } \%=1-\left(\mathrm{A}_{\text {样品 }}-\mathrm{A}_{\text {空白 }}\right) /\left(\mathrm{A}_{\text {对照 }}-\mathrm{A}_{\text {空白 }}\right) \times 100 \% $ |
借TCMSP(http://tcmspw.com/tcmsp.php)和PharmMaper(http://www.lilab-ecust.cn/pharmmapper/)数据平台对已鉴定的化学成分进行靶点预测。利用UniProt数据库(https://www.uniprot.org/)规范与活性成分相关的靶点蛋白,获得靶点对应的基因名。
1.4.2 疾病靶点筛选运用Genecards数据库(https://www.genecards.org)搜索相关的疾病靶点。利用Venny平台(https://bioinfogp.cnb.csic.es/tools/venny/)将大白桩菇药效成分调控的靶点与疾病的靶点取交集,得到大白桩菇抗乳腺癌的潜在靶点。
1.4.3 核心靶点网络互作分析(PPI)通过String数据库(https://cn.string-db.org/)分析大白桩菇抗乳腺癌的交集靶点,构建靶点蛋白间的互作网络关系,将构建的PPI网络分析结果导入用Cytoscape 3.8.0,根据度值(Degree,D)、度介中心度(Betweenness Centrality,BC)和接近中心度(Closeness Centrality,CC)筛选核心靶点。
1.4.4 靶点功能通路富集分析借助于DAVID数据库(https://david.ncifcrf.gov/)对疾病相关的药物活性成分的交集靶点进行GO与KEGG富集分析,设定阈值P < 0.01进行筛选,整理分析数据,利用R语言及Cytoscape 3.8.0对网络进行可视化。
1.4.5 分子对接从RSCB数据库(http://www.rcsb.org/)中下载核心蛋白靶点的蛋白质晶体结构,从znic数据库获取活性化合物的结构文件。利用iGEMDOCK软件进行分子对接,Discovery Studio 2016 Client软件进行可视化,并通过R Studio制作热图。
1.5 分子生物学验证 1.5.1 FACS检测细胞凋亡将对数生长期的MDA-MB-231细胞(每孔5×105)接种于6孔板中,继续培养24 h。细胞经不同浓度绿原酸(0、5、10、20、40、80 mg·L-1)处理,继续培养48 h。取出培养板消化洗涤收集细胞,按凋亡试剂盒说明书操作,最后流式细胞仪检测细胞凋亡率。
1.5.2 绿原酸对CASP3和CHK2表达的影响Western blot检测CHEK2和CASPASE3的表达。提取不同组细胞中的总蛋白。10% SDS-PAGE电泳后,转移到PVDF膜上,用一抗在4 ℃孵育过夜,随后用二抗室温封闭孵育膜1.5 h。胶片用LabWorksTM凝胶成像及分析系统进行摄像,分析各组CHEK2和CASP3条带的亮度值。一抗为抗CHEK2和CASPASE3抗体(天津赛尔生物技术有限公司),二抗为HRP标记的羊抗兔IgG(天津赛尔生物技术有限公司),GAPDH为内参。
1.6 数据分析数据均以x±s表示,使用SPSS 22.0软件对数据进行统计,组间比较采用单因素方差分析, 分别用P < 0.05, P < 0.01表示结果的统计学意义。
2 结果 2.1 大白桩菇化学成分分析通过上述分离纯化步骤共得到13种化合物,通过分子量、熔点、1H-NMR和13C-NMR数据,并与参考文献进行比对,13种化合物分别鉴定为见Tab 1。其中化合物3、4、6、7、9、10和11为首次从该菌中分离得到。
| No | Compound | Formula | Mass/m/z | MeltingPoint/℃ | Reference |
| 1 | 5a,8a-epidioxyergosta-6,9(11),22-triene-3β-ol | C28H42O3 | 426.3 | 165~167 | [6] |
| 2 | ergosta-5,7,22-trien-3β-ol | C28H44O | 396.3 | 165~166 | [7] |
| 3 | 5α,8α-epidioxyergosta-6,22-dien-3β-ol | C28H44O3 | 428.3 | 182~183 | [6] |
| 4 | nicotinic acid | C6H5NO2 | 123.1 | 225~227 | [6] |
| 5 | cholest-7-en-3β-ol | C27H46O | 386.6 | 124~125 | [8] |
| 6 | succinic acid | C4H6O4 | 118.1 | 184~186 | [6] |
| 7 | hydroquinone | C6H6O2 | 110.1 | 172 | [6] |
| 8 | clitocine | C9H13N5O6 | 287.1 | 228~230 | [6] |
| 9 | cis-butenedioic acid | C4H4O4 | 116.1 | 134~138 | [6] |
| 10 | chlorogenic acid | C16H18O9 | 354.8 | 205~209 | [9] |
| 11 | 20S,22E,24R)-ergosta-7,22-dien-3β,5a,6β,9a-tetrol | C28H46O4 | 446.3 | 248~250 | [6] |
| 12 | R)-4-ethoxy-2-hydroxy-4-oxo-butanoic acid | C6H10O5 | 162.1 | [3] | |
| 13 | ergosta-5,7-dien-3β-ol | C28H46O | 398.3 | 267~269 | [10] |
LGEE对肿瘤细胞NCI-H502、BG-803和MDA-MB-231都有一定抑制作用,且与浓度成正相关;LGEE对NCI-H502、BG-803和MDA-MB-231细胞的半数抑制浓度(Tab 2)分别为(84.76±2.08)、(65.06±1.37)和(46.26±0.54) mg·L-1。其中LGEE对MDA-MB-231的抑制性最强,在浓度为200 mg·L-1时抑制率为(87.35±1.55)%,但低于紫杉醇(92.67%±1.53%),且差异显著(P < 0.05)。
| Sample | Tumor cell lines | ||
| MDA-MB-231 | BGC-803 | NCI-H520 | |
| LGEE | 46.26±0.54 | 65.06±1.37 | 84.76±2.08 |
| Paclitaxel | 16.52±0.33 | 14.67±0.89 | 19.75±1.00 |
采用TCMSP和PharmMapper数据库对鉴定的13个化学成分进行靶点预测,共得到1 898个作用靶点,去除重复靶点,共得到大白桩菇化学成分潜在靶标203个。在Genecards数据库中以“Breast cancer”(乳腺癌)作为关键词进行搜索,按Relevance score排序,选取疾病的前2 000个靶点,将药物有效成分靶点与疾病靶点交集,得到78个可能与大白桩菇抗乳腺癌作用相关的靶点。
2.3.2 核心靶点及PPI网络分析运用String数据库构建了78个靶点的PPI网络,将数据导入Cytoscape 3.8.0,进行网络分析,包含78个节点和466条边。根据3个拓扑参数对PPI网络中所有节点进行分析,选取D大于13、BC大于0.008和CC大于0.52的21个靶点作为核心靶点,核心靶点相关信息见Tab 3。
| Protein | Gene | Uniprot ID | Degree | Betweenness centrality | Closeness centrality |
| Glyceraldehyde-3-Phosphate Dehydrogenase | GAPDH | P04406 | 43 | 0.235431535 | 0.708737864 |
| BRCA1 DNA repair associated | BRCA1 | P38398 | 33 | 0.068180478 | 0.618644068 |
| ATM serine/threonine kinase | ATM | Q13315 | 32 | 0.090705991 | 0.613445378 |
| Caspase 3 | CASP3 | P42574 | 29 | 0.087966403 | 0.613445378 |
| Catalase | CAT | P04040 | 26 | 0.104447372 | 0.598360656 |
| Tumor necrosis factor | TNF | P01375 | 25 | 0.053688436 | 0.598360656 |
| Checkpoint kinase 2 | CHEK2 | O96017 | 25 | 0.027224028 | 0.557251908 |
| Checkpoint Kinase 1 | CHEK1 | O14757 | 24 | 0.024536426 | 0.553030303 |
| BRCA2 DNA repair associated | BRCA2 | P51587 | 24 | 0.021698726 | 0.54887218 |
| MutL Homolog 1 | MLH1 | P40692 | 24 | 0.018667474 | 0.525179856 |
| MutS Homolog 2 | MSH2 | P43246 | 23 | 0.028867936 | 0.496598639 |
| Proliferating cell nuclear antigen | PCNA | P12004 | 23 | 0.025330328 | 0.528985507 |
| Cadherin 1 | CDH1 | P12830 | 22 | 0.043120166 | 0.565891473 |
| Prostaglandin-endoperoxide synthase 2 | PTGS2 | P35354 | 20 | 0.029837379 | 0.521428571 |
| Androgen receptor | AR | P10275 | 17 | 0.01620543 | 0.540740741 |
| CREB-binding protein | CREBBP | Q92793 | 16 | 0.032933965 | 0.521428571 |
| Thymidylate synthase | TYMS | P04818 | 15 | 0.027794665 | 0.528985507 |
| Myeloperoxidase | MPO | P05164 | 14 | 0.016838082 | 0.493243243 |
| Glucose-6-phosphate 1-dehydrogenase | G6PD | P11413 | 14 | 0.014747372 | 0.528985507 |
| Superoxide dismutase[Mn] | SOD2 | P04179 | 14 | 0.01383229 | 0.528985507 |
| Progesterone receptor | PGR | P06401 | 14 | 0.0089461 | 0.525179856 |
通过DAVID数据库进行GO功能富集分析,得到生物过程(BP)条目36个(P < 0.01),将排名前20的GO条目绘制柱状图,见Fig 1A。KEGG通路富集主要针对筛选出的78个靶点进行分析,筛选出15条信号通路(P < 0.05)(Fig 1B)。
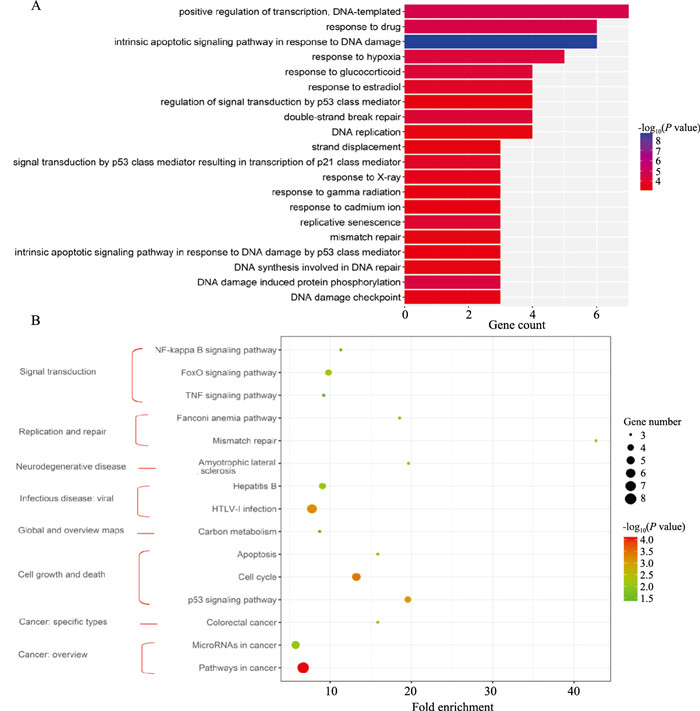
|
| Fig 1 Analysis of GO function (A) and KEGG pathway (B) |
“大白桩菇化合物-关键靶点-通路”网络如Fig 2所示,13个活性成分可通过21个靶点,在9条信号通路中发挥作用,说明大白桩菇可能通过多成分、多靶点、多通路抑制乳腺癌的发生和发展。
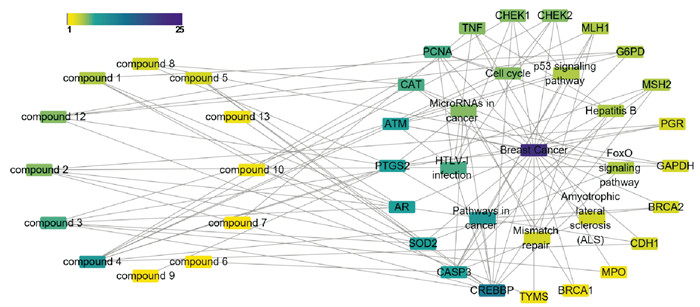
|
| Fig 2 Core compound-core target-pathway diagram |
将13个活性成分和2个药物(多柔比星和紫杉醇)与21个靶点进行对接。配体与受体的结合能越低结构越稳定,发挥的作用可能性越大。其中化合物10(绿原酸)和化合物8(克力托辛)与多个核心靶点结合较好(Fig 3)。绿原酸与CASP3和CHEK2的分子对接见Fig 4。
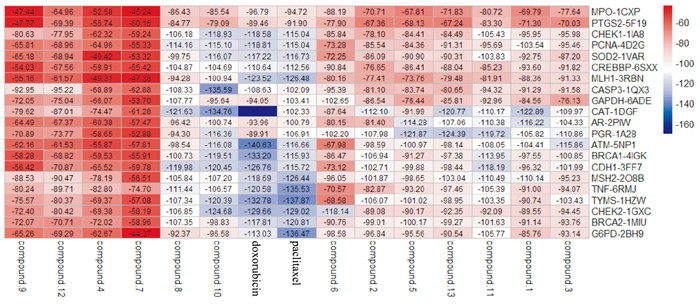
|
| Fig 3 Heat map of docking between active ingredient and core target protein |
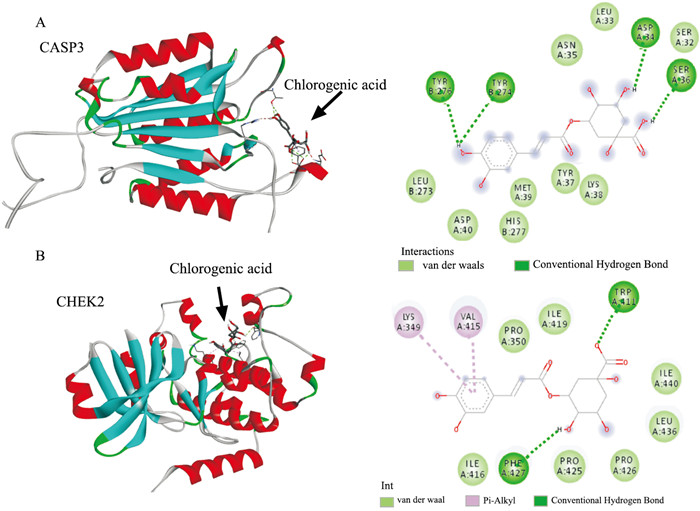
|
| Fig 4 Visualization of docking between chlorogenic acid and core target |
为了验证网络药理学和分子对接的可靠性,以绿原酸为代表,进行体外验证。不同浓度的绿原酸处理MDA-MB-231细胞,进行细胞凋亡检测,结果见Fig 5,细胞的总凋亡率从4.08%升高至26.63%。
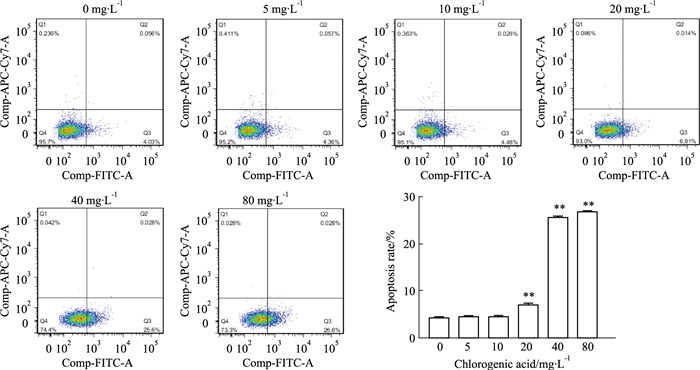
|
| Fig 5 Effect of chlorogenic acid on apoptosis of MDA-MB-231 cells **P < 0.01 vs control group |
MDA-MB-231细胞经不同浓度绿原酸处理后,促凋亡蛋白CASP3和抑癌基因CHK2编码的丝氨酸/苏氨酸激酶CHEK2的表达显著上升(Fig 6)。细胞实验结果证实了网络药理学和分子对接技术在大白桩菇活性成分治疗乳腺肿瘤相关靶点的正确性。
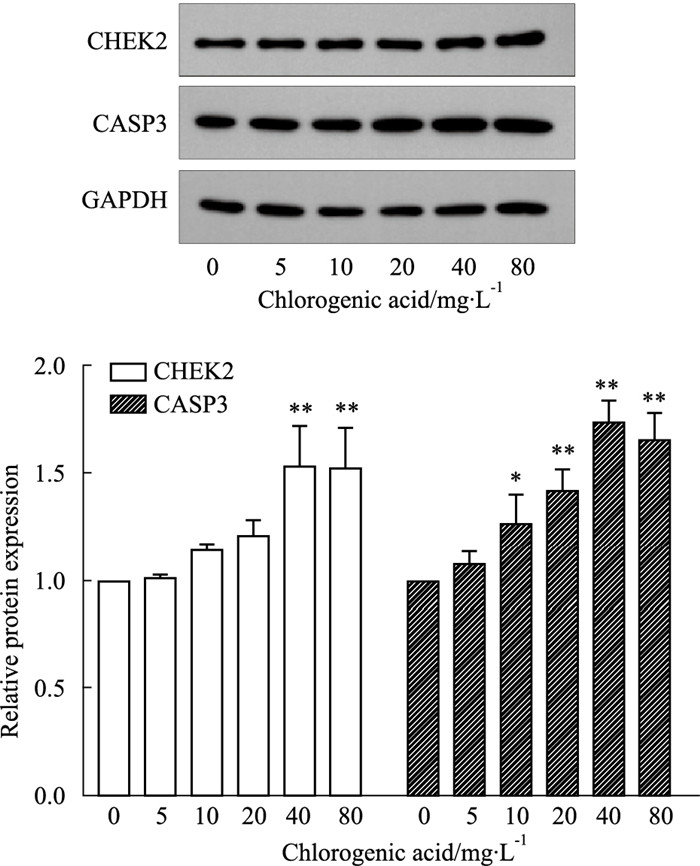
|
| Fig 6 Western blot analysis *P < 0.05, **P < 0.01 vs control group |
本研究从LGEE中分离到13个化合物,其中8个化合物为首次从该菌中分离得到,且LGEE抑制MDA-MB-231生长的IC50为(46.26±0.54) mg·L-1。采用网络药理学方法,构建药物活性成分-靶点-通路网络,从分子水平上探讨阐明大白桩菇抑制乳腺瘤细胞生长的药用成分、潜在靶点和作用机制。
通过网络药理预测,13个化合物可以通过78个潜在靶点与乳腺癌相关,且已有多个物质被报道具有抗乳腺的作用。如:绿原酸可通过抑制RARB基因启动子区甲基化修饰[11],而抑制MDA-MB-231细胞生长;克力托辛对乳腺癌细胞MCF-7和Bcap37都有较高的抑制作用[12];麦角甾-5,7,22-三烯-3β-醇和5α,8α-过氧化麦角甾-6,22-二烯-3β-醇有抗MDA-MD-231的活性[13]。因此,大白桩菇的这些成分可能会在抗乳腺癌中发挥重要作用。
通过PPI网络分析,CHEK2、CASP3、BRCA2、CREBBP等靶点具有重要地位。CHEK2是一种丝氨酸/苏氨酸激酶,可通过DNA损伤诱导细胞周期阻滞和凋亡,其功能的丧失与不同类型的癌症有关,尤其是乳腺癌[14];CASP3作为细胞凋亡途径中最为关键的酶类之一,对乳腺癌的发生和发展起重要作用[15];BRCA2是乳腺癌易感基因BRCA2编码的一种多功能蛋白,用于精确修复DNA双链断裂和复制性DNA损伤[16]。CREBBP作为核激素信号通路的关键调节因子,是乳腺癌中雄激素受体(AR)和雌激素受体(ER)信号的关键共激活因子,CREBBP抑制剂也可用于治疗乳腺癌[17]。这些靶点主要与凋亡、DNA复制修复、p53类介质对信号转导的调控、激素反应等多种生物学过程有关。KEGG通路富集结果主要涉及p53信号通路、FOXO信号通路、错配修复等方面。已有研究表明[18],乳腺癌发病机制中,通路富集较高的有p53、PI3K-AKT和VEGF等通路,排名和连接度较高的基因有TP53、BRCA2和CREBBP等。分子对接结果也显示大白桩菇中多个成分与上述靶点结合较好。但本研究还有一些不足之处,由于分离鉴定的成分较少,未能更好更全面的通过网络药理学分析大白桩菇治疗乳腺癌的药用成分和作用机制。
分子对接结果显示,绿原酸与CASP3和细胞周期检测点激酶2(checkpoint kinase2,CHEK2)等16个核心靶点结合得分均小于-100,克力托辛与CASP3和CREBBP等13个核心靶点分子对接得分均小于-100,说明绿原酸和克力托辛与以上靶点结合较好。通过分子对接研究,发现绿原酸可通过氢键结合CASP3靶蛋白A链的ASP34、SER36和B链的TYR274、TYR276(Fig 4A);通过氢键结合CHEK2靶蛋白A链的TRP411和PHE427(Fig 4B)。并且绿原酸对于CHEK2靶蛋白的相互作用还未见报道。同时通过KEGG富集分析得到的与乳腺癌相关的p53信号通路等多条通路涉及到以上基因。
网络药理学和分子对接技术综合分析显示CHEK2、CASP3、CHEK1和ATM基因可能是大白桩菇通过p53信号通路治疗乳腺癌最重要的4个基因。分子对接结果显示绿原酸与相关靶点结合最佳,并且绿原酸已经被证明可以预防和抑制各种癌症,因此选用绿原酸作为大白桩菇的主要成分进行体外实验研究有一定的代表性。体外实验发现绿原酸有效抑制了MDA-MD-231细胞增殖,处理48 h后,细胞凋亡率增加;Western blot验证了绿原酸上调MDA-MD-231细胞中CASP3和CHEK2蛋白的表达。证实了绿原酸作为大白桩菇药效成分之一,可作用于p53信号通路中多个肿瘤调控因子发挥促凋亡功效,同时也验证了本研究中网络药理筛选和分子对接结果与预测分子机制的准确性。
综上所述,本研究从大白桩菇中分离鉴定到13个化合物,体外实验证明了大白桩菇乙醇提取物的抗肿瘤活性,应用网络药理学方法,对大白桩菇的多成分、多靶点与乳腺癌之间复杂网络关系进行研究,初步阐述了大白桩菇治疗乳腺癌的主要潜在活性成分及其作用靶点和相关通路,同时结合分子对接技术和细胞实验验证了本研究中网络药理学分析结果的可靠性,为大白桩菇对乳腺癌的潜在作用和机制研究奠定基础。
| [1] |
卯晓岚. 中国大型真菌[M]. 郑州: 河南科学技术出版社, 2000: 181. Mao X L. The macrofungi in China[M]. Zhengzhou: Henan Sci and Tech Press, 2000: 181. |
| [2] |
Ren G, Zhao Y P, Yang L, et al. Anti-proliferative effect of clitocine from the mushroom Leucopaxillus giganteus on human cervical cancer HeLa cells by inducing apoptosis[J]. Cancer Lett, 2008, 262(2): 190-200. doi:10.1016/j.canlet.2007.12.013 |
| [3] |
Malya I Y, Wu J, Harada E, et al. Plant growth regulators and Axl and immune checkpoint inhibitors from the edible mushroom Leucopaxillus giganteus[J]. Biosci Biotechnol Biochem, 2020, 84(7): 1332-8. doi:10.1080/09168451.2020.1743170 |
| [4] |
段贤春, 黄石, 彭代银, 等. 网络药理学在中药复方研究中的应用[J]. 中国药理学通报, 2020, 36(3): 303-8. Duan X C, Huang S, Peng D Y, et al. Application of network pharmacology in the study of traditional Chinese medicine formula[J]. Chin Pharmacol Bull, 2020, 36(3): 303-8. |
| [5] |
Liu K, Wang J, Zhao L, et al. Anticancer, antioxidant and antibiotic activities of mushroom Ramaria flava[J]. Food Chem Toxicol, 2013, 58(8): 375-80. |
| [6] |
刘坤. 内蒙古克什克腾旗大型真菌资源利用研究[D]. 北京: 中央民族大学, 2012. Liu K. Utilization research on macrofungi resources in Hexigten Banner of Inner Mongolia[D]. Beijing: Minzu Univ of China, 2012. |
| [7] |
程锁明, 翟银成, 薛芳, 等. 僵蚕化学成分的研究[J]. 中草药, 2015, 46(24): 3630-6. Cheng S M, Zhai Y C, Xue F, et al. Chemical constituents of Bombyx Batryticatus[J]. Chin Tradit Herbal Drugs, 2015, 46(24): 3630-6. |
| [8] |
尹海龙, 李建, 李箐晟, 等. 白英的化学成分研究[J]. 军事医学, 2010, 34(1): 65-7. Yin H L, Li J, Li J S, et al. Chemical constituents from Solanum lyratum Thunb[J]. Military Med Sci, 2010, 34(1): 65-7. |
| [9] |
何婷, 赵怡程, 李鹏跃, 等. 滇白珠抗炎镇痛活性部位的化学成分研究[J]. 中草药, 2017, 48(17): 3469-74. He T, Zhao Y C, Li P Y, et al. Chemical constituents from anti-inflammatory and analgesic active fraction of Gaultheria leucocarpa var. yunnanensis[J]. Chin Tradit Herbal Drugs, 2017, 48(17): 3469-74. |
| [10] |
Yaoita Y, Amemiya K, Ohnuma H, et al. Sterol constituents from five edible mushrooms[J]. Chem Pharm Bull, 1998, 46(6): 944-50. doi:10.1248/cpb.46.944 |
| [11] |
Marzag H, Warnault P, Bougrin K, et al. Chapter 7 - natural polyphenols as potent inhibitors of dna methyltransferases[J]. Studies in Natural Products Chemistry, 2014, 41: 195-223. |
| [12] |
孙建国. 新型NF-κB抑制剂Clitocine抑制耐药性肿瘤细胞的分子机制研究[D]. 杭州: 浙江大学, 2012. Sun J G. The suppression effect of clitocine in drug resistant cancer cells as a novel NF-KB inhibitor[D]. Hangzhou: Zhejiang Univ, 2012. |
| [13] |
Jagadeesh R, Babu G, Lakshmanan H, et al. Bioactive sterol derivatives isolated from the Pleurotus djamor var. roseus induced apoptosis in cancer cell lines[J]. Cardiovasc Hematol Agents Med Chem, 2020, 18(2): 124-34. |
| [14] |
Badgujar N V, Tarapara B V, Shah F D. Computational analysis of high-risk SNPs in human CHK2 gene responsible for hereditary breast cancer: A functional and structural impact[J]. PloS One, 2019, 14(8): e0220711. |
| [15] |
李美玲, 高美华, 宋云峰, 等. Survivin和Caspase-3在乳癌组织的表达及相关性[J]. 齐鲁医学杂志, 2009, 24(5): 377-9. Li M L, Gao M H, Song Y F, et al. The expressions and their correlation of survivin and caspase-3 in breast cancer[J]. Qilu Med J, 2009, 24(5): 377-9. |
| [16] |
Sessa G, Ehlén Å, von Nicolai C, et al. Missense variants of uncertain significance: A powerful genetic tool for function discovery with clinical implications[J]. Cancers, 2021, 13(15): 3719. |
| [17] |
Waddell A R, Huang H, Liao D. CBP/p300: Critical co-activators for nuclear steroid hormone receptors and emerging therapeutic targets in prostate and breast cancers[J]. Cancers, 2021, 13(12): 2872. |
| [18] |
López-Cortés A, Paz-y-Miño C, Cabrera-Andrade A, et al. Gene prioritization, communality analysis, networking and metabolic integrated pathway to better understand breast cancer pathogenesis[J]. Sci Rep, 2018, 8(1): 16679. |

