

2. 深圳大学医学部基础医学院,广东 深圳 518060
2. College of Basic Medicine, Health Center, Shenzhen University, Shenzhen 518060, China
癌症是中国和发达国家最主要的死因之一[1],根据国际癌症研究机构IARC的数据,全球发病率前10的癌症中,胃癌位居第5位,死亡率位居第4位。在中国,胃癌的发病率和死亡率均位居第3位,严重威胁着我国人民的生命安全。目前,胃癌的治疗主要包括手术切除、化学治疗、放射治疗和免疫治疗等手段,但术后复发、转移率仍然较高,治疗效果难以令人满意。此外,化疗和放疗会使癌细胞逐渐产生耐药性[2],且对患者身体的伤害较大。因此,需要开发新的、负担得起的、有效的药物,以提升治疗效果,减少常规治疗方法对患者机体的伤害。从传统中药材中提取具有抗胃癌活性的化合物进行研究,越来越受到人们的广泛关注[3],许多天然产物已被食品和药物监督管理局(FDA)批准用于癌症治疗,其中药用植物为癌症治疗提供了一种常见的替代方法[4]。
绞股蓝[Gynostemma pentaphyllum (Thunb.) Makino]为葫芦科多年生草本攀援植物,在我国有“南方人参”之称,美国称其“绿色金子”,新加坡称其“百病克星”,可见它对疾病的功效。本属植物主要分布于中国(长江流域以南,秦岭南坡区域)、亚洲热带(越南、泰国、缅甸)、东亚(韩国、日本)、喜马拉雅(印度、孟加拉)等地。最早可以追溯到公元1368~1644年,朝代为明朝[5],于《救荒本草》一书中被首次记载,当时绞股蓝作为一种可食用的野菜。而它作为一种药用植物,在中国已有1 000多年药用历史了,其用法和疗效最早记录于李时珍所编撰的《本草纲目》中[6]。近年来,绞股蓝因其具有广泛的生物活性和极低的药理毒性而备受关注[7]。目前,在中国及其他几个亚洲国家,欧洲、美国等地,已有绞股蓝相关产品的上市,包括茶叶、饮料、胶囊、片剂等[8]。多项研究表明,绞股蓝中的化学成分在体内体外均显示出药理活性,对糖尿病、肝炎、支气管炎、癌症等疾病的治疗有潜在的疗效。现已从绞股蓝中分离鉴定出大量化合物,大部分是皂苷,其余化合物被归类为甾醇、黄酮类、多糖、木脂素、氨基酸、维生素和无机元素等[9]。皂苷被认为是绞股蓝中具有多种生物活性和临床作用的主要活性成分。特别是近年来,体内外研究均显示其有抗肿瘤效应[10],但在胃癌中的研究尚少见报道。
本研究以人胃癌细胞SGC-7901和AGS为研究对象,旨在探索绞股蓝皂苷对胃癌细胞增殖和凋亡的影响,分析绞股蓝皂苷抗胃癌的作用机制,期望为胃癌的综合治疗提供新方法,为绞股蓝皂苷在临床胃癌治疗中的应用奠定理论基础。
1 材料与方法 1.1 细胞株人胃癌细胞SGC-7901和AGS细胞株,由深圳大学医学部细胞库保存。
1.2 药物与试剂绞股蓝皂苷购于成都曼斯特生物科技有限公司,批号MUST-21070818,纯度98%。溶于二甲基亚砜(DMSO)中制备溶液,在培养基中处理期间DMSO的最终浓度,保持低于0.5%。DMEM/HIGH GLUCOUSE培养基(货号SH30243.01)、Trypsin胰酶消化液(货号SH30042.01)和PBS缓冲液(货号SH30256.01)购于美国cytiva公司;Cell Counting Kit-8试剂盒(货号HY-K0301)购于美国MedChemExpress公司;细胞凋亡检测试剂盒(货号556547)购于美国Becton,Dickinson and Company公司;caspase-9活性检测试剂盒(货号C1157)、caspase-3活性检测试剂盒(货号C1115)、BCA蛋白浓度测定试剂盒(货号P0010)和Bradford蛋白浓度测定试剂盒(货号P0006C)购于上海碧云天生物技术有限公司;cleaved-PARP(货号5625)、caspase-9(货号9502)、cleaved-caspase-3(货号9664)、Bax(5023)、Anti-rabbit IgG(货号7074)、Anti-mouse IgG(货号7076)等抗体购于美国Cell Signaling Technology公司;caspase-3(货号GB11767C)抗体购于武汉赛维尔生物科技有限公司;Bcl-2(货号A0208)抗体购于武汉爱博泰克生物科技有限公司;GAPDH(货号60004-1-Ig)抗体购于美国Proteintech公司;meilunbio飞克特超敏ECL发光液(货号MA0186-1)购于大连美伦生物技术有限公司。
1.3 仪器倒置荧光显微镜(明美,型号:MF53-N),多功能酶标仪(TECAN,型号:INFINITE E PLEX),流式细胞仪(BECKMAN COULTER,型号:No:B75442),全自动化学发光荧光成像分析系统(MinichemiTM,型号:MiniChemi 910 Plus)。
1.4 方法 1.4.1 细胞培养与实验分组细胞在含有10%胎牛血清和1%青霉素-链霉素的DMEM培养基中进行培养,传代数不超过20代。待细胞生长至对数期时,用不同浓度的绞股蓝皂苷处理细胞,实验分成空白对照组和给药组。
1.4.2 细胞增殖实验在96孔板中接种SGC-7901和AGS细胞,每孔4×103个细胞,培养24 h,加入绞股蓝皂苷(0、5、10、20、40、80、160和320 mg·L-1),继续培养48 h。48 h后每孔加入CCK-8,孵育2 h后在450 nm波长下测定吸光度,计算得到绞股蓝皂苷对SGC-7901和AGS细胞的半数抑制浓度IC50。
1.4.3 细胞克隆实验按常规方法进行,在6孔板中接种细胞后加入绞股蓝皂苷处理。SGC-7901细胞中绞股蓝皂苷浓度分别为0、60和120 mg·L-1,AGS细胞中浓度则分别为0、40和80 mg·L-1。培养箱中孵育7 d以允许细胞集落生长。在长期孵育期间,每3 d更换含有相应浓度的绞股蓝皂苷的新鲜培养基。待孔板长出克隆后,弃培养基,每孔加入1 mL的4%多聚甲醛固定30 min,固定完后加入1 mL的1%结晶紫溶液染色30 min。之后将结晶紫去掉,并用清水漂洗几次,再将孔板倒扣晾干,使用ImageJ软件对克隆斑点进行计数。
1.4.4 流式细胞实验在6孔板中接种SGC-7901和AGS细胞,每孔3×105个细胞后加入绞股蓝皂苷处理。SGC-7901细胞中浓度分别为0、60、120和240 mg·L-1,AGS细胞中浓度分别为0、40、80和160 mg·L-1。48 h后,收集培养基,用1× PBS洗1次,加入胰酶消化后将细胞收集离心,再用凋亡试剂盒进行染色。将Annexin V和PI染色液加入到1×binding buffer中并混匀,然后加100 μL混合液至每个样品中,室温避光孵育15 min后,用1×PBS清洗并离心,再加200 μL 1× binding buffer,上流式细胞仪检测各组细胞的凋亡率。
1.4.5 caspase活性检测实验用不同浓度的绞股蓝皂苷处理胃癌细胞,SGC-7901细胞中浓度分别为0、60和120 mg·L-1;AGS细胞中浓度分别为0、40和80 mg·L-1。48 h后,消化并收集细胞沉淀,PBS洗1次,吸尽上清,加入试剂盒裂解液,重悬沉淀。冰浴裂解30 min,离心取上清,然后分别加入10 μL的Ac-DEVD-pNA(2 mmol·L-1)或Ac-LEHD-pNA(2 mmol·L-1)混匀。37 ℃孵育2 h后,用酶标仪测定A405,得到吸光度。
1.4.6 Western blot实验用0、60和120 mg·L-1的绞股蓝皂苷作用于SGC-7901,用0、40和80 mg·L-1的绞股蓝皂苷作用于AGS,48 h后离心收集细胞沉淀,加入细胞裂解液200 μL,放入冰浴中裂解30 min后用BCA试剂盒测定蛋白浓度。SDS-PAGE凝胶电泳分离总蛋白后,湿法转膜。封闭2 h后,加入一抗封闭过夜(4 ℃)。次日,洗膜3次后加入二抗室温孵育2 h,再次洗膜3次。最后,将化学发光显影液滴在膜上,使其完全覆盖,放入蛋白成像系统中进行曝光。
1.4.7 统计学分析所有数据均表示为x±s。使用GraphPad Prism检验计算组间变量差异的统计学显著性,两组间比较采用t检验。
2 结果 2.1 绞股蓝皂苷对胃癌细胞增殖的抑制作用细胞增殖实验结果显示,随着绞股蓝皂苷浓度的增加,两种胃癌细胞的生长逐渐受到抑制。低浓度时,药物对细胞抑制作用尚不明显,但在80~160 mg·L-1的浓度区间,SGC-7901细胞的增殖受到强烈的抑制,IC50值为121.8 mg·L-1(Fig 1A);在40~160 mg·L-1时,AGS细胞的增殖受到强烈的抑制,IC50值为86.63 mg·L-1(Fig 1B)。
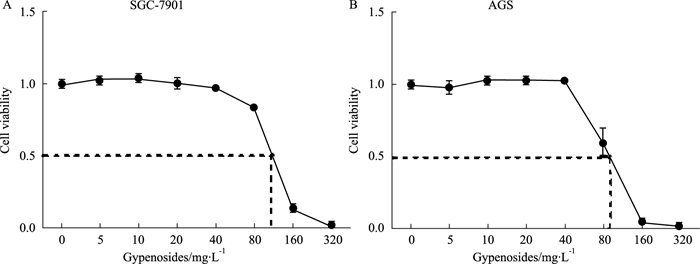
|
| Fig 1 Effect of gypenosides with different concentrations on viability of SGC-7901 (A) and AGS (B) cells (x±s, n=3) |
克隆形成实验结果显示,随着绞股蓝皂苷浓度的增加,两种胃癌肿瘤细胞的细胞集落数量均明显减少。绞股蓝皂苷浓度为60 mg·L-1时,SGC-7901细胞克隆数降低到(56.37±3.86)%;增大到120 mg·L-1时,降低到(19.58±1.70)%(Fig 2A)。绞股蓝皂苷浓度为40 mg·L-1时,AGS细胞克隆数降低到(59.02±3.50)%,增大到80 mg·L-1时,基本没有AGS细胞克隆(Fig 2B)。
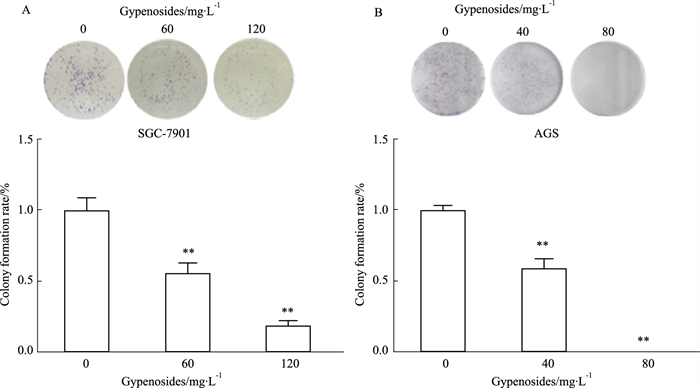
|
| Fig 2 Effect of gypenosides on abilities of SGC-7901 (A) and AGS (B) cells clone formation (x±s, n=3) **P < 0.01 vs Control |
流式结果显示,SGC-7901和AGS细胞用不同浓度的绞股蓝皂苷处理48 h后,凋亡率明显增加,并呈浓度依赖性。经60 mg·L-1绞股蓝皂苷处理48 h后,SGC-7901细胞的凋亡率增加为(6.84±1.56)%;浓度增加到120 mg·L-1和240 mg·L-1后,细胞凋亡率分别增加为(18.37±1.59)%和(55.37±1.69)%(Fig 3A)。经40 mg·L-1绞股蓝皂苷处理48 h后,AGS细胞的凋亡率增加为(0.69±0.36)%;经浓度为80 mg·L-1和160 mg·L-1绞股蓝皂苷处理后,其凋亡率分别增加为(1.50±0.37)%和(13.33±1.40)%(Fig 3B)。
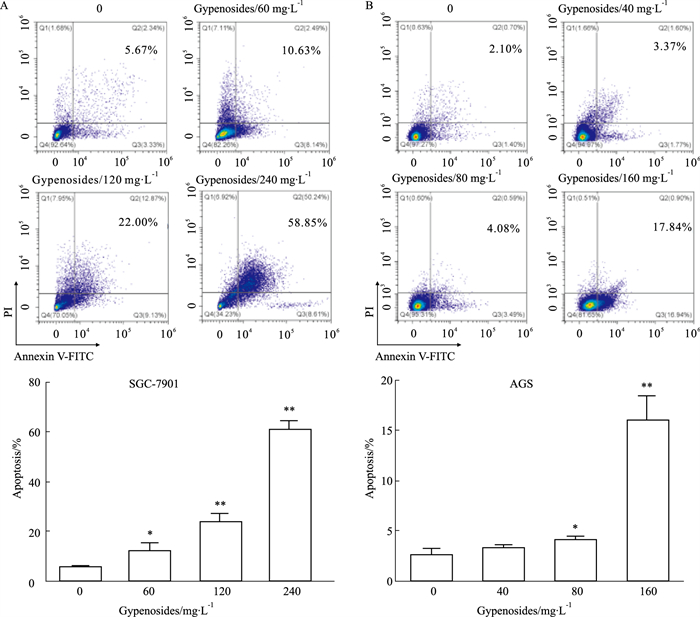
|
| Fig 3 Effect of gypenosides on apoptotic rates of SGC-7901 (A) and AGS (B) cells (x±s, n=3) *P < 0.05, **P < 0.01 vs Control |
活性检测结果显示,经绞股蓝皂苷处理48 h后,与空白对照组相比较,SGC-7901细胞实验组的caspase-9、caspase-3的活性均明显增加(Fig 4A);AGS细胞实验组的caspase-9的活性低浓度时没有明显变化,但高浓度时明显增加,caspase-3的活性明显增加(Fig 4B)。
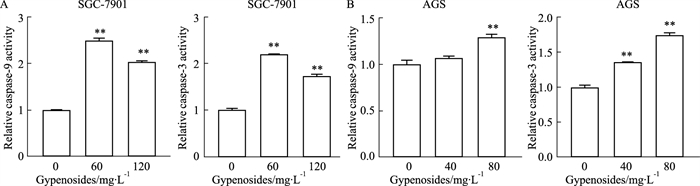
|
| Fig 4 Effect of gypenosides on activities of caspase-9 and caspase-3 in SGC-7901 (A) and AGS (B) cells (x±s, n=3) **P < 0.01 vs Control |
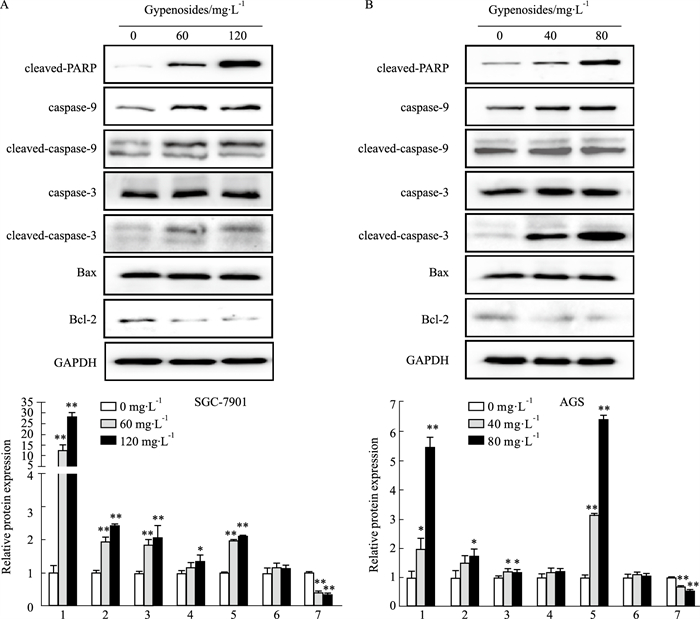
Western blot结果显示,经绞股蓝皂苷处理48 h后,与空白对照组相比较,随着浓度升高,cleaved-PARP的表达呈明显上调趋势,并呈明显的浓度依耐性;作为细胞凋亡的启动者caspase-9及其活化形式cleaved-caspase-9的表达呈明显上调趋势;caspase-3的表达变化不明显,但其活化形式cleaved-caspase-3的表达呈明显上调趋势;Bax的表达变化不明显,有轻微上调的趋势;而抑制凋亡的蛋白Bcl-2的表达呈明显下调趋势(Fig 5)。结果显示绞股蓝皂苷能通过调控凋亡蛋白的表达诱导人胃癌细胞SGC-7901和AGS发生凋亡。
|
| Fig 5 Effect of gypenosides on expression of relative apoptotic proteins in SGC-7901 (A) and AGS (B) cells (x±s, n=3) 1:Cleaved-PARP; 2:caspase-9;3:Cleaved caspase-9;4:caspase-3;5:Cleaved caspase-3;6:Bax; 7:Bcl-2;*P < 0.05 vs Control, **P < 0.01 vs Control |
胃癌是全球癌症相关死亡的主要原因之一,也是世界上最常见的恶性肿瘤之一。目前,胃癌的治疗手段虽已比较完善,但仍存在对患者健康伤害较大、预后较差等问题,从传统的、毒性小的中药材中提取具有抗癌活性的化合物已经成为抗肿瘤治疗的一大热点。
1976年,日本学者Zhang等[11]首次从绞股蓝地上部分的水解物中分离得到达玛烷型皂苷,结构为四环三萜类,经鉴定为人参二醇和2α-人参二醇。到目前为止,已从绞股蓝属植物及其炮制品中分离和鉴定了300多个皂苷,其药理作用包括:抗肿瘤、抗氧化、抗衰老、降血脂、降血糖、增强机体免疫力等[12],常用于治疗高脂血症、心血管疾病、肝炎、糖尿病、癌症等疾病。在肿瘤治疗方面,绞股蓝也备受关注。有研究证明,绞股蓝皂苷能诱导非小细胞肺癌A549细胞凋亡,并阻滞细胞周期于G0/G1期[13];可通过影响人肝癌细胞Huh-7内ROS的产生,线粒体Bax和Bcl-2的表达诱导细胞凋亡[14];还可通过抑制核因子-kappaB(NF-κB),基质金属蛋白酶-9,-2(MMP-9,-2)的信号转导来抑制人口腔癌细胞SAS的侵袭和迁移[15]。通过影响凋亡途径相关蛋白的表达来诱导细胞凋亡是绞股蓝皂苷发挥抗癌活性的可能机制,但国内外对绞股蓝抗胃癌凋亡机制的研究尚少有报道,本文首次探讨了绞股蓝皂苷对胃癌细胞增殖和凋亡的影响并初步分析了其作用机制。
细胞凋亡分为外源性途径和内源性途径。外源性途径又称为死亡受体途径,胞外配体与膜上受体结合后触发下游的半胱天冬酶(caspase)级联反应,诱导凋亡。内源性途径又称为线粒体途径,其过程依赖于线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)的打开,转换孔打开后线粒体内的促凋亡因子,如细胞色素C(Cyt-c),Smac/Diablo和HtrA2/ Omi等将会被释放到胞质中,与凋亡肽酶激活因子-1(apoptotic protease activating factor-1,Apaf-1)及三磷酸腺苷(adenosine triphosphate,ATP)结合[16]形成一种被称为“凋亡体”的蛋白质复合物,再激活下游caspase蛋白,导致细胞凋亡。PARP作为caspase的切割底物,它一旦发生剪切,即生成cleaved-PARP,通常认为caspase-3已被激活,细胞凋亡开始执行。细胞凋亡并不完全是条线性通路,而是一个庞大复杂的环性通路,不同信号分子间相互影响,其中还包括Bcl-2蛋白家族。Bcl-2蛋白家族通过增加或降低线粒体膜通透性,来调节细胞色素C和其他凋亡蛋白的释放,从而调控内源性途径[17]。Bcl-2家族分为抗凋亡和促凋亡蛋白两大类,Bcl-2和Bax就是其中的代表蛋白。这些蛋白作为受体中介,还可诱导内质网应激或线粒体应激依赖的细胞凋亡[18]。
在本研究中,我们首先通过观察绞股蓝皂苷对人胃癌细胞增殖的影响,证实了不同浓度的绞股蓝皂苷对SGC-7901和AGS细胞均有抑制作用并呈现剂量依赖性。细胞克隆形成实验也验证了随着药物浓度的增大,胃癌细胞克隆数逐渐减少。其次,通过流式细胞实验确定了绞股蓝皂苷能诱导胃癌细胞凋亡。接着,caspase活性检测实验证明了绞股蓝皂苷能增加胃癌细胞内caspase-9、caspase-3的活性。最后,还揭示了绞股蓝皂苷诱导胃癌细胞凋亡的分子机制。胃癌细胞经绞股蓝皂苷处理后,促进凋亡的蛋白cleaved-PARP和caspase-9及其活化形式cleaved-caspase-9的表达明显上调;caspase-3的表达呈轻微上调趋势,但是其活化形式cleaved-caspase-3的表达明显上调;Bax的表达也呈轻微上调趋势,而抑制凋亡的蛋白Bcl-2的表达明显下调。因此,绞股蓝皂苷可以通过内源性凋亡途径诱导胃癌细胞凋亡。
综上所述,本课题证实了中药成分绞股蓝皂苷能够抑制人胃癌细胞的增殖,并诱导细胞发生凋亡,其分子机制主要是通过调控细胞凋亡途径中的相关蛋白cleaved-PARP、caspase-9、caspase-3和Bcl-2等的表达。本研究为绞股蓝皂苷抗胃癌提供了实验依据,也为中药抗肿瘤的临床治疗奠定了实验基础。
| [1] |
Bray F, Laversanne M, Weiderpass E, et al. The ever-increasing importance of cancer as a leading cause of premature death worldwide[J]. Cancer, 2021, 127(16): 3029-30. doi:10.1002/cncr.33587 |
| [2] |
Pereira D M, Valentao P, Correia-da-Silva G, et al. Plant secondary metabolites in cancer chemotherapy: Where are we?[J]. Curr Pharm Biotechnol, 2012, 13(5): 632-50. doi:10.2174/138920112799857530 |
| [3] |
Sun D Z, Xu L, Wei P K, et al. Syndrome differentiation in traditional Chinese medicine and E-cadherin/ICAM-1 gene protein expression in gastric carcinoma[J]. World J Gastroenterol, 2007, 13(32): 4321-7. doi:10.3748/wjg.v13.i32.4321 |
| [4] |
Wang C Z, Calway T, Yuan C S. Herbal medicines as adjuvants for cancer therapeutics[J]. Am J Chin Med, 2012, 40(4): 657-69. doi:10.1142/S0192415X12500498 |
| [5] |
Yang F, Shi H, Zhang X, et al. Two novel anti-inflammatory 21-nordammarane saponins from tetraploid Jiaogulan (Gynostemma pentaphyllum)[J]. Agric Food Chem, 2013, 61(51): 12646-52. doi:10.1021/jf404726z |
| [6] |
Razmovski-Naumovski V, Huang T H, Tran V H, et al. Chemistry and pharmacology of Gynostemma pentaphyllum[J]. Phytochem Rev, 2005, 4(2): 197-219. |
| [7] |
Chiranthanut N, Teekachunhatean S, Panthong A, et al. Toxicity evaluation of standardized extract of Gynostemma pentaphyllum Makino[J]. J Ethnopharmacol, 2013, 149(1): 228-34. doi:10.1016/j.jep.2013.06.027 |
| [8] |
Wang J, Li C H, Farimani M M, et al. Dammarane-type saponins from Gynostemma pentaphyllum and their potential anti-AD activity[J]. Phytochem Lett, 2019, 31: 147-54. doi:10.1016/j.phytol.2019.03.022 |
| [9] |
南瑛, 张薇, 常晋瑞, 等. 绞股蓝皂苷通过Nrf2/NF-κB信号通路发挥抗小鼠急性酒精性肝损伤作用[J]. 中国药理学通报, 2019, 35(1): 40-5. Nan Y, Zhang W, Chang J R, et al. Gypenosides protect acute alcoholic liver injury through Nrf2/NF-κB signaling pathway in mice[J]. Chin Pharmacol Bull, 2019, 35(1): 40-5. |
| [10] |
Tai W C, Wong W Y, Lee M M, et al. Mechanistic study of the anti-cancer effect of Gynostemma pentaphyllum saponins in the Apc(Min/+) mouse model[J]. Proteomics, 2016, 16(10): 1557-69. doi:10.1002/pmic.201500293 |
| [11] |
张涛, 袁弟顺. 中国绞股蓝种质资源研究进展[J]. 云南农业大学学报, 2009, 24(3): 459-61. Zhang T, Yuan D S. Advance in study on Gynostemma Germplasm Resource in China[J]. J Yunnan Agric Uni, 2009, 24(3): 459-61. |
| [12] |
耿亚楠, 赵名, 范明, 等. 绞股蓝皂苷对神经系统疾病的保护效应及作用机理的研究进展[J]. 中国药理学通报, 2021, 37(6): 765-8. Geng Y N, Zhao M, Fan M, et al. Advance on protective effects of gypenosides on neural disorders and underlying mechanisms[J]. Chin Pharmacol Bull, 2021, 37(6): 765-8. |
| [13] |
Qi Y S, Xie J B, Xie P, et al. Uncovering the anti-NSCLC effects and mechanisms of gypenosides by metabolomics and network pharmacology analysis[J]. J Ethnopharmacol, 2021, 281: 114506. doi:10.1016/j.jep.2021.114506 |
| [14] |
Wang Q F, Chiang C W, Wu C C, et al. Gypenosides induce apoptosis in human hepatoma Huh-7 cells through a calcium/reactive oxygen species-dependent mitochondrial pathway[J]. Planta Med, 2007, 73(6): 535-44. doi:10.1055/s-2007-967200 |
| [15] |
Lu K W, Chen J C, Lai T Y, et al. Gypenosides inhibits migration and invasion of human oral cancer SAS cells through the inhibition of matrix metalloproteinase-2 -9 and urokinase-plasminogen by ERK1/2 and NF-kappa B signaling pathways[J]. Hum Exp Toxicol, 2011, 30(5): 406-15. doi:10.1177/0960327110372405 |
| [16] |
张杨, 孙弯弯, 陆丽丹, 等. 细胞自噬与凋亡相互作用分子机制的研究进展[J]. 基础医学与临床, 2021, 41(9): 1342-6. Zhang Y, Sun W W, Lu L D, et al. Research progress on molecular mechanism of the interaction between autophagy and apoptosis[J]. Basic and Clin Med, 2021, 41(9): 1342-6. |
| [17] |
Wu C C, Bratton S B. Regulation of the intrinsic apoptosis pathway by reactive oxygen species[J]. Antioxid Redox Signal, 2013, 19(6): 546-58. |
| [18] |
Reed J C. Proapoptotic multidomain Bcl-2/Bax-family proteins: Mechanisms, physiological roles, and therapeutic opportunities[J]. Cell Death Differ, 2006, 13(8): 1378-86. |

