

肝癌是全球第六大最常见恶性肿瘤,也是全球恶性肿瘤相关死亡的第四大原因,肝癌发病率在全球范围内不断增长,其5年生存率不到18%[1]。在中国,肝癌的发病率和死亡率远高于其他国家,其发病率和死亡率约占全球45%[2]。肝细胞癌(hepatocellular carcinoma,HCC)是最常见的肝癌类型,约占所有肝癌患者的90%。肝癌治疗的常规方法是化疗,虽然临床治疗肝癌的化疗药物种类繁多,但由于严重副作用及癌细胞耐药性出现阻碍其临床运用,而且肝癌患者预后差、复发率高一直是临床亟待解决的问题[3]。尽管在新的诊断技术、化疗药物和治疗策略的发展方面取得了巨大的进步,但由于耐药、远处转移和生存率有限,HCC的治疗仍然是一个关键的挑战[4-5]。因此,开发有效的、副作用小的肝癌治疗方法已迫在眉睫。
葫芦素B(cucurbitacin B,Cu B)是从葫芦科植物分离的一种活性单体,具有多种药理活性,已广泛用于抗肿瘤研究[6],体内和体外实验表明,Cu B通过NF-κB、JAK/STAT、PI3K/AKT和MAPK/ERK信号通路抑制多种肿瘤的增殖[7-8]。铁死亡是一种新发现的细胞程序性死亡方式,大量研究表明[9],铁死亡在肿瘤的发生、发展和表型转变中发挥着重要作用。许多中药小分子能够促进细胞铁死亡,可为肿瘤治疗提供新的策略。尽管CU B已被报道可通过许多分子机制来抑制肿瘤生长,但其抑制肝癌细胞增殖是否与促进细胞铁死亡尚不清楚。所以,本研究拟探讨Cu B抑制肝癌细胞的增殖与细胞铁死亡的关系和可能的作用机制,以期为肝癌的治疗和新药的开发提供理论依据。
1 材料与方法 1.1 细胞株人肝癌细胞株Huh-7(目录号:SCSP-526)购于中科院细胞库。
1.2 药品与试剂葫芦素B(Cu B,HY-N0416)Deferoxamine (DFO,HY-B0988),Ferrostatin-1 (Fer-1,HY-100579),Necrostatin-1 (Nce-1,HY-15760),Z-VAD-FMK (HY-16658B),Chloroquine (CQ,HY-17589A),and Liproxstatin-1 (Lip-1,HY-12726)购于美国MCE公司,EdU-488试剂盒(C0071S),购于上海碧云天生物公司,CCK-8(C0038)、DCFH-DA荧光探针(MB4682)购于大连美仑生物公司,C11-BODIPY荧光探针(D3861),免疫共沉淀试剂盒(26169)购于美国Thermo公司;FeRhonox-1(货号GC901),购于日本Goryo Chemical公司,逆转录试剂盒和qRT-PCR试剂盒(EE047A,RR820A)购于日本TaKaRa公司,SLC7A11 (ab37185)、GPX4 (ab125066)、SLC40A1 (ab239583)、Transferrin (ab214039)、HO-1 (ab13248)抗体购于Abcam公司,Nrf2 (12721)、GAPDH (5174),辣根过氧化酶(HRP)标记的山羊抗兔二抗(7074)-购于CST公司。引物合成,上海生物工程公司。
1.3 仪器多模式酶标仪(SpectraMaxⓇiD3,澳大利亚),流式细胞仪(FACS Calibur Becton Dickinson,美国),CO2细胞培养箱(Thermo Scientific,美国),电泳系统、凝胶成像分析系统(BIO-RAD,美国),流式细胞仪(BD,美国),共聚焦显微镜(SP8,德国徕卡公司)。
2 方法 2.1 细胞培养及分组人肝癌细胞Huh-7培养于DMEM培养基中(10% FBS,1%双抗),细胞于5% CO2、37 ℃的饱和湿度培养箱中培养,细胞培养2~3 d可传代培养,取处于对数期生长状态良好的细胞继续后续实验。根据IC50实验结果,分别以1/2倍IC50、1倍IC50、2倍IC50为Cu B低、中、高剂量组进行后续实验。
2.2 CCK-8法检测Cu B对Huh-7细胞的增殖影响取对数期Huh-7细胞,以6×103/100 μL的细胞密度接种于96孔板,于37 ℃培养箱中继续培养,待细胞过夜贴壁后,将细胞分为空白组、对照组和药物处理组,药物组分别以终浓度为(0、0.1、0.2、0.4、0.8、1、2、3 μmol·L-1)的Cu B处理细胞24 h;及Cu B(0.5、1、2 μmol·L-1)单独或者与细胞坏死抑制剂(Nec-1,10 μmol·L-1);细胞自噬抑制剂(CQ,25 μmol·L-1);细胞焦亡和凋亡抑制剂(Z-VAD,10 μmol·L-1);细胞铁死亡抑制剂(DFO,20 μmol·L-1,Fer-1,10 μmol·L-1,and Lip-1,1 μmol·L-1)联用处理细胞24 h,每组3个复孔。实验结束后每孔加CCK-8溶液(10 μL),继续培养2 h,酶标仪上测定450 nm处吸光度(OD)值,计算细胞存活率,并用GraphPad软件计算药物IC50值。

|
取对数期Huh-7细胞,以6×103/100 μL的细胞密度接种于96孔板,于37 ℃培养箱中继续培养,待细胞过夜贴壁后,将细胞分为对照组和Cu B(0.5、1、2 μmol·L-1)组处理24 h,然后加入EdU工作液(10 μmol·L-1)继续孵育2 h,去除培养液,4%的多聚甲醛室温固定15 min;去除固定液,洗涤液洗涤3次,每次3 min;去除洗涤液,用通透液(0.3% Triton X-100的PBS),室温孵育10 min。去除通透液,用洗涤液洗涤细胞2次,每次3 min;每孔加入Hoechst 33342(1X工作液)染核,最后用荧光显微镜拍照分析。
2.4 细胞内活性氧(ROS)检测取对数期Huh-7细胞,以1×105/个细胞密度接种于共聚焦小皿中,于37 ℃培养箱中继续培养,待细胞过夜贴壁后,将细胞分为对照组和Cu B(0.5、1、2 μmol·L-1)组处理24 h。然后每孔加入DCFH-DA探针溶液(200 μL工作液),于培养箱中继续孵育1 h(避光),荧光显微镜拍照,ImageJ软件计算相对荧光强度。
2.5 细胞脂质过氧化检测取对数期Huh-7细胞,以1×105/个细胞密度接种于共聚焦小皿中,于37 ℃培养箱中继续培养,待细胞过夜贴壁后,将细胞依次分为对照组,Cu B(0.5、1、2 μmol·L-1)组处理24 h。然后加入C11-BODIPY工作液(2 μmol·L-1),于37 ℃孵育30 min。然后用共聚焦显微镜拍照,ImageJ软件计算相对荧光强度。
2.6 细胞内二价铁离子浓度检测取对数期Huh-7细胞,以1×105/个细胞密度接种于共聚焦小皿中,于37 ℃培养箱中继续培养,待细胞过夜贴壁后,将细胞依次分为对照组,Cu B(0.5、1、2 μmol·L-1)组处理24 h。然后用5 μmol·L-1 FeRhonox-1继续孵育细胞1 h,然后用共聚焦显微镜拍照,ImageJ软件计算相对荧光强度。
2.7 细胞内谷胱甘肽(GSH)和丙二醛(MDA)检测取对数期Huh-7细胞,以2.5×105/个细胞密度接种于6孔板中,于37 ℃培养箱中继续培养,待细胞过夜贴壁后,将细胞依次分为对照组,Cu B(0.5、1、2 μmol·L-1)组处理24 h组。收集细胞裂解液,细胞GSH与MDA含量分别用相应试剂盒按照说明书测量。
2.8 Real-time PCR分析取对数期Huh-7细胞,以2.5×105/个细胞密度接种于6孔板中,于37 ℃培养箱中继续培养,待细胞过夜贴壁后,将细胞依次分为对照组,Cu B(0.5、1、2 μmol·L-1)组处理24 h组。收集细胞,总RNA根据试剂盒提取,根据说明书使用PrimeScriptTMRT Master和TB GreenTM-Premix Ex TaqTM进行逆转录反应和实时PCR,GAPDH作为内参,mRNA的相对表达量根据2-ΔCT方法计算,Nrf2、HO-1、SLC7A11、GPX4、SLC40A1、Transferrin引物由上海生工合成。正反链引物序列如下:SLC7A11上游:5′-TCCTGCTTTGGCTCCATGAACG-3′,下游:5′-AGAGGAGTGTGCTTGCGGACA-3′;GPX4上游:5′-ACAAGAACGGCTGCGTGGTGAA-3′,下游:5′-GCCACACACTTGTGGAGCTAGA-3′;SLC40A1上游:5′-GAGACAAGTCCTGAATCTGTGCC-3′,下游:5′-TTCTTGCAGCAACTGTGTCACAG-3′;Transferrin上游:5′-AACTCAGCAAAGTCTGGCGT-3′,下游:5′-ATACGCCACATAACCCCCAG-3′;GAPDH上游:5′-GGTTGTCTCCTGCGACTTCA-3′,下游:5′-TGGTCCAGGGTTTCTTACTCC-3′。
2.9 Western blot分析取对数期Huh-7细胞,以2.5×105/个细胞接种于6孔板中,待细胞过夜贴壁后,将细胞依次分为对照组,Cu B(0.5、1、2 μmol·L-1)组处理24 h组。将细胞样品用RIPA(含PMSF蛋白酶抑制剂)裂解液冰上裂解15~30 min,离心机10 000 r·min-1离心10 min,分离上清提取总蛋白,BCA法测定蛋白浓度,加入5× loading buffer,然后金属浴(100 ℃)10 min使蛋白变性。20 μg蛋白样品经PAGE凝胶电泳(80 V,30 min,120 V,1.5 h)后转至PVDF膜(冰浴,200 mA,2 h)。然后5%脱脂牛奶封闭1 h,1× TBST洗涤3次,每次8 min。孵育相应一抗(4 ℃冰箱过夜),1× TBST洗涤3次,每次8 min。加入已稀释的二抗,室温孵育2 h,1× TBST洗涤3次,每次8 min。采用ECL显影液显色,凝胶成像系统拍照,ImageJ软件分析条带灰度值。
2.10 免疫共沉淀分析取对数期Huh-7细胞,以2.5×105个细胞接种于6孔板中,待细胞过夜贴壁后,将细胞依次分为对照组,Cu B(0.5、1、2 μmol·L-1)组处理24 h组。每组细胞加入裂解液,收集细胞裂解液,染核用GPX4抗体在4 ℃冰箱过夜孵育,然后再用蛋白A/G磁珠继续孵育2 h,蛋白A/G珠用裂解缓冲液洗涤4次。富集后的蛋白悬浮于1 × loading buffer,金属浴(100 ℃)15 min,最后用SDS-PAGE分离分析。
2.11 统计学分析采用GraphPad Prism 6.0统计软件进行分析。实验数据以x±s表示,两组间数据差异比较采用t检验,多组间数据差异比较采用One-Way ANOVA方差分析。
3 结果 3.1 Cu B对Huh-7细胞增殖的影响如Fig 1所示,使用CCK-8检测不同浓度Cu B作用于Huh-7细胞24 h后,与对照组比较,细胞存活率随着Cu B的浓度增大逐渐降低,其IC50为0.96 μmol·L-1。故选择1/2倍IC50(0.5 μmol·L-1)、1倍IC50(1 μmol·L-1)、2倍IC50(2 μmol·L-1)分别作为CU B的低、中、高3个剂量进行后续实验。EdU分析法进一步研究Cu B对Huh-7细胞增殖的抑制作用,与对照组比较,Cu B(0.5、1、2 μmol·L-1)使EdU阳性细胞明显减少(P < 0.05)。结果表明,Cu B能够抑制Huh-7细胞增殖。

|
| Fig 1 Effects of Cu B on huh-7 cell proliferation (x±s, n=3) (A): The structure of Cu B. (B): The cell viability of Cu B on Huh-7 cells. (C): The effects of Cu B on Huh-7 cell proliferation were determined by EdU staining. (D): Statistical analysis of the EdU staining assay. *P < 0.05, **P < 0.01 vs control. |
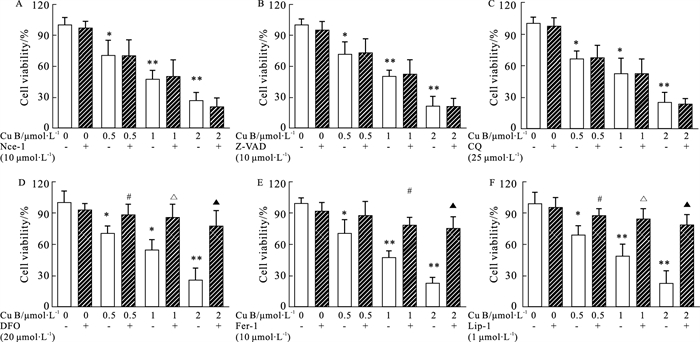
细胞的死亡形式主要包括凋亡、自噬、焦亡和铁死亡。我们使用细胞坏死抑制剂(Nec-1,10 μmol·L-1);细胞自噬抑制剂(CQ,25 μmol·L-1),细胞焦亡和凋亡抑制剂(Z-VAD,10 μmol·L-1),以及细胞铁死亡抑制剂(DFO,20 μmol·L-1,Fer-1,10 μmol·L-1,and Lip-1,1 μmol·L-1)来评估Cu B对Huh-7细胞的死亡形式。如Fig 2所示,Cu B(0.5、1、2 μmol·L-1)对Huh-7细胞存活率明显降低(P < 0.05)。Nec-1、CQ和Z-VAD对Cu B引起的细胞存活率没有影响,而铁死亡抑制剂(DFO、Fer-1和Lip-1)和Cu B联用明显升高了Huh-7细胞存活率(P < 0.05)。结果表明,Cu B诱导Huh-7细胞死亡形式主要是铁死亡。
|
| Fig 2 Effects of Cu B on Huh-7 cell death pattern (x±s,n=3) (A-C): Cell viability of Cu B alone or combined with (necroptosis inhibitor, Nec-1 10 μmol·L-1, pan-caspase inhibitor, Z-VAD 10 μmol·L-1, and autophagy inhibitor, CQ 10 μmol·L-1) on Huh-7 cells. (D-F): Cell viability of Cu B alone or combined with ferroptosis inhibitor (DFO, 20 μmol·L-1, Fer-1, 10 μmol·L-1, and Lip-1, 1 μmol·L-1) on Huh-7 cells. *P < 0.05, **P < 0.01 vs control, #P < 0.05 vs Cu B(0.5 μmol·L-1), △P < 0.01 vs Cu B (1 μmol·L-1), vs ▲P < 0.01 vs Cu B (2 μmol·L-1) |
铁死亡会引起细胞内ROS、细胞脂质过氧化水平、细胞内亚铁离子浓度、细胞脂质过氧化产物MDA及细胞内GSH等相关指标变化。如Fig 3所示,与对照组比较,Cu B(0.5、1、2 μmol·L-1)剂量组细胞内ROS、脂质过氧化水平和二价铁离子的荧光强度明显增强(P < 0.05),表示细胞内ROS、脂质过氧化水平和二价铁离子浓度明显增多。细胞内脂质过氧化产物MDA的积累也明显增多(P < 0.05),而且细胞内GSH/GSSG比率明显下降,表示细胞内GSH水平明显降低(P < 0.05)。结果表明,Cu B诱导Huh-7细胞铁死亡。

|
| Fig 3 Effects of Cu B on ferroptosis related indicators in Huh-7 cells (x±s, n=3) (A): The levels of ROS, lipid peroxidation and Fe2+by fluorescence probe. (B): The level of MDA. (C): The level of GSH. *P < 0.05, **P < 0.01 vs control. |
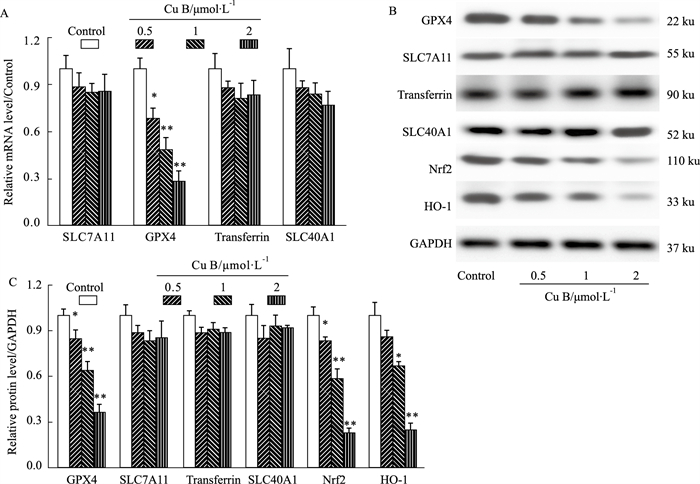
为了进一步研究Cu B对Huh-7细胞铁死亡的影响,我们评估了Cu B对铁死亡相关蛋白的表达。如Fig 4所示,RT-PCR结果显示,与对照组比较,Cu B(0.5、1、2 μmol·L-1)剂量组铁死亡相关基因SLC7A11,Transferrin,SLC40A1的mRNA水平变化较小,而铁死亡相关基因GPX4的mRNA水平明显降低(P < 0.05)。Western blot结果也显示,与对照组比较,Cu B(0.5、1、2 μmol·L-1)剂量组铁死亡相关蛋白SLC7A11,Transferrin,SLC40A1的表达变化较小,而铁死亡相关蛋白GPX4的表达限制下降(P < 0.05)。我们继续考察Cu B对铁死亡相关通路Nrf2/HO-1的影响,结果显示,Cu B(0.5、1、2 μmol·L-1)分别使Nrf2和HO-1的蛋白表达明显降低(P < 0.05)。结果表明,Cu B降低铁死亡相关蛋白GPX4的表达,抑制Nrf2/HO-1抗氧化系统通路诱导Huh-7细胞铁死亡。
|
| Fig 4 Effect of Cu B on ferroptosis-related proteins in Huh-7 cells (x±s, n=3) (A): The mRNA level of ferroptosis-related genes (SLC7A11, GPX4, Transferrin, SLC40A1) by RT-PCR. (B and C): The expression of ferroptosis-related proteins (SLC7A11, GPX4, Transferrin, SLC40A1) and Nrf2, HO-1 by Western blot. *P < 0.05, **P < 0.01 vs control. |
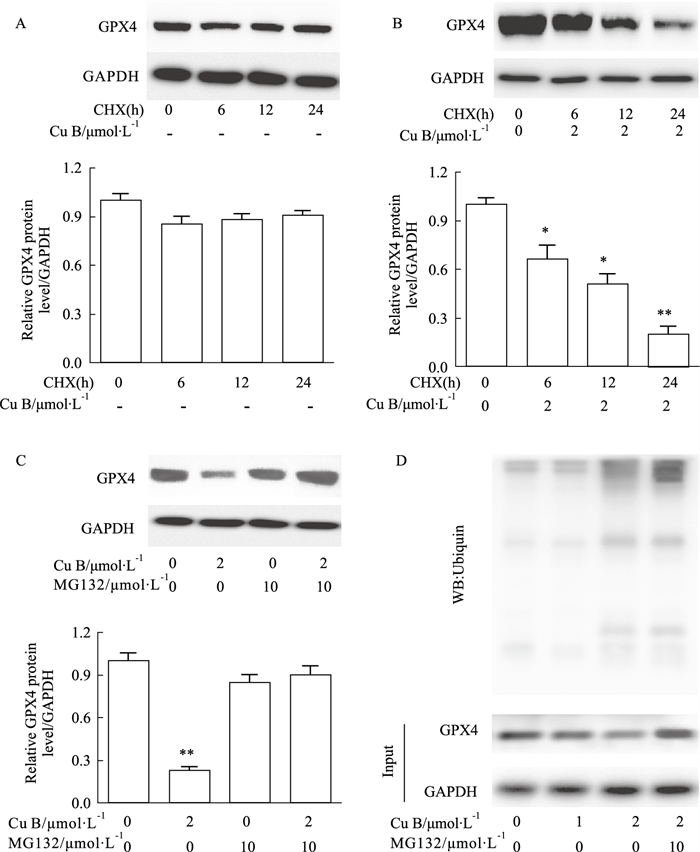
由于GPX4在细胞铁死亡负向调控中起着关键作用,为了进一步研究Cu B是否促进GPX4的降解,我们研究了Cu B对环己酰亚胺(CHX,一种蛋白合成抑制剂)存在下GPX4稳定性的影响。如Fig 5所示,与单独使用CHX相比,Cu B促进了GPX4在CHX存在下的降解。而且蛋白酶体抑制剂MG132(抑制降解)可以提高GPX4的蛋白水平,表明GPX4在Huh-7细胞中受泛素化调控,MG132逆转了Cu B对GPX4的抑制作用。随后,免疫共沉淀分析也显示,Cu B明显增加了GPX4的泛素化。结果表明,Cu B能够加速GPX4的泛素化和降解,从而诱导Huh-7细胞铁死亡。
|
| Fig 5 Effect of Cu B on degradation of GPX4 in Huh-7 cells (x±s, n=3) (A): The expression of GPX4 protein in the presence of CHX (20 mg·L-1) for the indicated time intervals. (B): The expression of GPX4 protein after treated with or without Cu B(2 μmol·L-1) in the presence of CHX (20 μg/ml) for the indicated time intervals. (C): The expression of GPX4 protein after incubated with MG132 (10 μmol·L-1) for 2 h, then with or without Cu B(2 μmol·L-1) for additional 16 h. (D): The results of immunoprecipitation (IP). *P < 0.05, **P < 0.01 vs control. |
根据世界卫生组织(WHO)的数据,肝癌目前是全球癌症相关死亡的第四大常见原因,虽然肝癌的治疗取得了一定的进展,但目前仍然是一个日益严重的公共卫生问题[10]。肝癌的治疗方法主要有手术切除、放疗、化疗等药物治疗,然而,这些治疗方式的结果并不令人满意。有许多化疗药物可用于肝癌治疗,如奥沙利铂、卡培他滨、吉西他滨、索拉菲尼和5-氟尿嘧啶。然而,大多数HCC患者化疗后预后较差,5年生存率在17%~53%之间,2年内复发率高达50%,主要是因为肝癌细胞对临床化疗药物产生了强烈的耐药性[11]。越来越多的研究报道从一些中草药中纯化的单体化合物具有较好的抗肿瘤作用和较低的毒性[12]。在本研究中,我们发现Cu B能够有效抑制肝癌细胞Huh-7细胞增殖,其IC50为0.96 μmol·L-1,是一种值得研究的抗肿瘤药物。
铁死亡是一种铁依赖形式的非凋亡细胞死亡,其核心机制是脂质过氧化和铁积累[13]。铁死亡是由脂质过氧化引起的,通常是通过抑制溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)和谷胱甘肽过氧化物酶4 (glutathione peroxidase 4,GPX4) 而引起,SLC7A11是胱氨酸-谷氨酸反转运蛋白,SLC7A11表达的减少导致胱氨酸消耗,谷胱甘肽(glutathione,GSH)短缺,并随之增加脂质过氧化[14]。脂质过氧化的关键抑制剂GPX4将谷胱甘肽氧化成谷胱甘肽二硫(glutathione glutathione disulfide,GSSG),抑制GPX4降低了通过GSH中和脂质过氧化的能力[15]。转铁蛋白和溶质载体家族40成员1 (solute carrier family 40 member 1,SLC40A1)对维持细胞内铁浓度至关重要; 转铁蛋白将铁导入细胞SLC40A1从细胞中输出铁,因此,转铁蛋白的增加和SLC40A1的减少可能导致细胞内铁的积累[16]。癌细胞通常适应铁,并存在于持续的氧化应激下。为了保护自己免受铁离子诱导的细胞死亡,癌细胞可以促进自身的抗氧化系统,例如核因子红系2相关因子2 (nuclear factor erythroid 2-related factor 2,Nrf2)是一种主要的抗氧化调节因子转录因子,通过上调抗氧化酶,如血红素加氧酶-1(heme oxygenase-1,HO-1)来阻止铁原诱导的细胞死亡[17]。在本研究中,我们发现Cu B能够使Huh-7细胞内ROS增多,脂质过氧化水平升高,Fe2+浓度升高,脂质过氧化产物丙二醛(MDA)积累增多,进一步研究发现,Cu B能够降低GPX4蛋白的表达,而且抑制Nrf2/HO-1抗氧化系统,诱导Huh-7细胞铁死亡。
泛素化是一种酶促过程,包括泛素蛋白与底物蛋白的结合,泛素化最常见的结果是蛋白质通过蛋白酶体降解。有报道称,GPX4在蛋白酶体抑制剂MG132的作用下积累,提示GPX4降解存在泛素化修饰[18]。因此,我们研究了Cu B对GPX4降解的影响,结果显示,Cu B在CHX(一种蛋白质合成抑制剂)存在的情况下抑制GPX4的蛋白表达,加速其降解。进一步的研究发现,Cu B增加了GPX4蛋白的泛素化,同时,在蛋白酶体抑制剂MG132存在情况下,Cu B对GPX4的泛素化作用增强。进一步说明Cu B可以促进GPX4的降解。
综上所述,Cu B可能通过促进GPX4泛素化和降解,使细胞内脂质过氧化水平升高,细胞内亚铁离子浓度增多,细胞内ROS增多,同时破坏Nrf2/HO-1抗氧化通路,诱导细胞铁死亡,抑制Huh-7细胞增殖。提示Cu B对肝癌细胞Huh-7有良好的抗肿瘤活性,是一种治疗肝癌的潜在药物。
| [1] |
Siegel R L, Miller K D, Jemal A, et al. Cancer statistics 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. doi:10.3322/caac.21654 |
| [2] |
Zheng R, Qu C, He J, et al. Liver cancer incidence and mortality in China: Temporal trends and projections to 2030[J]. Chin J Cancer Res, 2018, 30(6): 571-9. doi:10.21147/j.issn.1000-9604.2018.06.01 |
| [3] |
Ogunwobi O O, Harricharran T, Tan Y, et al. Mechanisms of hepatocellular carcinoma progression[J]. World J Gastroenterol, 2019, 25(19): 2279-93. doi:10.3748/wjg.v25.i19.2279 |
| [4] |
Zhang X, Zhang P, Tang W, et al. Miltirone induces cell death in hepatocellular carcinoma cell through GSDME dependent pyroptosis[J]. Acta Pharm Sin B, 2020, 10(8): 1397-413. doi:10.1016/j.apsb.2020.06.015 |
| [5] |
Yang J D, Hainaut P, Roberts L R, et al. A global view of hepatocellular carcinoma: Trends, risk, prevention and management[J]. Nat Rev Gastroenterol Hepatol, 2019, 16(10): 589-604. doi:10.1038/s41575-019-0186-y |
| [6] |
Wang X, Bai Y, Zhang T, et al. Cucurbitacin B exhibits antitumor effects on CD133+HepG2 liver cancer stem cells by inhibiting JAK2/STAT3 signaling pathway[J]. Anti Cancer Drugs, 2021, 32(5): 548-57. doi:10.1097/CAD.0000000000001062 |
| [7] |
Klungsaeng S, Kukongviriyapan V, Senggunprai L, et al. Targeted modulation of FAK/PI3K/PDK1/AKT and FAK/p53 pathways by cucurbitacin B for the antiproliferation effect against human cholangiocarcinoma cells[J]. Am J Chin Med, 2020, 48(6): 1475-89. doi:10.1142/S0192415X2050072X |
| [8] |
Yuan R, Zhao W, Yang S, et al. Cucurbitacin B inhibits non-small cell lung cancer in vivo and in vitro by triggering TLR4/NLRP3/GSDMD-dependent pyroptosis[J]. Pharmacol Res, 2021, 170: 105748. doi:10.1016/j.phrs.2021.105748 |
| [9] |
关锡梅, 解勇圣, 唐丽琴, 等. Nrf2/HO-1/GPX4对高糖诱导足细胞铁死亡的影响及小檗碱的干预机制研究[J]. 中国药理学通报, 2021, 37(3): 396-403. Guan X M, Xie Y S, Tang L, et al. Influence of Nrf2/HO-1/GPX4 signaling pathway on high glucose-induced podocyte ferroptosis and intervention of berberine[J]. Chin Pharmacol Bull, 2021, 37(3): 396-403. |
| [10] |
Villanueva A. Hepatocellular carcinoma[J]. N Engl J Med, 2019, 380: 1450e. doi:10.1056/NEJMra1713263 |
| [11] |
祝珊珊, 秦飞, 郑晓辉, 等. 索拉菲尼对肝癌HepG2细胞凋亡、耐药及PTEN蛋白表达的影响[J]. 中国药理学通报, 2020, 36(11): 1532-6. Zhu S S, Qin F, Zheng X H, et al. Sorafenib induces apoptosis and drug resistance of HCC cells and regulates PTEN expression[J]. Chin Pharmacol Bull, 2020, 36(11): 1532-6. |
| [12] |
Zhu J, Huang R, Wang Y, et al. Licorice extract inhibits growth of non-small cell lung cancer by downregulating CDK4-Cyclin D1 complex and increasing CD8 T cell infiltration[J]. Cancer Cell Int, 2021, 21(1): 529. doi:10.1186/s12935-021-02223-0 |
| [13] |
Dixon S J, Lemberg K M, Yang W S, et al. Ferroptosis: An iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-72. doi:10.1016/j.cell.2012.03.042 |
| [14] |
Koppula P, Zhang Y, Gan B, et al. Amino acid transporter SLC7A11/xCT at the crossroads of regulating redox homeostasis and nutrient dependence of cancer[J]. Cancer Commun (Lond), 2018, 38: 12. doi:10.1186/s40880-018-0288-x |
| [15] |
Forcina G C, Dixon S J. GPX4 at the crossroads of lipid homeostasis and ferroptosis[J]. Proteomics, 2019, 19(18): e1800311. doi:10.1002/pmic.201800311 |
| [16] |
Mou Y, Wang J, Li B, et al. Ferroptosis, a new form of cell death: opportunities and challenges in cancer[J]. J Hematol Oncol, 2019, 12(1): 34. doi:10.1186/s13045-019-0720-y |
| [17] |
Hirschhorn T, Stockwell B R. The development of the concept of ferroptosis[J]. Free Radic Biol Med, 2019, 133: 130-43. doi:10.1016/j.freeradbiomed.2018.09.043 |
| [18] |
Popovic D, Vucic D, Dikic I. Ubiquitination in disease pathogenesis and treatment[J]. Nat Med, 2014, 20(11): 1242-53. doi:10.1038/nm.3739 |

