

2. 华中科技大学同济医学院附属协和医院麻醉科,湖北 武汉 430022;
3. 北京中医药大学中医学院,北京 100029
2. Dept of Anesthesiology, Union Hospital Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430022, China;
3. Institute of Traditional Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
抑郁症又被称作抑郁障碍,是一种常见的情绪障碍综合征。主要临床特征为显著而持久的心境低落、自卑厌世、思维迟缓等[1]。近年来,抑郁症的发病率逐年上升,已经开始严重影响越来越多人的生活质量,据世界卫生组织统计,目前全球患有抑郁症人数已超过三亿。但现有临床应用的抗抑郁一线西药存在着许多无法忽视的问题,如起效慢、副作用大、用药周期长、临床治愈率低、作用时间短、复发率高等[2]。
蒙医学作为我国的传统医学,对于抑郁症有着特有的理念以及研究成果。在蒙医学中,赫依、希拉、巴达干被视作人体的三根,人体发生病症均是由于三根功能失调所致。赫依失调会导致头晕、失眠、注意力无法集中、干呕等症状,巴达干失调则会引起食欲下降、消化不良、身心发沉、思维迟缓、意识模糊、精神紊乱等症状,因此蒙医学中认为抑郁症的病因与赫依、巴达干病变有关。抑郁症的发病部位位于心、脑、白脉,过度悲伤、过度脑力劳动、过度怀疑等均可引起体内赫依过剩,导致三根失调,进而影响心、脑,累及白脉,故抑郁症的治疗主要原则是镇赫依、巴达干,安神、宁心以及促进白脉传导[3]。
蒙药安神补心六味丸(吉如和-6)是蒙医药学中的经典组方药物,由牛心、广枣、肉豆蔻、木香、丁香、枫香脂六味药材组成。具有祛赫依、镇静功效,用于心慌、气短。经现代药理初步研究结果表明,安神补心六味丸可用于治疗冠心病、心绞痛、心律失常、神经官能症等[4],亦可用于治疗情志不舒、肝郁气滞等精神刺激所致的抑郁、神经衰弱、心烦、焦虑、失眠、健忘、更年期症候群等,但目前关于安神补心六味丸的抗抑郁活性成分报道相对较少,作用机制尚不明确。本文通过网络药理学的研究理论与方法,筛选出安神补心六味丸的主要药用活性成分,预测药物作用靶点以及作用通路,使用分子对接技术将药用活性成分与疾病靶点进行对接评分,阐释安神补心六味丸抗抑郁症的分子作用机制,旨在为该药物抗抑郁症的临床应用提供理论依据。
1 材料与方法 1.1 药物活性成分及作用靶点的筛选[5]将蒙药安神补心六味丸中的5味蒙药(除牛心)为关键词分别在中药系统药理学分析平台TCMSP (http://tcmspw.com/tcmsp.php) 中检索其化学组成成分,以口服生物利用度(oral bioavailability,OB)≥30%,类药性(drug likeness,DL)≥0.18为条件进行筛选,结合已发表的文献报道补充未预测到的其活性化合物,共同筛选出蒙药安神补心六味丸的主要有效成分。SwissTargetPrediction在线平台能够对生物活性分子靶点进行精准预测。将筛选出的药物主要有效成分应用PubChem数据库转换为标准的Canonical SMILES格式,将其Canonical SMILES格式导入SwissTargetPrediction在线平台,设定物种为Homo sapiens,获取Probability>0.1的成分靶点,统一在Uniprot数据库中将靶点信息进行规范。将所获得的靶点信息以及对应的化合物信息、药物信息导入Cytoscape 3.7.1软件中,构建药材-成分-靶点网络图。
1.2 抑郁症靶点的筛选分别在Drugbank数据库(https://www.drugbank.ca/)、OMIM数据库(https://omim.org/)、GeneCards数据库(https://genecards.weizmann.ac.il/v3/),以“depression”,“depressed”,“antidepressant”为关键词在数据库中搜索抑郁症疾病相关靶点,将筛选结果进行整合,应用Uniprot数据库(http://www.uniprot.org/)对于靶点信息予以校正。
1.3 PPI网络的构建及核心靶点的筛选将“1.1”和“1.2”中筛选的药物与疾病的靶点制成韦恩图进行映射,获得安神补心六味丸治疗抑郁症疾病的潜在作用靶点。登录STRING数据库,设定属性为Homo sapiens,阈值设置为0.4,其余参数保持默认值,将获得的潜在作用靶点信息导入平台,获取蛋白相互作用关系(PPI)网络TSV格式文件。将蛋白网络信息文件导入Cytoscape 3.7.1软件中,分析网络拓扑学参数。以网络中节点“Betweenness Centrality”、“Closeness Centrality”、“Degree”等参数大于均值为标准筛选出核心靶点。
1.4 生物富集分析将1.3中筛选出的核心靶点基因名导入DAVID数据库(https://DAVID.neiferf.gov),设定属性为Homo sapiens,进行GO生物过程富集分析和KEGG信号通路富集分析,将结果以P < 0.05为条件进行筛选,分析安神补心六味丸治疗抑郁症的主要信号通路及生物进程。将GO富集分析结果绘制成条形图,KEGG信号通路分析结果绘制成高级气泡图,进行可视化。
1.5 疾病-成分-交集靶点网络构建及核心成分的筛选将1.3中筛选出的交集靶点信息及对应的活性成分信息进行整理并导入Cytoscape 3.7.1软件构建疾病-成分-交集靶点网络图,进行网络拓朴学分析并筛选药物核心成分。
1.6 分子对接Autodock vina是一款由MGL实验室开发的分子对接软件,与传统分子对接程序相比,具有精度更高,对接速度更快的优点。登录ZINC数据库下载核心化合物的MOL2格式文件,使用AutoDock Tools1.5.6对化合物进行结构修饰,输出为pdbqt格式。另从PDB数据库下载核心靶蛋白的3D结构文件,使用Pymol软件移除靶蛋白中的配体、非蛋白分子以及水分子,保存为pdb格式文件。再导入AutoDock Tools1.5.6软件进行结构修饰,输出为pdbqt格式,设置好相关参数并运行Autodock vina进行蛋白与化合物分子对接。
1.7 细胞实验 1.7.1 细胞株BV2小胶质细胞购自中国典型培养物保藏中心。
1.7.2 药物及试剂安神补心六味丸由中国内蒙古乌兰浩特中蒙药业有限公司提供,产品批号:190722;DMEM培养基;胎牛血清;青/链霉素;脂多糖(lipopolysaccharide,LPS);二甲基亚砜(dimethyl sulfoxide,DMSO);胰蛋白酶;CCK-8试剂盒;TRIzol试剂;逆转录试剂盒。
1.7.3 主要仪器倒置式生物显微镜;高速冷冻离心机;全自动酶标仪;荧光定量PCR仪;二氧化碳普通培养箱。
1.7.4 细胞培养与分组BV2小胶质细胞(DMEM高糖培养基,10%胎牛血清,1%青/链霉素培养)置于37 ℃、5% CO2、95% O2培养箱中培养,待细胞生长至对数生长期,胰蛋白酶消化离心,重悬计数,将细胞均匀接种至96孔板(约1×104个/孔)或6孔板中(约1×106个/孔),待细胞再次生长至对数生长期时开展后续实验研究。本实验共分为5组,分别为:正常组、LPS模型组、安神补心六味丸低剂量组、安神补心六味丸中剂量组、安神补心六味丸高剂量组。
1.7.5 BV2细胞损伤模型建立BV2细胞接种培养24 h后将原培养基换为无血清DMEM培养基孵育4 h,给药安神补心六味丸2 h,再弃去药液,在需要LPS刺激的培养液中加入LPS溶液,孵育24 h。结束后收集BV2细胞,保存于-80 ℃低温冰箱中进行进一步检测。
1.7.6 CCK-8法检测细胞存活率取对数生长期的BV2细胞,消化后以每孔1×104个/孔密度接种于96孔板上。根据实验分组要求进行相应处理,完成后每孔加入CCK-8溶液10 μL,37 ℃、5% CO2培养箱孵育2 h,酶标仪450 nm处检测吸光度。
1.7.7 实时荧光PCR分析使用TRIzol试剂按说明从细胞中提取总RNA。然后使用SYBR primeScript RT-PCR试剂盒和gDNA Eraser(TaKaRa,日本)将总RNA反转录为cDNA。PCR扩增步骤为:阶段1:95 ℃预热变性40 s;阶段2:循环系统循环40次,95 ℃,15 s,58 ℃,1 min。每个样本都检测3次,将上述基因的表达水平归一化为β-actin的表达水平,并用比较2-ΔΔCt法进行检测。引物的正向和反向序列如Tab 1所示。
| Gene | Forward(5′-3′) | Reverse(5′-3′) | Annealing temperature(℃) |
| β-actin | ACCGTGAAAAGATGACCCAG | TCTCAGCTGTGGTGGTGAAG | 57 |
| AKT1 | CGAGGCCCAACACCTTCATC | CCGGAAGTCCATCGTCTCCT | 57 |
| APP | AGATCTCGGAAGTGAAGATGGATC | TGATGACAATCACGGTTGCTATG | 57 |
| ALB | TCAGCCATTTCACCATAGGTT | TGCTGATGAGTCAGCTGAAA | 57 |
| MAPK3 | GGTAGACCGTTCTGGAATGG | CGTTACATGTGGCAGCTTGAG | 57 |
| VEGFA | GAACTTTCTGCTGTCTTGGGTG | GGCAGTAGCTGCGCTGATAG | 57 |
| MAPK1 | GTCGCCATCAAGAAAATCAGC | GGAAGGTTTGAGGTCACGGT | 57 |
将广枣、肉豆蔻、丁香、木香、枫香脂这五味药材经TCMSP平台以OB≥30%,DL≥0.18为条件进行筛选,结合已发表的文献来补充挖掘平台未预测到的其活性化合物,得到活性成分共34种。将筛选出的药物活性成分的Canonical SMILES格式导入SwissTargetPrediction在线平台进行靶点预测,剔除无靶点化合物,去除靶点重复值。最后共得到药物作用靶点529个,活性成分28种,其中药材共有成分5种,分别为β-谷固醇(Beta-sitosterol)、山萘酚(Kaempferol)、槲皮素(Quercetin)、桦木酸(Mairin)和豆甾醇(Stigmasterol)。广枣潜在活性成分7个,肉豆蔻潜在活性成分6个,木香潜在活性成分3个,丁香潜在活性成分6个,枫香脂潜在活性成分6个,见Tab 2。
| Medicine | Mol ID | Molecule name | Chemical formula | MW | Number |
| Guang Zao | MOL001002 | Ellagic acid | C14H6O8 | 302.20 | GZ1 |
| MOL001040 | (R)-naringenin | C15H12O5 | 272.27 | GZ2 | |
| MOL001490 | Bis[(2S)-2-ethylhexyl]benzene-1,2-dicarboxylate | C24H38O4 | 390.62 | GZ3 | |
| MOL004328 | Naringenin | C15H12O5 | 272.27 | GZ4 | |
| MOL000358 | Beta-sitosterol | C29H50O | 414.79 | A | |
| MOL000422 | Kaempferol | C15H10O6 | 286.25 | B | |
| MOL000098 | Quercetin | C15H10O7 | 302.25 | C | |
| Nutmeg | MOL000358 | Beta-sitosterol | C29H50O | 414.79 | A |
| MOL007920 | Meso-1,4-Bis- (4-hydroxy-3- methoxyphenyl)- 2,3-dimethylbutane | C20H26O4 | 330.46 | RDQ1 | |
| MOL009243 | Isoguaiacin | C20H24O4 | 328.44 | RDQ2 | |
| MOL009254 | Galbacin | C20H20O5 | 340.40 | RDQ3 | |
| MOL009255 | Licarin B | C20H20O4 | 324.40 | RDQ4 | |
| MOL009259 | Kudos | C21H20Cl2O3 | 391.31 | RDQ5 | |
| MOL009263 | Saucernetindiol | C20H24O5 | 344.44 | RDQ6 | |
| MOL009264 | Tetrahydrofuroguaiacin B | C20H24O5 | 344.44 | RDQ7 | |
| MOL009265 | Threo-austrobailignan-5 | C20H22O4 | 326.42 | RDQ8 | |
| Wood incense | MOL010813 | Benzo[a]carbazole | C16H11N | 217.28 | MX1 |
| MOL000359 | Sitosterol | C29H50O | 414.79 | MX2 | |
| MOL000211 | Mairin | C30H48O3 | 456.78 | D | |
| MOL000359 | Stigmasterol | C29H48O | 412.77 | E | |
| Clove | MOL013219 | Strictosamide | C26H30N2O8 | 498.50 | DX1 |
| MOL001749 | Bis(2-Ethylhexyl) Phthalate | C24H38O4 | 390.62 | DX2 | |
| MOL000358 | Beta-sitosterol | C29H50O | 414.79 | A | |
| MOL000422 | Kaempferol | C15H10O6 | 286.25 | B | |
| MOL000098 | Quercetin | C15H10O7 | 302.25 | C | |
| MOL000359 | Sitosterol | C29H48O | 414.79 | E | |
| Liquidambar | MOL000036 | Caryophyllene | C15H24 | 204.39 | FXZ1 |
| MOL002295 | Cinnamic acid | C9H8O2 | 148.17 | FXZ2 | |
| MOL000511 | Ursolic acid | C30H48O3 | 456.78 | FXZ3 | |
| MOL001996 | Betulonic acid | C30H46O3 | 454.76 | FXZ4 | |
| MOL000516 | Bornyl cinnamate | C19H24O2 | 284.43 | FXZ5 | |
| MOL003781 | Cinnamyl cinnamate | C18H16O2 | 264.34 | FXZ6 | |
| MOL010808 | Oleanonic acid | C30H46O3 | 454.76 | FXZ7 | |
| MOL000211 | Mairin | C30H48O3 | 456.78 | D |
将所筛选的活性成分以及对应的靶点和药材信息进行编号并导入Cytoscape 3.7.1软件,构建药材- 成分-靶点网络图,共包含562个节点,1 761条边,其中A、B、C、D、E表示药材共有成分。在网络中将药材名用圆形统一表示,活性成分用八边形统一表示,靶点用菱形统一表示。八边形与菱形颜色由浅逐渐变深、八边形与菱形形状由小到大的程度与度值(degree)成正比。网络中节点的度值表示其在网络中和各节点关联的边的数目,度值越高,代表这些节点越有可能是药物作用的潜在关键成分或关键靶点。从网络中可以看出,每种活性成分均可以对应多个不同的靶点,相同的靶点也可以对应不同的活性成分,充分体现了安神补心六味丸药物作用具有的多靶点、多成分的优势。
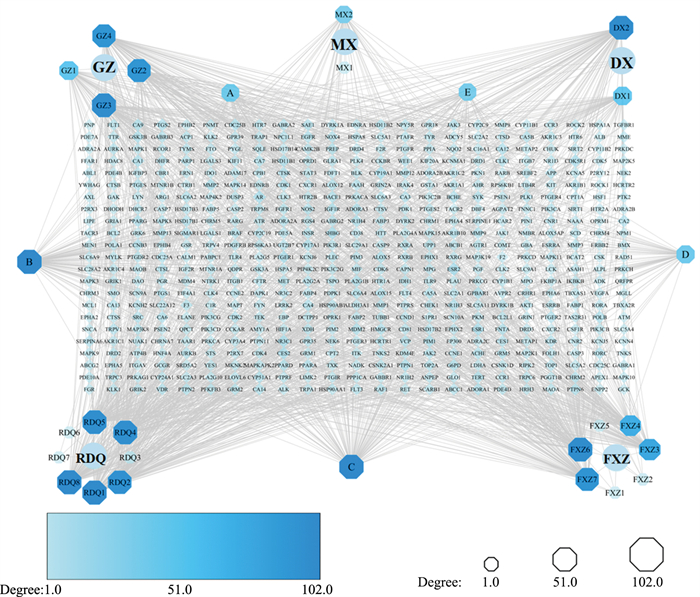
|
| Fig 1 Drug-Ingredient-Target network map of Ansheng Buxin Liuwei pills |
登录Drugbank、GeneCards、OMIM等数据库,以“depressed”,“depression”,“antidepressant”为关键词搜索抑郁症疾病相关靶点,整合数据去除重复值后共得到1 064个疾病靶点。将药物作用靶点与疾病靶点应用Venn图进行映射,得到140个交集靶点,这些交集靶点则为安神补心六味丸活性成分对抑郁症作用潜在靶点。
2.3 核心靶点的筛选及PPI网络构建登录STRING数据库,获取靶点相互作用网络TSV文件,将蛋白相互作用信息导入Cytoscape 3.7.1软件进行网络拓扑学分析,制成PPI网络图,图中节点颜色由蓝色向橙色转变、节点尺寸由小到大转变代表节点(Node)的度值(Degree)逐渐增高,各节点的连线由细到粗转变代表节点的结合分数(combined score)逐渐增高,见Fig 3。PPI网络共包含140个节点,1 602条边,以网络中节点“Betweenness Centrality”(均值为0.002 815 87)、“Closeness Centrality”(均值为0.501 805 05)、“Degree”(均值为20)等参数大于均值为标准出核心靶点共59个,见Tab 3。其中度值排名前10的有:AKT1(苏氨酸蛋白激酶)、APP(淀粉样前体蛋白基因)、ALB(血清白蛋白)、MAPK3(促分裂原活化蛋白激酶激酶激酶3)、VEGFA(血管内皮生长因子A)、MAPK1(促分裂原活化蛋白激酶激酶激酶1)、CASP3(胱天蛋白酶3)、GRM5(促代谢型谷氨酸受体5基因)、DRD2(D2多巴胺受体)、CNR1(大麻素受体1)。
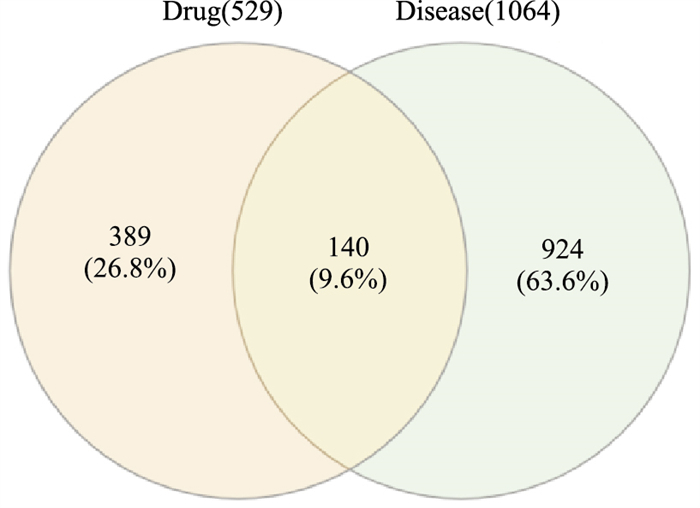
|
| Fig 2 Venn diagram of targets and disease targets of Ansheng Buxin Liuwei pills |
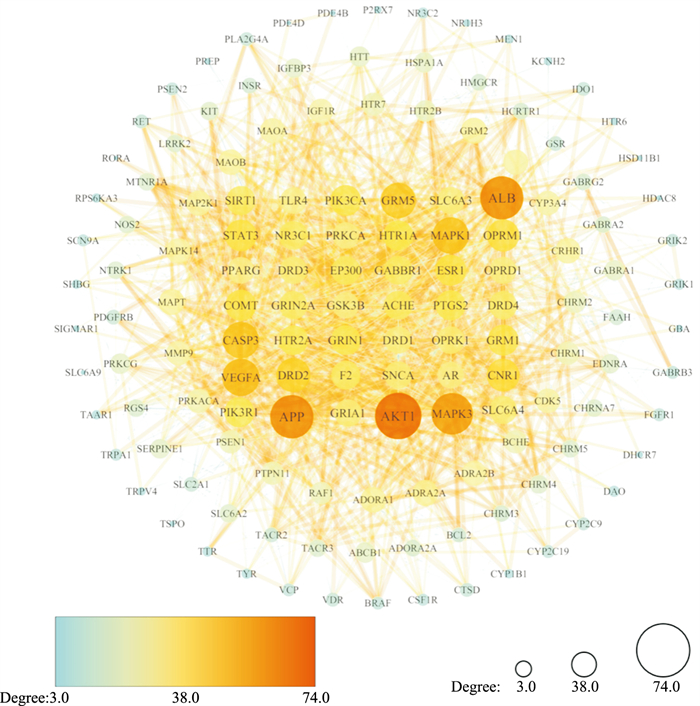
|
| Fig 3 PPI network map of intersection target |
| Coretarget | Degree | Betweenness centrality | Closeness centrality |
| AKT1 | 74 | 0.066 | 0.68 |
| APP | 67 | 0.066 | 0.66 |
| ALB | 67 | 0.064 | 0.66 |
| MAPK3 | 63 | 0.044 | 0.65 |
| VEGFA | 54 | 0.033 | 0.60 |
| MAPK1 | 52 | 0.032 | 0.61 |
| CASP3 | 52 | 0.020 | 0.60 |
| GRM5 | 50 | 0.025 | 0.59 |
| DRD2 | 47 | 0.017 | 0.59 |
| CNR1 | 44 | 0.019 | 0.59 |
| OPRM1 | 43 | 0.018 | 0.58 |
| STAT3 | 41 | 0.017 | 0.56 |
| PIK3CA | 40 | 0.016 | 0.57 |
| ESR1 | 40 | 0.013 | 0.56 |
| COMT | 40 | 0.020 | 0.56 |
| GRM1 | 40 | 0.013 | 0.57 |
| PIK3R1 | 38 | 0.016 | 0.56 |
| PTGS2 | 38 | 0.011 | 0.56 |
| HTR1A | 38 | 0.009 9 | 0.56 |
| GRIN1 | 37 | 0.030 | 0.56 |
| HTR2A | 37 | 0.017 | 0.56 |
| SIRT1 | 36 | 0.013 | 0.55 |
| EP300 | 35 | 0.015 | 0.54 |
| NR3C1 | 35 | 0.019 | 0.56 |
| GABBR1 | 35 | 0.008 7 | 0.52 |
| F2 | 35 | 0.015 | 0.55 |
| ACHE | 35 | 0.011 | 0.56 |
| GRIN2A | 34 | 0.012 | 0.55 |
| DRD4 | 34 | 0.004 1 | 0.55 |
| SLC6A4 | 33 | 0.011 | 0.54 |
| SLC6A3 | 32 | 0.010 | 0.55 |
| SNCA | 32 | 0.014 | 0.54 |
| GRIA1 | 32 | 0.008 0 | 0.55 |
| DRD3 | 32 | 0.003 0 | 0.55 |
| OPRK1 | 32 | 0.005 7 | 0.55 |
| OPRD1 | 31 | 0.006 1 | 0.55 |
| DRD1 | 31 | 0.010 | 0.55 |
| GSK3B | 30 | 0.006 6 | 0.54 |
| PPARG | 30 | 0.0072 | 0.54 |
| PRKCA | 30 | 0.019 | 0.55 |
| AR | 30 | 0.004 9 | 0.52 |
| TLR4 | 30 | 0.005 2 | 0.54 |
| MAPT | 29 | 0.008 4 | 0.55 |
| GRM2 | 29 | 0.004 5 | 0.51 |
| ADRA2A | 29 | 0.005 0 | 0.54 |
| MAOB | 28 | 0.008 6 | 0.53 |
| CRHR1 | 28 | 0.015 | 0.51 |
| ADORA1 | 28 | 0.007 2 | 0.54 |
| MAPK14 | 27 | 0.004 5 | 0.54 |
| MAOA | 27 | 0.006 9 | 0.52 |
| TRPV1 | 27 | 0.008 4 | 0.54 |
| ADRA2B | 27 | 0.004 5 | 0.53 |
| CDK5 | 26 | 0.008 0 | 0.54 |
| CYP3A4 | 26 | 0.014 | 0.54 |
| PRKACA | 25 | 0.013 | 0.52 |
| PSEN1 | 23 | 0.003 2 | 0.52 |
| CHRM1 | 23 | 0.004 0 | 0.51 |
| HTR7 | 23 | 0.008 3 | 0.52 |
| BCHE | 23 | 0.006 1 | 0.51 |
登录DAVID数据库网站,将59个核心靶点导入数据库进行GO生物功能注释以及KEGG信号通路分析(P < 0.05)。在GO富集分析中,共得到了344个条目,其中生物过程(BP条目248个),细胞组成(CC条目48个),分子功能(MF条目50个),主要涉及凋亡过程调控、炎症反应、G蛋白偶联受体信号通路转导、神经系统发育、细胞增殖等。生物过程分析中排名前5的分别是RNA聚合酶II启动子转录的正调控、化学突触传递、药物反应、信号转导、疼痛感受。细胞组成分析中排名前5的分别是细胞质膜、质膜整体成分、膜的组成部分、细胞质、胞浆。分子功能分析中排名前5的分别是蛋白质结合、相同蛋白结合、酶结合、药物结合、蛋白丝氨酸/苏氨酸激酶活性。分别取潜在靶标数量排名前20的BP、CC、MF条目进行GO功能富集分析结果绘制(Fig 4)。
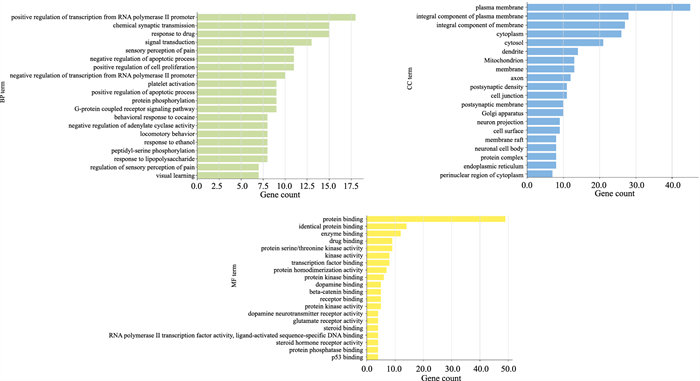
|
| Fig 4 GO function enrichment analysis |
KEGG通路富集分析显示共得到99条信号通路(P<0.05),涉及多条与神经系统、炎症反应、癌症等相关的通路。其中主要包括神经活性配体-受体相互作用、cAMP信号通路、5-羟色胺能突触、胆碱能突触、Rap1信号通路、Ras信号通路、可卡因成瘾、长期抑郁、阿尔茨海默症、PI3K-Akt信号通路、HIF-1信号通路、逆行内源性大麻素信号转导通路、MAPK信号转导通路、钙信号通路等。取潜在靶标数量排名前20的信号通路应用高级气泡图进行分析结果绘制(Fig 5)。
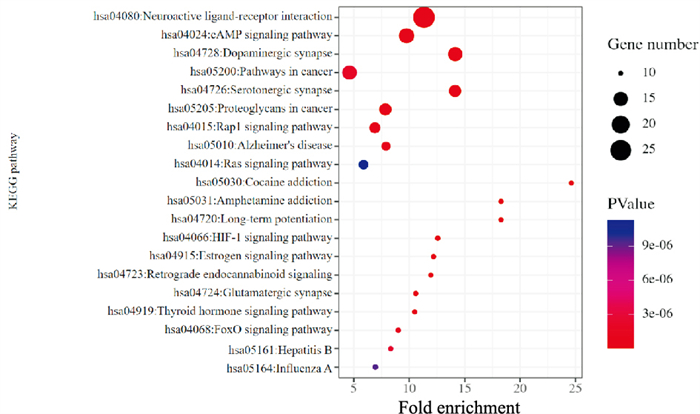
|
| Fig 5 KEGG pathway enrichment analysis |
将2.2中筛选出的140个交集靶点以及对应的活性成分信息进行整理并导入Cytoscape 3.7.1软件,构建疾病-成分-交集靶点网络图进行网络拓朴学分析,共得到167个节点,516条边。网络中活性成分统一用八边形表示,作用靶点统一用菱形表示。网络中八边形与菱形节点的尺寸由小到大、
颜色由浅到深表示节点度值逐渐增高。选取度值靠前的5种活性成分:肉桂酸肉桂酯(Degree=37)、邻苯二甲酸二辛酯(Degree=34)、邻苯1,2-二甲酸双(2-乙基己基)酯(Degree=34)、内消旋二氢愈创木脂酸(Degree=31)、异愈创霉素(Degree=30),再选取5种药物的共有成分:β-谷固醇、山萘酚、槲皮素、桦木酸、豆甾醇共同作为药物核心成分。
2.6 分子对接登录ZINC数据库下载核心成分MOL2格式文件,将文件导入Autodock Tools 1.5.6软件对其进行结构修饰,输出为pdbqt格式文件。选取2.3中构建的PPI网络中Degree值排名前6的关键靶蛋白,登录PDB数据库下载其3D结构文件,导入Pymol 2.4软件移除靶蛋白中的配体、非蛋白分子以及水分子,保存为pdb格式文件,再将此文件导入Autodock Tools 1.5.6软件进行结构修饰,输出为pdbqt格式文件,最后设置好相关参数并进行蛋白与化合物的半柔性分子对接验证。分子对接技术可通过匹配原则与半自由能计算方法来计算受体与配体的相互作用模式,预测受体与配体的能力及结合稳定性,来进一步推测受体与配体的结合位点。一般认为受体与配体结合时能量越低,表示该构象越稳定。将结合能≤5.0 kJ·mol-1作为筛选标准,发现安神补心六味丸核心化合物与核心靶点AKT1、APP、ALB、MAPK3、VEGFA、MAPK1的结合能均远小于-5.0 kJ·mol-1,提示核心化合物与受体结合活性较高。选取与AKT1、APP、ALB、MAPK3、VEGFA、MAPK1 6个靶点蛋白结合能最小的成分,其中AKT1、APP与豆甾醇结合能量最低,ALB与β-谷固醇结合能量最低,MAPK3、VEGFA、MAPK1与桦木酸结合能量最低,结果应用Pymol 2.4软件进行作图展示并标出氢键位置。
| Sort | Degree | Protein name | PDB ID |
| 1 | 74 | AKT1 | 1UNQ |
| 2 | 67 | APP | 3IVH |
| 3 | 67 | ALB | 2BX8 |
| 4 | 63 | MAPK3 | 2ZOQ |
| 5 | 54 | VEGFA | 3QTK |
| 6 | 52 | MAPK1 | 3D44 |
当细胞经0~10 mg·L-1浓度的LPS溶液处理后,细胞的存活率随着LPS浓度的升高而下降。5 mg·L-1 LPS浓度时细胞存活率在80%左右,10 mg ·L-1 LPS浓度时细胞存活率已低于70%,不利于后续实验,故选用5 mg·L-1 LPS浓度对后续研究来说更为合适。CCK-8细胞活力检测实验结果表明,与对照组相比,模型组BV2细胞活力明显下降(P < 0.05),而安神补心六味丸给药可剂量依赖性的抑制这种损伤从而保护BV2细胞,细胞活力明显上升,见Fig 8。
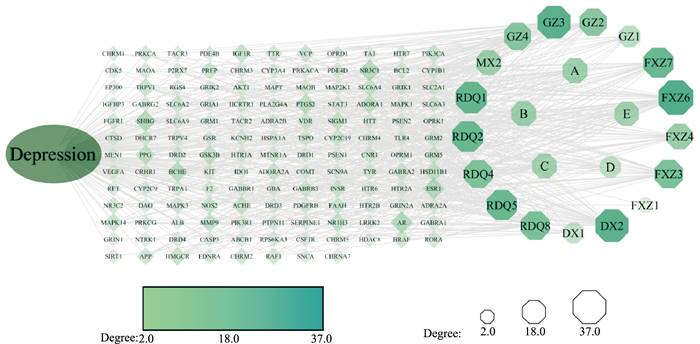
|
| Fig 6 Disease-ingredient-intersection target network map |
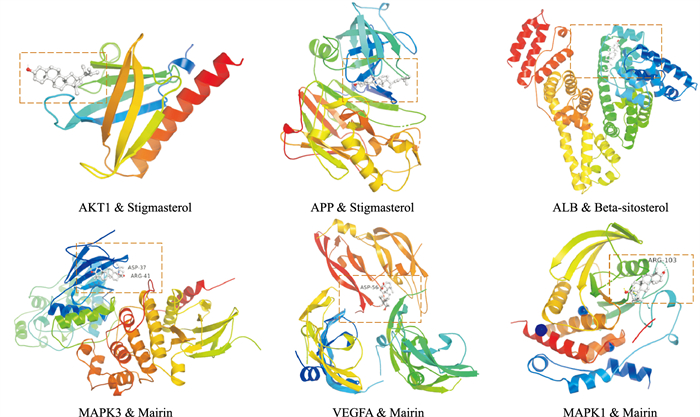
|
| Fig 7 Schematic diagram of molecular docking results |
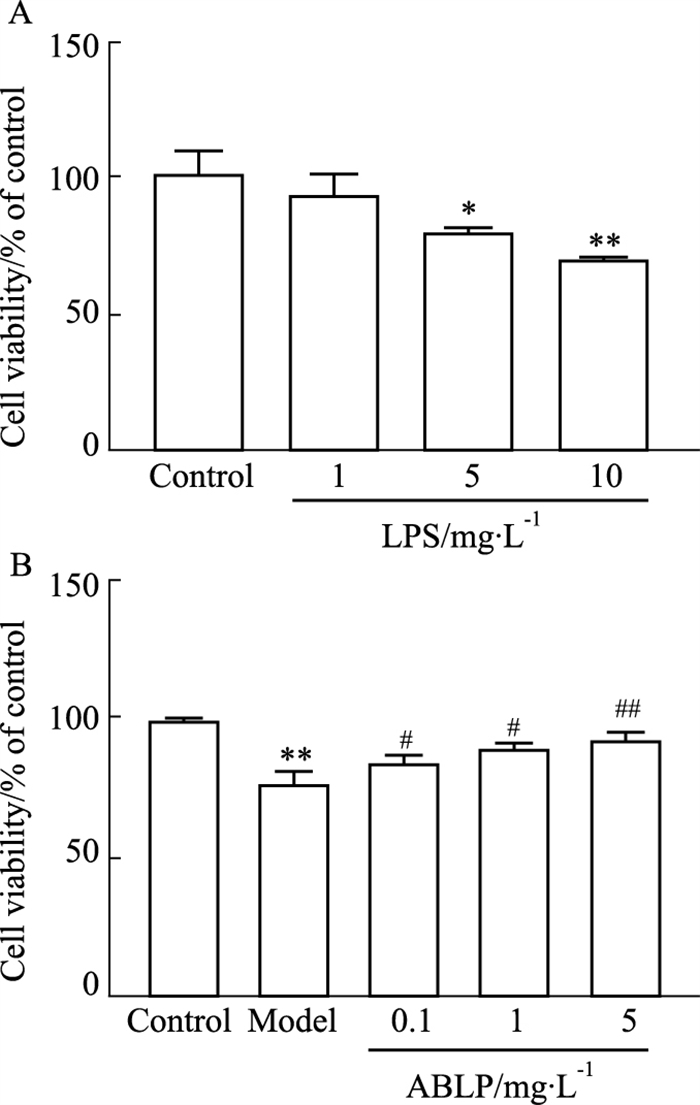
|
| Fig 8 Effect of Anshen Buxin Liuwei pills (ABLP) on activity of BV2 cells induced by LPS (x±s, n=4) *P < 0.05, **P < 0.01 vs Control group, #P < 0.05, ##P < 0.01 vs Model group. |
| Pub Chem CID | Chemical compound | Docking energy with AKT1/ kJ·mol-1 | Docking energy with APP/ kJ·mol-1 | Docking energy with ALB/ kJ·mol-1 | Docking energy with MAPK3/ kJ·mol-1 | Docking energy with VEGFA/ kJ·mol-1 | Docking energy with MAPK1/ kJ·mol-1 |
| 1550890 | Cinnamyl cinnamate | -22.60 | -32.65 | -34.74 | -33.49 | -25.95 | -26.37 |
| 8343 | Bis(2-Ethylhexyl) Phthalate | -19.26 | -29.30 | -30.98 | -26.79 | -26.79 | -22.19 |
| 7057920 | Bis[(2S)-2-ethylhexyl]benzene-1,2-dicarboxylate | -19.26 | -30.56 | -28.46 | -25.53 | -24.70 | -20.51 |
| 476856 | Meso-1,4-Bis-(4-hydroxy-3-methoxyphenyl)-2,3-dimethylbutane | -23.86 | -32.23 | -32.23 | -30.14 | -29.30 | -28.88 |
| 10314441 | Isoguaiacin | -27.63 | -33.49 | -31.40 | -30.14 | -33.07 | -30.14 |
| 222284 | Beta-sitosterol | -28.46 | -33.07 | -41.02 | -30.56 | -32.23 | -28.88 |
| 5280863 | Kaempferol | -26.37 | -34.33 | -33.07 | -30.98 | -30.98 | -24.70 |
| 5280343 | Quercetin | -26.79 | -36.00 | -30.14 | -30.98 | -26.37 | -28.88 |
| 64971 | Mairin | -28.88 | -36.84 | -35.16 | -36.00 | -33.91 | -34.74 |
| 5280794 | Sitosterol | -30.14 | -40.60 | -40.60 | -31.81 | -33.07 | -29.30 |
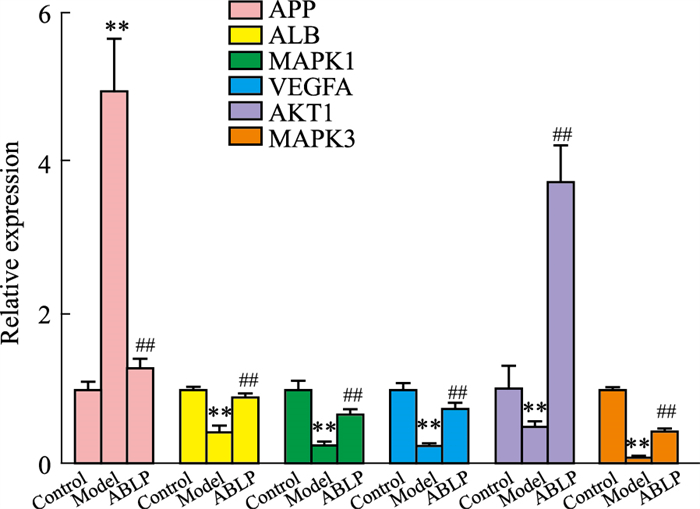
与正常组比较,模型组APP mRNA表达上调,AKT1、ALB、MAPK3、VEGFA、MAPK1 mRNA表达降低(P < 0.05)。实验结果显示,给予安神补心六味丸干预后,可在一定程度上抑制LPS所致BV2小胶质细胞炎症模型APP mRNA表达,上调AKT1、ALB、MAPK3、VEGFA、MAPK1 mRNA表达(P < 0.01),见Fig 9。
|
| Fig 9 Effect of Anshen Buxin Liuwei pills on mRNA expression of AKT1, APP, ALB, MAPK3, VEGFA and MAPK1 in BV2 cells (x±s, n=3) **P < 0.01 vs Control group, ##P < 0.01 vs Model group. |
随着社会经济发展加快,人们生活压力增大,情感冲击增强,抑郁症的发病率呈现逐年上涨的趋势,正在严重影响国人身体健康。现代医学理论认为,抑郁症的病因与遗传、生物化学、环境、心理等多种因素密切相关。蒙药安神补心六味丸为蒙医药经典配伍组方,具有祛赫依、镇静之功效,已有研究报道证明,其对冠心病、心绞痛、心律失常、神经官能症等具有良好的治疗作用[4],但其作用活性物质基础及作用机制尚未明确。
在蒙医学理论中,“赫依”、“希拉”、“巴达干”共称为人体的三根,是人类赖以生存的基本物质。在人体处于正常生理状态的情况下,三根之间相互依存、相互制约,从而形成一种平衡状态,但若是三根之中有任何一方出现偏盛或偏衰的情况,都会打破这种平衡,从而导致机体出现反常变化,并进而引发各种疾病。因此,抑郁症的产生亦是由于三根功能失调所致[6]。在蒙医学理论中,精神情志的改变与赫依变化的关系最为密切,赫依功能正常则人的精神、神志、思辨能力就正常。若人体内赫依偏盛,则会出现眩晕、不安、紧张、焦虑、全身疼痛等病症,当体内赫依偏盛至较严重程度时,赫依功能紊乱,侵害希拉、巴达干,从而导致体内三根失调,患者则会出现精力减退、神智失常、心境低落等抑郁症症状。由此可见,赫依功能紊乱为人体产生抑郁症的主要原因。蒙医学认为,赫依以循行之道遍布人体各个部位,巴达干依赖于脑部而居于胸部,而心脏位于胸腔,可表明心与赫依、巴达干密切相关。而心与脑有着密不可分的联系,心与脑主要以黑脉和白脉相互连接,白脉可影响脑、脊髓,而脑作为白脉的起源可连接到心,支配人体各系统的生理功能。因此,抑郁症的发病部位在心、脑及白脉系统中,抑郁症的治疗主要以镇赫依、巴达干,安神宁心,促进白脉传导为治疗原则。蒙药安神补心六味丸由牛心、广枣、肉豆蔻、木香、丁香、枫香脂6味药材配伍而成,牛心、广枣为甘味药,肉豆蔻、丁香、木香、枫香脂为辛味药,蒙医学中认为甘味药与辛味药均具有抑制赫依、希拉,生巴达干之效用[7]。
本研究应用网络药理学的技术与方法,探究安神补心六味丸对于抑郁症治疗的活性成分、活性靶点以及作用通路。研究共筛选出安神补心六味丸作用于抑郁症的主要活性成分共有22个,作用于抑郁症潜在靶点蛋白140个。现代药理研究表明,安神补心六味丸的多种活性成分具有不同的抗抑郁药理活性。山萘酚具有抗癌、抗氧化、抗炎、免疫调节等药理作用,能有效清除活性氧自由基,调节NO及NOS表达水平,减少脑细胞凋亡[8]。β-谷固醇可提高脑内5-HT、NA的表达水平,作用与经典抗抑郁药氟西汀类似。另有实验研究表明,β-谷固醇可能通过脑组织中关键物质的合成来影响小鼠大脑功能,增强小鼠的空间学习记忆能力[9]。槲皮素具有抗氧化、抗炎、抗抑郁等药理作用,实验研究证明,槲皮素对皮质酮损伤的PC12细胞具有保护作用,作用效果与经典抗抑郁药丙咪嗪类似[10]。桦木酸具有抗抑郁、抗焦虑、改善睡眠质量的作用,并且存在于某些抗抑郁药中[11]。豆甾醇具有保护精神状况、改善精神病症状的作用,研究发现豆甾醇能明显减少氯胺酮引起的小鼠精神病症状,上调γ-氨基丁酸、谷胱甘肽表达,下调多巴胺、TNF-α表达,并且能够降低乙酰胆碱酯酶活性[12]。
对交集靶点PPI网络进行网络拓朴学分析,得到安神补心六味丸治疗抑郁症的核心靶点59个,主要调控AKT1、APP、ALB、MAPK3、VEGFA、MAPK1等靶蛋白来达到抗抑郁作用,在后续的分子对接实验中发现,安神补心六味丸的核心活性成分与以上6种疾病靶蛋白均具有良好的结合活性,进一步验证了网络药理学研究结果。BDNF及其信号通路分布于中枢系统的海马体、前额叶皮质,在小脑、周围神经系统、纹状体、丘脑中亦存在,具有保护神经系统、促进血管新生的作用,为当前抑郁症研究的热点通路[13],AKT1为BDNF P13K途径的重要靶点因子,在信号传导中起重要作用。APP基因发生突变时,APP片段发生异常反应可形成β-淀粉样多肽(β-Amyloid peptide,Aβ),已有研究表明Aβ具有神经元毒性作用,释放强烈的神经毒性产物,引起细胞死亡,进而损害人体脑功能[14]。有研究表明,抑郁症患者体内可能会产生氧化应激反应,导致抗氧化性能降低,影响体内ALB水平。VEGFA是PDGF / VEGF生长因子家族的成员,可通过刺激血管再生,保护及修复大脑缺血神经元。MAPK3/MAPK1为脯氨酸导向的丝氨酸/苏氨酸激酶,能够使脯氨酸相邻的丝氨酸/苏氨酸磷酸化,并可通过MAPK信号转导通路多级激酶的级联途径,该级联途径与大脑发育、神经细胞凋亡、神经递质作用有关[15]。核心靶点的GO富集及KEGG富集分析结果显示,安神补心六味丸可涉及多种生物学途径来干预神经系统发育、炎症反应、免疫反应等,参与的疾病主要有长期抑郁、阿尔兹海默症、乙型肝炎、癌症、吗啡成瘾、慢性粒细胞白血病、Ⅱ型糖尿病等。共同提示安神补心六味丸可通过调控多条疾病相关反应通路、涉及多种生物途径来保护神经系统、心血管系统、免疫系统等,发挥抗抑郁的药理作用。
小胶质细胞是中枢神经系统里的免疫细胞,正常情况下处于静息状态,在外界刺激的条件下小胶质细胞可被激活,细胞形态由静息状态的高度分枝状转变为阿米巴状,释放炎性因子以及其他因子混合物。小胶质细胞约占全部脑细胞的10%,是大脑中固有的免疫细胞,在脑部损伤、感染、神经退行性疾病等中均起着重要作用[16]。在过去十年中,有学者认为小胶质细胞可能也参与了抑郁症的病理生理学,目前对小胶质细胞在抑郁症领域方面的实验研究内容仍较少,但已有学者尝试应用BV2小胶质细胞探究抑郁症体外模型[17]。LPS处理的BV2小胶质细胞被广泛用于研究与神经炎症、抑郁相关的细胞和分子途径以及新的治疗方法,越来越多的证据表明,LPS可以激活与一系列炎症相关的各种炎症途径。本实验应用LPS处理BV2小胶质细胞致其损伤,实验结果表明模型组细胞较正常对照组细胞存活率下降至80%左右,而安神补心六味丸给药后可剂量依赖性的抑制细胞损伤,提高细胞存活率至90%以上,从而保护BV2细胞。qRT-PCR结果表明,经安神补心六味丸处理的给药组细胞与模型组细胞相比,AKT1、APP、ALB、MAPK3、VEGFA、MAPK1 mRNA水平均有明显变化(P < 0.05),提示安神补心六味丸可能通过调控上述基因的表达,从而调控BV2小胶质细胞病理进程。
蒙医学发展至今已有2 000多年的历史,在对于抑郁症治疗中有自己的特色与长处。本研究应用网络药理学及分子对接技术,初步预测了安神补心六味丸的抗抑郁作用靶点及作用机制,探讨了药物活性成分与靶点蛋白的复杂作用网络,并且验证了蒙药安神补心六味丸的抗抑郁药理作用机制具有多成分、多靶点、多通路、整体性的特点,与西药单一的作用机制相比具有显著的优势。本研究旨在为其对抑郁症的进一步研究提供理论基础,也为临床运用该复方治疗抑郁症提供了一定的科学依据与新的思路。
| [1] |
Yang X W, McEwen R, Ong R O, et al. A big data analytics framework for detecting user-level depression from social networks[J]. Int J Inf Manage, 2020, 54: 10. doi:10.1016/j.ijinfomgt.2020.102141 |
| [2] |
王惠芹, 王真真, 林美妤, 等. 抑郁症发病与神经营养因子异常研究进展[J]. 中国药理学通报, 2020, 36(10): 1333-7. Wang H Q, Wang Z Z, Lin M Y, et al. Research progress on the pathogenesis of depression and abnormal neurotrophic factors[J]. Chin Pharmacol Bull, 2020, 36(10): 1333-7. doi:10.3969/j.issn.1001-1978.2020.10.001 |
| [3] |
白亮凤, 佟海英, 布仁达来, 等. 浅析蒙医赫依与抑郁症的关系[J]. 北京中医药, 2014, 33(3): 189-92. Bai L F, Tong H Y, Bu R D L, et al. To analyze the relationship between Mongolian doctor Heyi and depression[J]. Beijing Tradit Chin Med, 2014, 33(3): 189-92. doi:10.16025/j.1674-1307.2014.03.010 |
| [4] |
张晶, 纳顺达来. 蒙药安神补心六味丸治疗冠心病心绞痛临床观察[J]. 中国民族医药杂志, 2008, 14(3): 12-3. Zhang J, Na S D L. Clinical observation of Mongolian medicine Anshen Buxin Liuwei pill in the treatment of coronary heart disease and angina pectoris[J]. Chin J Ethn Med, 2008, 14(3): 12-3. doi:10.3969/j.issn.1006-6810.2008.03.006 |
| [5] |
张雨, 李恒, 李克宁, 等. 复方中药网络药理学的研究进展[J]. 中成药, 2018, 40(7): 1584-8. Zhang Y, Li H, Li K N, et al. Research progress of network pharmacology of compound traditional Chinese medicine[J]. Chin Tradit Pat Med, 2018, 40(7): 1584-8. doi:10.3969/j.issn.1001-1528.2018.07.029 |
| [6] |
佟海英, 呼格吉乐, 乌兰其其格, 等. 蒙医学对抑郁症的认识概述[J]. 中国民族医药杂志, 2012, 18(2): 1-2. Tong H Y, Hu G J L, Wu L Q Q G, et al. Overview of Mongolian medicine's understanding of depression[J]. Chin J Ethn Med, 2012, 18(2): 1-2. doi:10.3969/j.issn.1006-6810.2012.02.001 |
| [7] |
张丽凤, 王月洪. 简述蒙药的六味之作用[J]. 中国民族医药杂志, 2012, 18(6): 48-9. Zhang L F, Wang Y H. The function of six flavors of Mongolian medicine[J]. Chin J Ethn Med, 2012, 18(6): 48-9. |
| [8] |
Wei Q W, Yang B, Qiao Y, et al. Kaempferol protects mitochondria and alleviates damages against endotheliotoxicity induced by doxorubicin[J]. Biomed Pharmacother, 2020, 126: 110040. doi:10.1016/j.biopha.2020.110040 |
| [9] |
Zhao D, Zheng L, Qi L, et al. Structural features and potent antidepressant effects of total sterols and β-sitosterol extracted from sargassum horneri[J]. Mar Drugs, 2016, 14(7): E123. doi:10.3390/md14070123 |
| [10] |
Oliva J, Bardag-Gorce F, Tillman B, et al. Protective effect of quercetin, EGCG, catechin and betaine againstoxidatives stress induced by ethanol in vitro[J]. Exp Mol Pathol, 2011, 90(3): 295-9. doi:10.1016/j.yexmp.2011.02.006 |
| [11] |
Ruta M, Kristine S, Juris R, et al. Betulin binds to γ-aminobutyric acid receptors and exerts anticonvulsant action in mice[J]. Pharmacol Biochem Behav, 2008, 90(4): 712-6. doi:10.1016/j.pbb.2008.05.015 |
| [12] |
Yadav M, Parle M, Jindal D K, et al. Protective effects of stigmasterol against ketamine-induced psychotic symptoms: Possible behavioral, biochemical and histopathological changes in mice[J]. Pharmacol Rep, 2018, 70: 591-9. |
| [13] |
Wu C C, Lu J, Lu S J, et al. Increased ratio of mature BDNF to precursor-BDNF in patients with major depressive disorder with severe anhedonia[J]. J Psychiatr Research Res, 2020, 126: 92-7. |
| [14] |
Allison K, Swati M, Refugio M, et al. Depletion of the AD risk gene SORL1 selectively impairs neuronal endosomal traffic independent of amyloidogenic APP processing[J]. Cell Rep, 2020, 31(9): 107719. |
| [15] |
Muris H, Beyza A, Léa J B, et al. Ketamine induces rapid and sustained antidepressant-like effects in chronic pain induced depression: Role of MAPK signaling pathway[J]. Prog Neuro-Psychoph, 2020, 100: 109898. |
| [16] |
Kreisel T. Dynamic microglial alterations underlie stress-induced depressive-like behavior and suppressed neurogenesis[J]. Mol Psychiatr, 2014, 19(6): 699-709. |
| [17] |
Zheng M. Geniposide protects depression through BTK/JAK2/STAT1 signaling pathway in lipopolysaccharide-induced depressive mice[J]. Brain Res Bull, 2021, 170: 65-73. |

