

2. 西部战区总医院心血管内科,四川 成都 610083;
3. 西南医科大学临床医学院,四川 泸州 646000;
4. 西部战区总医院药剂科,四川 成都 610083
杨大春(1971-),男,博士,教授,研究方向:血管再狭窄的发生与防治,通信作者,E-mail:yangdc71@126.com
2. Dept of Cardiovascular Medicine, General Hospital of Western Theater Command, Chengdu 610083, China;
3. Clinical College of Medicine, Southwest Medical University, Luzhou, Sichuan 646000, China;
4. Dept of Pharmacy, General Hospital of Western Theater Command, Chengdu 610083, China
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是冠心病的重要治疗手段,PCI术后血管再狭窄(in-stent restenosis,ISR)会影响其治疗效果,尽管应用新型药物支架后其再狭窄率有明显降低,但目前其再狭窄率仍高达10%左右。寻找进一步降低PCI术后再狭窄的措施成为研究的焦点。研究表明,血管再狭窄与血管重塑、血管内膜过度增生密切相关[1]。既往对于内膜增生的研究主要集中于血管平滑肌细胞,但最近研究表明血管外膜成纤维细胞(adventitial fibroblasts,AFs)在血管重塑中也发挥重要作用[2]。
核受体亚家族1组D成员1(nuclear receptor subfamily 1,group D,member 1,NR1D1)是昼夜节律的核心组成部分,参与代谢、自噬和炎症反应的过程[3]。研究表明,激活NR1D1能够减轻心肌缺血/再灌注损伤以及预防心力衰竭[4]。但NR1D1在AFs的增殖、迁移以及血管内皮损伤后内膜增生中是否具有调控作用尚未见报道。本文主要对NR1D1在AFs的增殖和迁移的作用进行了探讨,期望为防治血管内皮损伤后内膜过度增生提供新的思路。
1 材料与方法 1.1 材料 1.1.1 动物SPF级C57BL/6J野生型8~10周龄雄性小鼠20只,体质量(18~25) g,购自湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004,饲养于西部战区总医院中心实验室。
1.1.2 试剂DMEM高糖培养基(SH30243.01)以及胰蛋白酶(SH30042.01)购自美国HyClone公司;胎牛血清(10091-148)购自美国Gibco公司;HE染色试剂盒(G1120-100)购自北京索莱宝生物有限公司;RNA提取试剂盒(RR820A)和反转录试剂盒(RR047A)购自日本TaKaRa公司;qPCR引物由北京擎科生物科技有限公司合成;过表达病毒NR1D1由中国上海吉凯基因科技有限公司构建;GAPDH(2118S)、NR1D1(13418S)以及β-catenin(8480S)购自美国Cell Signaling Technology公司;Ki-67抗体(BS-23103R)购自中国北京博奥森生物有限公司;山羊抗兔Ⅱ抗(SA00001-2)购自中国武汉三鹰生物技术有限公司;β-catenin激动剂SKL2001(HY-101085)和NR1D1激动剂SR9009(HY-16989)购自美国MedChemExpress公司;ECL发光显影液(WBKLSO100)购自美国Millipore公司。
1.2 方法 1.2.1 细胞培养从小鼠胸主动脉中分离出AFs,采用酶消化分离的方法提取原代AFs。在37 ℃、5% CO2培养箱中,原代AFs用含10%胎牛血清及1%青霉素和1%链霉素的DMEM高糖培养基培养。3 d更换1次培养基,待细胞生长丰度约90%时,用胰酶消化后进行传代培养。将3~8代小鼠AFs铺于6孔板中进行后续细胞学实验。用腺病毒转染使NR1D1过表达。用SKL2001恢复β-catenin的表达。为观察NR1D1过表达对AFs增殖和迁移的影响,将AFs分为Ad-Con组、Ad-Nr1d1组、Ad-Con+SKL2001组、Ad-Nr1d1+SKL2001组,各组在成功转染病毒对照Ad-Con空载体或Ad-Nr1d1后加入SKL2001(40 μmol·L-1)或者等量DMSO干预24 h。
1.2.2 细胞NR1D1过表达腺病毒转染将细胞悬液均匀铺于6孔板中,当细胞生长丰度50%左右时,按照腺病毒说明书,以MOI=50进行NR1D1腺病毒或病毒空载体转染。8~12 h后换回完全培养基,若细胞形态发生变化,可提前换液以保持细胞正常生长状态。
1.2.3 CCK-8实验CCK-8检测细胞活力(数目)时,将细胞悬液以1×108 L-1接种于96孔板,各组处理完成后,每孔加入10 μL CCK-8染液,在37 ℃下避光孵育2 h,用酶标仪在450 nm处检测各组的吸光度值,每组设5个复孔,取均值。
1.2.4 Ki-67细胞免疫荧光染色在24孔板中放入爬片,将细胞以1×108 L-1均匀铺于孔板中,按上述分组处理完成后倒掉培养基,用PBS洗3次,4%多聚甲醛固定20 min,PBS洗3次,浓度为0.5%的TritonX-100通透10 min,PBS洗3次,5% BSA室温封闭30 min,吸掉封闭液,每个孔滴加足量Ki-67抗体并4 ℃过夜。次日,PBS洗涤3次,将稀释的荧光Ⅱ抗加入到孔板里(此后在避光条件下操作),室温孵育1 h,滴加稀释好的DAPI复染核2 min,PBS洗3次,在荧光显微镜下进行图像采集。
1.2.5 Western blot实验细胞处理完成后,经过裂解、离心、变性和定量后,首先将样品按照分组加入泳道进行电泳,其次将分离的蛋白转到PVDF膜上,然后5% BSA室温封闭1 h,加入一抗4 ℃孵育过夜,随后洗膜,加入二抗室温孵育1 h,最后洗膜加入发光液,在曝光仪中显影进行图像采集。
1.2.6 qRT-PCR用TRIzol法提取AFs的总RNA,将各组RNA浓度标准化,逆转录为cDNA后扩增,GAPDH为内参,用相应的引物检测Nr1d1的mRNA水平。计算Nr1d1相对表达量用2-ΔΔCt法。Nr1d1的上游引物序列为5′-TACATTGGCTCTAGTGGCTCC-3′,下游引物序列为5′-CAGTAGGTGATGGTGGGAAGTA-3′;GAPDH的上游引物序列为5′-AGGTCGGTGTGAACGGATTTG-3′,下游引物序列为5′-TGTAGACCATGTAGTTGAGGTCA-3′。
1.2.7 划痕实验将细胞悬液加到6孔板中,待细胞长满用200 μL灭菌吸头在孔板中间画一条竖线,用PBS清洗3次,拍摄图片。加入无血清培养基或干预药物,培养箱中培养24 h,在光学显微镜下再次采集图片。
1.2.8 动物模型构建与分组通过构建血管内皮损伤模型来探讨NR1D1与内膜增生的关系,将20只雄性野生型小鼠随机分为假手术组(Sham+DMSO组)、颈动脉内皮损伤组(Injured+DMSO组)、假手术组+SR9009组(Sham+SR9009组)以及颈动脉内皮损伤组+SR9009组(Injured+SR9009组),每组5只。按照参考文献建立小鼠颈动脉损伤模型[5],本实验涉及的动物实验均符合本单位及国家相关实验动物管理和使用规定。
1.2.9 HE染色取颈动脉,多聚甲醛固定,石蜡包埋,切片。用二甲苯脱蜡2次,经过梯度浓度的乙醇复水,蒸馏水2 min。苏木精染液3~5 min,自来水洗涤。分化液分化10 s,自来水洗涤。伊红染色1~2 min,自来水冲洗10 s左右,快速脱水,晾干。中性树胶封片,采图。
1.3 统计学方法GraphPad Prism 9软件进行统计分析。实验数据以x±s表示,比较两组之间的差异采用独立样本t检验,采用单因素方差分析来比较多组间差异。
2 结果 2.1 过表达NR1D1抑制小鼠AFs的增殖和迁移Ki-67细胞免疫荧光结果提示,与Ad-Con组相比,Ad-Nr1d1组明显降低Ki-67阳性细胞率(P < 0.01,Fig 1A、1B)。CCK-8结果提示,与Ad-Con组相比,Ad-Nr1d1组细胞活力明显降低(P < 0.01,Fig 1C),即总细胞数降低。划痕实验结果提示,与Ad-Con组相比,Ad-Nr1d1组能使AFs划痕愈合速度减慢(P < 0.01,Fig 1D、1E)。
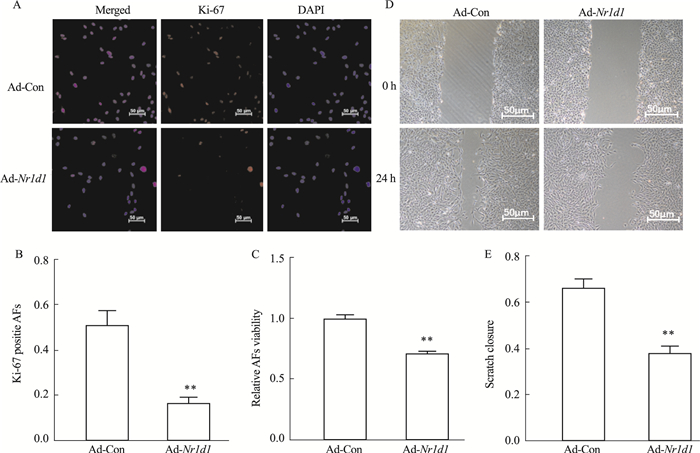
|
| Fig 1 NR1D1 overexpression suppressed proliferation and migration of AFs A: The proliferation of AFs was determined by Ki-67 staining; B: Quantification of A(x±s, n=3); C: The cell viability of AFs(x±s, n=5); D: The migration ability of AFs was performed by wound-healing assays; E: Quantification of D(x±s, n=3). **P < 0.01 vs Ad-Con. |
β-catenin与细胞增殖密切相关,血管内皮细胞和平滑肌细胞中β-catenin水平的增加促进细胞增殖[6]。qPCR和Western blot结果显示,与Ad-Con组相比,Ad-Nr1d1组中Nr1d1的mRNA水平明显升高(P < 0.01,Fig 2A)。与Ad-Con组相比,Ad-Nr1d1组NR1D1蛋白水平升高(P < 0.01,Fig 2B、2C)且β-catenin蛋白水平下降(P < 0.05,Fig 2B、2D)。与Ad-Nr1d1组对比,Ad-Nr1d1+SKL2001组β-catenin蛋白水平恢复,说明SKL2001恢复了β-catenin表达(P < 0.01,Fig 3A、3C)。

|
| Fig 2 NR1D1 overexpression reduced expression of β-catenin in AFs (x±s, n=3) A: The mRNA level of Nr1d1; B: The protein expression levels of NR1D1 and β-catenin; C, D: Quantification of B. *P < 0.05, **P < 0.01 vs Ad-Con. |
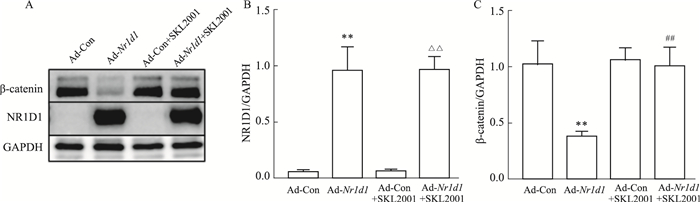
|
| Fig 3 SKL2001 abolished inhibitory effect of NR1D1 overexpression on β-catenin expression in AFs (x±s, n=3) A: The protein expression levels of NR1D1 and β-catenin; B, C: Quantification of A. **P < 0.01 vs Ad-Con, △△P < 0.01 vs Ad-Con+SKL2001, ##P < 0.01 vs Ad-Nr1d1. |
Ki-67细胞免疫荧光结果提示,与Ad-Con组相比,Ad-Nr1d1组Ki-67阳性细胞率明显降低。CCK-8结果显示,与Ad-Con组相比,Ad-Nr1d1组细胞活力明显降低,即细胞总数降低。加入SKL2001后,过表达NR1D1对Ki-67阳性细胞率(P < 0.01,Fig 4A、4B)以及细胞活力(P < 0.01,Fig 4C)的抑制作用消失。划痕实验结果显示,与Ad-Con组相比,Ad-Nr1d1组迁移速度明显减慢,加入SKL2001后,过表达NR1D1对迁移速度抑制作用消失(P < 0.01,Fig 4D、4E)。
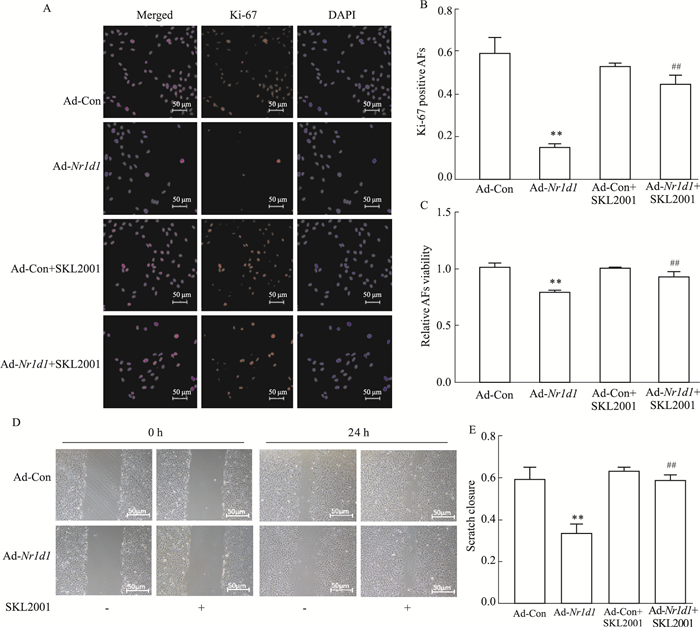
|
| Fig 4 Recovery of β-catenin by SKL2001 reversed inhibitory effect of NR1D1 overexpression on proliferation and migration of AFs A: The proliferation of AFs was determined by Ki-67 staining; B: Quantification of A(x±s, n=3); C: The cell viability of AFs(x±s, n=5); D: The migration ability of AFs was performed by wound-healing assays; E: Quantification of D(x±s, n=3). **P < 0.01 vs Ad-Con, ##P < 0.01 vs Ad-Nr1d1. |
HE染色结果提示,Injured+DMSO组内膜增生程度、内膜/中膜面积比值相比于Sham+DMSO组明显增高(P < 0.01,Fig 5);Sham+SR9009组管腔狭窄程度及内膜/中膜面积比值相比于Sham+DMSO组无明显差异;Injured+SR9009组内膜增生程度、内膜/中膜面积比值相比于Injured+DMSO组明显降低(P < 0.01,Fig 5)。
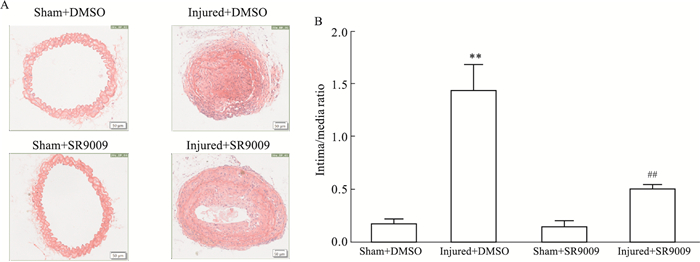
|
| Fig 5 Up-regulation of NR1D1 activity suppressed intimal hyperplasia after vascular endothelial injury (x±s, n=3) A: HE staining of carotid arteries; B: Quantification of A. **P < 0.01 vs Sham+DMSO, ##P < 0.01 vs Injured+DMSO. |
以冠心病等动脉粥样硬化性疾病为主的心血管疾病(cardiovascular diseases,CVDs)发病率、死亡率在世界范围内居于首位[7]。血管介入手术是冠心病及外周血管疾病患者最重要的血运重建手段,但支架植入后造成的ISR严重影响其疗效。血管内膜增生是导致ISR的主要因素[8],既往对于血管内膜增生的研究主要集中在血管平滑肌细胞。作为血管外膜主要组成部分,AFs与血管重塑和动脉粥样硬化等CVDs密切相关。AFs主要功能为整合、储存和释放调节血管壁结构和功能的关键调节因子[9]。在血管损伤后,AFs激活能促进生理性组织修复,但当其过度增生时,反而对组织功能有害[2]。此外,激活AFs会改变血管壁的张力和结构,这是血管重塑的重要生理病理特征,而血管重塑在高血压、动脉粥样硬化和ISR的发展中均起着关键作用[10]。在血管损伤等病理条件下,AFs增殖、迁移到内膜,促进内膜增生的形成[1],这可能是AFs参与血管内膜增生的机制。
昼夜节律基因在心血管疾病包括血管狭窄相关疾病中发挥重要作用[11]。作为昼夜节律中重要的负性调节分子,NR1D1在哺乳动物的肝脏、骨骼肌、大脑和脂肪组织中高度表达[12],并且参与细胞分化、脂质代谢和炎症过程,成为癌症、血脂异常和炎性疾病潜在的治疗靶点[3]。研究表明,激动NR1D1能减轻压力超负荷诱导的小鼠心肌肥厚[13],用SR9009对急性心肌梗死前小鼠进行预处理也能发挥心脏保护作用[14]。Reitz等[4]研究表明,心肌缺血/再灌注后1 d内应用SR9009可抑制心肌NLRP3炎性小体合成、活性以及抑制炎性细胞聚集到心肌梗死部位,从而抑制心肌重塑和梗死面积扩大,起到预防小鼠心力衰竭的作用。以上研究表明,NR1D1在心血管系统中发挥重要作用。本研究中,我们发现过表达NR1D1可显著降低AFs细胞Ki-67阳性率以及减慢划痕愈合速度,表明过表达NR1D1具有抑制AFs的增殖和迁移的作用。
β-catenin在调节细胞增殖、迁移和分化中发挥重要作用[15]。DiRenzo等[16]研究表明,β-catenin在大鼠颈动脉内皮损伤所造成的内膜增生处表达增多,表明β-catenin可能参与内膜增生的过程。近期有研究发现在3T3-L1前脂肪细胞及骨髓间充质干细胞中激活NR1D1均能降低β-catenin水平[12]。在本研究中,我们发现过表达NR1D1可降低AFs中β-catenin的表达;加入β-catenin激动剂SKL2001后,过表达NR1D1对AFs细胞Ki-67阳性率、细胞活力及划痕愈合速度的抑制作用降低。表明NR1D1可能通过抑制β-catenin的作用,从而抑制AFs的增殖和迁移。
本研究动物实验结果表明,NR1D1可抑制血管内皮损伤后内膜过度增生,但NR1D1是否通过抑制AFs的增殖和迁移,从而减轻血管内皮损伤后内膜过度增生的机制有待进一步的研究。
| [1] |
Dutzmann J, Koch A, Weisheit S, et al. Sonic hedgehog-dependent activation of adventitial fibroblasts promotes neointima formation[J]. Cardiovasc Res, 2017, 113(13): 1653-63. doi:10.1093/cvr/cvx158 |
| [2] |
Han X, Wu A, Wang J, et al. Activation and migration of adventitial fibroblasts contributes to vascular remodeling[J]. Anat Rec (Hoboken), 2018, 301(7): 1216-23. doi:10.1002/ar.23793 |
| [3] |
Akagi R, Akatsu Y, Fisch K M, et al. Dysregulated circadian rhythm pathway in human osteoarthritis: NR1D1 and BMAL1 suppression alters TGF-β signaling in chondrocytes[J]. Osteoarthritis Cartilage, 2017, 25(6): 943-51. doi:10.1016/j.joca.2016.11.007 |
| [4] |
Reitz C J, Alibhai F J, Khatua T N, et al. SR9009 administered for one day after myocardial ischemia-reperfusion prevents heart failure in mice by targeting the cardiac inflammasome[J]. Commun Biol, 2019, 2: 353. doi:10.1038/s42003-019-0595-z |
| [5] |
Sun X, Li S, Gan X, et al. Wild-type p53-induced phosphatase 1 promotes vascular smooth muscle cell proliferation and neointima hyperplasia after vascular injury via p-adenosine 5'-monophosphate-activated protein kinase/mammalian target of rapamycin complex 1 pathway[J]. J Hypertens, 2019, 37(11): 2256-68. doi:10.1097/HJH.0000000000002159 |
| [6] |
Zhong W, Oguljahan B, Xiao Y, et al. Serum and glucocorticoid-regulated kinase 1 promotes vascular smooth muscle cell proliferation via regulation of beta-catenin dynamics[J]. Cell Signal, 2014, 26(12): 2765-72. doi:10.1016/j.cellsig.2014.08.002 |
| [7] |
Musunuru K. Treating coronary artery disease: Beyond statins, Ezetimibe, and PCSK9 inhibition[J]. Annu Rev Med, 2021, 72: 447-58. doi:10.1146/annurev-med-080819-044918 |
| [8] |
Spadaccio C, Antoniades C, Nenna A, et al. Preventing treatment failures in coronary artery disease: What can we learn from the biology of in-stent restenosis, vein graft failure, and internal thoracic arteries[J]. Cardiovasc Res, 2020, 116(3): 505-19. doi:10.1093/cvr/cvz214 |
| [9] |
Stenmark K R, Yeager M E, El Kasmi K C, et al. The adventitia: Essential regulator of vascular wall structure and function[J]. Annu Rev Physiol, 2013, 75: 23-47. doi:10.1146/annurev-physiol-030212-183802 |
| [10] |
Xu F, Liu Y, Shi L, et al. RGS3 inhibits TGF-beta1/Smad signalling in adventitial fibroblasts[J]. Cell Biochem Funct, 2017, 35(6): 334-8. doi:10.1002/cbf.3280 |
| [11] |
Crnko S, Du Pre B C, Sluijter J P G, et al. Circadian rhythms and the molecular clock in cardiovascular biology and disease[J]. Nat Rev Cardiol, 2019, 16(7): 437-47. doi:10.1038/s41569-019-0167-4 |
| [12] |
Chu G, Zhou X, Hu Y, et al. Rev-erbα Inhibits proliferation and promotes apoptosis of preadipocytes through the agonist GSK4112[J]. Int J Mol Sci, 2019, 20(18): 4524. doi:10.3390/ijms20184524 |
| [13] |
Zhang L, Zhang R, Tien C L, et al. REV-ERBalpha ameliorates heart failure through transcription repression[J]. JCI Insight, 2017, 2(17): e95177. doi:10.1172/jci.insight.95177 |
| [14] |
Stujanna E N, Murakoshi N, Tajiri K, et al. Rev-erb agonist improves adverse cardiac remodeling and survival in myocardial infarction through an anti-inflammatory mechanism[J]. PLoS One, 2017, 12(12): e95177. |
| [15] |
邱晓霞, 李逸朗, 梁关凤, 等. 经典Wnt/β-catenin/TCF7L2信号通路在1型糖尿病心肌病中的作用[J]. 中国药理学通报, 2019, 35(8): 1104-9. Qiu X X, Li Y L, Liang G F, et al. Effect of activated canonical Wnt/β-catenin/TCF7L2signaling pathway in type 1 diabetic cardiomyopathy[J]. Chin Pharmacol Bull, 2019, 35(8): 1104-9. doi:10.3969/j.issn.1001-1978.2019.08.014 |
| [16] |
DiRenzo D M, Chaudhary M A, Shi X, et al. A crosstalk between TGF-beta/Smad3 and Wnt/beta-catenin pathways promotes vascular smooth muscle cell proliferation[J]. Cell Signal, 2016, 28(5): 498-505. doi:10.1016/j.cellsig.2016.02.011 |

