


2. 延边大学附属医院耳鼻喉科,吉林 延吉 133002;
3. 延边大学医学院解剖学教研室,吉林 延吉 133002
金永德(1964-),男,博士,教授,博士生导师,研究方向:过敏性鼻炎,通信作者,E-mail:jyd0091@126.com
 ,
WANG Chong-yang1,3,
LIU Si-qi1,2,
JIN Hai-nan1,2,
SONG Yi-lan1,3,
YAN Guang-hai1,3
,
WANG Chong-yang1,3,
LIU Si-qi1,2,
JIN Hai-nan1,2,
SONG Yi-lan1,3,
YAN Guang-hai1,3
 ,
JIN Yong-de1,2
,
JIN Yong-de1,2

2. Dept of Otolaryngology, Affiliated Hospital of Yanbian University, Jilin Yanji 133002, China;
3. Dept of Anatomy, Yanbian University School of Medicine, Jilin Yanji 133002, China
过敏性鼻炎(allergic rhinitis,AR)是最常见的过敏性疾病之一,是由IgE介导的Ⅰ型超敏反应,Th2免疫反应介导的炎症,其特征是打喷嚏、鼻塞、流鼻涕以及相关的嗅觉、味觉的丧失。AR表现出鼻黏膜的长期炎症,影响患者的生活质量并增加他们的经济负担,大约影响了10%~40%的人口[1]。然而AR的确切发病机制仍未确定。
线粒体是一种动态细胞器,通过不断裂变、融合和自噬调节稳态,这种动态重塑对于线粒体DNA稳定性、由活性氧(reactive oxygen species,ROS)引起的细胞压力至关重要,并且在过敏性疾病发生发展中起到重要作用[2]。线粒体裂变所需的关键蛋白质之一是dynamin-related protein 1(DRP1)。通过DRP1关键残基的磷酸化和/或其他翻译修饰调节线粒体裂变,进而导致线粒体功能障碍和细胞凋亡[3]。Li等[4]研究提示,环境PM2.5明显上调肺泡巨噬ROS水平,引起线粒体肿胀碎裂,明显上调DRP1表达、促进ROS生成、最终导致肺损伤。Delmotte等[5]研究显示,在过敏原引起的哮喘中,炎症会导致气道平滑肌细胞线粒体DRP1增加,线粒体呈碎片化,从而启动内质网应激引起氧化损伤,加重哮喘。然而目前尚未发现线粒体裂变融合与AR相关研究。
AMP激活蛋白激酶(AMP-activated protein kinase,AMPK)是一种细胞能量状态传感器,它在细胞中发挥基本的生理功能,包括抑制炎症、ROS产生、保护线粒体以及防止细胞凋亡[6]。Zhu等[7]研究提示,脂联素通过上调AMPK磷酸化水平而减轻肥胖相关哮喘小鼠气道炎症和氧化应激。Qi等[8]研究表明,AR药物Amlexanox通过增加磷酸化AMPK水平和Nrf2的核转位,保护对乙酰氨基酚诱导的急性肝损伤。可见,AMPK在过敏性哮喘发病中起着关键作用。以往报道表明,AMPK与线粒体有着密切联系[6]。激活AMPK可调节DRP1磷酸化和线粒体ROS介导的内质网应激,还可通过抑制TXNIP/NLRP3炎症小体激活调控线粒体形态,改善内皮细胞功能障碍。然而,目前,AMPK在AR中的调控作用鲜有报道。
PNS-R1是中国传统中药三七的重要化学单体之一,能够抗炎、抗氧化和抗凋亡。先前的研究表明,PNS-R1调节TNF-α/NF-κB信号传导并减轻哮喘中的过敏性气道炎症[9]。在糖尿病脑病中,PNS-R1激活Nrf2通路和抑制NLRP3炎症小体激活[10]。在七氟醚诱导的神经毒性中,PNS-R1减轻ROS生成,凋亡蛋白表达和激活Nrf2/HO-1和sestrin 2/AMPK信号级联减弱细胞凋亡[11]。在大鼠慢性萎缩性胃炎中,PNS-R1消除了化学诱变剂单功能烷化剂甲基硝基亚硝基胍引起的大鼠胃组织中Bcl-2表达增加和Bax表达降低。但PNS-R1是否能降低OVA诱导的鼻黏膜上皮细胞(human nasal epithelial cells, HNEpC)损伤及其调节线粒体裂变融合和凋亡具体机制尚不清楚。
本研究以AR小鼠模型和HNEpC为研究对象,通过AMPK/DRP1介导的线粒体裂变和凋亡研究PNS-R1对AR的抑制作用。我们研究表明PNS-R1通过减少线粒体裂变和细胞凋亡来改善AR症状,进一步证明PNS-R1对AR的治疗效果。
1 材料与方法 1.1 药品与试剂PNS-R1(B21099-200,纯度:98%)、地塞米松(Dex,B25793-100,纯度:98%)均购自上海源叶生物科技有限公司。PBS(P1010)、OVA(A8040,纯度:80%)、EDTA脱钙液(E1171-500)、HE染色试剂盒(G1120)、RIPA裂解液(R0020)、BCA检测试剂盒(PC0020)均购自北京索莱宝科技有限公司。氢氧化铝佐剂(WC320438)、MEM培养基(A4192201)、MitoSOX染料(M36008)、MitoTracker Red染色液(M7521)均购自美国ThermoFisher公司。ELISA试剂盒(YS-E1626)购自上海研生生化试剂有限公司。重组人IL-13(78029.1)购自加拿大STEMCELL公司。HNEpC购自广州吉妮欧生物有限公司。PVDF膜(R0AB94016)购自北京诺为生物技术有限公司。DRP1(GR3369203-2)、TXNIP(GR3381593-1)、Bcl-2(GR3370998-1)、山羊抗兔IgG(批号GR3357864-1)抗体购自美国abcam公司。Cyt-c(NBP2-21569)购自美国Novus公司。β-actin(3700S)、cleaved-caspase-3(9644S)、cleaved-caspase-9(20750S)、Apaf-1(8969S)、Alexa Fluor 488标记的驴抗山羊IgG (H+L)抗体(4412S)购自美国CST公司。p-DRP1(616)(81t5235)、GAPDH(62u0922)、NLRP3(87p8121)、AMPKα(11c4512)、p-AMPKα(49t6850)购自美国Affinity公司。Bax(A19684)购自美国Abclonal公司。山羊抗鼠IgG(BJ10131963)购自北京博奥森生物技术有限公司。DCFH-DA荧光染料(S0033S)、JC-1染色试剂盒(C2006)均购自上海碧云天生物技术有限公司。
1.2 仪器Slide扫描仪器(深圳市生强科技有限公司); Quantity One软件(美国BioRad公司); Cytation 5(美国BioTek公司)。
1.3 小鼠模型雌性小鼠BALB/c(6~8周龄,体质量18~22 g)从延边大学医学实验动物中心(中国吉林省)获得,小鼠饲养在无特定病原体(SPF)条件下,室温为(22±2)℃,相对湿度为50%~60%。所有动物实验中操作程序均符合《实验动物管理条例》的规定,并经延边大学医学院伦理委员会批准。合格证号SYXK(吉)2020-0009。
1.4 小鼠AR模型及过敏症状雌性小鼠BALB/c共40只,5组:对照(Control)、模型(Model)、PNS-R1(15、30 mg·kg-1)和Dex(5 mg·kg-1)组(n=8)。AR模型建立,在d 0、7和14将溶于300 μL PBS中的25 μg OVA和2 mg氢氧化铝佐剂通过腹膜内注射使小鼠致敏。对照组小鼠注射等剂量的PBS和氢氧化铝佐剂。最后一次OVA致敏后1周(d 21),小鼠每天接受溶于20 μL PBS中OVA(100 μg)的鼻内激发,然后用PNS-R1或Dex腹腔注射治疗30 min。在用OVA进行最后一次鼻腔攻击后,不知情的观察者在20 min的时间间隔内记录每只小鼠的擦鼻及打喷嚏次数。4周后,将所有小鼠颈椎脱臼处死,并收集眼球血和鼻黏膜组织用于之后实验。
1.5 酶联免疫吸附测定末次OVA攻击24 h后处死小鼠,收集眼眶后丛血液并离心(1 000×g,10 min)获得血清,用生理盐水灌洗鼻腔从鼻部获取鼻腔灌洗液(nasal lavage fluid,NLF),ELISA测量血清OVA特异性IgE、NLF中IL-4、IL-6、IL-8。每组动物中4只用于鼻组织病理检测,4只用于提取蛋白。
1.6 鼻组织的石蜡切片小鼠被处死后,鼻组织用4%多聚甲醛固定2 d,EDTA脱钙液13 d。然后将鼻组织标本用石蜡包埋,切成4 μm厚切片,进行HE染色。在光学显微镜下检查计数鼻中隔黏膜组织病理学变化,浸润的嗜酸性粒细胞和炎症状态。在Slide扫描系统下观察鼻中隔黏膜组织中的嗜酸性粒细胞浸润。
1.7 细胞培养和处理HNEpC在37 ℃和5%CO2条件下, 使用MEM培养基培养。用PNS-R1(2,4 μmol·L-1)和Dex(5 μmol·L-1)处理细胞30 min,然后用10 μg·L-1重组人IL-13[12]刺激24 h,剂量参考文献[12]。处理细胞用于后续实验。
1.8 蛋白质印迹将均质化的鼻组织和处理过的细胞用RIPA裂解,用BCA检测试剂盒定量总蛋白浓度。蛋白质(30 μg)在10%的SDS-PAGE凝胶上分离,然后电泳转移到PVDF膜上分别与一抗(Bax、Bcl-2、Cyt-c、Apaf-1、β-actin、cleaved-caspase-3、cleaved-caspase-9、DRP1、p-DRP1(616)、GAPDH、TXNIP、NLRP3、AMPK-α和p-AMPK-α)在4 ℃孵育一夜,与二抗在37 ℃孵育1 h。用ECL化学发光检测试剂盒观察蛋白条带。通过Quantity One软件分析蛋白质水平。
1.9 ROS水平的检测对于细胞ROS水平检测,使用DCFH-DA(10 μmol·L-1)荧光探针进行。将HNEpC培养80%左右,与ROS特异性荧光探针染料DCFH-DA试剂盒在37 ℃下孵育30 min,评估细胞ROS水平。对于mtROS的检测,细胞用MitoSOX染料(5 μmol·L-1)在37 ℃下染色30 min。在Cytation 5中观察并拍照阳性染色的细胞(红色荧光)。
1.10 线粒体膜电位(MMP)检测和线粒体裂变分析处理后的细胞用JC-1(5 μmol·L-1)染色液37 ℃孵育20 min。线粒体裂变检测用400 nmol·L-1的MitoTracker Red在37 ℃下染色30 min。固定、渗透细胞,在4 ℃条件下用抗DRP1抗体孵育一夜,然后用Alexa Fluor 488标记的驴抗山羊IgG(H+L)抗体孵育2 h。在Cytation 5中观察并拍照,以完整的管状线粒体网络为主的细胞被鉴定为正常细胞,以球形线粒体为主的破裂细胞被鉴定为线粒体裂变细胞。
1.11 统计学分析使用GraphPad Prism 9.1.2进行数据分析与作图,所有数据均采用x±s表示,两组间对比使用t检验,多组间比较使用方差分析和Bonferroni校正的t检验。
2 结果 2.1 PNS-R1对小鼠AR炎性细胞浸润、OVA特异性IgE、促炎细胞因子表达的影响为了检测PNS-R1对AR的影响,用15或30 mg·kg-1剂量的PNS-R1以及5 mg·kg-1剂量的Dex治疗OVA诱导的AR小鼠后,使用临床及病理评估鼻部炎症的严重程度。结果显示,PNS-R1治疗明显降低了AR模型小鼠打喷嚏(Fig 1A)和揉鼻(Fig 1B)的发生频率。组织学HE染色显示,PNS-R1治疗减少了鼻黏膜下层中浸润的嗜酸性粒细胞和炎症状况(Fig 1C)。ELISA检测发现,经过PNS-R1和Dex治疗后,小鼠血清中OVA特异性IgE的浓度低于OVA组(Fig 1D)。PNS-R1治疗后,小鼠NLF中IL-4、IL-6、IL-8细胞因子的浓度也明显低于OVA组,与PNS-R1(15 mg·kg-1)相比,PNS-R1(30 mg·kg-1)和Dex(5 mg·kg-1)治疗效果更明显(如Fig 1E)。这些结果表明,PNS-R1可以在一定程度上缓解过敏性鼻炎的嗜酸性粒细胞浸润、OVA特异性IgE以及IL-4、IL-6、IL-8细胞因子的表达。
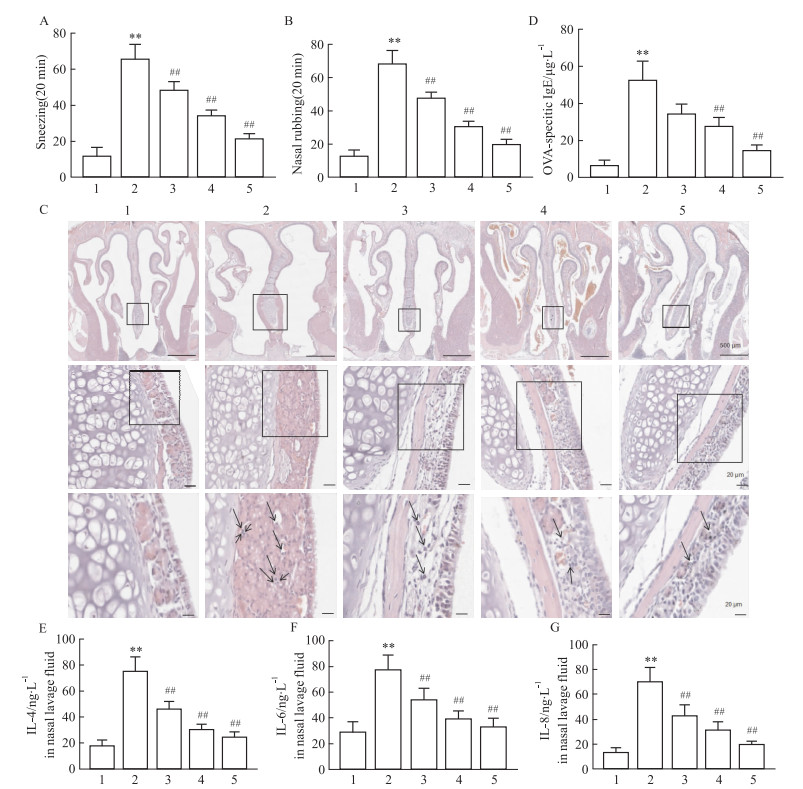
|
| Fig 1 Effects of PNS-R1 on AR inflammatory cell infiltration, specific IgE and pro-inflammatory cytokine expression in mice (x±s, n=4) A and B: Sneezing frequency (A) and nasal rubbing frequency (B) of AR mice. C: HE staining of nasal tissue sections. Scale=2 mm. Arrows indicate eosinophils. D: Ova-specific IgE in serum. E~G: Levels of IL-4, IL-6 and IL-8 in NLF. NLF: Nasal lavage fluid; Dex: Dexamethasone. 1:Control; 2:Model; 3:PNS-R1(15 mg·kg-1); 4:PNS-R1(30 mg·kg-1); 5:Dex(5 mg·kg-1). **P < 0.01 vs Control group, ##P < 0.01 vs Model group. |
为验证PNS-R1对AR小鼠鼻组织细胞凋亡的影响,采用Western blot检测鼻组织中凋亡蛋白。PNS-R1明显抑制了凋亡蛋白cleaved-caspase-3、Bax、Cyt-c、Apaf-1、cleaved-caspase-9的表达,但上调了抗凋亡蛋白Bcl-2(Fig 2A)。PNS-R1的作用与Dex相似。提示PNS-R1对AR小鼠鼻组织具有抗凋亡作用。
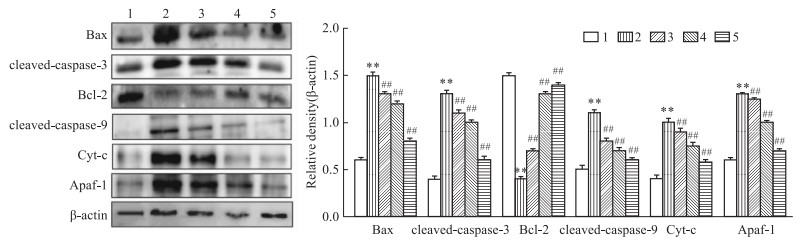
|
| Fig 2 PNS-R1 inhibited apoptosis of nasal mucosal epithelial cells in AR mice (x±s, n=4) A: Western blot analysis of Bax, cleaved caspase-3, Bcl-2, cleaved caspase-9, Cyt-c, and Apaf-1 expressions in nasal tissues. 1:Control; 2:Model; 3:PNS-R1(15 mg·kg-1); 4:PNS-R1(30 mg·kg-1); 5:Dex(5 mg·kg-1). **P < 0.01 vs Control group, ##P < 0.01 vs Model group. |
为了检测PNS-R1对AR小鼠线粒体膜电位及细胞凋亡的影响,利用了经典TH2细胞因子IL-13作为刺激因子模拟体内炎症状态。如Fig 3A所示,利用JC-1染料检测和分析发现,PNS-R1治疗可以恢复IL-13诱导的线粒体膜电位的丧失。如Fig 3B所示,与对照组相比,IL-13导致cleaved-caspase-3、Bax表达和活性明显增加,经PNS-R1治疗后明显降低,而Bcl-2的结果相反。这些结果表明,PNS-R1能够恢复IL-13诱导的线粒体膜电位丧失且具有抗凋亡作用。
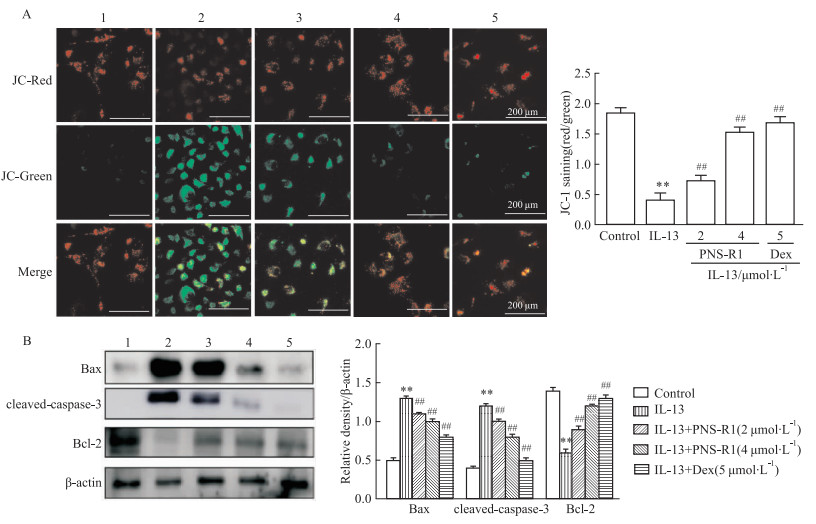
|
| Fig 3 PNS-R1 restored IL-13-induced mitochondrial membrane potential loss and reduced apoptosis of nasal epithelial cells (x±s, n=8) A: MMP of HNEpC after IL-13 stimulation was detected by JC-1 staining. Ratio of red-green fluorescence intensity. B: Bax, cleaved caspase-3, and Bcl-2 were detected by Western blot. 1:Control; 2:Model; 3:PNS-R1(4 μmol·L-1); 4:PNS-R1(2 μmol·L-1); Dex(5 μmol·L-1). **P < 0.01 vs Control group, ##P < 0.01 vs Model group. |
为检测PNS-R1在IL-13诱导的线粒体功能障碍中的调控作用,故检测了DRP1表达和易位情况。如Fig 4A所示,鼻上皮细胞损伤期间DRP1总蛋白丰度没有变化,而IL-13的刺激增加了DRP1中Ser616处的磷酸化,表明DRP1被激活。但是,这些改变可以通过用PNS-R1和Dex处理来逆转。接下来我们通过MitoTracker Red染色进一步研究了线粒体形态的变化发现,刺激组的线粒体由高度动态的管状网络组织发展为碎裂或球形线粒体,线粒体出现裂变,干预组则逆转了该现象。DRP1从细胞质到线粒体的易位是DRP1激活的指标[13]。结果显示,PNS-R1减少了HNEpC线粒体DRP1易位(Fig 4B),表明对DRP1募集的抑制作用。由此可见,PNS-R1能够抑制IL-13诱导的线粒体裂变,DRP1易位,从而抑制HNEpC线粒体损伤。
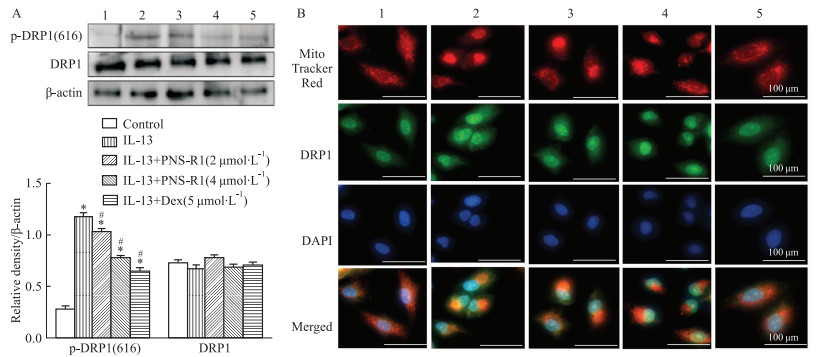
|
| Fig 4 PNS-R1 regulated phosphorylation of DRP1, translocates and prevented mitochondrial fission (x±s, n=8) A: The levels of p-DRP1 (616) and DRP1 in HNEpC were detected by Western blot. B: Co-localization of MitoTracker Red and DRP1 in HNEpC.1:Control; 2:Model; 3:PNS-R1(4 μmol·L-1); 4:PNS-R1(2 μmol·L-1); Dex(5 μmol·L-1). **P < 0.01 vs Control group, ##P < 0.01 vs Model group. |
线粒体是产生ROS的主要场所,而ROS的积聚与线粒体的损伤密切相关。HNEpC细胞经IL-13诱导后,ROS产生明显增加,这种变化可通过PNS-R1和Dex治疗得以阻止(Fig 5A)。利用mitoSOX Dye检测到mtROS,发现与IL-13诱导组相比,经PNS-R1和Dex处理后的细胞mtROS产生明显降低(Fig 5B)。PNS-R1能够抑制这些结果很好地证明了PNS-R1能够抑制鼻上皮组织中ROS介导的线粒体裂变能力。
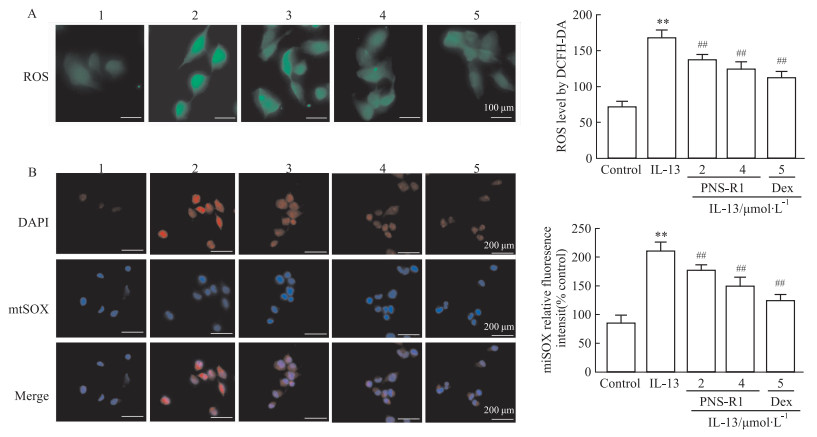
|
| Fig 5 PNS-R1 reduced IL-13-induced ROS production in nasal mucosal epithelial cells (x±s, n=8) A: ROS generation in HNEpC was detected using a DCFH-DA probe. Scale bar = 100 μm. B: mtROS detection in HNEpC was performed using MitoSOX dye.1:Control; 2:Model; 3:PNS-R1(4 μmol·L-1); 4:PNS-R1(2 μmol·L-1); Dex(5 μmol·L-1). **P < 0.01 vs Control group, ##P < 0.01 vs Model group. |
为探索PNS-R1对AMPK的调控关系以及与TXNIP/ NLRP3的关系,我们观察了不同剂量PNS-R1处理后对上皮细胞AMPK活性的影响。结果显示,PNS-R1明显增加了鼻上皮细胞的p-AMPKα磷酸化,同时p-DRP1(616)蛋白的表达水平明显降低(Fig 6A)。可见,PNS-R1通过激活HNEpC中p-AMPK表达,从而降低DRP1介导的线粒体裂变和损伤。如Fig 6B所示,经IL-13攻击后,HNEpC中TXNIP/NLRP3表达增加,而该变化被PNS-R1和Dex抑制。综上所述,PNS-R1可通过调节AMPK/DRP1介导的线粒体裂变和随后的TXNIP/NLRP3炎症小体激活,从而缓解AR。
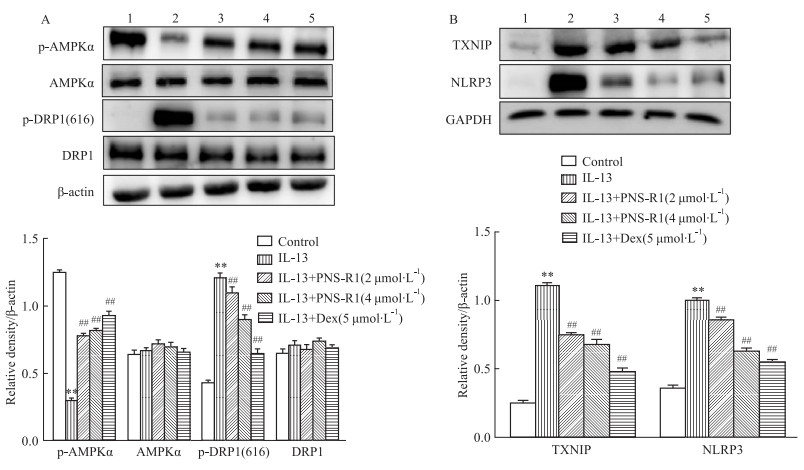
|
| Fig 6 PNS-R1 inhibited mitochondrial fission and reduced TXNIP/NLRP3 inflammasome activation by regulating AMPK expression (x±s, n=8) A: Western blot analysis of p-AMPKα, AMPKα, p-DRP1(616) and DRP1 levels in HNEpC; B: Western blot analysis of TXNIP and NLRP3 levels in HNEpC. 1:Control; 2:Model; 3:PNS-R1(4 μmol·L-1); 4:PNS-R1(2 μmol·L-1); Dex(5 μmol·L-1). *P < 0.01 vs Control group, #P < 0.01 vs Model group. |
我们研究了PNS-R1对OVA诱导的AR的影响及其涉及线粒体裂变和细胞凋亡的潜在机制。研究发现,PNS-R1抑制血清中OVA特异性IgE水平以及NLF中IL-4、IL-6和IL-8细胞因子的产生。在体外,在IL-13诱导的HNEpC中,PNS-R1能有效增加线粒体膜电位,降低凋亡蛋白,如减少cleaved-caspase-3和Bax的表达,增加Bcl-2的表达。PNS-R1还可以抑制AR小鼠中线粒体裂变蛋白DRP1、DRP1(Ser616)表达。PNS-R1能够抑制ROS、mtROS的产生和DRP1的易位。机制研究表明,PNS-R1通过激活AMPK抑制DRP1(Ser616)表达和DRP1易位,随后抑制TXNIP/NLRP3信号轴,最终减轻AR。
线粒体是产生ROS的主要场所,而ROS的过度积聚导致线粒体裂变和线粒体功能障碍[2]。线粒体裂变由DRP1负责,DRP1最初定位于细胞质中,当其丝氨酸616位点被磷酸化激活时,DRP1将易位至线粒体外膜启动裂变反应[14]。在本研究中,IL-13可在体外使HNEpC线粒体膜电位丢失、ROS产生增加,从而介导氧化应激引起DRP1活化,易位到线粒体外膜,启动导致线粒体裂变。PNS-R1可通过调节DRP1磷酸化使其失活,阻止其易位,增加线粒体膜电位,从而保护线粒体的功能和结构。PNS-R1是三七的重要活性成分,有效缓解慢性炎症疾病。Zhao等[15]研究提示,PNS-R1能调节XIST/miR-221-3p/TRAF6轴减轻人脐静脉血管内皮细胞中氧化低密度脂蛋白诱导的ROS介导的氧化应激、细胞凋亡和炎症应答。本研究中,我们证实了PNS-R1对AR小鼠和IL-13刺激的HNEpC中DRP1介导的线粒体损伤具有调控作用。
线粒体凋亡途径是诱导细胞凋亡的重要途径,包括Bcl-2、Bax、Cyt-c、Apaf-1、caspase-3、caspase-9等重要蛋白质[16]。其中,caspase-3是凋亡途径最下游的一种酶,当它被激活时,会导致DNA降解和细胞凋亡[16]。我们目前的研究结果表明,用PNS-R1治疗抑制了AR小鼠HNEpC凋亡,减弱了IL-13诱导的HNEpC线粒体凋亡。由此推论,PNS-R1通过抑制细胞凋亡减轻AR。
AMPK是线粒体稳态的重要调节因子,可将线粒体裂变和自噬相联系起来,在应激状态下,启动细胞核的新线粒体的生物合成,以替代受损线粒体。被激活的AMPK可直接调控靶标底物的丝氨酸或苏氨酸残基的磷酸化,并通过调节线粒体裂变因子的磷酸化来触发线粒体裂变,线粒体裂变因子是DRP1的主要线粒体外膜受体。Fan等[17]研究提示,热休克蛋白22通过AMPK/PGC1α依赖的途径恢复线粒体生物合成,负反馈调节DRP1介导的线粒体裂变和凋亡,进一步减少氧化应激和脑损伤。本研究中,PNS-R1能够激活AMPK同时降低DRP1的表达。可见,PNS-R1对AR的保护作用,部分是通过激活AMPK/DRP1信号通路来实现的。
AMPK还与TXNIP/NLRP3炎症小体活化相关。AMPK的磷酸化可导致TXNIP的变性,从而促进NLRP3炎症小体的激活[18]。细胞发生损伤时,TXNIP从与硫氧还蛋白的结合中解离,诱导NLRP3炎性小体活化。本研究中,我们观察到利用PNS-R1阻止了IL-13诱导的HNEpC的TXNIP/ NLRP3炎症小体活化,揭示了PNS-R1在AR中的调控分子机制。这进一步支持了我们的研究结论,PNS-R1通过AMPK/DRP1介导的线粒体裂变和TXNIP/NLRP3炎症小体激活改善AR小鼠的分子作用机制。
总之,我们发现AMPK激动剂PNS-R1能够通过抑制ROS生成,DRP1活化介导的线粒体裂变来保护线粒体完整性,还能抑制TXNIP/NLRP3炎症小体激活,从而阻止了炎症的进一步加重。这些结果表明,PNS-R1可以改善AR症状,本研究为AR治疗提供了一种新的分子调控机制和潜在的药物靶点。
| [1] |
Mandhane S N, Shah J H, Thennati R. Allergic rhinitis: An update on disease, present treatments and future prospects[J]. Int Immunopharmacol, 2011, 11(11): 1646-62. doi:10.1016/j.intimp.2011.07.005 |
| [2] |
Prakash Y S, Pabelick C M, Sieck G C. Mitochondrial dysfunction in airway disease[J]. Chest, 2017, 152(3): 618-26. doi:10.1016/j.chest.2017.03.020 |
| [3] |
张业昊, 姚明江, 丛伟红. 西红花提取物对局灶型脑缺血/再灌注大鼠线粒体分裂融合的影响[J]. 中国药理学通报, 2018, 34(6): 770-5. ZHang Y H, Yao M J, Cong W H, et al. Effect of extraction of saffron crocus on mitochondrial dynamics in ischemia/reperfusion rats[J]. Chin Pharmacol Bull, 2018, 34(6): 770-5. |
| [4] |
Li R, Kou X, Geng H, et al. Effect of ambient PM(2.5) on lung mitochondrial damage and fusion/fission gene expression in rats[J]. Chem Res Toxicol, 2015, 28(3): 408-18. doi:10.1021/tx5003723 |
| [5] |
Delmotte P, Sieck G C. Endoplasmic reticulum stress and mitochondrial function in airway smooth muscle[J]. Front Cell Dev Biol, 2020, 7: 374. doi:10.3389/fcell.2019.00374 |
| [6] |
Herzig S, Shaw R J. AMPK: Guardian of metabolism and mitochondrial homeostasis[J]. Nat Rev Mol Cell Biol, 2018, 19(2): 121-35. |
| [7] |
Zhu L, Chen X, Chong L, et al. Adiponectin alleviates exacerbation of airway inflammation and oxidative stress in obesity-related asthma mice partly through AMPK signaling pathway[J]. Int Immunopharmacol, 2019, 67: 396-407. |
| [8] |
Qi J, Zhou Z, Lim C W, et al. Amlexanox ameliorates acetaminophen-induced acute liver injury by reducing oxidative stress in mice[J]. Toxicol Appl Pharmacol, 2019, 385: 114767. |
| [9] |
Xue K, Ruan L, Hu J, et al. Panax notoginseng saponin R1 modulates TNF-alpha/NF-kappaB signaling and attenuates allergic airway inflammation in asthma[J]. Int Immunopharmacol, 2020, 88: 106860. |
| [10] |
Zhai Y, Meng X, Luo Y, et al. Notoginsenoside R1 ameliorates diabetic encephalopathy by activating the Nrf2 pathway and inhibiting NLRP3 inflammasome activation[J]. Oncotarget, 2018, 9(10): 9344-63. |
| [11] |
Zhang Y, Zhao Y, Ran Y, et al. Notoginsenoside R1 attenuates sevoflurane-induced neurotoxicity[J]. Transl Neurosci, 2020, 11(1): 215-26. |
| [12] |
Wang L, Lv Q, Song X, et al. ADRB2 suppresses IL-13-induced allergic rhinitis inflammatory cytokine regulated by miR-15a-5p[J]. Hum Cell, 2019, 32(3): 306-15. |
| [13] |
Hu J, Zhang Y, Jiang X, et al. ROS-mediated activation and mitochondrial translocation of CaMKⅡ contributes to Drp1-dependent mitochondrial fission and apoptosis in triple-negative breast cancer cells by isorhamnetin and chloroquine[J]. J Exp Clin Cancer Res, 2019, 38(1): 225. |
| [14] |
Archer S L. Mitochondrial dynamics-mitochondrial fission and fusion in human diseases[J]. N Engl J Med, 2013, 369(23): 2236-51. |
| [15] |
Zhao J, Cui L, Sun J, et al. Notoginsenoside R1 alleviates oxidized low-density lipoprotein-induced apoptosis, inflammatory response, and oxidative stress in HUVECS through modulation of XIST/miR-221-3p/TRAF6 axis[J]. Cell Signal, 2020, 76: 109781. |
| [16] |
Bock F J, Tait S W G. Mitochondria as multifaceted regulators of cell death[J]. Nat Rev Mol Cell Biol, 2020, 21(2): 85-100. |
| [17] |
Fan H, Ding R, Liu W, et al. Heat shock protein 22 modulates NRF1/TFAM-dependent mitochondrial biogenesis and DRP1-sparked mitochondrial apoptosis through AMPK-PGC1α signaling pathway to alleviate the early brain injury of subarachnoid hemorrhage in rats[J]. Redox Biol, 2021, 40: 101856. |
| [18] |
Wei H, Bu R, Yang Q, et al. Exendin-4 protects against hyperglycemia-induced cardiomyocyte pyroptosis via the AMPK-TXNIP pathway[J]. J Diabetes Res, 2019, 2019: 8905917. |