


2. 湖南中医药大学第一附属医院四肢关节科,湖南 长沙 410007;
3. 怀化市中医院小儿骨科,湖南 怀化 418000;
4. 湖南省中药粉体与创新药物省部共建国家重点实验室培育基地,湖南 长沙 410208
廖小林(1987-),男,博士生,研究方向:中药创新药物与中药药理学,E-mail:598383099@qq.com。
 ,
CHENG Bai-yi2,
WANG Kang3,
MI Yi-lin1,
DUAN Hang1,
LIAO Xiao-lin1,4
,
CHENG Bai-yi2,
WANG Kang3,
MI Yi-lin1,
DUAN Hang1,
LIAO Xiao-lin1,4 ,
KUANG Gao-yan2,
LU Min2
,
KUANG Gao-yan2,
LU Min2

2. Dept of Extremity and Joint, the First Affiliated Hospital of Hunan University of Traditional Chinese Medicine, Changsha 410007, China;
3. Dept of Pediatric Orthopedics, Huaihua Traditional Chinese Medicine Hospital, Huaihua, Hunan 418000, China;
4. Training Bases, Hunan Key Laboratory of Chinese Materia Medica Powder and Innovative Drugs Established by Province and Ministry, Changsha 410208, China
膝骨关节炎(knee osteoarthritis,KOA)是一种常见、多发的慢性筋骨疾病,疼痛为大多数患者就医的首要症状[1],因此,目前KOA治疗目的主要集中在减轻炎症,最大程度减少疼痛并维持关节功能。非甾体类抗炎药是KOA疼痛治疗的基石,但疗效有限,并且长期使用此类药物产生的副作用给临床医生带来了巨大的挑战。由于KOA为一种慢性疾病,长期治疗是不可避免的,因此,找到可长期使用并安全有效的治疗方案极为重要。
传统中医药中众多经典复方经过现代科学诸多临床试验验证其疗效稳定,安全可靠,近年来,在KOA的治疗过程中愈加广泛使用。加味独活寄生合剂为《备急千金要方》中经典中药复方独活寄生汤的基础上加用黄芩、木瓜、威灵仙、制天南星四味中药而成的改革制剂(湘药制备字:Z20190064,批号:20191111),本课题组前期通过大量临床及基础研究证实其可有效改善KOA患者临床症状,疗效可靠[2]。但由于中药成分复杂,目前尚缺乏对其有效发挥显著治疗作用的物质基础及作用机制的科学认识,阻碍了中药成分的应用,因此,亟需揭示中药治疗疾病的作用机制。
网络药理学因其具备良好的整体性与系统性,使其迅速成为应用于阐明中药方剂的活性成分和潜在作用机制的一种新策略,在新药发现、药物再利用和合理配方发现中发挥关键作用[3]。因此,本研究借助网络药理学方法探究加味独活寄生合剂发挥治疗KOA作用的潜在靶点及通路,并通过动物实验进行初步验证,以期为加味独活寄生合剂的临床合理应用和进一步实验研究提供理论支持。
1 材料与方法 1.1 加味独活寄生合剂治疗KOA的网络药理学研究 1.1.1 药物化学成分检索与筛选将加味独活寄生合剂中包含的19味中药依次输入中药系统药理学数据库与分析平台(TCMSP)[4]进行检索相关化学成分的药动力学特性(ADME)参数,设定类药性(drug likeness,DL)≥0.18及口服生物利用度(oral bioavailability,OB)≥30进行筛选,获得药物的主要活性成分及对应靶点信息,不符合TCMSP数据库筛选条件的药物则借助中药分子机制生物信息学分析工具(BATMAN-TCM)数据库查询,筛选条件设为校正后P值< 0.05及分数截断值≥30[5]。使用Uniprot数据库(https://www.uniprot.org/)将加味独活寄生合剂中有效成分靶点信息进行标准化。
1.1.2 膝骨关节炎疾病靶点从GeneCards、OMIM和GEO 3个数据库中获取KOA疾病靶点。其中,在GEO数据库中获得的基因数据集使用R软件(version 3.6.2)中的Limma软件包在|log FC|值>0.5的筛选条件下对数据进行分析,获得KOA的差异表达基因。将上述3个数据库中获得的所有KOA相关基因进行汇总去重,获得KOA相关靶点。
1.1.3 药物活性成分-疾病靶点网络的构建KOA相关靶点与“1.1.1”中获得的药物活性成分靶点相映射,获得加味独活寄生合剂治疗KOA的作用靶点,即药物-疾病共同靶点,制作Venn图,并导入Cytoscape3.7.2软件中,构建加味独活寄生合剂活性成分-疾病靶点可视化网络图。
1.1.4 靶蛋白相互作用网络(PPI)构建将药物-疾病共同靶点导入STRING平台进行分析,构建PPI网络图,并借助Cytoscape软件计算相关拓扑参数,分析PPI网络中的关键靶点。网络中某个节点与其他节点的连线数量称之为度(degree),度值越大,表示该节点在所构建的网络中越重要。利用R软件,根据度值大小绘制排序图,筛选出核心靶点。
1.1.5 交集基因GO富集与KEGG通路富集分析借助Metascape数据库[6](http://metascape.org)进行GO富集分析和KEGG通路富集分析。P < 0.01被认为是有统计学意义的,前20个具有统计学意义的结果,根据基因比率,以直方图显示。
1.1.6 分子对接选取PPI图中度值最大的疾病靶点蛋白通过PDB数据库获取三维结构,经AutoDockTools1.5.6软件去水、加氢等处理后,与加味独活寄生合剂中的主要活性成分分别作为受体和配体导入AutoDock Vina1.1.2软件中进行分子对接,根据结合能是否小于0初步判定配体与受体能否自发结合,当结合能绝对值大于5.0代表拥有较强结合能力[7]。
1.2 实验验证 1.2.1 动物选取与伦理声明24只成年新西兰正常雄性健康白兔(体质量2.0~2.5 kg)购自湖南太平生物科技有限公司,许可证号:SCXK(湖南)2020-0005,检疫合格后单独饲养,实验动物的日常饲料和饮水由湖南中医药大学动物实验中心提供。本实验已通过湖南中医药大学动物伦理委员会审查(伦理编号:LLBH-202006190001)。
1.2.2 主要试剂及仪器加味独活寄生合剂购于湖南中医药大学第一附属医院药剂科(批号:20191111,湘药制备字:Z20190064)。方药组成:桑寄生18 g,独活6 g,当归12 g,杜仲12 g,牛膝6 g,秦艽6 g,细辛3 g,川芎6 g,党参12 g,茯苓12 g,肉桂3 g,防风6 g,木瓜12 g,白芍10 g,甘草3 g,熟地黄15 g,制天南星6 g,黄芩6 g,威灵仙12 g。每瓶250 mL,含生药量为0.664 kg·L-1。白细胞介素1β(IL-1β)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒(武汉华美生物工程有限公司,批号:CSB-E06900Rb、CSB-E06998Rb),Bcl-2相关X蛋白(BAX)、胱天蛋白酶3(Caspase 3)ELISA试剂盒(江莱生物公司,批号:JL10071、JL33424),丝氨酸/苏氨酸蛋白激酶1(AKT1)、β-肌动蛋白抗体(β-actin)(美国Proteintech公司,批号:60203-2-Ig、66009-1-Ig)。
台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R)、多功能酶标分析仪(深圳市汇松科技发展有限公司,型号:MB-530)、电泳仪(中国北京六一仪器厂、型号:DYY-6C)、荧光定量RCP仪(Thermo,型号:PIKOREAL96)。
1.2.3 模型建立、分组与给药将兔随机分为3组:对照组(Control)、模型组(Model)、中药组(JDJM),每组8只,模型组及中药组均参考经典Videman造模法,即采用高分子石膏将兔右下肢固定伸直位造模建立KOA模型[8]。6周后,在模型及中药组中随机选取3只兔拍摄膝关节X线片。X线见造模侧关节间隙较健侧狭窄,且可见软骨下硬化或骨赘形成提示造模成功[9]。随后,中药组予以3.4 mL·kg-1加味独活寄生合剂灌胃,剂量按体表面积剂量换算法计算得出,模型组每日给予等量蒸馏水灌胃,每日2次,持续4周。
1.2.4 影像学及ELISA检测给药4周后,每组随机挑选5只兔右侧膝关节予以X片拍摄;禁食禁水一晚,于d 2处死兔子,抽取关节液、血液室温放置2 h后,于2 ℃、3 000 r·min-1(离心半径10 cm)离心15 min,取上清-80 ℃保存。按照ELISA试剂盒说明,测定关节液及血清中IL-1β、TNF-α、BAX、Caspase 3的含量。
1.2.5 qRT-PCR检测关键靶点根据PPI分析结果,选取度值最大的关键靶点AKT1进行验证。通过TRIzol法提取兔膝关节软骨组织总RNA,使用SYBR法进行qRT-PCR反应,引物采用Primer5软件设计,由上海生物技术有限公司合成。引物序列如下:AKT1(上游:5′-AAGGATGAAGTCGCCCACAC-3′; 下游:5′-GACGATTTCCGCACCGTAGA-3′)。PCR反应的循环条件为:95 ℃ 10 min, 95 ℃ 15 s, 60 ℃ 30 s,循环40次。采用2-△△Ct法计算基因相对表达量。
1.2.6 Western Blot检测关键靶点加入300 μL RIPA裂解液裂解0.025 g关节软骨组织10 min,在4 ℃下12 000 r·min-1离心15 min,然后用BCA法测定蛋白浓度。裂解液总蛋白经SDS-PAGE电泳后转移到PVDF膜上。用5%脱脂奶粉封膜90 min,将一抗溶液按一定比例稀释(AKT1 ∶1 ∶2 000)与膜一起孵育,置于4 ℃冰箱中过夜。然后用二抗在室温下孵育90 min,用ECL化学发光液显影,曝光后用Quantity one软件对曝光膜进行扫描分析。
1.3 统计学方法统计分析采用R4.1.1软件进行。计量数据以x±s表示,采用单因素方差分析(analysis of variance, ANOVA)计算组间差异,组件差异有统计学意义时,进一步两两比较采用Turkey检验,等级资料采用秩和检验。
2 结果 2.1 加味独活寄生合剂-KOA共同靶点和活性成分筛选依据设定的检索条件,19味中药共获得309个有效成分,其中白芍13个,川芎7个,茯苓15个,当归2个,党参21个,独活9个,秦艽2个,杜仲28个,熟地2个,防风18个,黄芩36个,木瓜4个,牛膝20个,甘草92个,桑寄生2个,天南星7个,威灵仙7个,细辛8个,肉桂16个,去重后获得194种活性成分、278个作用靶点。从GeneCard、OMIM数据库中分别获得2 564、2 593个与KOA相关的靶点。在GEO数据库中,获得包含5例正常受试者和6例KOA患者样本的基因表达数据集(GSE169077),分析后获得差异表达基因345个,包含151个上调基因以及194个下调基因(Fig 1A, B)。所有靶点汇总去重后,共获得2 783个KOA相关靶点。将疾病靶点与药物作用靶点匹配,得到152个共同靶点(Fig 1C)。
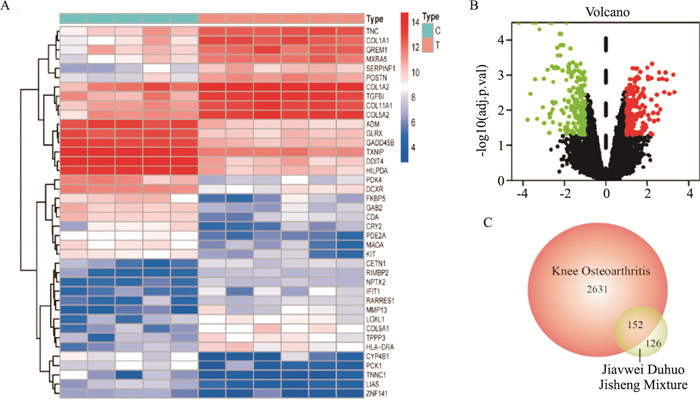
|
| Fig 1 Screening of JDJM-KOA common targets and active ingredients A: Heatmap of the GSE169077 gene expression dataset; B: Volcano plot of the GSE169077 gene expression dataset; C: Venn diagram of JDJM-related and KOA-related targets. |
将上述数据输入Cytoscape 3.7.2软件中构建成分-疾病靶点网络,结果显示152个共同靶点与加味独活寄生合剂中180种活性成分相映射,其中作用靶点较多的活性成分为:槲皮素(quercetin)、山奈酚(kaempferol)、木犀草素(luteolin)等。
筛选获得的共同靶点基因导入STRING平台进行PPI网络分析,分析结果导入Cytoscape3.7.2软件进行可视化并计算度值,根据度值大小,针对前20个进行绘制直方图(Fig 2),其中,AKT1为度值最大的靶点。
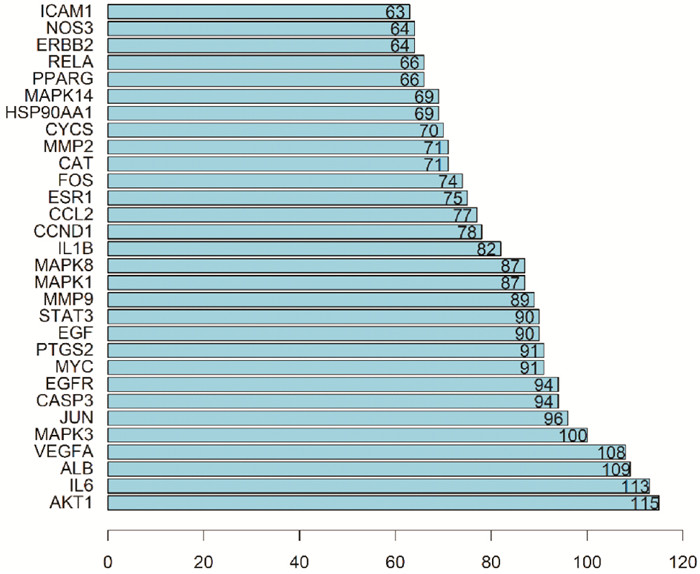
|
| Fig 2 Key proteins in PPI network diagram |
利用Metascape数据库对2.2中获得的152个共同靶点基因进行GO富集分析,结果可分为生物过程(BP)、分子功能(MF)、细胞组成(CC)3类,其中,生物过程占比最多(Fig 3 A-D),说明生物过程起主要作用,内容主要富集于炎症反应、凋亡信号通路有关。因此,加味独活寄生合剂可能主要通过抗炎和抗凋亡过程发挥对KOA的治疗作用。KEGG富集分析显示,加味独活寄生合剂治疗KOA的机制可能涉及314条相关通路,主要包括TNF信号通路、HIF-1信号通路、NF-κB信号通路、p53信号通路和Wnt信号通路(Fig 3E),这些通路均已被证实与KOA的病理发展密切相关。
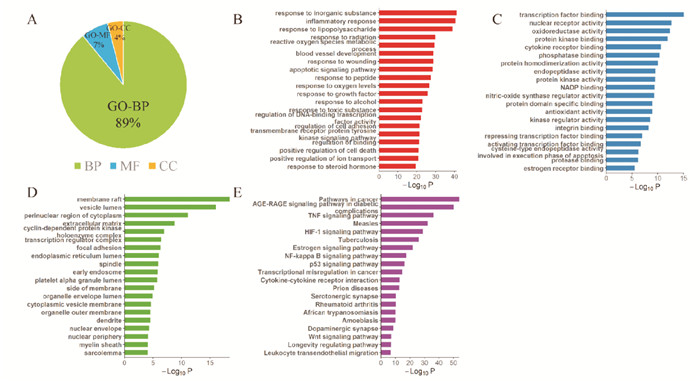
|
| Fig 3 Bar chart of GO function and KEGG pathway enrichment analysis A: GO analysis results percentage chart; B: Top 20 significantly enriched terms in GO-BPs; C: Top 20 significantly enriched terms in GO-MFs; D: Top 20 significantly enriched terms in GO-CCs; E: KEGG pathway analysis |
基于PPI分析结果,本研究选用AKT1作为疾病靶点蛋白作为受体与加味独活寄生合剂中的主要有效活性成分进行分子对接。加味独活寄生合剂中主要活性成分与疾病靶点蛋白AKT1结合能均为负值,说明其能自发结合;AKT1与槲皮素、山奈酚、木犀草素对接结合能分别为:-6.0 kcal·mol-1、-5.9 kcal·mol-1、-6.1 kcal·mol-1,结合能均小于-5 kcal·mol-1,体现了较强的结合能力(Fig 4)。
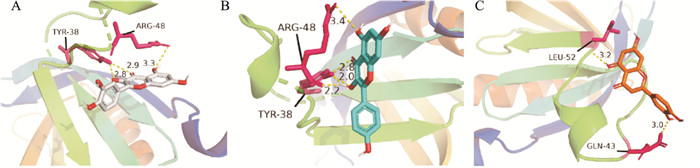
|
| Fig 4 The docking diagram of AKT1 with Quercetin (A), Kaempferol (B) and Luteolin (C) |
为初步评估加味独活寄生合剂对KOA兔膝关节的影响,本研究通过拍摄其膝关节X片来评估KOA的严重程度。与对照组相比,模型组兔膝关节僵硬,屈伸活动受限,X片示内外侧关节间隙明显变窄,部分出现软骨下骨硬化以及骨赘形成;与模型组相比,中药组外侧关节间隙较均匀,以内侧关节间隙变窄为主,偶见软骨下骨硬化,未见明显骨赘形成。参考Kellgren-Lawrence评分系统评估膝关节骨性关节炎的严重程度,结果显示,中药组评分明显低于模型组(P < 0.05) (Fig 5)。

|
| Fig 5 Effects of JDJM on severity of knee osteoarthritis in rabbits Median(Q25, Q75) (n=5) A: Anteroposterior X-rays of rabbit knee joint; B: Lateral X-rays of rabbit knee joint; C: KL score. *P < 0.05 vs Control; #P < 0.05 vs Model |
本研究通过检测各组兔IL-1β和TNF-α表达变化情况,评估加味独活寄生合剂对炎症反应的影响。与对照组比较,模型组兔血清中IL-1β、TNF-α含量均升高(P < 0.05);与模型组相比,中药组血清中IL-1β、TNF-α含量降低(P < 0.05)(Fig 6 A )。随后,通过检测关节液中IL-1β和TNF-α表达变化情况进一步验证。模型组兔关节液中IL-β、TNF-α的表达明显高于对照组;中药组关节液中TNF-α和IL-1β含量较模型组明显降低(P < 0.05)(Fig 6 B)。
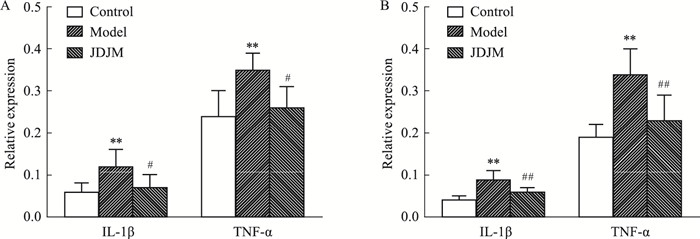
|
| Fig 6 Effect of JDJM on inflammatory cytokines in KOA rabbits(x±s, n=8或6) A: Relative expression levels of IL-1β and TNF-α in serum; B: Relative expression levels of IL-1β and TNF-α in joint fluid; **P < 0.01 vs Control; #P < 0.05, ##P < 0.01 vs Model. |
ELISA结果显示,与对照组比较,模型组兔血清及关节液中Caspase 3、BAX含量均升高(P < 0.05);与模型组相比,中药组Caspase 3、BAX含量降低(P < 0.05)(Fig 7)。
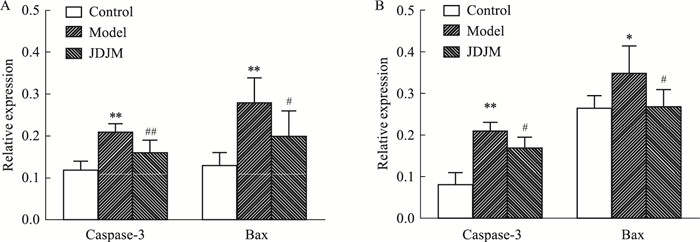
|
| Fig 7 Effect of JDJM on apoptosis factors in KOA rabbits(x±s, n=8或6) A: Relative expression levels of Caspase 3 and Bax in serum; B: Relative expression levels of Caspase 3 and Bax in joint fluid; *P < 0.05, **P < 0.01 vs Control; #P < 0.05, ##P < 0.01 vs Model. |
采用Real-time PCR、Western blot对加味独活寄生合剂抗KOA核心靶点AKT1的mRNA及蛋白表达水平进行验证。同对照组相比,模型组AKT1的mRNA及蛋白表达水平均升高(P < 0.01);同模型组相比,中药组AKT1的mRNA及蛋白表达水平均降低(P < 0.01)(Fig 8)。
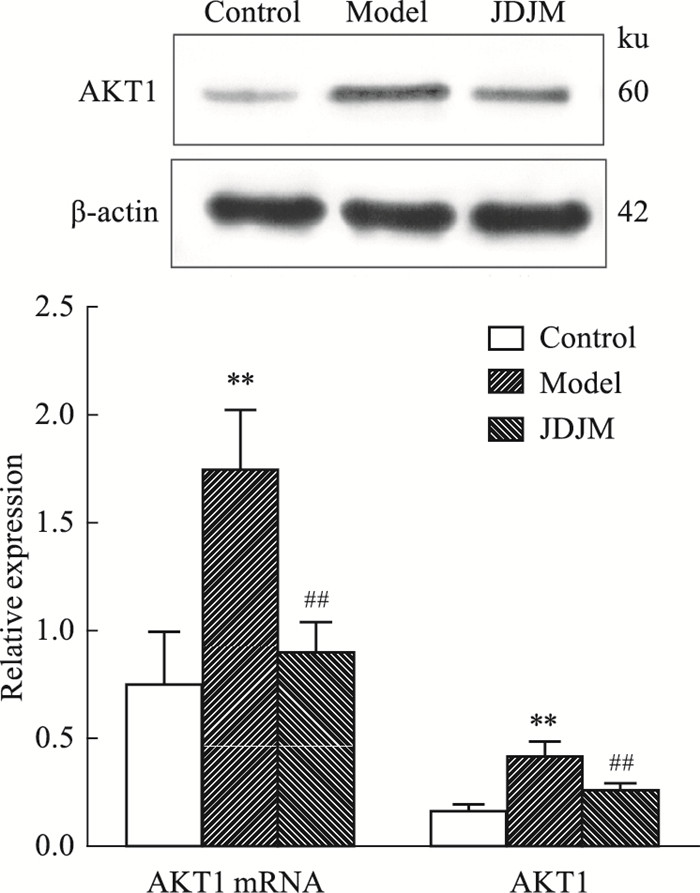
|
| Fig 8 Effect of JDJM on AKT1 expression(x±s, n=4) **P < 0.01 vs Control; ##P < 0.01 vs Model |
骨痹多因虚实之邪夹杂所致,而肝肾不足、正气亏虚是其发病的重要内因。独活寄生汤为治痹经方,功可补益肝肾,祛风除痹,加味独活寄生合剂在其基础上增加黄芩、木瓜、制天南星、威灵仙,使其解毒除痹、祛风除湿之效加强,可有效缓解患者疼痛等相关症状,运用于临床治疗KOA卓有成效,表现出其抗KOA的巨大潜力。本研究采用网络药理学的方法探索加味独活寄生合剂抗KOA的作用机制,并进一步对其药效进行动物实验验证。
网络药理学结果显示,槲皮素(quercetin)、山奈酚(kaempferol)、木犀草素(luteolin)可能为加味独活寄生合剂发挥主要作用的有效活性成分。槲皮素、山奈酚、木犀草素3者同属于黄酮类化合物,是植物为抵御外界胁迫而产生天然化合物,诸多研究均证实槲皮素可以通过抑制炎症相关信号通路、降低促炎性细胞因子的表达发挥保护关节软骨的作用,从而延缓OA进展[10]。山奈酚因在多种疾病治疗过程中表现出突出的抗炎和抗氧化作用而被广泛关注,其可通过抑制MAPK相关途径有效下调基质金属蛋白酶水平,在一定程度上减缓了软骨退变的程度[11]。施凤超等[12]通过实验表明,木犀草素可通过降低血液及关节液中炎症因子水平,改善Treg/Th17细胞免疫失衡达到抗骨关节炎的作用。炎症反应贯穿KOA病程的始终。关节液中的IL-1β水平可在一定程度上反映骨关节炎的病变程度,是诱导关节软骨基质分解代谢及炎症反应的主要细胞因子,在OA关节的软骨、滑液及滑膜中均可检测到表达水平升高,其生物活性复杂多样,能够作用于骨关节炎发生发展病理过程中诸多环节,加重关节的炎症程度[13];TNF-α是导致OA发病的关键细胞因子,IL-1β可通过与TNF-α的协同刺激激活多条炎症相关信号通路,诱导大量促炎因子的产生,进而导致进行性细胞外基质损伤和软骨破坏[14]。本研究采用动物实验验证,结果显示,予以加味独活寄生合剂治疗后,血清及关节液中炎症因子IL-1β、TNF-α表达水平较模型组同时出现明显降低。因此,加味独活寄生合剂很可能通过黄酮类化合物如槲皮素、山奈酚、木犀草素等关键有效成分发挥抗炎作用达到治疗KOA的目的。
为进一步探究加味独活寄生合剂作用于KOA的关键靶点,本研究构建了加味独活寄生合剂-KOA蛋白互作网络,排名第一的靶点丝氨酸/苏氨酸蛋白激酶1(AKT1)可能为其治疗KOA最重要的关键潜在靶点。软骨内骨化不仅是生理性骨骼生长的重要过程,也是骨关节炎进展过程中骨赘形成等病理表现的重要过程,AKT1在调节软骨细胞中的软骨钙化过程中发挥关键作用,降低AKT1水平可减少骨赘的形成[15],同时,AKT1也是PI3K/AKT信号通路中重要下游靶点,Pan等[16]研究报道了抑制PI3K/AKT信号通路的激活可抑制炎症和凋亡;Caspase 3和BAX是细胞凋亡过程的重要参与者和执行者,Caspase 3在OA的软骨高表达能够调节软骨细胞凋亡并破坏OA中结构和生化稳态,与OA的严重程度呈正相关[17]。本次动物实验结果表明,予以加味独活寄生合剂治疗后,中药组兔的KOA影像学严重程度较模型组明显改善,血清及关节液中Caspase 3、BAX表达水平出现明显降低,AKT1m RNA及蛋白表达水平均较模型组明显下降。因此,抑制AKT1的表达可能在使用加味独活寄生合剂治疗KOA中起关键作用,然而可能还有其他分子机制尚未探索,需要进一步研究。
通过功能富集分析可更加方便揭示和理解基因产物如何相互作用,进一步探寻加味独活寄生合剂在KOA的治疗过程中发挥的潜在作用机制。从其GO、KEGG富集分析结果可见大量与KOA有关的GO功能及KEGG通路显现出显著富集,GO富集分析中生物过程占比最多,内容主要富集于炎症反应、凋亡信号通路有关,KEGG通路主要富集TNF信号通路、HIF-1信号通路、NF-kB信号通路等。TNF信号通路在炎症反应中起显著作用,通路中的TNF-α可诱导大量炎症和分解代谢因子的产生并激活NF-κB信号通路,诱导基质金属蛋白酶的产生,加速软骨破坏[14];HIF-1信号通路可在软骨细胞处于严重缺氧环境下出现过度激活,抑制软骨细胞内能量代谢和生物合成,影响软骨细胞增殖,研究表明缺氧诱导因子参与关节软骨的退化过程,在软骨细胞存活及维持正常缺氧环境中软骨细胞的稳态中发挥重要作用[18]。以上网络药理学结果反映了在KOA疾病进展过程中诸多分子、生物过程及信号通路出现紊乱,涉及炎症、凋亡、氧化应激等信号通路表现出异常活跃状态。
综上,本研究借助网络药理学方法,初步探究得出加味独活寄生合剂治疗KOA具有多成分、多靶点、多通路的特征,动物实验验证其作用机制可能与抗炎症及抗凋亡相关。但是,本研究仍存在很多不足,动物实验只选取了少量核心靶点进行验证,未完全验证涉及的相关信号通路,这也是今后课题组团队研究的方向,将进行更加深入的动物实验及细胞实验来加以验证加味独活寄生合剂治疗膝关节骨性关节炎的作用机制,为加味独活寄生合剂的临床合理应用提供更加坚实的理论基础。
| [1] |
Wang K, Xing D, Dong S, et al. The global state of research in nonsurgical treatment of knee osteoarthritis: A bibliometric and visualized study[J]. BMC Musculoskelet Disord, 2019, 20(1): 407. doi:10.1186/s12891-019-2804-9 |
| [2] |
张永辉, 欧梁, 邝高艳, 等. 加味独活寄生合剂对膝关节骨性关节炎关节液中IL-1、NO、Sox9及CollagenⅡ的影响[J]. 中华中医药杂志, 2018, 33(8): 3710-2. Zhang Y H, Ou L, Kuang G Y, et al. Effects of Jiawei Duhuo Jisheng mixture on IL-1、NO、Sox9 and Collagen Ⅱ in synovial fluid of knee osteoarthritis[J]. Chin J Tradit Chin Med Pharm, 2018, 33(8): 3710-2. |
| [3] |
段贤春, 黄石, 彭代银, 等. 网络药理学在中药复方研究中的应用[J]. 中国药理学通报, 2020, 36(3): 303-8. Duan X C, Huang S, Peng D Y, et al. Application of network pharmacology in the study of Traditional Chinese Medicine formula[J]. Chin Pharmacol Bull, 2020, 36(3): 303-8. doi:10.3969/j.issn.1001-1978.2020.03.003 |
| [4] |
Ru J, Li P, Wang J, et al. TCMSP: A database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6: 13. doi:10.1186/1758-2946-6-13 |
| [5] |
Liu Z, Guo F, Wang Y, et al. BATMAN-TCM: A bioinformatics analysis tool for molecular mechANism of traditional Chinese Medicine[J]. Sci Rep, 2016, 6: 21146. doi:10.1038/srep21146 |
| [6] |
Zhou Y, Zhou B, Pache L, et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets[J]. Nat Commun, 2019, 10(1): 1523. doi:10.1038/s41467-019-09234-6 |
| [7] |
Hsin K Y, Ghosh S, Kitano H. Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology[J]. PLoS One, 2013, 8(12): e83922. doi:10.1371/journal.pone.0083922 |
| [8] |
Videman T. Experimental osteoarthritis in the rabbit: Comparison of different periods of repeated immobilization[J]. Acta Orthop Scand, 1982, 53(3): 339-47. doi:10.3109/17453678208992226 |
| [9] |
Liu J W, Wu Y L, Wei W, et al. Effect of warm acupuncture combined with bone marrow mesenchymal stem cells transplantation on cartilage tissue in rabbit knee osteoarthritis[J]. Evid Based Complement Alternat Med, 2021, 2021: 5523726. |
| [10] |
于维汉, 何耀华. 槲皮素在治疗骨关节炎中作用机制的研究进展[J]. 中华骨与关节外科杂志, 2019, 12(6): 477-80. Yu W H, He Y H. Advances in the mechanism of quercetin in the treatment of osteoarthritis[J]. Chin J Bone Joint Surg, 2019, 12(6): 477-80. doi:10.3969/j.issn.2095-9958.2019.06.16 |
| [11] |
Huang X, Pan Q, Mao Z, et al. Kaempferol inhibits interleukin1β stimulated matrix metalloproteinases by suppressing the MAPK-associated ERK and p38 signaling pathways[J]. Mol Med Rep, 2018, 18(3): 2697-704. |
| [12] |
施凤超. 木犀草素抗骨关节炎的作用机制研究[D]. 苏州: 苏州大学, 2015. Shi F C. Study of the mechanism of luteolin on osteoarthritis[D]. Suzhou: Soochow Univ, 2015. |
| [13] |
McNulty A L, Rothfusz N E, Leddy H A, et al. Synovial fluid concentrations and relative potency of interleukin-1 alpha and beta in cartilage and meniscus degradation[J]. J Orthop Res, 2013, 31(7): 1039-45. doi:10.1002/jor.22334 |
| [14] |
Liao C R, Wang S N, Zhu S Y, et al. Advanced oxidation protein products increase TNF-α and IL-1β expression in chondrocytes via NADPH oxidase 4 and accelerate cartilage degeneration in osteoarthritis progression[J]. Redox Biol, 2020, 28: 101306. doi:10.1016/j.redox.2019.101306 |
| [15] |
Fukai A, Kawamura N, Saito T, et al. Akt1 in murine chondrocytes controls cartilage calcification during endochondral ossification under physiologic and pathologic conditions[J]. Arthritis Rheum, 2010, 62(3): 826-36. doi:10.1002/art.27296 |
| [16] |
Pan T, Shi X, Chen H, et al. Geniposide suppresses interleukin-1β-Induced inflammation and apoptosis in rat chondrocytes via the PI3K/Akt/NF-κB signaling pathway[J]. Inflammation, 2018, 41(2): 390-9. doi:10.1007/s10753-017-0694-2 |
| [17] |
Yassin A M, AbuBakr H O, Abdelgalil A I, et al. COL2A1 and caspase-3 as promising biomarkers for osteoarthritis prognosis in an equus asinus model[J]. Biomolecules, 2020, 10(3): 354. doi:10.3390/biom10030354 |
| [18] |
Stegen S, Laperre K, Eelen G, et al. HIF-1α metabolically controls collagen synthesis and modification in chondrocytes[J]. Nature, 2019, 565(7740): 511-5. doi:10.1038/s41586-019-0874-3 |