

2. 徐州医科大学附属医院神经外科,江苏 徐州 221002
2. Dept of Neurosurgery, The Affiliated Hospital of Xuzhou Medical University, Xuzhou Jiangsu 221002, China
胶质母细胞瘤(glioblastoma multiforme,GBM)是恶性程度最高的原发性脑肿瘤,但尽管采用手术、放疗和化疗等综合疗法,其中位生存期仍小于15个月,5年生存率低于6%[1-2]。替莫唑胺(temozolomide,TMZ)是目前GBM化疗的一线药物,能使DNA甲基化导致DNA错配修复系统失效,最终导致肿瘤细胞的死亡[3]。在GBM中存在胶质母细胞瘤干细胞(glioblastoma stem cells,GSC)亚群,GSC具有高度致瘤、自我更新和多向分化能力。GSC被认为是促使GBM发生、发展、侵袭、抗治疗和恶性复发的驱动力,对各种杀伤肿瘤细胞的理化因素不敏感。这提示抑制GSC的自我更新能力和多向分化,能够减慢肿瘤的进展[4-6]。因此,根除GSC有助于消除GBM的形成与复发,对靶向GBM的治疗非常重要。
N6-甲基酰胺(m6A)是真核生物mRNA和非编码RNA中含量最丰富的内部修饰,对RNA上m6A修饰的精确调控在各种生物和病理过程中发挥着重要作用[7-8]。m6A去甲基化酶(the fat mass and obesity-associated gene,FTO)在调控GBM恶性增殖及维持GSC干性中具有重要作用[4, 9]。FB23-2是FTO的选择性抑制剂,能发挥出良好的抗白血病作用,还可抑制白血病干细胞的自我更新能力[10]。
本研究分析了m6A去甲基化酶FTO抑制剂FB23-2对GSC活性和自我更新能力等功能的影响。
1 材料与方法 1.1 主要药品与试剂人胶质母细胞瘤干细胞GSC1和GSC2从胶质瘤组织中分离获得,U251及U87细胞均购自中国科学院上海细胞库。FB23-2(成都华田生物技术有限公司),TMZ(上海陶术生物科技有限公司,T1178),均溶于DMSO配成50 mmol·L-1母液;层黏蛋白(美国Corning公司,354232),BCA试剂盒(上海碧云天生物科技公司,P0010),细胞增殖-毒性检测试剂盒(CCK-8试剂盒,VICMED公司,VC5001L),EdU试剂盒(广州锐博生物科技有限公司,C10310-1),EGF和bFGF(美国PeproTech公司,96-AF-100-15-100,96-100-18B-100),Accutase、B27和Neurobasal培养液(美国Gibco公司,A11105-01,GB17504-044,21103-049),Annexin V-FITC/PI凋亡检测试剂盒(美国BD公司,556547)。
1.2 主要仪器多功能酶标仪(美国BioTek公司),电泳槽、电泳仪及ChemiDocTM触摸成像系统(美国Bio-rad公司),倒置显微镜(IX53)及荧光倒置显微镜(IX71+DP721)(日本Olympus公司),Facs Canto Ⅱ流式细胞仪(美国BD公司)。
1.3 方法 1.3.1 细胞培养细胞接种到含有20 μg·L-1 EGF、20 μg·L-1 bFGF、2% B27的Neurobasal培养液中,置于37 ℃ CO2培养箱培养,待GSC长成悬浮球状态,选取生长合适的GSC用于各类实验。
1.3.2 免疫荧光提前用5×104 μg·L-1的层黏蛋白包被的爬片放置在24孔板内,将干细胞接种在24孔板内,待细胞黏附在爬片后,多聚甲醛固定45 min,0.1% Triton X-100通透20 min,1% BSA封闭2 h,一抗孵育过夜,PBS洗2遍,荧光二抗避光孵育2 h,PBS洗2遍,DAPI染15 min,洗2遍后取出爬片,荧光显微镜下拍摄照片。
1.3.3 Western blot使用处于对数生长期的细胞接种6孔板内,约106个细胞,待普通细胞贴壁后收取细胞蛋白,BCA试剂盒检测蛋白浓度,配平浓度,经SDS-PAGE凝胶电泳后,转至PVDF膜上,3% BSA室温封闭2 h,一抗4 ℃摇床过夜孵育,1× TBST洗3遍,每遍10 min,二抗室温孵育2 h,1× TBST洗3遍,然后显影。
1.3.4 CCK-8实验将GSC接种于96孔板,每孔6 000个细胞,加入不同浓度的FB23-2/TMZ处理72 h后,每孔加入10 μL CCK-8工作液,混匀后避光孵育30~60 min,然后使用酶标仪检测波长450 nm处的吸光值(OD)。每组设3个重复孔。存活率/%=(实验组OD-空白对照OD)/(对照组OD-空白对照OD)×100%。
1.3.5 神经球形成实验取直径大概200 μm的细胞球的GSC,用Accutase常规消化GSC,在96孔板中以1 000个/孔的细胞数接种,每个实验组均重复3个孔,将不同浓度的FB23-2加入实验组,混匀培养,每3 d添加50 μL新鲜培养基,继续培养至7~10 d,本实验重复3次。
1.3.6 EdU参入实验将干细胞接种于用5×104 μg·L-1的层黏蛋白包被的96孔板内,待细胞贴壁后,加入不同浓度的FB23-2。培养72 h后,用EdU培养基(50 μmol·L-1)孵育2 h,再使用4%多聚甲醛的PBS固定30 min,PBS清洗后,用0.5%的Triton X-100处理10 min。PBS清洗后,用1×ApolloⓇ反应液避光孵育30 min,DAPI染色15 min。PBS清洗3次,最后1次液体留在孔内,在荧光显微镜下拍照。
1.3.7 流式细胞术检测细胞凋亡取直径大概200 μm的细胞球,用Accutase常规消化,在6孔板中以每孔约1×105个细胞接种,将0.1% DMSO加入对照组,实验组加入不同浓度的FB23-2药物,混匀培养,培养72 h后收集细胞,用冰PBS洗涤细胞两次,用Annexin V-FITC/PI凋亡检测试剂盒染色。流式细胞仪检测并用流式细胞软件分析细胞凋亡比例。
1.4 统计学分析实验结果采用统计软件GraphPad Prism 8.0进行统计学处理。图片采用ImageJ进行处理,数据以x±s表示,多组比较宜先用方差分析,两样本比较采用独立样本t检验。
2 结果 2.1 GSC鉴定及FTO的表达量检测CD133和Nestin是鉴定GSC的分子标志物。如Fig 1A所示,GSC1和GSC2均稳定表达CD133和Nestin两种干细胞标记物。同时,我们检测了FTO在不同细胞株内的表达情况,Fig 1B显示,FTO在不同细胞株表达量不同,相对于U251和U87细胞,在GSC细胞内表达更高。说明FTO在GSC中表达较高,可能是潜在的治疗靶点。

|
| Fig 1 GSC identification and FTO expression in cells A: The expression of CD133 and Nestin was detected by immunofluorescence assay. B: The expression level of FTO in GSC1, GSC2, U251 and U87 cells. |
为评估FTO抑制剂FB23-2对胶质瘤干细胞活性的影响,我们使用CCK-8法检测不同浓度FB23-2及TMZ处理后GSC1、GSC2的细胞活性,如Fig 2结果显示,GSC对TMZ的敏感性不同,GSC1明显耐药,而GSC2较为敏感;而FB23-2能够有效抑制两种GSC的活性,且呈浓度依赖性抑制,其IC50分别为7.11 μmol·L-1和4.63 μmol·L-1。
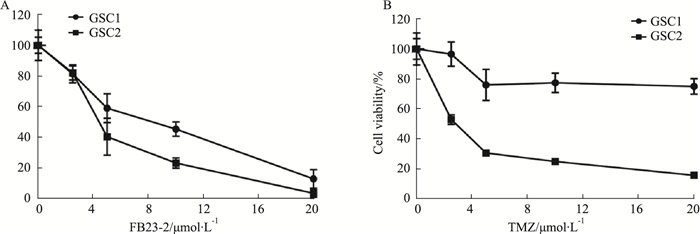
|
| Fig 2 The inhibitory effect of FB23-2 on GSC activity Cell viability was detected after 72 hours of drug treatment. A: Cell viability after FB23-2 treatment was detected by CCK-8 method. B: Cell viability after TMZ treatment was detected by CCK-8 method. |
FB23-2/TMZ(4、8 μmol·L-1)处理GSC 7 d后,倒置显微镜下观察神经球的形成情况。如Fig 3显示,与对照组相比,TMZ对GSC1成球能力的抑制不明显,但能抑制GSC2神经球的大小和数量;而FB23-2处理组的两种GSC神经球的大小和数量较对照组明显减少。这表明FB23-2能明显抑制胶质瘤干细胞神经球形成能力。
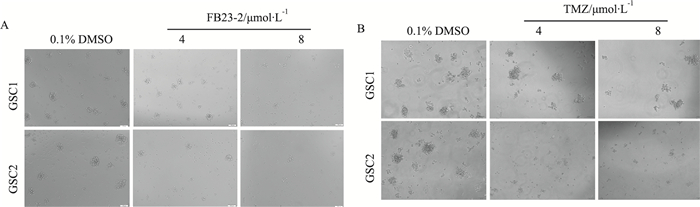
|
| Fig 3 The effect of FB23-2/TMZ on GSC neural sphere formation detected by sphere formation assay(10×) A: Effect of 4 or 8 μmol·L-1 FB23-2 on sphere formation of GSC. B: Effect of 4 or 8 μmol·L-1 TMZ on sphere formation of GSC (Scale bar=100 μm). |
为进一步评估FB23-2对GSC自我更新的影响,我们采取体外有限稀释实验法检测GSC的自我更新能力。在2、4、8 μmol·L-1浓度的FB23-2处理7 d后,如Fig 4显示,FB23-2处理组的细胞自我更新能力较对照组显著降低,且呈浓度依赖性。

|
| Fig 4 Inhibition of GSC self-renewal by FB23-2 analyzed by limited dilution assay in vitro The self-renewal ability of GSC1 after different concentrations of FB23-2 treatment for 7 days was tested by limited dilution assay in vitro. (**P < 0.01 vs Control group) |
为评估FB23-2对GSC增殖的影响,我们使用EdU掺入增殖实验显示对细胞增殖能力的影响。如Fig 5所示,FB23-2(4、8 μmol·L-1)处理72 h后,荧光显微观察显示,对EdU阳性细胞进行计数,处理组分别为(70.59±13.74)%和(50.33±4.53)%。因此,FB23-2可以明显抑制胶质瘤干细胞的增殖活性,而且呈剂量依赖性。

|
| Fig 5 Inhibition of GSC proliferation by FB23-2 by EdU method (10×) The EdU method showed that the inhibited proliferation of GSC1 cells after 4 μmol·L-1 and 8 μmol·L-1 FB23-2 treatment for 72 hours. (Scale bar=100 μm.) |
为评估GSC的凋亡是否受到FB23-2影响,采用流式细胞术检测4、8 μmol·L-1处理72 h后的GSC。如Fig 6显示,处理组细胞的凋亡率分别为(12.16±1.90)%、(16.77±1.17)%,这表明FB23-2可诱导GSC的凋亡。
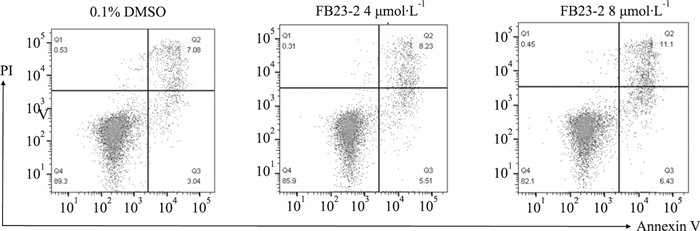
|
| Fig 6 Effect of FB23-2 on GSC apoptosis analyzed by flow cytometry Flow cytometry was used to detect the apoptosis of GSC1 cells after 4 μmol·L-1 and 8 μmol·L-1 FB23-3 treatment for 72 hours. |
GBM是侵袭性最强的脑恶性肿瘤,但目前依然缺乏有效的治疗措施[11-12]。目前认为,胶质瘤干细胞的自我更新和无限增殖与肿瘤治疗的化疗耐药密切相关的因素之一,耐药已经成为目前肿瘤化疗的难题[13-14]。因此,亟需新型小分子靶向药物来提高GBM治疗疗效。在本研究中,我们证明FTO抑制剂FB23-2可调控GSC的细胞活性、成球、自我更新、增殖、以及凋亡功能。
m6A是真核生物中最丰富的内部mRNA修饰,能够影响各种生物过程,在控制胚胎干细胞多能性和分化中发挥重要的作用[15]。m6A甲基化与包括肿瘤在内的多种疾病的发生密切相关,临床数据分析显示与预后和治疗策略的制定也紧密相关[16]。m6A甲基化修饰主要是由一个甲基转移酶复合物来催化,该复合物包含甲基转移酶样3(METTL3)、甲基转移酶样14(METTL14)和Wilm肿瘤-1相关蛋白(WTAP)。METTL3或METTL14表达的敲除降低m6A mRNA水平,促进GSC在体外的生长和自我更新,促进GSC在体内形成脑肿瘤的能力,过表达METTL3或METTL14或抑制FTO能明显抑制肿瘤进展并延长GSC移植小鼠的寿命[4, 17]。
FTO被鉴定为第一个使mRNA中的m6A氧化去甲基化的RNA去甲基化酶,参与各种疾病过程[17]。GSC有独特的m6A RNA甲基化模式,以及对这种细胞状态特异性甲基化模式的翻译反应有明显的差异;FTO识别结合m6A靶标后RNA甲基化峰值丢失,能提高其翻译效率[18]。FTO抑制剂FB23-2可通过MYC、CEBPA、RARA和ASB2等FTO下游靶点,显著抑制白血病干细胞的自我更新能力,表明FTO可能是白血病干细胞中一个潜在的分子靶点,以抑制白血病的发生[10]。本研究表明,抑制FTO能够有效的抑制GSC的生长、自我更新以及神经球的形成,且有一定剂量依赖性。同时,FB23-2还能抑制GSC的细胞增殖,促进GSC的细胞凋亡。
综上,FB23-2作为FTO的特异性小分子靶向抑制剂,能够有效的抑制GSC的生长、自我更新、增殖及凋亡等功能。本研究为FB23-2治疗胶质母细胞瘤提供了实验基础,靶向FTO可能是清除胶质瘤干细胞的潜在策略。
( 致谢: 本实验在徐州医科大学神经外科实验室完成,感谢各位老师的帮助。)
| [1] |
汤兆奇, 王克生, 徐宏斌. 没药甾酮下调PI3K/Akt通路增强替莫唑胺抗脑胶质瘤细胞增殖作用[J]. 中国药理学通报, 2019, 35(8): 1098-103. Tang Z Q, Wang K S, Xu H B. Guggulsterone enhanced inhibitory effect of temozolomide on glioblastoma cells through PI3K/Akt pathway[J]. Chin Pharmacol Bull, 2019, 35(8): 1098-103. doi:10.3969/j.issn.1001-1978.2019.08.013 |
| [2] |
Martin D H, Bianchi E, Ben Mustapha S, et al. Glioblastoma[J]. Rev Med Liege, 2021, 76(5-6): 419-24. |
| [3] |
Kang D W, Hwang, W C, Noh Y N, et al. Phospholipase D1 inhibition sensitizes glioblastoma to temozolomide and suppresses its tumorigenicity[J]. J Pathol, 2020, 252(3): 304-16. doi:10.1002/path.5519 |
| [4] |
Cui Q, Shi H, Ye P, et al. m(6)A RNA methylation regulates the self-renewal and tumorigenesis of glioblastoma stem cells[J]. Cell Rep, 2017, 18(11): 2622-34. doi:10.1016/j.celrep.2017.02.059 |
| [5] |
Yun H S, Lee J, Kil W J, et al. The radiosensitizing effect of AZD0530 in glioblastoma and glioblastoma stem-like cells[J]. Mol Cancer Ther, 2021, 20(9): 1672-9. doi:10.1158/1535-7163.MCT-20-0883 |
| [6] |
Pelaz S G, Ollauri-Ibanez C, Lillo C, et al. Impairment of autophagic flux participates in the antitumor effects of TAT-Cx43266-283 in glioblastoma stem cells[J]. Cancers (Basel), 2021, 13(17): 4262. doi:10.3390/cancers13174262 |
| [7] |
Esteller M, Pandolfi P P. The epitranscriptome of noncoding RNAs in cancer[J]. Cancer Discov, 2017, 7(4): 359-68. doi:10.1158/2159-8290.CD-16-1292 |
| [8] |
Hsu P J, Zhu Y, Ma H, et al. Ythdc2 is an N(6)-methyladenosine binding protein that regulates mammalian spermatogenesis[J]. Cell Res, 2017, 27(9): 1115-27. doi:10.1038/cr.2017.99 |
| [9] |
Li Z, Weng H, Su R, et al. FTO Plays an oncogenic role in acute myeloid leukemia as a N(6)-methyladenosine RNA demethylase[J]. Cancer Cell, 2017, 31(1): 127-41. doi:10.1016/j.ccell.2016.11.017 |
| [10] |
Huang Y, Su R, Sheng, Y, et al. Small-Molecule targeting of oncogenic FTO demethylase in acute myeloid leukemia[J]. Cancer Cell, 2019, 35(4): 677-91. doi:10.1016/j.ccell.2019.03.006 |
| [11] |
Sun K, Du Y, Hou Y, et al. Saikosaponin D exhibits anti-leukemic activity by targeting FTO/m(6)A signaling[J]. Theranostics, 2021, 11(12): 5831-46. doi:10.7150/thno.55574 |
| [12] |
Janjua T I, Rewatkar P, Ahmed-Cox A, et al. Frontiers in the treatment of glioblastoma: Past, present and emerging[J]. Adv Drug Deliv Rev, 2021, 171: 108-38. doi:10.1016/j.addr.2021.01.012 |
| [13] |
Uddin M S, Mamun A A, Alghamdi B S, et al. Epigenetics of glioblastoma multiforme: From molecular mechanisms to therapeutic approaches[J]. Semin Cancer Biol, 2022, 83: 100-20. doi:10.1016/j.semcancer.2020.12.015 |
| [14] |
Lang F, L iu, Y, Chou F J, et al. Genotoxic therapy and resistance mechanism in gliomas[J]. Pharmacol Ther, 2021, 228: 107922. doi:10.1016/j.pharmthera.2021.107922 |
| [15] |
Gimple R C, Bhargava S, Dixit D, et al. Glioblastoma stem cells: Lessons from the tumor hierarchy in a lethal cancer[J]. Genes Dev, 2019, 33(11-12): 591-609. doi:10.1101/gad.324301.119 |
| [16] |
Roundtree I A, Evans M E, Pan T, et al. Dynamic RNA modifications in gene expression regulation[J]. Cell, 2017, 169(7): 1187-200. doi:10.1016/j.cell.2017.05.045 |
| [17] |
Chen T, Hao Y J, Zhang Y, et al. m(6)A RNA methylation is regulated by microRNAs and promotes reprogramming to pluripotency[J]. Cell Stem Cell, 2015, 16(3): 289-301. doi:10.1016/j.stem.2015.01.016 |
| [18] |
Zepecki J P, Karambizi D, Fajardo J E, et al. miRNA-mediated loss of m6A increases nascent translation in glioblastoma[J]. PLoS Genet, 2021, 17(3): e1009086. doi:10.1371/journal.pgen.1009086 |

