

2. 常州大学生物医学工程与健康科学研究院,江苏 常州 213164
2. Institute of Biomedical Engineering and Health Sciences, Changzhou University, Changzhou Jiangsu 213164, China
原发性肝细胞癌(hepatic cell carcinoma, HCC)是我国常见的恶性肿瘤之一,其发病率和死亡率都非常高。HCC的发病是由多种因素及多个步骤共同演变而来的繁杂过程,同时也受到内外环境的双重影响,但其病因及确切的分子机制尚未清楚[1]。临床上常采用手术切除、化疗、放疗等手段进行肿瘤治疗,但由于耐药和不良反应,大部分HCC治疗药物效果不佳,因此,寻找更有效的抗HCC药物迫在眉睫[2]。
丹参酮ⅡA(tanshinone ⅡA, Tan ⅡA)是中草药丹参的主要有效活性成分之一,具有多方面的药理活性,如Tan ⅡA对多种肿瘤细胞具有明显的细胞毒性作用,能够抑制肿瘤细胞的增殖活力,诱导细胞凋亡,其机制可能与抑制细胞内相关DNA合成、阻滞细胞周期过渡、激活凋亡基因以及上调原癌基因的表达水平等有关[3-4]。近年来[5-6],丹参酮调控线粒体功能也屡有报道,认为丹参酮ⅡA可引起细胞线粒体膜透性转运孔(mitochondrial permeability transition pore, MPTP)开放,释放大量活性氧,降低跨膜电位,从而诱导细胞凋亡。
MPTP是与线粒体凋亡途径有关的重要结构,由线粒体外膜的电压依从性阴离子通道、内膜的腺苷酸转运蛋白以及转位分子蛋白(translocator protein, TSPO)等共同构成[7]。TSPO调节离子通道的开放,在线粒体凋亡过程中起着关键作用[8]。但目前有关转位蛋白TSPO及线粒体途径在Tan ⅡA诱导肝癌细胞凋亡中的研究较少,本实验选用人肝癌细胞HepG2作为实验对象,观察Tan ⅡA对肿瘤细胞HepG2的作用及相关线粒体凋亡途径的调控,探讨其可能存在的作用机制,为肝癌的预防和治疗提供新的分子靶标和实验支持,为未来临床应用提供理论依据和新思路。
1 材料与方法 1.1 材料人肝癌细胞HepG2(中国科学院上海细胞库);Tan ⅡA(质量分数≥ 98%)(中国药品生物制品检定所,批号110766-200619);DMEM培养基、胰蛋白酶(美国Gibco公司,货号12100046、25200-056);新生牛血清(杭州四季青,货号22011-8612/22011-8615);荧光素酶-ATP检测试剂盒(南通碧云天,货号S0026);JC-1试剂盒(美国BD公司,货号551302);Annexin V PE/7-氨基-放线菌素D细胞凋亡检测试剂盒(北京索莱宝科技有限公司,货号CA1030);噻唑蓝MTT(美国Amresco公司,货号0793);兔抗TSPO多克隆抗体(美国CST公司,货号70358S);兔抗线粒体内细胞色素C(mitochondrial cytochrome C, Cyto C)、半胱氨酰天冬氨酸特异性蛋白酶-3(cysteinyl aspartate specific proteinase-3, caspase-3)、半胱氨酰天冬氨酸特异性蛋白酶-9(cysteinyl aspartate specific proteinase-9, caspase-9)多克隆抗体(美国Abcam公司,货号ab133504、ab32351、ab32539);鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)单克隆抗体(美国Santa Cruz公司,货号sc-47724);超敏显影液ECL(美国Millipore公司,货号WBKlS0100)。其余未注明试剂均为国产分析纯。
1.2 仪器超净台(苏州净化设备总厂);CO2细胞培养箱(上海Heal Force公司);倒置显微镜(日本Olympus公司);超纯水机(成都超纯科技有限公司);电子分析天平(德国赛多利斯公司);酶标仪、电泳仪(美国Bio-Rad公司);凝胶成像系统(南京麦高德生物科技公司);冷冻离心机(美国Thermo Fisher公司);荧光显微镜(德国Carl Zeiss公司);超声波粉碎机(新芝生物科技公司);流式细胞仪(美国BD公司)。
1.3 方法 1.3.1 细胞培养及药物处理将HepG2细胞培养于含10%新生牛血清、1×105 U·L-1青霉素和100 mg·L-1链霉素的高糖DMEM中,然后置于含5% CO2和95%空气的培养箱中,待单层细胞生长至80%后传代。实验用细胞均处于指数生长期。
1.3.2 MTT比色法检测细胞存活率将细胞按5×107 L-1密度接种于96孔板中,加入不同浓度的Tan ⅡA,使其终浓度分别为2.5、5、10 μmol·L-1,对照组中加入相应体积的溶剂。
药物处理结束后,在每孔中加入MTT(终浓度为0.5 g·L-1),37 ℃下反应4 h,弃去培养液,在每孔加入100 μL DMSO,待完全溶解后,于490 nm处测定各孔吸光度。按公式:细胞增殖抑制率/%=(1-处理组OD值/对照组OD值)×100%,计算抑制率。
1.3.3 细胞形态学检测用终浓度为2.5、5、10 μmol·L-1的Tan ⅡA处理HepG2细胞24 h后,将培养皿置于普通光学倒置显微镜下,记录细胞形态和变化并拍照。
1.3.4 细胞凋亡检测药物作用24 h后,加入Hoechst 33342染色液于室温下反应5 min,用荧光酶标仪检测荧光强度,在倒置显微镜下观察细胞的核变化,并计算细胞核凋亡小体的数量。
同时,将细胞离心重悬于100 μL的缓冲液中,分别加入5 μL Annexin-V-PE和7-氨基-放线菌素D荧光染料,避光孵育15 min,用流式细胞仪检测细胞凋亡率。
1.3.5 荧光素酶发光法检测ATP的生成加入ATP裂解液进行细胞裂解,收集细胞裂解液,置于冷冻离心机中离心10 min,取上清液,加入100 μL/孔的ATP检测试剂,常温下反应2~3 min后放于化学发光酶标仪上检测细胞荧光强度,同时测定各组ATP浓度和蛋白含量,计算每毫克蛋白中ATP的量。
1.3.6 Clark氧电极法检测细胞耗氧率将细胞悬液收集于离心管中,在37 ℃记录每组细胞的耗氧率[nmol · (min · mL)-1]的变化。根据各组细胞耗氧率和细胞密度分别计算细胞耗氧率[nmol O2 · (min · 104细胞)-1]。
1.3.7 JC-1染色检测线粒体膜电位以每孔4×103个密度将细胞接种于24孔培养板中,药物处理24 h结束后,加入2.5 mg·L-1的JC-1染色工作液,37 ℃负载探针40 min,PBS洗涤2次后,倒置荧光显微镜观察并拍照,同时用荧光酶标仪检测和记录线粒膜电位的变化。
1.3.8 细胞内TSPO的表达定位检测将HepG2细胞接种于放置玻璃片的培养皿中,用冰甲醇固定细胞,0.3% Triton X-100透化,羊血清封闭半小时后,滴加抗TSPO抗体(1 ∶300),4 ℃摇床反应过夜;后加入Cy3标记的二抗(1 ∶600)常温下避光反应1 h,加入Hoechst 33258染液于室温下染色10 min,置荧光显微镜下观察。
1.3.9 细胞TSPO、Cyto C、caspase-3、caspase-9蛋白的表达检测HepG2细胞经不同浓度Tan ⅡA处理24 h后,收集细胞,提取总蛋白并测定蛋白浓度。各组按比例以30 μg总蛋白上样,电泳分离后转膜,脱脂奶粉封闭后加入TSPO(1 ∶1 000)、Cyto C(1 ∶1 000)、caspase-3(1 ∶1 000)、caspase-9(1 ∶1 000)和GAPDH(1 ∶7 000)抗体,于4 ℃反应过夜。PBS洗涤后,将膜和对应的二抗(1 ∶5 000)在常温下孵育1 h,洗涤后加入显影剂并在凝胶成像系统下进行拍照,以Image J软件分析各条带灰度值。以GAPDH条带灰度值作参照,进行半定量分析。
1.3.10 统计学处理数据均以x±s表示,应用SPSS 16.0统计软件进行分析,多组间均数采用单因素方差分析,两组间比较用Bonferroni检验法。
2 结果 2.1 Tan ⅡA对HepG2细胞形态及增殖的影响如Fig 1A所示,对照组中HepG2细胞形态完整且饱满,2.5 μmol·L-1的Tan ⅡA处理24 h后,HepG2细胞数量减少,并开始出现死亡;而10 μmol·L-1 Tan ⅡA处理过的HepG2细胞形态发生明显变化,细胞胞体皱缩成圆形,细胞数量明显减少。
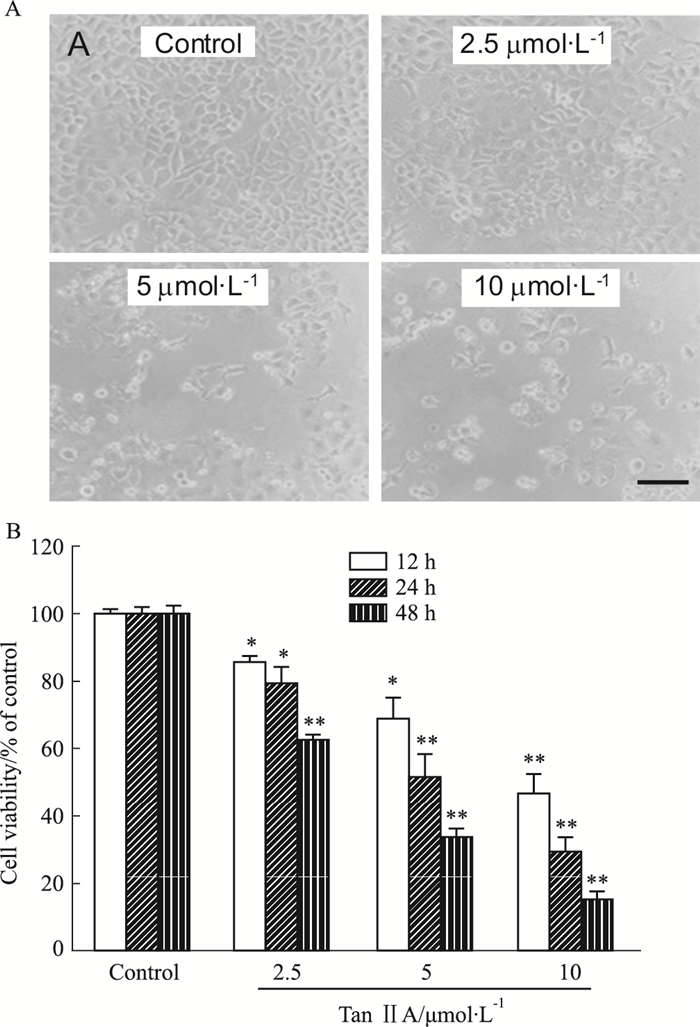
|
| Fig 1 Treatment with Tan ⅡA induced cell death and morphological changes of HepG2 cells(n=5) A: Representative micrographs showed that HepG2 cells exhibited decreased cellular processes and cell viability after the treatment with Tan ⅡA for 24 h. Scale Bar = 20 μm; B: After the treatment with Tan ⅡA for 12 h, 24 h, 48 h, the viability of HepG2 cells was significantly reduced, *P < 0.05, **P < 0.01 vs control Group. |
以终浓度为2.5、5、10 μmol·L-1的Tan ⅡA作用于HepG2细胞12 h、24 h和48 h后,如Fig 1B所示,2.5 μmol·L-1的Tan ⅡA即能引起细胞损伤,10 μmol·L-1的Tan ⅡA抑制率达到70.26%,说明Tan ⅡA可抑制HepG2细胞的增殖,并且具有时间-浓度梯度依赖性。经计算,不同浓度的Tan ⅡA作用HepG2细胞24 h,引起细胞损伤的的IC50为(5.8±1.83) μmol·L-1。
2.2 Tan ⅡA对HepG2细胞凋亡的影响Hoechst 33342是一种常用于检测细胞凋亡的荧光染料。细胞膜在正常情况下常保持完整性,荧光染料极少能透过细胞膜,因此只能产生微弱的蓝色荧光;而当细胞发生凋亡时,细胞膜的通透性会随之增强,从而进入膜内里的荧光染料逐渐增多,因此凋亡细胞的荧光强度要比正常细胞明显。如Fig 2A所示,不同浓度的Tan ⅡA处理细胞24 h后,对照组中的HepG2细胞核凋亡小体较少,呈现出相对较弱的蓝色荧光,5 μmol·L-1的Tan ⅡA导致HepG2细胞的胞核皱缩碎裂,出现较多凋亡小体,蓝色荧光加强;而10 μmol·L-1的Tan ⅡA则导致大量细胞出现凋亡,蓝色荧光进一步增强。
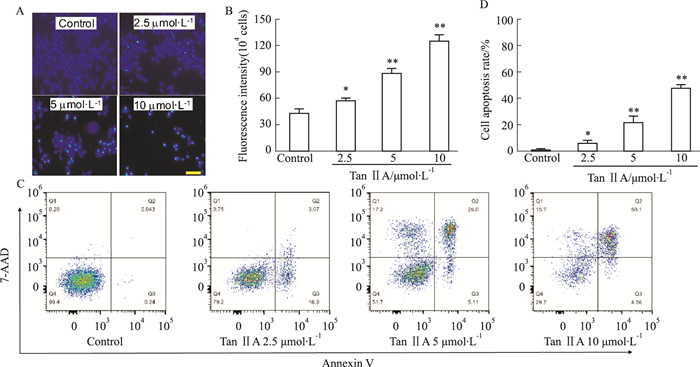
|
| Fig 2 Tan ⅡA induced cell apoptosis in HepG2 cells(n=4) After the treatment with Tan ⅡA for 24 h, the HepG2 cell apoptosis was determined by Hoechst 33342 staining and flow cytometry. A: Representative micrographs showing cell apoptosis in HepG2 cells. Scale bar = 20 μm; B: The increased ratio of condensed nuclei of the cells; C: Representative flow cytometry dot plots showing the induction of cell apoptosis in the Tan ⅡA-treated cells after labelling with annexin V-PE and 7-amino-actinomycin D; D: The quantification of apoptotic ratio determined by flow cytometry. *P < 0.05, **P < 0.01 vs Control group. |
以Tan ⅡA处理HepG2细胞24 h后,将细胞以Annexin V PE/7-氨基放线菌染色,经流式细胞仪检测细胞凋亡率,结果如Fig 2C所示,对照组细胞凋亡率为(0.88±0.83)%,终浓度为2.5、5、10 μmol·L-1的Tan ⅡA处理后,细胞凋亡率分别为(5.34±2.38)%、(20.85±5.40)%和(47.04±3.11)%,表明Tan ⅡA可诱导HepG2细胞凋亡,且呈浓度依赖性。
2.3 Tan ⅡA对HepG2细胞ATP含量及耗氧率的影响荧光素-荧光素酶法检测细胞中ATP的含量,结果如Fig 3A所示,与对照组相比,2.5~10 μmol·L-1浓度Tan ⅡA能明显降低HepG2细胞中的ATP水平;用Clark氧电极检测各组HepG2细胞的耗氧率。结果如Fig 3B所示,与空白对照组相比,Tan ⅡA(5~10 μmol·L-1)作用于HepG2细胞24 h后,细胞耗氧率明显降低,且随着Tan ⅡA浓度的增加,HepG2细胞耗氧率不断降低。

|
| Fig 3 Tan ⅡA inhibited ATP production and decreased oxygen consumption rate in HepG2 cells(n=5) After challenge with Tan ⅡA for 24 h, the intracellular ATP levels and oxygen consumption rate of the cells were determined. A: Tan ⅡA reduced ATP production in a concentration-dependent manner; B: The decreased oxygen consumption rate of the cells after Tan ⅡA treatment. *P < 0.05, **P < 0.01 vs Control group. |
JC-1染色法检测结果如Fig 4所示,对照组JC-1呈聚合体形式存在于细胞中,表明细胞的线粒体膜电位比较高。当不同终浓度的Tan ⅡA作用于HepG2细胞后,图中JC-1的红色荧光逐渐减弱,绿色荧光随JC-1的单体增多而逐渐增强,说明细胞线粒体膜电位的降低呈剂量依赖性;从定量结果中分析发现,各浓度Tan ⅡA处理后,细胞中线粒体膜电位也随之下降,尤其10 μmol·L-1的Tan ⅡA处理后线粒体膜电位下降明显。
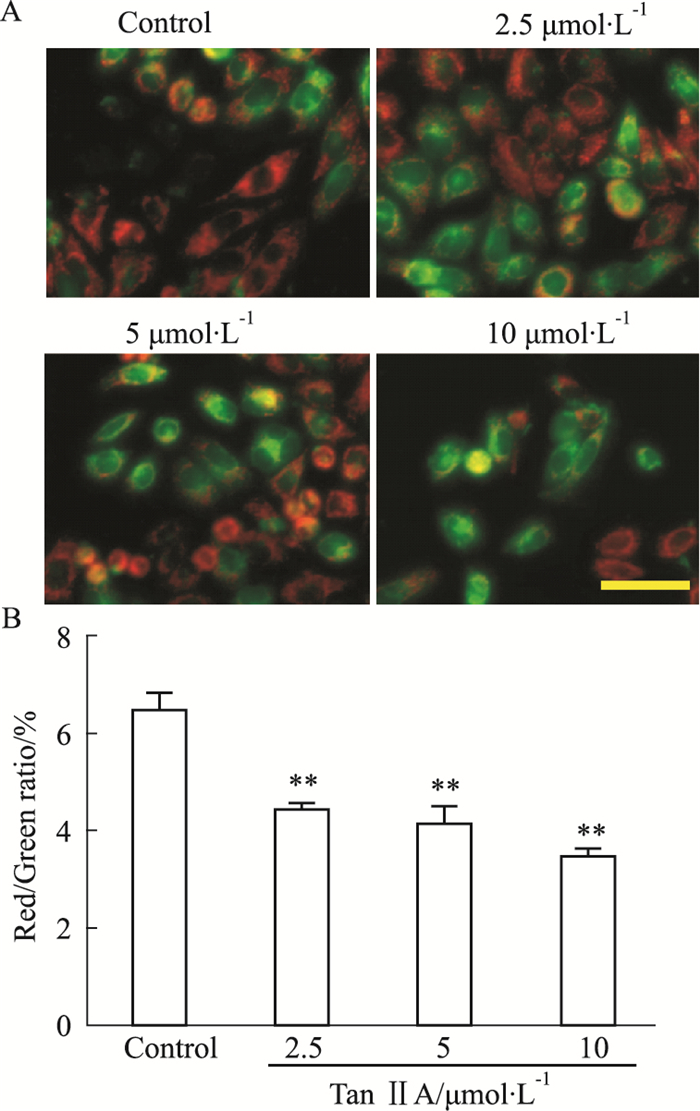
|
| Fig 4 Tan ⅡA decreased mitochondrial membrane potential in HepG2 cells(n=4) After the treatment with Tan ⅡA for 24 h, the mitochondrial membrane potential of the HepG2 cells significantly decreased. The fluorescence intensity ratio (Red/Green) was reduced. Scale bar = 50 μm. **P < 0.01 vs Control group. |
免疫荧光染色可准确检测TSPO在细胞内的表达位置。如Fig 5所示,在正常细胞中,TSPO几乎不表达;2.5~5 μmol ·L-1的Tan ⅡA处理HepG2细胞24 h后,细胞内TSPO出现表达;经10 μmol·L-1的Tan ⅡA处理后,细胞核内TSPO的表达明显增加,表明Tan ⅡA可诱导HepG2细胞TSPO的表达,并且使TSPO进入细胞核内。
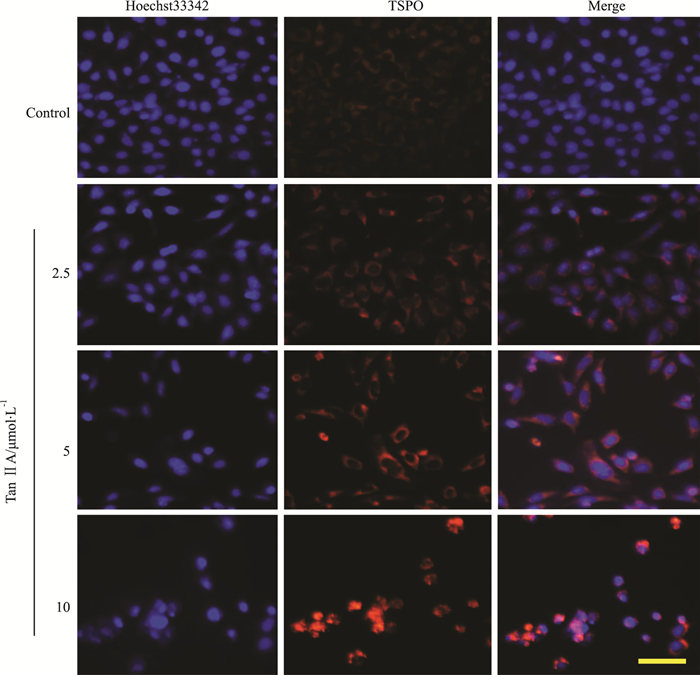
|
| Fig 5 Tan ⅡA induced nucleic TSPO expression in HepG2 cells HepG2 cells exhibited induced accumulation of TSPO in the nuclei after the treatment with Tan ⅡA for 24 h. Scale bar = 100 μm. |
采用免疫印迹法检测Tan ⅡA对HepG2细胞中TSPO、Cyto C、caspase-3、caspase-9的蛋白表达。如Fig 6所示,与对照组相比,HepG2细胞经不同浓度(2.5~10 μmol·L-1)Tan ⅡA处理后,细胞内TSPO、Cyto C、caspase-3以及caspase-9蛋白的表达水平随Tan ⅡA剂量的增加而明显上调。
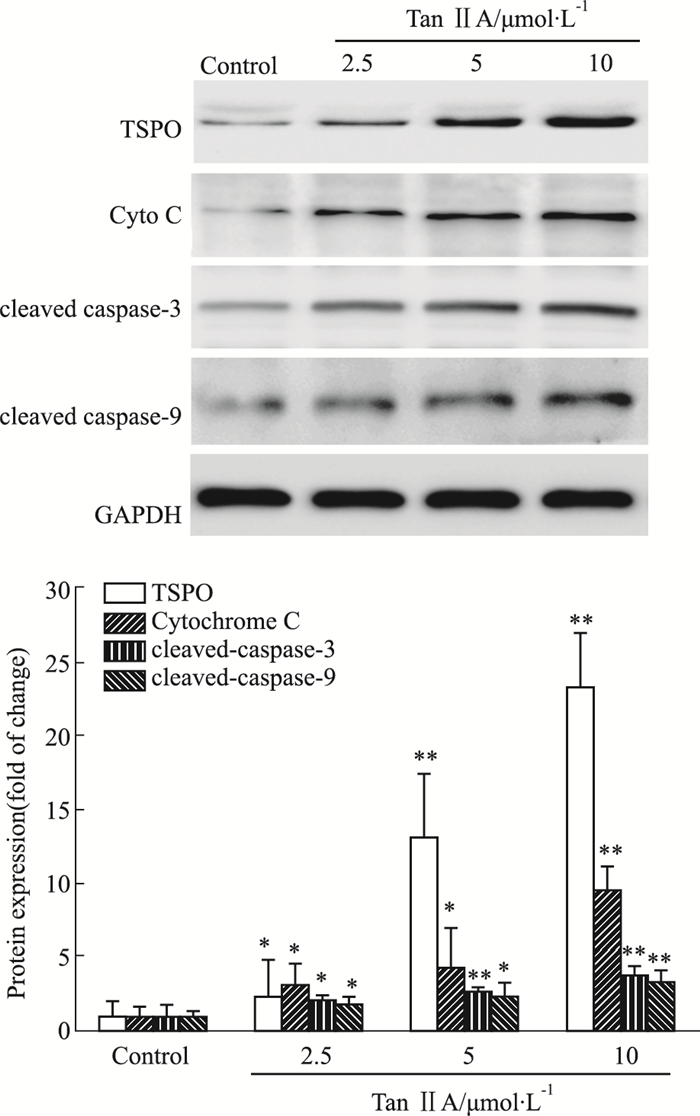
|
| Fig 6 Tan ⅡA induced expressions of TSPO, Cyto C, caspase-3, caspase-9 in HepG2 cells(n=4) After the challenge with Tan ⅡA in HepG2 cells for 24 h, the expression levels of TSPO, Cytochrome C, caspase-3, caspase-9 were determined by immunoblotting. Tan ⅡA induced the expressions of TSPO, Cytochrome C, caspase-3, caspase-9. *P < 0.05, **P < 0.01 vs Control group. |
中药提取物Tan ⅡA是从丹参中提取的脂溶性菲醌类化合物,具有多种药理学作用,如Tan ⅡA可保护肝脏损伤,抑制肿瘤细胞增殖、诱导凋亡[9-10]。本研究结果显示,Tan ⅡA(2.5~10 μmol·L-1)对HepG2细胞有增殖抑制作用,并呈时间-剂量依赖性。同时,Tan ⅡA作用于HepG2细胞24 h后,细胞形态缩小,细胞发生核皱缩,流式细胞仪检测也表明Tan ⅡA可诱导细胞出现凋亡性死亡。
细胞凋亡是一种复杂的生化过程,主要经外源性和内源性两种途径发生,外源性途径常由细胞表面的死亡引发,而内源性途径则与线粒体相关。通常认为后者是细胞凋亡主要的途径[11]。线粒体功能障碍引起细胞膜电位下降,继而引发线粒体通透性转换孔(mitochondrial permeability transition pore, mPTP)开口,使Cyto C从线粒体释放到胞质中,促使caspase-9原型活化,启动半胱氨酰天冬氨酸酶从而激活下游caspase-3[12],最终导致核染色质的皱缩,基因组的片段化以及凋亡小体的产生。本实验中,Tan ⅡA(2.5~10 μmol·L-1)作用于HepG2细胞24 h后,凋亡相关蛋白caspase-9与caspase-3的表达均上调,从而促使HepG2细胞发生早期凋亡。
同时,Tan ⅡA作用于HepG2细胞24 h后,胞质中Cyto C表达上调、细胞ATP产生减少、耗氧能力降低,以及线粒体膜电位下降,表明细胞线粒体功能受损。细胞线粒体膜电位是产生ATP的前提[13-14],也是线粒体维持氧化磷酸化,保持功能正常所必需的。本实验中,随着Tan ⅡA浓度的增加,JC-1染色结果从红色到绿色荧光的转变,表明HepG2细胞膜电位下降,线粒体功能发生障碍,提示Tan ⅡA诱导HepG2细胞凋亡可能为药物抑制了线粒体功能。
TSPO主要定位于线粒体的外膜,是mPTP的主体成分,具有多种生理功能,如参与mPTP的开放、细胞凋亡与增殖调控、甾体生成、免疫应答等,其聚集于细胞核内时可导致线粒体功能障碍[15-16]。研究表明,TSPO的蛋白表达和TSPO mRNA的转录在肝癌、前列腺癌、肾癌和脑癌中显着增加,在结肠癌和肺癌中明显下降[17];而在小鼠乳腺肿瘤模型实验中,TSPO配体PK-11195可抑制肿瘤细胞的增殖,侵袭和迁移[18]。本实验中,Tan ⅡA抑制HepG2细胞增殖时,TSPO的蛋白表达提高,表明转位蛋白TSPO可能参与Tan ⅡA诱导HepG2细胞凋亡过程。
综上所述,本研究证明了Tan ⅡA可诱导HepG2细胞发生凋亡的同时,提高凋亡相关蛋白Cyto C、caspase-3、caspase-9的表达,减少细胞内ATP含量和细胞耗氧量,诱导线粒体膜电位下降,同时诱导TSPO蛋白表达,表明Tan ⅡA具有潜在的治疗肝脏肿瘤的作用,其作用机制可能与诱导细胞线粒体转位蛋白TSPO及线粒体功能障碍有关。
| [1] |
Madduru D, Ijaq J, Dhar S, et al. Systems challenges of hepatic carcinomas: a review[J]. J Clin Exp Hepatol, 2019, 9(2): 233-44. doi:10.1016/j.jceh.2018.05.002 |
| [2] |
Fraum T J, Tsai R, Rohe E, et al. Differentiation of hepatocellular carcinoma from other hepatic malignancies in patients at risk: Diagnostic performance of the liver imaging reporting and data system version 2014[J]. Radiology, 2017, 286(1): 158-72. |
| [3] |
赵丕文, 臧金凤, 陶仕英, 等. 丹参酮ⅡA抗乳腺癌T47D细胞增殖的GPER途径研究[J]. 中国药理学通报, 2015, 31(10): 1458-62. Zhao P W, Zang J F, Tao S Y, et al. Research on GPER pathway of tanshinone ⅡA in anti-proliferation of breast cancer T47D cells[J]. Chin Pharmacol Bull, 2015, 31(10): 1458-62. doi:10.3969/j.issn.1001-1978.2015.10.026 |
| [4] |
Lin C Y, Chang T W, Hsieh W H, et al. Simultaneous induction of apoptosis and necroptosis by tanshinone ⅡA in human hepatocellular carcinoma HepG2 cells[J]. Cell Death Discov, 2016, 2: 16065. doi:10.1038/cddiscovery.2016.65 |
| [5] |
Gao S, Li L, Li L, et al. Effects of the combination of tanshinone ⅡA and puerarin on cardiac function and inflammatory response in myocardial ischemia mice[J]. J Mol Cell Cardiol, 2019, 137: 59-70. doi:10.1016/j.yjmcc.2019.09.012 |
| [6] |
Huang S T, Huang C C, Huang W L, et al. Tanshinone ⅡA induces intrinsic apoptosis in osteosarcoma cells both in vivo and in vitro associated with mitochondrial dysfunction[J]. Sci Rep, 2017, 7: 40382. doi:10.1038/srep40382 |
| [7] |
Rostovtseva T, Rovini A, Jacobs D, et al. Alpha-synuclein-induced mitochondrial dysfunction: role of VDAC and membrane composition[J]. Biophys J, 2018, 114(3): 2a. |
| [8] |
Scaini G, Barichello T, Fries G R, et al. TSPO upregulation in bipolar disorder and concomitant downregulation of mitophagic proteins and NLRP3 inflammasome activation[J]. Neuropsychopharmacology, 2019, 44(7): 1291-9. doi:10.1038/s41386-018-0293-4 |
| [9] |
Ghanem A, Emara H A, Muawia S, et al. Tanshinone ⅡA synergistically enhances the antitumor activity of doxorubicin by interfering with the PI3K/AKT/mTOR pathway and inhibition of topoisomerase Ⅱ: In vitro and molecular docking studies[J]. New J Chem, 2020, 44(40): 17374-81. doi:10.1039/D0NJ04088F |
| [10] |
李晓明, 常伟, 刘浩. 丹参酮ⅡA通过调控Grp78/caspase-12通路改善小鼠内质网应激性肝损伤[J]. 中国药理学通报, 2021, 37(8): 1081-6. Li X M, Chang W, Liu H. Tanshinone ⅡA improves acute liver injury in mice by inhibiting Grp78/caspase-12 pathway[J]. Chin Pharmacol Bull, 2021, 37(8): 1081-6. doi:10.3969/j.issn.1001-1978.2021.08.009 |
| [11] |
Lopez J, Tait S W G. Mitochondrial apoptosis: killing cancer using the enemy within[J]. Br J Cancer, 2015, 112(6): 957-62. doi:10.1038/bjc.2015.85 |
| [12] |
Burke P J. Mitochondria, bioenergetics and apoptosis in cancer[J]. Trends Cancer, 2017, 3(12): 857-70. doi:10.1016/j.trecan.2017.10.006 |
| [13] |
Bonora M, Wieckowski M R, Chinopoulos C, et al. Molecular mechanisms of cell death: Central implication of ATP synthase in mitochondrial permeability transition[J]. Oncogene, 2015, 34(12): 1475. doi:10.1038/onc.2014.96 |
| [14] |
Perelman A, Wachtel C, Cohen M, et al. JC-1: Alternative excitation wavelengths facilitate mitochondrial membrane potential cytometry[J]. Cell Death Dis, 2012, 3(11): e430. doi:10.1038/cddis.2012.171 |
| [15] |
Batarseh A, Papadopoulos V. Regulation of translocator protein 18 kDa (TSPO) expression in health and disease states[J]. Mol Cell Endocrinol, 2010, 327(1-2): 1-12. doi:10.1016/j.mce.2010.06.013 |
| [16] |
Notter T, Schalbetter S M, Clifton N E, et al. Neuronal activity increases translocator protein (TSPO) levels[J]. Mol Psychiatry, 2021, 26(6): 2025-37. doi:10.1038/s41380-020-0745-1 |
| [17] |
Bhoola N, Mbita Z, Hull R, et al. Translocator protein (TSPO) as a potential biomarker in human cancers[J]. Int J Mol Sci, 2018, 19(8): 2176. doi:10.3390/ijms19082176 |
| [18] |
Mukherjee S, K Das S. Translocator protein (TSPO) in breast cancer[J]. Curr Mol Med, 2012, 12(4): 443-57. |

