

2. 中国人民解放军联勤保障部队第九四〇医院药剂科,甘肃 兰州 730050
2. Dept of Pharmacy, The 940th Hospital of Joint Logistics Support force of Chinese People′s Liberation Army, Lanzhou 730050, China
高海拔地区低压低氧的环境会造成记忆障碍、睡眠障碍、情绪障碍等与脑功能相关的影响[1-3]。低压低氧引起的记忆损伤通常与活性氧(reactive oxygen species,ROS)的产生、神经递质及调节剂水平的变化、海马神经变性等有关。目前,虽然已经充分证明不同海拔高度和持续时间对记忆功能有不同程度的损害,但却尚未开发出广泛有效的药物来改善这种损伤。目前常用的治疗高原低氧损伤的药物主要有乙酰唑胺、地塞米松等,但由于其存在副作用,不建议用于预防[4]。因此,在高原低氧条件下评估以寻找对记忆损伤有效的预防药物具有重要意义。
红景天苷是红景天属药用植物的主要活性成分,已被证实具有抗癌、抗氧化及神经保护作用[5-7]。但是对于红景天苷神经保护作用过程中所涉及的作用机制还有太多的不明确关系,其研究尚停留在实验基础阶段。在本研究中,我们旨在评估红景天苷是否能够改善高原低氧造成的小鼠记忆障碍,并进一步探讨了红景天苷是否通过减轻氧化应激损伤、调节神经递质水平及减少神经元凋亡来改善高原低氧造成的记忆损伤。
1 仪器与材料SPF级C57BL/6J小鼠,♂,体质量(20±2) g,由斯贝福(北京)生物技术有限公司提供[实验动物许可证号:SCXK(京)2019-0010]。
红景天苷(宝鸡晨光生物,批号:HS181211S1,纯度≥98%);SOD试剂盒(批号:20210819)、MDA测定试剂盒(批号:20210628)、GSH测试盒(批号:20210819)、H2O2测试盒(批号:20210625)、谷氨酸测试盒(批号:20210926)、A-CHE测试盒(批号:20210712)均购自南京建成生物工程研究所。Bax、caspase-3、Grin1抗体,辣根过氧化物酶(horse reddish peroxidase,HRP)标记二抗均购自proteintech公司。
Panlab水迷宫(深圳市瑞沃德生命科技有限公司);MDF-U2086S超低温冰箱(SANYO);3K15型4 ℃高速台式冷冻离心机(sigma);Tissuelyser-24多样品组织研磨机(上海净信实业发展有限公司);SpectraMax i3型全自动荧光酶标仪(Molecular)等。
2 方法 2.1 动物模型的建立及分组将实验小鼠随机分成平原对照组(Con组)、高原模型组(Hyp组)、红景天苷组(Sal组),每组16只。Con组和Hyp组的小鼠给予等量的灭菌注射用水,Sal组给予10 mg·kg-1的红景天苷。
适应性喂养3 d后,各组小鼠按剂量预防灌胃给药3 d后急进青海玉树巴塘全军高原环境损伤防治重点实验室(海拔4 010 m),运送途中果冻补水。抵达高原后,缺氧暴露1 d,期间继续每日按剂量给药,自由获取食水,于末次给药1 h后开始实验。平原组的小鼠与高原组同时开始实验。
2.2 Morris水迷宫行为实验Morris水迷宫由一个直径120 cm的灰色圆形水池组成,水池壁标有4个明显标记,并以此将水池分为4个象限,即第1、2、3和4象限。平台位于第1象限中间位置,水深为高出平台1 cm,水温控制在(19~21) ℃,如Fig 1所示。实验历时6 d,前5 d学习记忆训练,每天将小鼠面向池壁分别从不同象限的入水点放入水中,记录其找到平台所需的时间,即为潜伏期。如果在60 s内找不到平台,则将其引导至平台并停留10 s,潜伏期记为60 s,每日进行两次测试,计算每个训练日的平均值。d 6为正式实验,记录小鼠在没有平台的情况下游泳60 s内的潜伏期及穿越平台次数。
|
| Fig 1 Schematic diagram of Morris water maze experiment |
按照试剂盒说明书检测小鼠脑组织MDA含量、H2O2含量、GSH含量和SOD活力。
2.4 小鼠脑组织及血清神经递质的测定通过摘眼球采血留取小鼠血液标本0.5 mL,室温下静置2 h后4 500 r·min-1离心10 min获取血清。小鼠颈椎脱臼处死,获取脑组织。按照试剂盒说明书检测小鼠脑组织及血清中的谷氨酸含量及AChE活力。
2.5 小鼠脑组织HE染色及尼氏染色用多聚甲醛固定液固定小鼠脑组织,组织固定好后切片,脱蜡至水,进行苏木精-伊红染色或尼氏染色、脱水封片。
2.6 蛋白印迹法取小鼠海马体组织加入预冷的RIPA裂解液(含1% PMSF),置于冰上进行匀浆,充分研磨后继续置于冰上裂解30 min,4 ℃ 12 000 r·min-1离心10 min,取上清液。用10% SDS-PAGE凝胶在恒压条件下电泳后转至PVDF膜上,在室温下与5%脱脂牛奶孵育2 h。在4 ℃下条带与一抗孵育过夜(Bax 1 ∶1 000;caspase-3 1 ∶500;Grin1 1 ∶1 000;β-actin 1 ∶3 000)。1× TBST洗涤3次,每次10 min,并在室温下孵育二抗1 h。1× TBST洗3次,每次10 min,显影。
2.7 统计学处理使用SPSS 25.0软件进行统计学分析。结果以均数±标准差表示。组间比较采用单因素方差分析(ANOVA)。
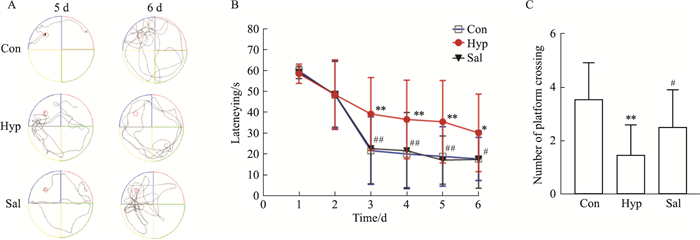
3 结果 3.1 红景天苷对小鼠学习记忆的影响Morris水迷宫实验是一项广泛用于研究学习记忆的方法,本文首先通过测试小鼠潜伏期及穿越平台次数研究小鼠学习记忆情况。结果如Fig 2所示,与Con组相比,Hyp组小鼠潜伏期从d 3开始明显增加,穿越平台次数明显下降;与Hyp组相比,Sal苷组小鼠潜伏期在d 3开始明显降低,穿越平台次数明显增加(均P < 0.05),说明红景天苷可以改善高原低氧条件下小鼠的学习记忆能力。
|
| Fig 2 The protective effect of salidroside on memory deficits in mice induced by high altitude hypoxia(n=16) A: Representative trajectories during Morris water maze training (with platform) and probe trials (without platform); B: Latencying; C: Number of platform crossing. *P < 0.05, **P < 0.01 vs Con; #P < 0.05, ##P < 0.01 vs Hyp |
高原低氧环境造成的氧化应激会对小鼠脑组织神经元造成损伤,研究结果显示,与Con组比较,Hyp组小鼠脑组织MDA和H2O2含量明显升高,GSH含量明显降低。与Hyp组比较,红景天苷能降低小鼠脑组织中MDA和H2O2含量,提高GSH含量及SOD活力,表明红景天苷可以减轻氧化应激损伤(P < 0.01),见Tab 1。
| Group | MDA (nmol·mgprot-1) | H2O2 (nmol·gprot-1) | GSH (mg·gprot-1) | SOD (U·mgprot-1) |
| Con | 9.58±0.61 | 28.00±1.57 | 7.28±1.31 | 151.22±10.89 |
| Hyp | 15.29±1.66** | 32.39±2.04** | 5.45±1.03** | 148.52±11.51 |
| Sal | 10.39±1.33## | 29.56±2.11## | 7.10±0.42## | 169.76±12.04## |
| **P < 0.01 vs Con;##P < 0.01 vs Hyp. | ||||
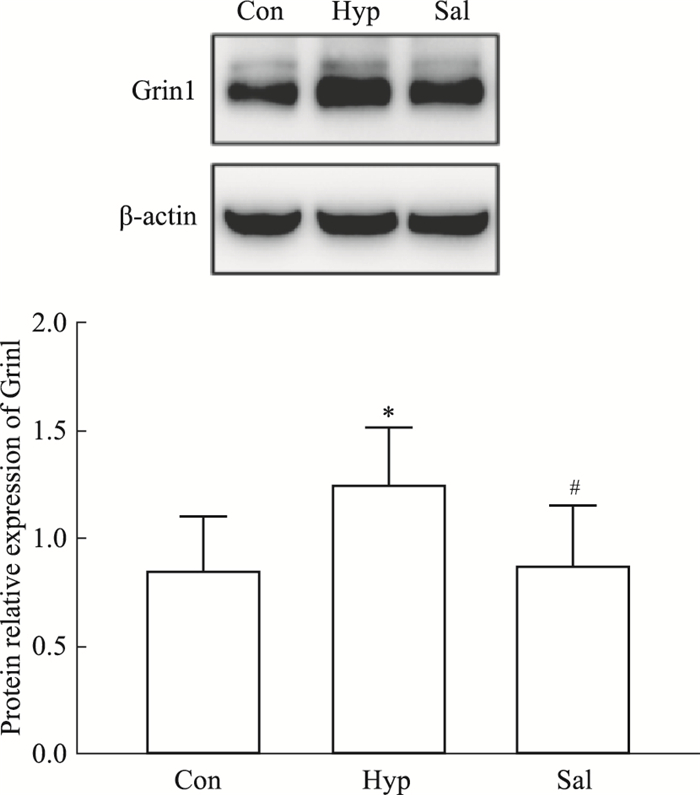
乙酰胆碱(ACh)及谷氨酸在学习记忆过程中起重要的作用,而AChE活力会直接影响乙酰胆碱的含量。本部分主要通过测定组织及血清中AChE活力及谷氨酸含量等方面来进一步评价红景天苷对低氧记忆损伤的改善作用。如Tab 2所示,与Con组比较,Hyp组小鼠脑组织和血清中乙酰胆碱酯酶活力明显升高,给予红景天苷后明显下降(P < 0.05或P < 0.01)。在Hyp组中谷氨酸含量及谷氨酸受体(Grin1)表达明显增高,红景天苷预防给药可明显降低其含量及受体的表达(P < 0.05或P < 0.01),如Fig 3所示,表明红景天苷可以通过调节神经递质水平改善小鼠的记忆能力。
| Group | Brain tissue | Serum | |||
| Glutamate (μmol·gprot-1) | A-CHE (U·mgprot-1) | Glutamate (μmol·L-1) | A-CHE (U·mL-1) | ||
| Con | 59.26±8.18 | 0.88±0.06 | 53.09±5.97 | 42.88±3.05 | |
| Hyp | 121.17±5.79** | 0.99±0.05* | 110.97±7.77** | 50.21±4.49** | |
| Sal | 76.44±9.85## | 0.87±0.17# | 51.45±7.84## | 45.76±3.30# | |
| *P < 0.05,**P < 0.01 vs Con;#P < 0.05,##P < 0.01 vs Hyp | |||||
|
| Fig 3 Effect of salidroside on expression of Grin1 in mouse hippocampus *P < 0.05 vs Con; #P < 0.05 vs Hyp |
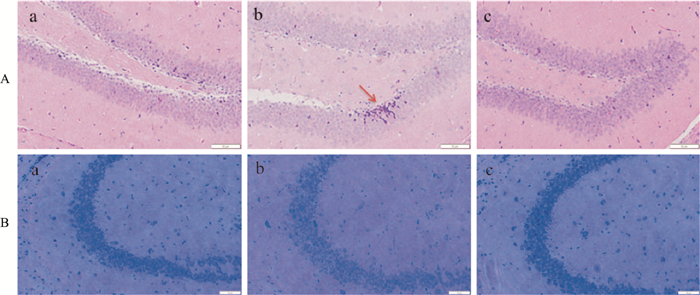
海马体是大脑中学习记忆的重要区域,尼氏小体分布于神经细胞内,当尼氏小体染色变淡甚至溶解消失时,表明神经细胞受到损伤情况。在高原低氧条件下,小鼠脑组织神经元的结构完整性会受到影响,通过HE染色观察海马神经元结构完整性,尼氏染色进一步反映神经元功能活性。由Fig 4可以看出, Con组小鼠的海马体神经元排列整齐,结构完整,核结构清晰,未出现明显病理变化(Fig 4A-a),海马体尼氏小体含量丰富(Fig 4B-a);Hyp组小鼠的海马体神经元结构受到损害,核固缩明显(Fig 4A-b),尼氏小体数量减少(Fig 4B-b);预防给予红景天苷可以缓解这些损伤(Fig 4A-c),增加尼氏小体数量(Fig 4B-c),表明红景天苷可以缓解高原低氧对小鼠脑组织神经元的损伤。
|
| Fig 4 The pathological changes in mouse brain tissues (A) HE staining of mouse brain tissue (20×), (B) Nissl staining of mouse brain tissue (20×). a: Con group; b: Hyp group; c: Sal group |
学习记忆功能障碍是由神经元受损或凋亡引起,而凋亡过程主要与Bcl-2和caspase家族相关。如Fig 5所示,与Con组比较,Hyp组小鼠海马中Bax和caspase-3含量明显升高,给予红景天苷后明显下降(P < 0.05或P < 0.01),结果表明中,在高原低氧条件下红景天苷可以抑制小鼠脑组织神经元的凋亡。
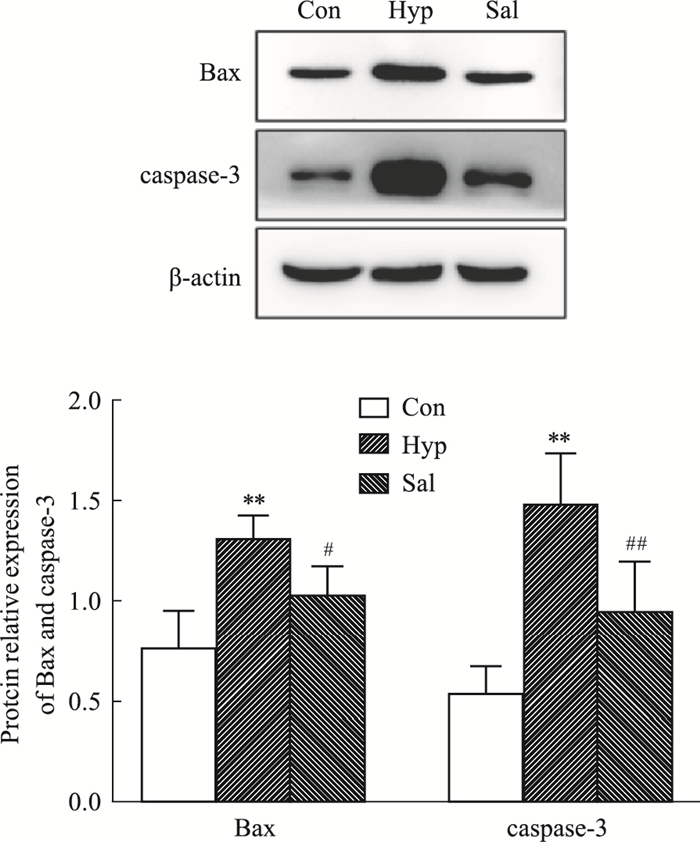
|
| Fig 5 Effects of salidroside on expression of Bax and caspase3 in mouse hippocampus **P < 0.01 vs Con; #P < 0.05, ##P < 0.01 vs Hyp. |
高原低氧会导致组织氧气供应失衡,缺氧会严重损害人类的认知和学习[8]。Morris水迷宫实验是一项公认通过动物行为学来研究学习记忆的方法,可以减少气味痕迹的干扰,被广泛用于空间学习和记忆的神经生物学和神经药理学研究。Xu等[9]用小鼠在Morris水迷宫中潜伏期及穿越平台次数等指标研究药物对认知功能的改善作用。本研究在高原低氧下进行Morris水迷宫测试,结果显示,与Hyp组相比,Sal组潜伏期明显减少,穿越平台次数明显增加,这些数据表明小鼠花费了更少的时间来寻找平台,并且在平台处多次探索,说明在高原低氧下红景天苷提高了小鼠的记忆能力。
低氧诱导的氧化应激是许多神经退行性疾病的病因。低氧环境下相关ROS生成和抗氧化保护之间的不平衡会导致生物分子的氧化损伤,其中包括H2O2等自由基。ROS会诱导脂质氧化产生MDA,造成脑组织神经细胞的损伤和凋亡,导致学习与记忆功能障碍[10]。SOD和GSH作为抗氧化剂系统可以消除体内ROS,对机体起到保护作用[11]。研究结果显示,红景天苷可以减少高原低氧条件下小鼠脑组织中MDA、H2O2含量,提高GSH含量及SOD活力,表明红景天苷可以通过减轻氧化应激损伤改善小鼠记忆能力。
乙酰胆碱和谷氨酸与神经元信息传递、营养发育和学习记忆等过程有着紧密的联系。神经递质的水平会影响神经元的功能,包括神经递质的含量及参与神经递质释放过程的分子和靶标。乙酰胆碱是与学习、记忆密切相关的重要中枢胆碱能神经递质,海马中ACh水平的降低能够引起学习记忆障碍[12],含量水平与AChE活性相关。正常生理状态下,AChE能够维持ACh含量的稳定,避免其对于突触后膜受体的过度刺激;病理条件下,AChE活性的异常升高,使ACh降解速度加快,从而造成含量显著降低,生物信号不能得到正常传导。另外,谷氨酸是人体内重要的神经递质,参与维系脑部的血液循环,调控人脑的功能;其在人体内属低水平游离氨基酸,含量过高(细胞毒性)引起认知功能障碍[13]。在本研究中,红景天苷可以降低小鼠脑组织和血清中的乙酰胆碱酯酶活力及谷氨酸含量,同时降低Grin1的表达,表明红景天苷可能通过调节神经递质水平改善小鼠记忆能力。
海马体是大脑中学习和记忆的重要区域,因此海马神经元的结构和功能备受关注[14]。有研究表明,急性高原缺氧下大鼠海马体严重受损,锥体细胞数量减少,色酸性凝结和神经变性[15-16]。病理实验结果表明,高原低氧条件下小鼠海马体的神经元紊乱变性甚至凋亡,给予红景天苷可以缓解神经元的损伤。缺氧环境会增加海马体中caspase-3表达的增加并诱导海马神经元的凋亡[17-18]。本研究结果显示,红景天苷可以减少促凋亡因子Bax及caspase-3的表达,表明红景天苷可以抑制神经元凋亡,保护海马神经元免受急性高原缺氧损伤。
综上所述,高原低氧条件下红景天苷可以通过减少氧化应激损伤/调节神经递质水平以及抑制神经元凋亡来减轻急性缺氧诱导的记忆障碍。因此,本研究为将红景天苷作为改善急性高原低氧下认知障碍的潜在治疗药物提供了理论基础。
| [1] |
Zhang X Y, Zhang X J, Xv J, et al. Crocin attenuates acute hypobaric hypoxia-induced cognitive deficits of rats[J]. Eur J Pharmacol, 2018, 818: 300-5. doi:10.1016/j.ejphar.2017.10.042 |
| [2] |
高蕾, 李方明, 马海林, 等. 长期高海拔暴露对高原移居大学生睡眠质量的影响[J]. 高原科学研究, 2021, 5(1): 49-55. Gao L, Li F M, Ma H L, et al. Effects of long-term exposure to high altitude on sleep qualityof college students migrated to high altitude[J]. Plateau Sci Res, 2021, 5(1): 49-55. |
| [3] |
Seo Y, Gerhart H D, Stavres J, et al. Normobaric hypoxia and submaximal exercise effects on running memory and mood state in women[J]. Aerosp Med Hum Perform, 2017, 88(7): 627-32. doi:10.3357/AMHP.4798.2017 |
| [4] |
Luks A M, McIntosh S E, Grissom C K, et al. Wilderness medical society practice guidelines for the prevention and treatment of acute altitude illness: 2014 update[J]. Wilderness Environ Med, 2014, 25(4 Suppl): S4-14. |
| [5] |
Rong L, Li Z, Leng X, et al. Salidroside induces apoptosis and protective autophagy in human gastric cancer AGS cells through the PI3K/Akt/mTOR pathway[J]. Biomed Pharmacother, 2020, 122: 109726. doi:10.1016/j.biopha.2019.109726 |
| [6] |
莫菁莲, 陈思丹, 符乃光, 等. 红景天苷介导TLR4调控小胶质细胞激活对小鼠抑郁样行为的改善作用[J]. 药物评价研究, 2021, 44(9): 1869-75. Mo Q L, Chen S D, Fu N G, et al. Salidroside improves depression-like behavior in mice through TLR4 mediated microglia activation[J]. Drug Evaluation Res, 2021, 44(9): 1869-75. |
| [7] |
Barhwal K, Das S K, Kumar A, et al. Insulin receptor A and Sirtuin 1 synergistically improve learning and spatial memory following chronic salidroside treatment during hypoxia[J]. J Neurochem, 2015, 135(2): 332-46. doi:10.1111/jnc.13225 |
| [8] |
Turner C E, Barker-Collo S L, Connell C J, et al. Acute hypoxic gas breathing severely impairs cognition and task learning in humans[J]. Physiol Behav, 2015, 142: 104-10. doi:10.1016/j.physbeh.2015.02.006 |
| [9] |
Xu Y M, Wang X C, Xu T T, et al. Kai Xin San ameliorates scopolamine-induced cognitive dysfunction[J]. Neural Regen Res, 2019, 14(5): 794-804. doi:10.4103/1673-5374.249227 |
| [10] |
Irarrazaval S, Allard C, Campodonico J, et al. Oxidative stress in acute hypobaric hypoxia[J]. High Alt Med Biol, 2017, 18(2): 128-34. doi:10.1089/ham.2016.0119 |
| [11] |
蒙萍, 景临林, 何蕾, 等. MitoQ对模拟高原缺氧大鼠脑组织的保护作用[J]. 中国药理学通报, 2019, 35(9): 1221-6. Meng P, Jing L L, He L, et al. Protective effects of MitoQ against plateau hypoxia injury on rats[J]. Chin Pharmacol Bull, 2019, 35(9): 1221-6. doi:10.3969/j.issn.1001-1978.2019.09.008 |
| [12] |
Li N, Liu C, Jing S, et al. Compound schisandra-ginseng-notoginseng-lycium extract ameliorates scopolamine-induced learning and memory disorders in mice[J]. Evid Based Complement Alternat Med, 2017, 2017: 8632016. |
| [13] |
Kumar G K. Hypoxia 3. Hypoxia and neurotransmitter synthesis[J]. Am J Physiol Cell Physiol, 2011, 300(4): C743-51. doi:10.1152/ajpcell.00019.2011 |
| [14] |
Vikbladh O M, Meager M R, King J, et al. Hippocampal contributions to model-based planning and spatial memory[J]. Neuron, 2019, 102(3): 683-93. doi:10.1016/j.neuron.2019.02.014 |
| [15] |
Guo P, Luo H, Fan Y, et al. Establishment and evaluation of an experimental animal model of high altitude cerebral edema[J]. Neurosci Lett, 2013, 547: 82-6. doi:10.1016/j.neulet.2013.05.008 |
| [16] |
Sharma D, Barhwal K K, Biswal S N, et al. Hypoxia-mediated alteration in cholesterol oxidation and raft dynamics regulates BDNF signalling and neurodegeneration in hippocampus[J]. J Neurochem, 2019, 148(2): 238-51. doi:10.1111/jnc.14609 |
| [17] |
Yacoub R, Lee K, He J C. The role of SIRT1 in diabetic kidney disease[J]. Front Endocrinol (Lausanne), 2014, 5: 166. |
| [18] |
Paladino S, Conte A, Caggiano R, et al. Nrf2 pathway in age-related neurological disorders: Insights into microRNAs[J]. Cell Physiol Biochem, 2018, 47(5): 1951-76. doi:10.1159/000491465 |

