


2. 武汉大学心血管病研究所,湖北 武汉 430060;
3. 心血管病湖北省重点实验室,湖北 武汉 430060;
4. 青海省人民医院心血管内科,青海 西宁 810007
黄从新(1951-),男,博士,主任医师,教授,博士生导师,研究方向:心律失常,通信作者,E-mail:huangcongxin@vip.163.com
 ,
LIU Tao1,2,3
,
LIU Tao1,2,3
 ,
CUI Bo1,2,3,
FAN Zhi-xing1,2,3,
ZHANG Wei1,2,3,
LUO Jun-miao1,2,3,
TANG Yan-hong1,2,3,
WU Gang1,2,3,
HUANG He1,2,3,
HUANG Cong-xin1,2,3
,
CUI Bo1,2,3,
FAN Zhi-xing1,2,3,
ZHANG Wei1,2,3,
LUO Jun-miao1,2,3,
TANG Yan-hong1,2,3,
WU Gang1,2,3,
HUANG He1,2,3,
HUANG Cong-xin1,2,3

2. Cardiovascular Research Institute, Wuhan University, Wuhan 430060, China;
3. Hubei Key Laboratory of Cardiology, Wuhan 430060, China;
4. Dept of Cardiology, Qinghai Provincial People′s Hospital, Xining 810007, China
右心衰竭(right heart failure,RHF)是多种原因导致右心室收缩和(或)舒张功能不全,进而引起心排血量下降和循环障碍的一类临床综合征,其中肺动脉高压(pulmonary arterial hypertension,PAH)为常见病因。RHF时,由于右心压力及容量负荷明显增加,引起心房重构、自主神经和内分泌失衡,导致RHF容易合并各种房性心律失常(atrial tachyarrhythmia,AT)[1]。达格列净(dapagliflozin,DAPA)是钠-葡萄糖共转运体2型抑制剂(Sodium Glucose cotransporter 2 inhibitor,SGLT2i)中的一种代表性药物,已被证明除降糖作用之外,兼有改善心功能、抗炎、抑制心律失常等多种心血管保护作用[2]。新近研究表明,SGLT2i具有降低PAH及右心室重塑,降低心衰后心律失常发生,同时可能具有抗纤维化等作用[3],而PAH后的心律失常与炎症、纤维化及心脏电重构密切相关[4]。DAPA是否能够通过抑制炎症及纤维化来改善PAH致RHF后的心房重构,降低RHF相关AT易感性目前无相关报道,其可能机制尚不清楚。本研究通过构建大鼠RHF模型,以DAPA进行干预,通过模型评估、炎症检测、心房纤维化评价,综合分析炎症及纤维化改变对模型大鼠心脏电生理特征的影响,旨在探讨DAPA对RHF大鼠AT易感性影响及可能机制,为探究DAPA的心血管保护机制做进一步的研究补充。
1 材料与方法 1.1 实验动物及分组60只♂ SD大鼠,(190~210)g,购自湖南斯莱克景达实验动物有限公司,饲养于武汉大学人民医院实验动物中心SPF级小动物房[动物使用许可证号:SYXK(鄂)2020-0027],环境温度为20~25 ℃,湿度为50%~70%,12 h明暗循环。适应性饲养5 d后称重并随机分为4组:对照组(CTL)、模型组(MCT)、模型组+低剂量DAPA干预组(MCT+LD)和模型组+高剂量DAPA干预组(MCT+HD)。CTL组给予单次生理盐水0.5 mL腹腔注射,其它3组根据既往研究给予无水酒精溶解的野百合碱(monocrotaline,MCT)单次腹腔注射(60 mg·kg-1)形成PAH,并逐渐进展成RHF[5]。造模d 2起,MCT+LD组和MCT+HD组分别接受干预药物(DAPA,1或3 mg·kg-1·d-1,批准文号:国药准字J20170040)灌胃,CTL组和MCT组给予等体积生理盐水灌胃,持续干预35 d。本实验由武汉大学动物实验伦理委员会审核并批准实施,WDRM动(福)第20201211号。
1.2 超声心动图检查大鼠称重(每组5只),以2%异氟醚麻醉,使用高频单晶探头彩色超声心动图仪(VINNO,苏州)评估大鼠心脏结构和功能。测量指标:右心室横径(RV-width)、右心室长径(RV-length)、肺动脉直径(PAD)、肺动脉加速时间(PAAT)、三尖瓣环平面收缩压偏移(TAPSE)、右心室面积变化分数(RVFAC)、左心室射血分数(LVEF)。上述心脏超声指标测量由同一位超声专业医师操作完成,结果取自5个心动周期下获得的平均值。
1.3 右心导管测量肺动脉高压(PAP)及标本取材大鼠(每组5只)以3%戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉并肝素化(400 U),将肝素盐水液冲洗的2 F聚乙烯(PE)导管连接换能器至Power Lab多道电生理记录仪并较零,Lab Chart 8.0软件同步记录体表心电图及压力波形曲线。参照既往研究方法[6],经右心导管测量并分析平均肺动脉压(mPAP)和平均右心室压(mRVP)。测压完成后,大鼠断颈处死,开胸游离心脏,经下腔静脉取血液样本2 mL,分离剪取右心房组织。血液离心制备成血清至-80 ℃冰箱冷冻保存,右心房组织以4%多聚甲醛固定并石蜡包埋。
1.4 血液学指标分析酶联免疫吸附试验(ELISA)检测血清心房脑钠肽(atrial natriuretic peptide,ANP)、高敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)、白介素-1β(interleukin-1,IL-1β)、白介素-6(interleukin-6,IL-6)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)水平,以此评估大鼠心功能及炎症反应状态。
1.5 组织学分析将右心房组织石蜡块切割成4 μm切片,常规脱蜡,采用HE染色观察右心房心肌细胞肥大情况,Masson三色染色检测右心房纤维化,并用图像分析软件(Image-pro plus 6.0)计算右心房胶原体积分数(collagen volume fraction,CVF),以此评估纤维化程度。
1.6 在体心脏电生理研究 1.6.1 右心房微电极阵列芯片记录分析大鼠(每组5只)以3%戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉,仰卧位固定连接体表心电图,气管插管后连接小动物呼吸机并给予机械通气(70次·min-1)。于左侧第三肋间隙水平开胸,然后逐层钝性分离直至暴露心脏,连接Power Lab多道电生理记录仪,Lab Chart 8.0软件同步记录体表心电图。参照既往研究方法[7],将MEA 256生理记录仪(Muti Channel Systems,Germany)记录电极片贴敷于右心房处并固定(3×3)mm,电极记录信号经过放大器放大后由Cardio 2D软件记录,进一步由Cardio 2D+软件分析右心房激动传导速度(conduction velocity,CV)。
1.6.2 心脏电生理指标测定记录分析体表心电图指标:P波时限、P波振幅、PR间期、QRS波间期、QT间期;在体心脏电生理指标:心房间传导时间(interatrial conduction time,IACT)、心房有效不应期(atrial effective refractory period at 150 ms,AERP150,S1=150 ms)、心房动作电位时程复极90%的时限(action potential duration 90%,APD90%)、AERP/APD比值、AT诱发率(atrial tachyarrhythmia inducibility,ATI)、平均AT持续时间(mean atrial tachyarrhythmia duration,MATD)。AT指左心房burst刺激,在右心房记录到的房颤、房扑或房速,且持续时间超过1 s的快速性房性心律失常。ATI为每组AT诱发成功的大鼠与该组所有大鼠的比值,MATD为每只大鼠诱发AT起始至终止出现窦性心律的时间。
1.7 统计学处理所有数据应用GraphPad prism软件(Version 8.0.2)进行统计学分析及作图。连续变量采用均数±标准差(x±s)表示,组间比较采用单因素方差分析或Tukey的多重比较检验,率的比较采用χ2检验。
2 结果 2.1 4组大鼠血流动力学及心脏结构功能评价结果Fig 1A显示了4组大鼠代表性的经胸骨旁短轴4腔心M型超声图像,Fig 1B显示了4组大鼠经右心导管测量PAP的波形图像。与CTL组相比,MCT组mPAP明显升高(18.94±2.13 mmHg vs 51.75±4.53 mmHg,P<0.05),mRVP明显升高(11.72±1.72 mmHg vs 36.77±1.90 mmHg,P<0.05)ANP水平明显升高(244.99±27.66 ng·L-1 vs 649.04±53.75 ng·L-1,P<0.05),RV-width增加(4.56±0.29 mm vs 5.84±0.16 mm,P<0.05)、RV-length增加(9.50±0.60 mm vs 11.41±0.16mm,P<0.05)、PAD增加(2.15±0.07 mm vs 3.70±0.18 mm,P<0.05)、PAAT增加(36.25±3.07 ms vs 21.4±2.41 ms,P<0.05)、Tapes增加(2.96±0.16 mm vs 2.21±0.12 mm,P<0.05)、RVFAC降低(0.45%±0.03% vs 0.27%±0.12%,P<0.05),而LVEF无统计学意义(81.3%±3.08% vs 83.42%±3.07% P>0.05),提示大鼠RHF模型造模成功。然而,经DAPA干预后,MCT+LD组mPAP较RHF组下降(40.94±3.53 mmHg vs 51.75±4.53 mmHg,P<0.05),mRVP下降(30.14±2.68 mmHg vs 36.77±1.90 mmHg,P<0.05),ANP下降(459.66±25.19 ng·L-1 vs 649.04±53.75 ng·L-1,P<0.05),其余超声指标提示右心功能有所改善,且高剂量DAPA干预较低剂量DAPA干预后右心改善效果明显(Tab 1)。
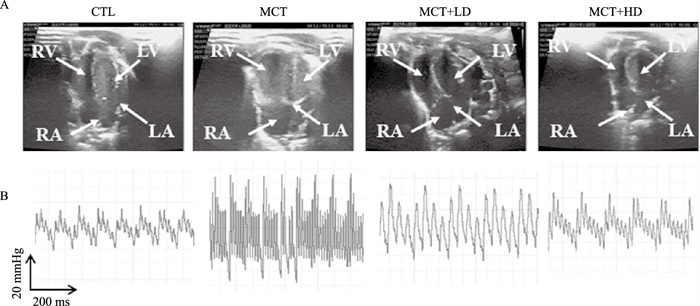
|
| Fig 1 Ultrasound and hemodynamics assessment of four groups of rats A:Representative transthoracic short-axis four-chamber heart M-mode ultrasound images of four groups of rats; B:Waveform images of PAP measured via right heart catheter in four groups of rats. 1 mmHg=0.133 kPa. |
| CTL | MCT | MCT+LD | MCT+HD | |
| mPAP/mmHg | 18.94±2.13 | 51.75±4.53* | 40.94±3.53# | 34.11±3.53#△ |
| mRVP/mmHg | 11.72±1.72 | 36.77±1.90* | 30.14±2.68# | 25.87±3.41#△ |
| ANP/ng·L-1 | 244.99±27.66 | 649.04±53.75* | 459.66±25.19# | 319.92±27.08#△ |
| RV-width/mm | 4.56±0.29 | 5.84±0.16* | 5.55±0.18 | 5.22±0.32# |
| RV-length/mm | 9.50±0.60 | 11.41±0.16* | 10.91+0.42 | 10.79±0.64 |
| PAD/mm | 2.15±0.07 | 3.70±0.18* | 3.56±0.28 | 2.65±0.14#△ |
| PAAT/ms | 36.25±3.07 | 21.4±2.41* | 25.40±3.36 | 28.20±1.92#△ |
| Tapes/mm | 2.96±0.16 | 2.21±0.12* | 2.85±0.14# | 2.82±0.10# |
| RVFAC/% | 0.45±0.03 | 0.27±0.12* | 0.38±0.04# | 0.36±0.03# |
| LVEF/% | 81.3±3.08 | 83.42±3.07 | 81.49±6.34 | 90.31±4.77 |
| mPAP:mean pulmonary arterial pressure; mRVP:mean right ventricular pressure; ANP:atrial natriuretic peptide; RV-width:right ventricular width; RV-length:right ventricular length; PAD:pulmonary arterial diameter; PAAT:pulmonary arterial flow acceleration time; Tapes:tricuspid annular systolic displacement; RVFAC:right ventricular fractional area change; LVEF:left ventricular ejection fraction. *P<0.05 vs CTL;#P<0.05 vs MCT;△P<0.05 vs MCT+LD. 1 mmHg=0.133 kPa | ||||
与CTL组相比,MCT组IL-1β(17.41±3.94 ng·L-1 vs 90.36±10.84 ng·L-1)、IL-6(16.31±3.95ng·L-1 vs 71.09±10.75 ng·L-1)、TNF-α(20.31±3.51 ng·L-1 vs 224.44±19.83 ng·L-1)、hs-CRP(3 221.57±707.84 ng·L-1 vs 11 045.6±1 835.51 ng·L-1)明显升高(全P<0.05),经DAPA干预后,MCT+LD组与MCT+HD组炎症指标IL-1β(56.26±5.40 ng·L-1 vs 38.02±4.31 ng·L-1)、IL-6(36.38±4.10 ng·L-1 vs 25.88±4.01 ng·L-1)、TNF-α(135.75±15.13 ng·L-1 vs 52.05±7.98 ng·L-1)、hs-CRP(6 295.65±464.60 ng·L-1 vs 4 483.58±441.64 ng·L-1)均下降,且下降程度与DAPA剂量相关(P<0.05)(Tab 2)。
| CTL | MCT | MCT+LD | MCT+HD | |
| IL-1β/ng·L-1) | 17.41±3.94 | 90.36±10.84* | 56.26±5.40# | 38.02±4.31#△ |
| IL-6/ng·L-1 | 16.31±3.95 | 71.09±10.75* | 36.38±4.10# | 25.88±4.01#△ |
| TNF-α/ng·L-1 | 20.31±3.51 | 224.44±19.83* | 135.75±15.13# | 52.05±7.98#△ |
| hs-CRP/ng·L-1 | 3 221.57±707.84 | 11 045.60±1835.51* | 6 295.65±464.60# | 4 483.58±441.64#△ |
| IL-1β:interleukin-1β; IL-6:interleukin-6; TNF-α:tumor necrosis factor; hs-CRP:high-sensitivity C-reactive protein. *P<0.05 vs CTL;#P<0.05 vs MCT;△P<0.05 vs MCT+LD. | ||||
Fig 2A显示了4组大鼠右心房组织HE染色及Masson三色染色示例图片及相关分析。在心房肌组织HE染色切片中,CTL组心肌横纹清晰,心肌细胞排列整齐,细胞核大小、形态基本一致,胞质染色均匀,MCT组可见心肌横纹肥大疏松,心肌细胞排列紊乱,结构破坏,部分心肌横纹消失,DAPA干预后上病理改变明显减轻,且MCT+HD组改善情况优于MCT+LD组。在心房肌组织Masson三色染色中,CTL组可见心肌细胞排列整齐,心肌细胞呈红色,几乎无蓝色标记的胶原纤维,MCT组可见心肌细胞排列紊乱,大量心肌细胞被蓝色胶原纤维包绕,MCT+LD组可见散在蓝色标记的胶原纤维,MCT+HD组蓝色标记的胶原纤维减少(Fig 2B)。右心房CVF分析提示DAPA能够改善RHF后的右心房纤维化(MCT:5.60% vs CTL:0.57%),且高剂量干预改善效果更加明显(MCT+LD:2.82% vs MCT+HD:1.56%)(P<0.05)(Fig 2C)。
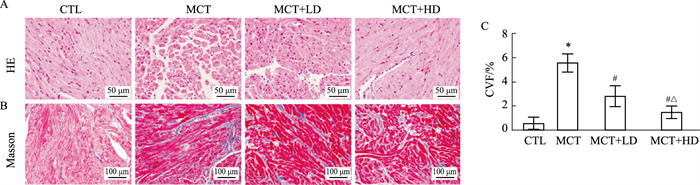
|
| Fig 2 Characteristics of histological changes and analysis of atria in four groups of rats A:Representative H-E stained image of the right atrium (×400); B:Representative Masson trichrome stained image of the right atrium (×200); C:Quantitative analysis of fibrosis in Masson trichrome stained sections. *P<0.05 vs CTL;#P<0.05 vs MCT;△P<0.05 vs MCT+LD. |
Fig 3A为微电极阵列记录右心房单向动作电位示意图。CV测量中,CTL组右心房CV较快且传导均一,MCT组CV较CTL组明显减慢且传导明显不均一(41.33 cm·s-1 vs 22.17 cm·s-1)(P<0.05),DAPA干预组CV及传导均一性改善(P<0.05),且高剂量组改善更明显(MCT+HD:31.83 cm·s-1 vs MCT+LD:26.67 cm·s-1),但高、低剂量组间CV差异无统计学意义(P>0.05)(Fig 3B)。
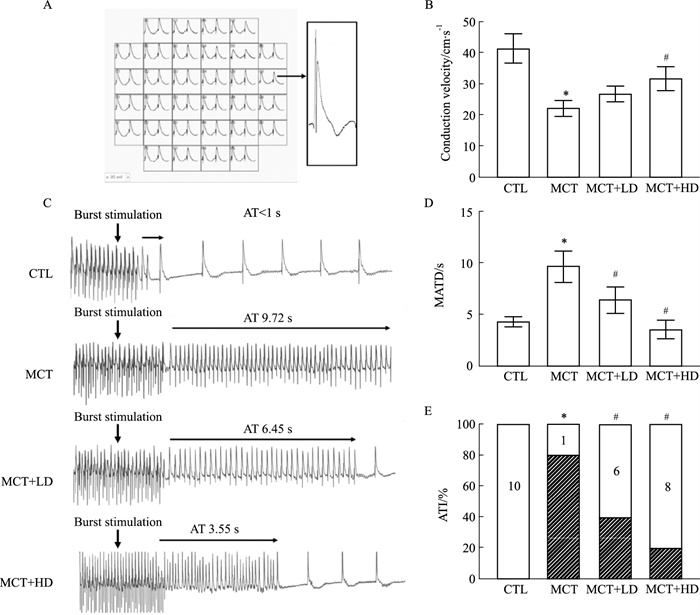
|
| Fig 3 The MEA analysis and electrophysiological characterization of four groups of rats A:Representative monophasic action potential recording maps using by MEA analysis. B:Comparison of mean atrial CVs in the four groups of rats. C:Representative AT evoked recordings in the four groups of rats. D:Comparison of MATD in the four groups of rats. E:Comparison of AT evoked rates in the four groups of rats. CV:conduction velocity; MATD:mean atrial tachyarrhythmia duration; AT:atrial tachyarrhythmia; ATI:atrial tachyarrhythmia inducibility. *P<0.05 vs CTL;#P<0.05 vs MCT. |
Tab 3汇总了4组大鼠在体电生理测定结果。与CTL组比较,MCT组QT间期延长(55.43±4.28 ms vs 91.71±3.45 ms,P<0.05)、IACT150延长(16.08±1.93 ms vs 27.42±4.27 ms,P<0.05)、AERP150延长(27.50±4.19 ms vs 40.50±3.92 ms,P<0.05)、APD90%延长(38±3.42 ms vs 47±4.38 ms,P<0.05),而HR、P波时限、PR间期、QRS波间期在4组间无统计学差异(P>0.05)。经过DAPA干预后,IACT150(27.42±4.27 ms vs 19.08±2.07 ms)、AERP150(40.50±3.92 ms vs 32.00±2.62 ms)、APD90%(47±4.38 ms vs 42±3.59 ms)(P<0.05)缩短,APD90%在不同剂量DAPA干预组间有变化趋势,但无统计学差异(MCT+LD:45±2.47 ms vs MCT+HD:42±3.59 ms)(P>0.05)。AERP/APD比值在MCT组间最低,提示AERP相对缩短,DAPA干预后该比值增加,但4组间差异无统计学意义(P>0.05)。
| CTL | MCT | MCT+LD | MCT+HD | |
| HR/bpm | 409±26 | 372±28 | 395±21 | 388±31 |
| P wave duration/ms | 16.71±1.75 | 17.34±2.32 | 17.40±4.16 | 17.36±2.83 |
| PR interval/ms | 48.31±3.21 | 51.46±2.58 | 47.49±4.02 | 45.25±3.64 |
| QRS interval/ms | 17.43±2.34 | 17.58±2.20 | 18.07±2.23 | 17.87±3.21 |
| QT interval/ms | 55.43±4.28 | 91.71±3.45* | 78.98±5.62 | 65.56±3.83# |
| IACT150/ms | 16.08±1.93 | 27.42±4.27* | 23.00±2.22# | 19.08±2.07#△ |
| AERP150/ms | 31.50±4.19 | 40.50±3.92* | 36.50±4.19# | 34.00±2.62#△ |
| APD90%150/ms | 38.35±3.42 | 51.46±4.38* | 45.32±2.47 | 42.28±3.59# |
| AERP/APD | 0.82 | 0.78 | 0.81 | 0.81 |
| IACT:interatrial conduction time; AERP:atrial effective expiration period; APD90%:action potential duration at 90% repolarization time. *P<0.05 vs CTL;#P<0.05 vs MCT;△P<0.05 vs MCT+LD. | ||||
Fig 3C为4组大鼠代表性的AT诱发图,Fig 3D为4组大鼠的MATD。CTL组未诱发出AT,MATD为0 s,而MCT组中9只诱发出AT,MATD为9.72 s(P<0.05)。经过DAPA干预后,MCT+LD组中4只诱发出AT,MATD为6.45 s(vs MCT P<0.05),MCT+HD组中2只诱发出AT,MATD为3.55 s(vs MCT P<0.05),而DAPA干预组间差异无统计学意义。进一步计算4组大鼠ATI,CTL组为0%,MCT组为80%,MCT+LD组较MCT组降低了40%,MCT+HD组ATI较MCT组降低了60%(P<0.05)(Fig 3E)。
3 讨论本实验应用MCT腹腔注射形成PAH并诱导形成RHF。MCT是双吡咯类生物碱,进入体内可引起肺血管不可逆性损伤而引起PAH,目前已广泛应用于人类PAH的替代动物模型实验用药,其方法简便可行,成功率高,重复性好[8]。既往研究表明[5],大鼠单次腹膜内注射MCT后21 d后即可形成PAH。随着PAH进展,右心压力超负荷,导致心脏出现代偿性向心性肥大,当超负荷持续存在时,出现失代偿性离心性肥大,并逐渐出现心功能不全,一般4~5周即可形成PAH后的RHF。我们实验中观察到,与CTL组相比,MCT组大鼠1周左右逐渐出现体重减轻、厌食、寒冷、毛发竖立和嗜睡等表现,5周时超声心动图、血流动力学检测提示PAP和RVP明显升高,右心扩大,取材时可见有多浆膜腔积液和肝脏、肺脏明显充血,心脏病理组织切片等提示右心肥大及纤维化病变,提示我们实验中RHF模型建立成功。
本研究发现,DAPA可以抑制心房纤维化。既往研究表明[9],心脏纤维化是大多数心肌疾病的常见病理改变,纤维化早期可能对心脏具有一定的保护作用,但长时间的纤维化通常会导致收缩和舒张功能障碍,心脏结构、电传导及兴奋性改变,另外心肌组织ERP、APD、膜上离子通道蛋白表达等也会受到纤维化的影响,形成心电传导阻滞及微折返,引起心律失常。本研究结果发现,与CTL组比较,MCT组右心房心肌细胞肥大,CVF明显高于CTL组,提示MCT组有明显纤维化改变,给予DAPA干预后,心肌细胞缩小,排列趋于整齐,纤维化指标减低,提示DAPA具有改善心房纤维化的作用,且高剂量改善作用明显。进一步电生理检查发现,MCT组右心房CV降低,ATI、MATD明显增加,然而DAPA干预能够逆转以上改变。综合以上分析,我们认为DAPA可能通过改善心房纤维化而能降低RHF大鼠AT易感性。
本研究发现,DAPA可以改善RHF大鼠炎症反应。既往研究表明[4],炎症是PAH形成的重要因素,MCT诱导的PAH大鼠模型中前一周为急性炎症期,之后炎症持续存在并进展为慢性炎症,随着后期心功能下降,炎症激活更加明显。而炎症与AT的发生密切相关,新近研究也表明,炎症具有促进心房纤维化和增加ATI的作用[10-11]。本研究结果发现,与CTL组比较,MCT组血清炎症指标明显升高,经过DAPA干预后,MCT+LD组血清IL-1β、IL-6、TNF-α、hs-CRP炎症标志物含量有所下降,MCT+HD组下降更明显,同时,DAPA干预组右心房CV升高,ATI、MATD下降,因此,推测DAPA还可能通过抑制炎症而降低RHF大鼠AT易感性。
本研究发现,DAPA改善了RHF大鼠心房电重构特征。既往研究表明[12-13],心房电重构与AT的发生和维持有关,如P波时限延长、IACT延长和AERP缩短等,其中P波时限延长和IACT延长提示心房电传导时间延长,心房易损期增加,易于发生延迟后除极及折返,进而发生心律失常。本研究结果发现,与CTL组比较,MCT组IACT150延长,ATI也增加,DAPA干预后IACT150缩短,ATI有降低趋势。同时,本研究发现,MCT组AERP和APD较CTL组延长,而ERP改变在心律失常的发生中起到关键作用,ERP缩短,折返越易于形成,进而发生心律失常。仔细分析后我们认为,RHF大鼠心房ERP和APD延长可能与纤维化和炎症激活相关,纤维化发生时成纤维细胞增殖并分化为分泌性成纤维细胞,心肌细胞被纤维组织鞘包饶,心电传导延缓,导致APD和ERP延长,此外,我们研究还发现AERP/APD比值在MCT中最低,即AERP相对缩短,然而DAPA干预后该比值增加,即AERP相对延长,可能导致干预组ATI降低,MATD缩短,即AT易感性降低,相关研究也支持我们的这一推断[14-15]。除此之外,既往研究认为[16],MCT模型大鼠心肌Cx43表达明显减低,其主要原因考虑与PAH后的心肌纤维化相关,而DAPA干预可以通过改善纤维化而起到抑制Cx43降解的作用[17],因此,我们推测DAPA还可能通过抑制Cx43降解而抑制RHF大鼠AT的发生,其具体机制有待进一步研究。
综上所述,DAPA通过抑制炎症反应和抗心房纤维化而降低PAH致RHF大鼠的AT易感性。
| [1] |
Mercurio V, Peloquin G, Bourji K I, et al. Pulmonary arterial hypertension and atrial arrhythmias:Incidence,risk factors,and clinical impact[J]. Pulm Circ, 2018, 8(2): 2045894018769874. |
| [2] |
Ni L, Yuan C, Chen G, et al. SGLT2i: Beyond the glucose-lowering effect[J]. Cardiovasc Diabetol, 2020, 19(1): 98. doi:10.1186/s12933-020-01071-y |
| [3] |
Zhang Y, Lin X, Chu Y, et al. Dapagliflozin: A sodium-glucose cotransporter 2 inhibitor, attenuates angiotensin II-induced cardiac fibrotic remodeling by regulating TGFbeta1/Smad signaling[J]. Cardiovasc Diabetol, 2021, 20(1): 121. doi:10.1186/s12933-021-01312-8 |
| [4] |
Tang C, Luo Y, Li S, et al. Characteristics of inflammation process in monocrotaline-induced pulmonary arterial hypertension in rats[J]. Biomed Pharmacother, 2021, 133: 111081. doi:10.1016/j.biopha.2020.111081 |
| [5] |
Benoist D, Stones R, Drinkhill M J, et al. Cardiac arrhythmia mechanisms in rats with heart failure induced by pulmonary hypertension[J]. Am J Physiol Heart Circ Physiol, 2012, 302(11): H2381-95. doi:10.1152/ajpheart.01084.2011 |
| [6] |
Jin H, Jiao Y, Guo L, et al. Astragaloside IV blocks monocrotalineinduced pulmonary arterial hypertension by improving inflammation and pulmonary arterial remodeling[J]. Int J Mol Med, 2021, 47(2): 595-606. |
| [7] |
Rao P, Liu Z, Duan H, et al. Pretreatment with neuregulin-1 improves cardiac electrophysiological properties in a rat model of myocardial infarction[J]. Exp Ther Med, 2019, 17(4): 3141-9. |
| [8] |
孙姝婵, 方莲花, 杜冠华. 肺动脉高压动物模型研究进展[J]. 中国药理学通报, 2020, 36(8): 1037-40. Sun S C, Fang L H, Du G H. Advances in animal models of pulmonary arterial hypertension[J]. Chin Pharmacol Bull, 2020, 36(8): 1037-40. |
| [9] |
Nguyen M N, Kiriazis H, Gao X M, et al. Cardiac fibrosis and arrhythmogenesis[J]. Compr Physiol, 2017, 7(3): 1009-49. |
| [10] |
Scott L, J r, Li N, Dobrev D. Role of inflammatory signaling in atrial fibrillation[J]. Int J Cardiol, 2019, 287: 195-200. doi:10.1016/j.ijcard.2018.10.020 |
| [11] |
Vonderlin N, Siebermair J, Kaya E, et al. Critical inflammatory mechanisms underlying arrhythmias[J]. Herz, 2019, 44(2): 121-9. doi:10.1007/s00059-019-4788-5 |
| [12] |
Nielsen J B, Kuhl J T, Pietersen A, et al. P-wave duration and the risk of atrial fibrillation: Results from the copenhagen ECG study[J]. Heart Rhythm, 2015, 12(9): 1887-95. doi:10.1016/j.hrthm.2015.04.026 |
| [13] |
Daoud E G, Bogun F, Goyal R, et al. Effect of atrial fibrillation on atrial refractoriness in humans[J]. Circulation, 1996, 94(7): 1600-6. doi:10.1161/01.CIR.94.7.1600 |
| [14] |
Tse G, Tse V, Yeo J M, et al. Atrial anti-arrhythmic effects of heptanol in langendorff-perfused mouse hearts[J]. PloS one, 2016, 11(2): e0148858. doi:10.1371/journal.pone.0148858 |
| [15] |
Costard-Jackle A, Franz M R. Frequency-dependent antiarrhythmic drug effects on postrepolarization refractoriness and ventricular conduction time in canine ventricular myocardium in vivo[J]. J Pharmacol Exp Ther, 1989, 251(1): 39-46. |
| [16] |
Tanaka Y, Takase B, Yao T, et al. Right ventricular electrical remodeling and arrhythmogenic substrate in rat pulmonary hypertension[J]. Am J Respir Cell Mol Biol, 2013, 49(3): 426-36. doi:10.1165/rcmb.2012-0089OC |
| [17] |
Lee C C, Chen W T, Chen S Y, et al. Dapagliflozin attenuates arrhythmic vulnerabilities by regulating connexin43 expression via the AMPK pathway in post-infarcted rat hearts[J]. Biochem Pharmacol, 2021, 192: 114674. doi:10.1016/j.bcp.2021.114674 |