

2. 河南中医药大学第一附属医院脾胃肝胆科,河南 郑州 450000
李素领(1962-),男,主任医师,教授,硕士生导师,研究方向:中医药防治消化系统疾病,通信作者,E-mail:hk-lsl@163.com
2. Dept of Gastroenterology, The First Affiliated Hospital of Henan University of Chinese Medicine Henan University of Chinese Medicine, Zhengzhou 450000, China
肝纤维化(hepatic fibrosis,HF)是存在于大多数慢性肝脏疾病过程中的病理变化,主要表现为肝组织内细胞外基质(extracellular matrix,ECM)的过度增生与沉积,其本质是一种可逆的肝组织损伤过度修复反应[1]。肝纤维化若未得到及时治疗及控制,可进展为肝硬化、肝癌或肝衰竭,逆转肝纤维化是防止慢性肝病进展的重要手段[2]。目前,尚未有公认特异有效的治疗肝纤维化的化学药物和生物制剂[3]。近年来,中医药抗肝纤维化的研究成为医学界关注的焦点和热点,多项研究显示,中医药在抗肝纤维化的治疗中起重要作用[4]。
黄芪,始载于《神农本草经》,为豆科植物膜荚黄芪或蒙古黄芪的干燥根,内含黄酮类化合物、皂苷类化合物、多糖类化合物和氨基酸类化合物等多种活性成分,具有调节免疫、抗炎、抗纤维化、抗肿瘤、抗糖尿病、降压等多种药理活性[5]。近年来有大量研究表明,黄芪活性成分可通过减轻肝脏炎症反应、抗氧化应激、抑制肝星状细胞活化、促进肝星状细胞凋亡、抑制肌成纤维细胞合成、减少细胞外基质合成等方面发挥抗肝纤维化的作用[6-7],但对其调控细胞信号通路的作用机制尚缺乏最新的综述。本文通过梳理黄芪及其活性成分抗肝纤维化的关键信号通路,为进一步阐明黄芪防治肝纤维化的分子机制提供理论支持,也为抗肝纤维化药物的开发提供新思路和参考。
1 肝纤维化发生机制肝脏受损后,大量的炎性细胞因子分泌,激活静息状态下的肝星状细胞(hepatic stellate cell,HSC),活化的HSC增殖,转变为表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA) 的肌成纤维细胞,大量合成如Ⅰ型胶原、Ⅲ型胶原、纤维连接蛋白等多种细胞外基质成分(extracellular matrix,ECM),致使ECM的合成与降解失衡,过量沉积在肝组织内,最终导致肝脏结构的破坏和肝纤维化的形成[8]。HSC是一种肝脏非实质性细胞,主要分布于Disse间隙内,包绕在肝窦周围,占非实质细胞总数的5%~10%,被认为是肝纤维化细胞的主要来源,HSC的激活是肝纤维化发生的中心环节,抑制HSC增殖、诱导其凋亡,从而减少ECM生成是治疗肝纤维化的重点[1],见Fig 1。
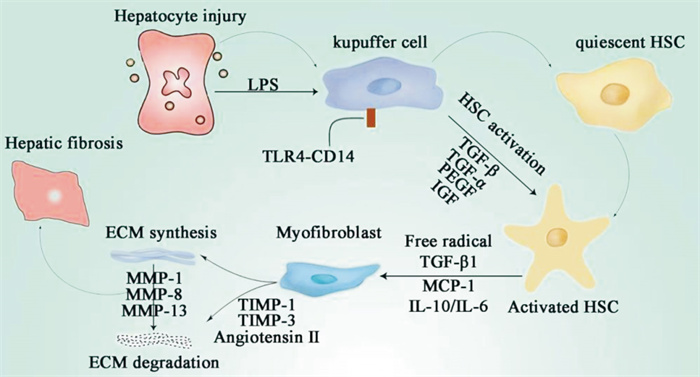
|
| Fig 1 Mechanism of hepatic fibrosis |
p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38MAPK)是MAPK家族的重要成员,转录激活因子-2 (activating transcription factor 2,ATF-2)是p38MAPK通路的重要下游因子,p38MAPK可活化AFT-2,调节相关细胞生长、分化、免疫应答、应激反应、凋亡的基因转录,影响肝纤维化的进程[9]。研究发现[10],p38MAPK可在肝纤维化进程中调节HSC的活化,HSC活化程度越高,p38MAPK磷酸化程度越高,而阻断p38MAPK信号通路后HSC活化度降低。已有研究证实,p38MAPK阻断剂SB203580在阻断P38MAPK通路后,可以降低静息HSC的蛋白表达,并可调节其细胞周期,影响肝纤维化的进程[11]。以上研究表明,p38MAPK信号通路可能通过促进HSC激活而影响HF进程,提示抑制p38MAPK信号通路可能是HF治疗的方向。
2.2 黄芪活性成分在HF中调节p38MAPK信号通路的机制MAPK激酶-3(MAPK kinase 3,MKK3)是一组具有双重磷酸化能力的蛋白激酶,是p38MAPK上游激活物,p38MAPK被磷酸化激活后诱发特定基因的表达,在肝纤维化中有重要作用。雷玲等[12]研究发现,黄芪能明显降低肝纤维化大鼠肝脏中MKK3的表达、磷酸化p38MAPK及其下游转录因子AFT-2的表达,调控p38MAPK信号传导通路上下游相关蛋白,抑制致纤维化因子的表达,抑制肝纤维化的形成。氧化应激是HSC活化、肝纤维化发生的重要影响因素,谷胱甘肽(glutathione,GSH)是丰富的抗氧化分子,在纤维化疾病中浓度降低。作为黄芪中活性较高的皂苷类成分,黄芪甲苷具有缺血性保护、抗病毒、免疫调节、抗纤维化等作用[6]。LI等[13]研究表明,黄芪甲苷通过诱导Nrf2的表达增加GSH含量,而抑制氧化应激,并参与p38MAPK磷酸化抑制,从而抑制HSC激活。林红等[14]发现,黄芪后处理可通过内源性机制激发p38MAPK信号表达,竞争性抑制Smad2/3向核内转位,阻断TGF-β1信号的转导,使I和III型胶原的表达减少,而发挥抗纤维化的作用。以上提示黄芪有效成分可通过调节p38MAPK信号通路抑制氧化应激、抑制胶原合成、抑制HSC活化而发挥抗肝纤维化作用,见Tab 1。
TGF-β1主要来源于肝实质细胞和HSC,作为目前最强的促纤维化细胞因子之一,其几乎在肝纤维化的所有关键环节都有参与。在TGF-β1信号从细胞膜受体上传导至细胞核内的过程中,Smads蛋白是关键蛋白,当TGF-β1被活化后会诱导下游Smad2、3蛋白磷酸化,与Smad4蛋白结合形成的Smad复合物与纤维化有关的靶基因结合,调控其转录与表达,影响HSC活化而促进肝纤维化的发生[15]。TGF-β1/Smads信号通路在HSC的活化与增殖、ECM的沉积及肝纤维化发生发展的过程中具有至关重要作用,是TGF-β1促纤维化作用中最经典的途径[16]。以上研究提示,TGF-β1/Smads信号通路与HF发生发展过程中多方面密切相关。
3.2 黄芪活性成分在HF中调节TGF-β1/Smads信号通路的机制黄芪多糖是黄芪中主要活性成分之一,具有免疫调节、抗动脉粥样硬化、抗纤维化等多种生物功能。黄进等[17]研究发现,黄芪多糖可对TGF-β1/Smads信号通路的传导多点调节,降低肝组织中的TGF-β1的表达,下调Smad3/4表达,保护正常肝组织的基底膜样细胞间质,修复受损肝纤维化组织,减轻肝纤维化程度。徐方明等[18]在继发性胆汁淤积性肝纤维化大鼠模型实验中发现,黄芪多糖可使肝组织TGF-β1蛋白表达量明显降低,使肝组织中羟脯氨酸(hydroxyproline,Hyp)含量明显降低,纤维组织的增生程度明显减轻,进而发挥抗继发性胆汁淤积性肝纤维化作用。毛蕊异黄酮是黄芪中的异黄酮类活性成分,具有明显的抗氧化、抗肿瘤和免疫调节等作用。任爽等[19]研究发现,毛蕊异黄酮能够抑制HSC活化,是通过抑制TGF-β1/Smads信号转导通路,减少TGF-β1、Smad2的表达,增加Smad7表达这一途径而实现的。以上提示黄芪有效成分可通过调节TGF-β1/Smads信号通路在HF的炎症反应、HSC活化、肌成纤维细胞合成、ECM沉积等过程中发挥重要作用,见Tab 2。
| Action pathway | Regulatory mechanism |
| Reduce inflammation | IL-1β,IL-6,TNF-α↓ |
| Inhibit hepatic stellate cell activation | TGF-β1,Smad2↓;Smad7↑ |
| Reduce ECM deposition | TGF-β1,Smad3,Smad4↓; Smad7↑ |
核因子-κB(nuclear factor-κB,NF-κB)是一种重要的基因转录调节因子,NF-κB通路已被证实是炎症反应和细胞免疫中的重要通路之一,NF-κB的上游分子因多种因素激活后,使IκB磷酸化并降解,激活NF-κB并移入核内在相关基因的核因子κB受体上结合,调控细胞增殖、凋亡、炎症等相关基因的转录,对肝脏的氧化应激、肝纤维化发生发展有着重要的作用[20]。研究发现,一方面NF-κB可促静止期HSC活化,当静止期HSC被激活时,NF-κB的结合活性增加,可以促进HSC活化;另一方面NF-κB可抑制活化期HSC凋亡,抑制IκBα的磷酸化会抑制NF-κB调节转录基因的表达,促使HSC的凋亡[21]。以上提示NF-κB信号通路与HF在多方面密切相关。
4.2 黄芪活性成分在HF中调节NF-κB信号通路的机制血小板衍生生长因子BB(platelet derived growth factor-BB,PDGF-BB)是一种有丝分裂原和纤维化细胞因子,可通过NF-κB信号通路有效激活HSC,进一步加剧肝纤维化。Chen等[6]研究发现,黄芪甲苷可通过调控NF-κB细胞信号通路,增加p65、p52、p50的表达,来抑制PDGF-BB诱导的HSC-T6活化,促进HSC细胞衰老和凋亡。An等[22]对黄芪中芒柄花素、异鼠李素、山柰酚、花萼素、槲皮素5种黄酮类成分抗肝纤维化的机制进行研究,发现5种成分能够通过调控NF-κB信号转导通路,调节炎症反应,来抑制TGF-β1介导的HSC活化,并降低α-SMA蛋白水平,减少ECM的沉积。骨形成蛋白和激活素跨膜抑制剂(BMP and activin membrane bound inhibitor,BAMBI)是被称为TGF-β的伪受体,可阻滞TGF-β的信号转导,影响肝纤维化的进展。蒋微[23]研究发现,黄芪总皂苷能够通过调控NF-κB信号通路,抑制HSC活化和NF-κBp65的磷酸化,降低TNF-α表达,而增加BAMBI水平来发挥抗纤维化作用。以上研究表明,黄芪有效成分通过调节NF-κB信号通路从减少炎症反应、抑制HSC活化、促进HSC衰老和凋亡及减少ECM沉积等方面作用于HF,见Tab 3。
| Action pathway | Regulatory mechanism |
| Reduce inflammation | TNF-α↓; |
| Inhibit hepatic stellate cell activation | TGF-β1,α-SMA↓;BAMBI↑ |
| Promote HSC apoptosis | NF-κBp65,p52,p50↑;PDGF-BB↓ |
| Reduce ECM deposition | TGF-β1,Col1α1,Col3α1,Acta2,Fn1↓ |
核因子过氧化物酶体增殖因子活化受体γ(peroxisome proliferator-activated receptor γ,PPARγ)属Ⅰ型核激素受体超家族成员,可通过抑制或促进NF-κB、信号转导子、转录激活子和激活蛋白-1的转录表达而对上述调控因子介导的信号通路进行干扰。Wang等[24]研究发现,PPARγ在正常肝脏的HSC中也有表达,炎症或损伤时HSC被激活,HSC的激活时PPARγ表达减少,对维持HSC静止状态,抑制HSC的活化具有重要作用。郭晏同等[25]研究表明,PPARγ转录活性的提高可能会抑制TGF-β1表达,阻断HSC中的TGF-β1自分泌环路,从而减少胶原分泌和HSC的增殖。以上均表明,PPARγ信号通路与HF发生发展中HSC活化、HSC增殖、ECM的沉积等方面密切相关。
5.2 黄芪活性成分在HF中调节PPARγ信号通路的机制肝纤维化发生发展的中心环节是HSC的活化、增殖及过度分泌,HSC激活后会诱导α-SMA的表达,α-SMA与HSC增殖、肝纤维化程度呈正相关,是判断HSC是否激活的重要标志。Dong等[26]研究表明,毛蕊异黄酮通过上调PPARγ信号转导途径,既能抑制正常HSC中α-SMA和Ⅰ型胶原的表达水平,且还能降低TGF-β1刺激下的HSC中二者mRNA的表达,抑制HSC活化而发挥抗纤维化作用。成扬等[7]研究发现,黄芪总黄酮可以上调PPARγ信号通路的表达,减轻Hyp含量,改善肝组织的胶原蛋白增生;亦可能是通过调控PPARγ信号通路和法尼酯衍生物X受体信号通路间的交互作用而抑制肝纤维化。以上研究表明,黄芪有效成分通过PPARγ信号通路抑制HSC活化、抑制胶原合成而在HF中发挥作用,见Tab 4。
| Action pathway | Regulatory mechanism |
| Inhibit hepatic stellate cell activation | ColI,α-SMA,TGF-β1↓ |
| Inhibit collagen synthesis | PPARγ↑;Hyp↓ |
Notch信号通路参与调节HSCs活化和肝纤维化发生,其中Notch3的高表达会促进HSC的活化,选择性干预Notch3的表达或许可成为治疗肝纤维化的新途径。Mu等[27]研究表明,黄芪甲苷能够显著减少Notch信号通路关键分子Notch2/3/4mRNA及蛋白表达,抑制Notch信号通路的活化,减少肝组织TGF-β1和α-SMAmRNA表达,降低肝组织中羟脯氨酸(hydroxyproline,Hyp)含量,而抑制肌成纤维细胞的活化和积聚,改善胆汁性肝纤维化程度。蛋白酶激活受体2(protease activated receptor 2,PAR2)属于G蛋白偶联受体家族,PAR2不仅可诱导肝纤维化的发生,还可激发肝脏炎症反应而加重肝脏损伤。李芬等[28]在糖尿病肝纤维化实验模型中发现,黄芪总皂苷可通过调控PAR2信号通路,下调p38MAPK、p-p38MAPK蛋白水平,降低炎症水平,改善肝纤维化程度。前列腺素E2 (prostaglandin E2,PGE2)是一种含有二十个碳原子的不饱和脂肪酸,PGE2可通过EP2/AC-cAMP途径实现抑制PDGF刺激的HSC增殖反应。刘浩[29]在免疫性肝纤维化实验模型中发现,黄芪甲苷可调节PGE2/EP2/cAMP信号转导通路,增加EP2的表达,升高细胞内cAMP的浓度,对TGF-β1诱导HSCs胶原合成的进行抑制,而发挥抗免疫性肝纤维化作用。以上提示黄芪可调控Notch、PAR2、PGE2/EP2/cAMP信号通路作用于HF,见Tab 5。
| Signaling pathway | Action pathway | Regulatory mechanism |
| Notch | Inhibits myofibroblasts synthesis | Hyp,α-SMA,TGF-β1↓;Smad7↑ |
| PAR2 | Reduce inflammation | p38MAPK,p-p38MAPK↓ |
| PGE2/EP2/cAMP | Inhibit collagen synthesis | EP2,cAMP↑;TGF-β1↓ |
细胞传导通路是一个复杂的相互作用网络,在黄芪作用于HF的通路中,一方面TGF-β1可诱导p38MAPK信号传导通路的活化;另一方面p38MAPK信号表达被激发后,会竞争性抑制Smad2/3向核内转位,阻断TGF-β1信号的转导[14]。HSC中的TGF-β1自分泌环路的阻断可受PPARγ转录的影响,PPARγ转录活性的提高可抑制TGF-β1的表达[25]。外源性PGE2可抑制HSC中COX-2基因的表达,促进PPARγ的表达,而抑制肝纤维化[30]。PPARγ可通过直接结合p50/p65亚基,来抑制NF-κB的转录和DNA合成,使NF-κB活性下降而完成抑制炎症反应;相反Notch1信号通路的激活是上调NF-κBp50/p65的表达,下调IκBα的表达,而增加NF-κB的DNA结合活性,引起下游一系列基因的活化[27]。p38MAPK信号通路的激活能激活NF-κB通路,促进其下游的细胞因子、炎症介质的转录而诱导肝纤维化发生;而PAR2信号通路被激活后,可以下调p38MAPK、p-p38MAPK蛋白水平,减轻炎症反应[28]。不同的信号传导通路之间存在相互协同或相互拮抗作用机制,黄芪的多成分可能会通过特定的细胞信息作用于多种靶细胞,与不同靶细胞的受体结合,形成相互作用网络,显示出从多靶点、多途径、多层次相互作用的机制特点,见Fig 2。
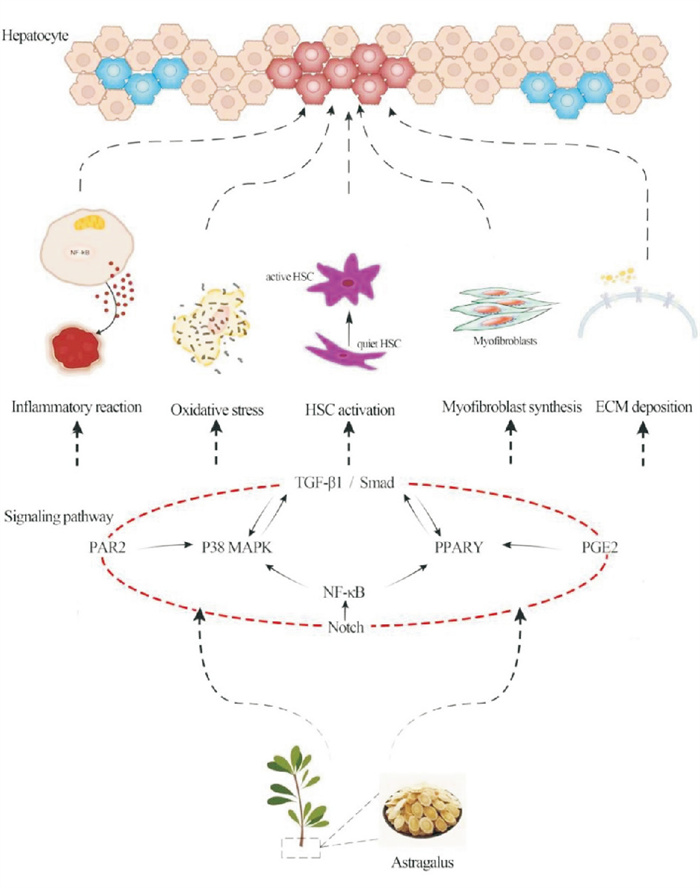
|
| Fig 2 The cellular signaling pathway mechanism of Astragalus against hepatic fibrosis |
本研究通过对黄芪活性成分治疗HF机制中所涉及到的细胞信号通路予以梳理,发现其可通过调控p38MAPK、TGF-β1/Smads、NF-κB、PPARγ、Notch、PAR2、PGE2/EP2/cAMP多条信号通路,发挥减轻肝脏炎症反应、抗氧化应激、抑制肝星状细胞活化、促进肝星状细胞凋亡、抑制肌成纤维细胞合成、减少细胞外基质合成等作用,达到防治HF的作用,显示出从多靶点、多途径、多层次相互作用的机制特点。
目前,黄芪在HF的治疗方面取得一定的进展,但黄芪活性成分治疗HF所涉及的相关信号通路的相关研究还存在一些局限性,如多数研究集中在经典通路探讨;研究所构建的肝纤维化模型比较单一,可从HF不同发病机制开展模型构建;此外,信号通路间联系机制研究不断深入,可深入剖析探索相关通路间的作用机制,把通路的相互调节、相互拮抗或抑制的作用机制与HP发生发展相联系。研究相关信号通路之间的联系机制,更好的发挥中药多靶点、多途径、多层次的优势,为黄芪抗肝纤维化提供强有力的支撑依据及新的思路可能是需关注的重点。
| [1] |
Bataller R, Brenner D A. Liver fibrosis[J]. J Clin Invest, 2005, 115(2): 209-18. doi:10.1172/JCI24282 |
| [2] |
Rosenbloom J, Macarak E, Piera-velazquez S, et al. Human fibrotic diseases: Current challenges in fibros is research[J]. Methods Mol Biol, 2017, 1627: 1-23. |
| [3] |
陆伦根, 尤红, 谢渭芬, 等. 肝纤维化诊断及治疗共识(2019年)[J]. 临床肝胆病杂志, 2019, 35(10): 2163-72. Lu L G, You H, Xie W F, et al. Consensus on the diagnosis and therapy of hepatic fibrosis (2019)[J]. J Clin Hepatol, 2019, 35(10): 2163-72. doi:10.3969/j.issn.1001-5256.2019.10.007 |
| [4] |
岳杉杉, 彭安康, 马泽江. 柚皮素通过调控TGF-β1/smad通路抑制肝纤维化[J]. 中国药理学通报, 2022, 38(2): 248-54. Yue S S, Peng A K, Ma Z J. The protective effects of naringenin on liver fibrosis by regulating TGF-β1/smad pathway[J]. Chin Pharmacol Bull, 2022, 38(2): 248-54. |
| [5] |
张蔷, 高文远, 满淑丽. 黄芪中有效成分药理活性的研究进展[J]. 中国中药杂志, 2012, 37(21): 3203-7. Zhang Q, Gao W Y, Man S L. Chemical composition and pharmacological activities of Astragali Radix[J]. Chin J Chin Mater Med, 2012, 37(21): 3203-7. |
| [6] |
Chen Z, Yao L, Liu Y, et al. Astragaloside IV regulates NF-κB-mediated cellular senescence and apoptosis of hepatic stellate cells to suppress PDGF-BB-induced activation[J]. Exp Ther Med, 2019, 18(5): 3741-50. |
| [7] |
成扬, 汪美凤, 平键, 等. 黄芪总黄酮对二甲基亚硝胺诱导的大鼠肝硬化的干预作用[J]. 中国中西医结合消化杂志, 2013, 21(11): 561-4. Cheng Y, Wang M F, Ping J, et al. The intervention effect of total flavonoids of astragalus on hepatic cirrhpsis induced by dimethylnitrosamine in rats[J]. Chin J Integr Tradit West Med Dig, 2013, 21(11): 561-4. doi:10.3969/j.issn.1671-038X.2013.11.001 |
| [8] |
Duarte S, Baber J, Fujii T, et al. Matrix metalloproteinases in liver injury, repair and fibrosis[J]. Matrix Biol, 2015, 44-/46: 147-56. doi:10.1016/j.matbio.2015.01.004 |
| [9] |
李政通, 李俊, 黄成, 等. CCL4诱导的大鼠肝纤维化模型肝纤维化逆转与MAPK信号通路的研究[J]. 中国药理学通报, 2011, 27(6): 809-14. Li Z T, Li J, Huang C, et al. Dynamic expression of MAPK signaling pathway on recovery hepatic fibrosis rats induced by CCL4[J]. Chin Pharmacol Bull, 2011, 27(6): 809-14. doi:10.3969/j.issn.1001-1978.2011.06.017 |
| [10] |
Parsons C J, Takashima M, Rippe R A. Molecular mechanisms of hepatic fibrogenesis[J]. J Gastroenterol Hepatol, 2007, 22(10): 79-84. |
| [11] |
Schnabl B, Bradham C A, Bennett B L, et al. TAK1/JNK and p38 have opposite effects on rat hepatic stellate cells[J]. Hepatology, 2001, 34(5): 953-63. doi:10.1053/jhep.2001.28790 |
| [12] |
雷玲, 闵珺, 刘锋, 等. 黄芪对肝纤维化大鼠肝损伤保护作用及机制研究[J]. 陕西中医, 2020, 41(9): 1192-6. Lei L, Min J, Liu F, et al. Study on protective effects and mechanism of astragalus on hepatic injury of rats with hepatic fibrosis[J]. Shaanxi J Tradit Chin Med, 2020, 41(9): 1192-6. doi:10.3969/j.issn.1000-7369.2020.09.004 |
| [13] |
Li X M, Wang X L, Han C Y, et al. Astragaloside Ⅳ suppresses collagen production of activated hepatic stellate cells via oxidative stress-mediated p38 MAPK pathway[J]. Free Radic Biol Med., 2013, 60(7): 168-76. |
| [14] |
林红, 蔡钢, 杨百京, 等. 黄芪后处理对大鼠肝纤维化中的影响及TGF-β1/Smad2、p38MAPK作用[J]. 世界科学技术-中医药现代化, 2014, 16(2): 410-5. Li H, Cai G, Yang B J, et al. Eeffects of TGF-β1/Smad2 and p38MAPK signaling pathway on Huangqi Postconditioning among hepatic fibrosis rat models[J]. World Sci Technol Modern Tradit ChinMed, 2014, 16(2): 410-5. |
| [15] |
Hu H H, Chen D Q, Wang Y N, et al. New insights into TGF-β/Smad signaling in tissue fibrosis[J]. Chem Biol Interact, 2018, 292: 76-83. doi:10.1016/j.cbi.2018.07.008 |
| [16] |
Xu F, Liu C, Zhou D, et al. TGF-beta/SMAD pathway and its regulation in hepatic fibrosis[J]. J Histochem Cytochem, 2016, 64(3): 157-67. doi:10.1369/0022155415627681 |
| [17] |
黄进, 张晨, 詹菲, 等. 黄芪多糖对肝纤维化大鼠TGF-β1/Smads信号通路的影响[J]. 中华中医药杂志, 2015, 30(6): 2184-6. Huang J, Zhang C, Zhan F, et al. Effects of astragalus on liver fibrosis rat in TGF-β1/Smads signal pathway[J]. Clin J Tradit Chin Med Pharm, 2015, 30(6): 2184-6. |
| [18] |
徐方明, 过建春, 包剑锋, 等. 黄芪多糖对继发性胆汁淤积性肝纤维化大鼠模型TGF-β1的影响[J]. 中华中医药学刊, 2012, 30(5): 1026-9, 1187. Xu F M, Guo J C, Bao J F, et al. Experimental Research of Astragalus Polysaccharide for TGF-β1 Expression on Secondary Cholestatic Hepatic Fibrosis Rats[J]. Chin Arch Tradit Chin Med, 2012, 30(5): 1026-9, 1187. |
| [19] |
任爽, 张杰. 毛蕊异黄酮抗肝星状细胞活化的作用机制研究[J]. 现代中西医结合杂志, 2016, 25(21): 2281-5. Ren S, Zhang J. 2016, 25(21): 2281-5.Study on the mechanism of action of Calycosin in inhibition of hepatic stellate cell activation[J]. Modern J Integr Tradit Chin West Med, 2016, 25(21): 2281-5. |
| [20] |
Zhang Q, Lenardo M J, Baltimre D, et al. 30 years of TNF-κB: A blossoming of relevance to human pathobiology[J]. Cell, 2017, 168(1-2): 37-57. |
| [21] |
He X, Pu G, Tang R, et al. Activation of nuclear factor kappa B in the hepatic stellate cells of mice with schistosomiasis japonica[J]. PLoS One, 2014, 9(8): 104323. |
| [22] |
An L, Lin Y, Li L, et al. Integrating network pharmacology and experimental validation to investigate the effects and mechanismof astragalus flavonoids against hepatic fibrosis[J]. Front Pharmacol, 2021, 11: 618262. |
| [23] |
蒋微. 黄芪总皂苷与甘草酸配伍抗肝纤维化的效应机制[D]. 上海: 上海中医药大学, 2019. Jiang Wei. Effect mechanism of total astragalus saponins combined with glycyrrhizic acid against liver fibrosis[D]. Shanghai: Shanghai Univ Tradit Chin Med, 2019. |
| [24] |
Wang Z, Xu J P, Zheng Y C, et al. Peroxisome proliferator-activated receptor gamma inhibits hepatic fibrosis in rats[J]. Hepatobiliary Pancreat Dis Int, 2011, 10(1): 64-71. |
| [25] |
郭晏同, 赵景明, 宋磊, 等. 过氧化物酶体增殖物激活受体γ配体抑制大鼠肝纤维化的实验研究[J]. 中华普通外科杂志, 2008, 23(10): 791-3. Guo Y T, Zhao J M, Song L, et al. Peroxisome proliferator activated receptor gamma ligand suppresses hepatic fibrosis in rats[J]. Chin J Gen Surg, 2008, 23(10): 791-3. |
| [26] |
Dong R, Luo Y, Zheng S. α-SMA overexpression associated with increased liver fibrosis in infants with biliary atresia[J]. J Pediatr Gastroenterol Nutr, 2012, 55(6): 653-6. |
| [27] |
Mu Y P, Zhang X, Xuewei L, et al. Astragaloside pre-vents BDL-induced liver fibrosis through inhibition of notch sig-naling activation[J]. J Ethnopharmacol, 2015, 169: 200-9. |
| [28] |
李芬, 王甲彬, 张世龙, 等. 黄芪总苷通过PAR2信号通路减轻糖尿病大鼠肝纤维化的机制研究[J]. 临床和实验医学杂志, 2021, 20(10): 1043-7. Li F, Wang J B, Zhang S L, et al. Study on the mechanism of total glycosides of astragalus in reducing liver fibrosis in diabetic rats through PAR2 signaling pathway[J]. J Clin Exp Med, 2021, 20(10): 1043-7. |
| [29] |
刘浩. 前列腺素E2受体信号转导在大鼠免疫性肝纤维化和肝星状细胞胶原合成中的作用及黄芪甲苷对其影响[D]. 合肥: 安徽医科大学, 2008. Liu H. Role of prostaglandin E2 receptor signaling on immune hepatic fibrosis and collagen synthesis in hepatic stellate cells in rats and the effect of astragaloside IV[D]. Hefei: Anhui Med Univ, 2008. |
| [30] |
李小茜. 前列腺素I2和前列腺素E2对大鼠肝星状细胞ACSL1、ACSL6及PPARγ基因表达的影响[D]. 衡阳: 南华大学, 2014. Li X Q. Effects of prostaglandin I2 and prostaglandin E2 on gene expression of ACSL1, ACSL6 and PPARγ in rat hepatic stellate cells[D]. Hengyang: Nanhua Univ, 2014. |

