

2. 南京中医药大学药学院药理学系,江苏 南京 210023
2. Dept of Pharmacology, School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China
近几十年来,肥胖逐渐成为一个紧迫的全球性公共卫生问题。最新的流行病学调查显示,中国学龄儿童和青少年超重和肥胖的比例为19.4%,而成年人的比例则超过50%[1]。预计到2030年,这一比例将分别增加到31.8%和65.3%[2]。超重或肥胖既影响心理和精神状态,又是多种常见慢性病(如心血管疾病、2型糖尿病、中枢神经系统疾病和部分肿瘤)的重要危险因素。每年有11.1%的慢性病死者归因于超重或肥胖相关的疾病[1],这使得预防、控制超重和肥胖成为一项迫切的社会需求。然而,现有的肥胖治疗药物的效果并不令人满意,迫切需要找到新的靶点,开发更加有效的药物。
在肥胖的调控因素研究中,生长分化因子15(growth differentiation factor 15,GDF15)正成为关注的热点。GDF15是转化生长因子β(transforming growth factor-β,TGF-β)超家族的成员。大量临床及动物实验表明,肥胖使血浆GDF15浓度升高,同时也发现,GDF15对摄食、体质量及能量代谢有显著调节作用。
1 GDF15的发现1997年,Bootcov等[3]用维A酸诱导U-937细胞分化,通过比对佛波酯处理或未处理细胞的基因表达差异,鉴定出一个与细胞活化相关的基因。该基因编码一种分泌蛋白,因其可抑制LPS刺激的巨噬细胞分泌肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),故命名为巨噬细胞抑制因子1(macrophage inhibitory cytokine 1)。同一年,Lu、Soares和Kato的实验室亦自胎盘中分离出该基因,分别命名为胎盘骨形态发生蛋白(placental bone morphogenetic protein)和胎盘转化生长因子-β(placental transforming growth factor beta)。此后,其他研究者又在不同实验条件或组织中鉴定出相同基因,将其命名为前列腺源性因子(prostate-derived factor)、GDF15[4]和非甾体抗炎药活化基因(nonsteroidal anti-inflammatory drug-activated gene)。GDF15是目前使用最广泛的名称。
2 GDF15的基因和蛋白结构及组织表达 2.1 GDF15的基因和蛋白结构人GDF15的编码基因位于第19对染色体短臂p13.11,包含2个长度分别为309 bp和891 bp的外显子,两者被一个1 819 bp的内含子隔开(Fig 1)。
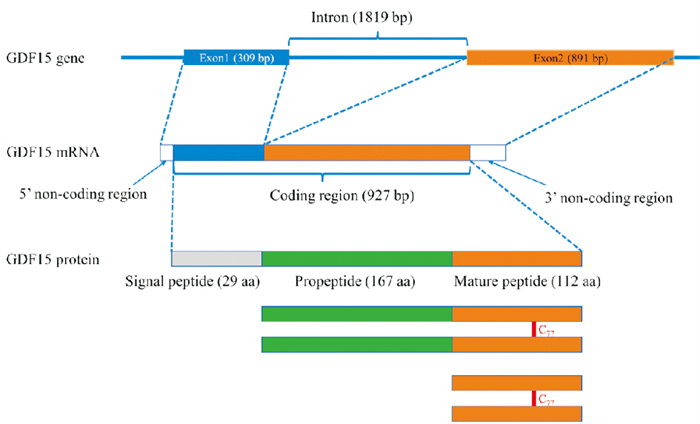
|
| Fig 1 Schematic of human GDF15 gene, mRNA and protein |
人GDF15基因编码一种含308个氨基酸的前体蛋白,由3部分构成:29个氨基酸的信号肽、167个氨基酸的前肽和112个氨基酸的成熟GDF15片段,后者的编码序列完全位于外显子2上(Fig 1)。小鼠和大鼠的GDF15前体蛋白含有303个氨基酸,包括32个氨基酸的信号肽,156个氨基酸的前肽和115个氨基酸的成熟GDF15片段[4]。大鼠和小鼠的成熟GDF15片段仅有4个氨基酸不同,相似度高达96.5%(Fig 2)。

|
| Fig 2 Amino acid sequences of human, mice, and rat prepropeptide of GDF15 The signal peptides are showed in black, the propeptides in green, and the mature GDF15 peptides in orange. The furin-like protease cleavage sites and the four different amino acids in mouse and rat mature GDF15 peptides are highlighted yellow and cyan, respectively. |
GDF15的氨基酸序列具有TGF-β家族的若干共同特征:1)前肽与成熟片段之间有保守的类弗林蛋白酶切位点:RXXR(Fig 2);2)具有半胱氨酸结(cysteine knot)结构。成熟GDF15片段含有9个半胱氨酸,除第6个半胱氨酸外,其余8个半胱氨酸两两之间形成二硫键(Fig 3)。两个成熟片段的第6个半胱氨酸(成熟片段第77个氨基酸)之间形成二硫键,连接成二聚体(Fig 1)。因此,GDF15被归为TGF-β超家族的一员。但是,通过分析成熟GDF15的氨基酸序列,并与TGF-β家族的其它成员比较后发现,GDF15仅C末端与其它家族成员有相似性,而N末端差异较大,这表明GDF15与TGF-β家族成员的亲缘关系较远。
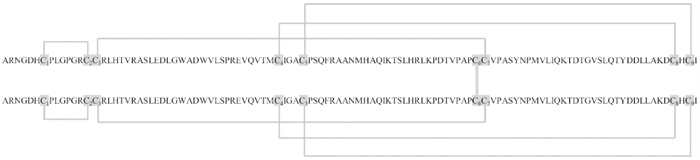
|
| Fig 3 Cysteine knots of human mature GDF15 homodimer The sixth cysteines (C6) of each GDF15 monomer form a disulfide bond |
在不同组织,GDF15的成熟过程依赖不同的蛋白水解酶。Li等[5]报道,在人胎盘滋养层细胞,基质金属蛋白酶-26(matrix metalloproteinase-26)与GDF15前体蛋白结合,切下前肽,促进成熟GDF15的产生。而在心肌细胞,3个前蛋白转化酶枯草溶菌素(proprotein convertase, subtilisin/kexin-type,PCSK)家族成员(PCSK3、PCSK5和PCSK6)负责切下前肽,促进GDF15成熟及分泌[6]。
2.2 GDF15在组织的表达GDF15在全身多种组织有程度不等的表达。Böttner等[4]用RT-PCR方法对成年小鼠组织GDF15的表达量进行半定量分析,发现肾脏、肺、肝脏和脾脏的表达量最高,而心脏、胃肠道、骨骼肌、胸腺和垂体的表达量次之,大脑各区域的表达量最低。采用原位杂交对大鼠脑组织GDF15的表达定位分析显示,GDF15主要表达在脑室脉络丛上皮细胞,而神经元和神经胶质细胞未见表达[7]。在外周组织,前列腺和小肠粘膜上皮细胞均有较强表达,其中肠绒毛上皮细胞的表达量强于隐窝上皮细胞,肠壁的其它组织未见表达。大多数支气管和小支气管上皮细胞都表达GDF15。下颌下腺和乳腺的分泌细胞有较强表达,而小叶间导管及结缔组织不表达GDF15。在肾脏,表达GDF15的细胞主要是近端小管S3段,集合管表达较少。肾上腺皮质广泛表达,而髓质表达稀少。值得注意的是,肾上腺内表达GDF15的细胞不是产生甾体激素或儿茶酚胺激素的内分泌细胞,而是组织内的巨噬细胞[7]。
Hromas等[8]采用Northern blot检测成年人体组织GDF15的表达情况,结果显示胎盘高表达GDF15,心脏、大脑、胰腺、肺和肝脏有程度不等的表达,但均显著低于胎盘,骨骼肌则完全不表达。Paralkar等[9]用免疫组化方法证实胎盘绒毛上皮细胞和前列腺上皮细胞有较强表达。这些结果表明,在生理状态下,GDF15虽有广泛表达,但主要集中在胎盘和前列腺。
3 GDF15与疾病 3.1 GDF15与肥胖 3.1.1 肥胖增加血浆GDF15Patel等[10]发现,进食本身并不影响血浆GDF15浓度,这表明GDF15并非一种饱觉激素,不参与进食后饱腹感的产生。健康志愿者连续7 d或8周摄入过剩能量,志愿者的体质量和血浆瘦素浓度都显著增加,但血浆GDF15浓度未见升高。以高脂饮食喂养小鼠7 d同样不影响血浆GDF15水平,继续喂养3周后,血浆GDF15水平开始升高并持续增加至实验结束(高脂喂养16周)[10]。临床研究也发现,肥胖者的血浆GDF15浓度显著高于正常体质量者[11]。这些结果表明,长期能量过剩在增加体质量的同时升高血浆GDF15,提示它可能参与机体能量代谢和体质量调节。
肥胖状态下升高的血浆GDF15可能来自多种组织。Xiong等[12]发现ob/ob小鼠的肝脏和脂肪组织GDF15表达升高。饮食诱导肥胖(diet-induced obesity,DIO)小鼠的附睾脂肪、棕色脂肪和肝脏GDF15的mRNA水平显著高于普通饲料组,而皮下脂肪、肾脏和骨骼肌无差异。在附睾脂肪,GDF15的表达升高伴有巨噬细胞标志物F4/80的同步增加,这提示脂肪组织内的巨噬细胞可能是GDF15的重要来源。进一步分离间质血管成分(stromal vascular fraction,SVF)和脂肪细胞,发现两者GDF15表达都显著升高[10]。Kim等[13]最近的报道与上述结果一致。他们发现高脂饮食使脂肪细胞和SVF的GDF15表达都增加,其中SVF的GDF15主要来自巨噬细胞。这些结果表明,在肥胖小鼠,脂肪细胞和脂肪组织浸润的巨噬细胞都是GDF15的重要来源。肥胖状态下,肝脏的GDF15表达也升高,不过尚不清楚确切的细胞来源。关于肥胖状态下人体组织GDF15表达情况,Dostálová等[11]报道肥胖者和2型糖尿病患者的血浆GDF15浓度显著高于正常体质量者,但她们的皮下和内脏脂肪的GDF15表达并无差异,这提示肥胖者和2型糖尿病患者血浆中升高的GDF15来自脂肪以外的组织。
3.1.2 GDF15降低体质量、改善代谢2006年,Eling实验室在研究GDF15对结肠肿瘤发生发展的影响过程中意外发现,GDF15转基因小鼠的体质量显著低于野生型小鼠,体脂比例降低。此后,大量研究者采用各种增加血浆GDF15的方法都显著降低实验动物的体质量,包括移植转染GDF15的肿瘤细胞[14]、病毒表达[12]和注射重组GDF15(recombinant GDF15,rGDF15)[12]。所用实验动物包括小鼠[14]、大鼠[15]和食蟹猴[16]。这些结果表明,GDF15降低体质量的效应不受给药方式和动物种属限制。
无论动物喂以普通饲料还是高脂饲料,注射rGDF15都可降低体质量。Tsai等[17]发现,用微量泵持续给小鼠注射rGDF15,高脂饲料组的体质量较注射前降低了21.1%,而普通饮食组只降低了9.98%,这表明GDF15对肥胖动物有更好的减重效果。值得注意的是,GDF15主要减少白色脂肪(包括附睾、腹膜后和腹股沟脂肪),而对肌肉影响不大。
除减轻体质量外,GDF15还能够改善肥胖导致的胰岛素敏感性降低和葡萄糖耐量异常。在DIO小鼠和食蟹猴模型中,Xiong等[12]发现,注射rGDF15降低血浆甘油三酯、胆固醇和胰岛素浓度,改善糖耐量异常。Wang等[17]也发现GDF15转基因小鼠的胰岛素敏感性提高,同时伴有白色脂肪内浸润的巨噬细胞减少,多种炎症因子(IL-18、IL-1β和TNF-α)表达减少以及NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3)炎症小体活性减弱。此外,rGDF15还减少了DIO小鼠肝脏内的甘油三酯含量和浸润的炎性细胞。
3.1.3 GDF15降低体质量的机制GDF15降低体质量、改善代谢的作用已经得到大量实验的证实,然而背后的机制尚未完全明了。目前已有的研究指向两个主要方向:1)减少摄食;2)代谢增强和(或)脂肪分解增强。
3.1.3.1 GDF15减少摄食GDF15可快速抑制摄食。单次注射rGDF15,小鼠在6 h和24 h内的摄食量显著降低,摄食量的降低是由于每次进食的量减少,而非进食次数[16]。在随后的24 h摄食量恢复到对照组水平,这可能是由于给药24 h后血浆中已检测不到rGDF15[18]。若使血浆GDF15水平长期维持较高水平,则GDF15可持久地抑制摄食[16]。人为地限制对照组的摄食量,使其与GDF15组相当,则对照组的体质量也降低到与GDF15组相近的程度[16],这提示GDF15降低体质量的主要原因是摄食减少。
截至目前,大部分研究都发现GDF15显著减少摄食,但也有一些研究得到了不同的结果。GDF15转基因小鼠每天的摄食量与野生型小鼠相似,甚至略高[19]。在另一项研究中,Fung等给小鼠注射一种长效GDF15(Fc-GDF15,将抗体Fc段与GDF15融合的重组GDF15,可显著延长GDF15的半衰期),发现Fc-GDF15只降低了d 1的摄食量。上述研究均采用摄食量/体质量来表示摄食量的变化,而其它研究使用摄食绝对量。Ellacott等[20]认为,在比较摄食量时,采用绝对量更为恰当。
GDF15还能延迟胃排空。Xiong等[12]给小鼠注射rGDF15,30 min后以酚红灌胃,之后在不同时间点观察胃内酚红剩余量。结果显示,5、15和30 min时间点的胃排空均显著减少。切断迷走神经后,GDF15抑制胃排空的效应消失,这表明GDF15并非直接作用于胃肠道,而是通过迷走神经抑制胃排空。不过,抑制胃排空并非GDF15抑制摄食、降低体质量所必须[18]。
Xiong等[12]发现GDF15影响动物对某种食物的偏好。他们将含有炼乳的饲料和普通饲料按1 ∶1放入饲养笼中,小鼠摄入的食物约有80%为含炼乳的饲料。给小鼠注射GDF15可降低摄食总量,并且含炼乳饲料的比例降低到55%。若笼中仅有含炼乳的饲料或普通饲料,GDF15使两种饲料的摄取量都减少。GDF15对饮水偏好也产生类似影响。通常,禁水过夜后重新给予饮水,小鼠更加偏好含糖精的饮水。Patel等[10]发现经过2次GDF15+糖精饮水预处理后再给予禁水过夜,小鼠几乎不再摄入含糖精的饮水而只摄入普通饮水。这些结果提示,GDF15使小鼠产生了条件性味觉厌恶。条件性味觉厌恶是动物或人类将某种食物的味道与内脏不适关联起来,从而减少或避免继续摄入该食物。最近,Borner等[18]对GDF15导致的条件性味觉厌恶进行了深入研究,他们发现皮下或侧脑室注射GDF15使大鼠摄食量减少,黏土摄入量增加(一种内脏不适的指征),体质量减轻。先给予特定食物后注射GDF15,此后几天大鼠不再摄入该食物,且在强制喂以该食物时表现出厌恶表情和行为。这些结果提示,当血浆GDF15浓度升高时,动物产生内脏不适感,它们将食物的味道与这种不适感关联起来,对该食物产生排斥和厌恶,从而导致摄食减少。
3.1.3.2 GDF15增加能量消耗和(或)脂肪分解除摄食减少外,能量消耗增加可能是GDF15降低体质量的另一原因。Chrysovergis等[19]发现,GDF15转基因小鼠在白天和夜间的O2消耗量、CO2产量和能量消耗都显著高于野生型小鼠。然而,Macia等[21]同样采用GDF15转基因小鼠却未发现能量消耗有所差异。注射rGDF15也得到不一致的结果。Johnen等[14]在黑夜开始前给小鼠注射rGDF15,发现小鼠在夜间的能量消耗、耗氧量、活动和呼吸交换率(respiratory exchange ratio,RER)都显著降低,而在白天无显著差异。Yang等[15]观察到rGDF15使小鼠夜间和白天的RER都降低,但不影响活动和能量消耗,而Hsu等[22]的结果显示rGDF15只降低小鼠白天的RER值。出现这些差异的原因并不清楚,可能与所用的实验动物品系或GDF15注射时间等因素有关。
最近,Kim等[13]发现肥胖患者和DIO小鼠脂肪组织浸润的巨噬细胞高表达转录因子EB(transcription factor EB,TFEB)。为了探究TFEB在肥胖发生、发展过程中的作用,他们在小鼠的巨噬细胞特异性高表达TFEB并喂以高脂饮食(以下简称TFEB小鼠),结果发现TFEB小鼠体质量显著低于野生型小鼠,胰岛素敏感性得到改善。他们发现TFEB小鼠的血浆GDF15浓度高于野生型小鼠,敲除GDF15可完全逆转高表达TFEB的上述效应。有趣的是,TFEB小鼠的摄食量并未出现减少,但其夜间产热增加,体温升高,这提示GDF15可能主要通过增加产热来对抗高脂饮食导致的体质量增加。同时,他们还发现TFEB小鼠脂肪组织(棕色和白色)内的与脂肪分解和产热有关的基因以及肝脏中与脂肪酸β氧化相关基因表达均升高,这些效应也都依赖GDF15。他们的研究结果与之前的研究相符,即GDF15降低体质量主要是减少脂肪,很少或不影响肌肉质量。
在高脂饮食喂养的TFEB小鼠,白色脂肪和棕色脂肪都显著减少,脂肪细胞的体积减小,这与这些组织内的脂肪甘油三脂脂肪酶(adipose triglyceride lipase,ATGL)和激素敏感性脂肪酶(hormone-sensitive lipase,HSL)表达增加有关。当敲除GDF15后,上述效应被逆转,表明GDF15可促进ATGL和HSL表达[13]。这一结果与Suriben等[23]报道的结果一致:注射rGDF15 6 h后,白色脂肪组织ATGL和HSL的mRNA显著增加,而敲除ATGL后,GDF15降低体质量、减少脂肪的效应大大减弱,证实ATGL介导的脂肪分解在其中发挥重要作用。
有研究表明,寒冷刺激激活支配脂肪组织的交感神经,后者释放的儿茶酚胺与脂肪细胞的肾上腺素能受体结合,诱导白色脂肪褐变,增加产热。那么,交感神经是否可能介导GDF15对脂肪组织的效应?在TFEB高表达小鼠的棕色和白色脂肪中,参与儿茶酚胺合成的酶(酪氨酸羟化酶、多巴脱羧酶)的表达有增加的趋势[13]。此外,Suriben等[23]之前发现用6-羟多巴胺破坏交感神经可抑制GDF15的减少脂肪、降低体质量效应。以上结果提示交感神经可能介导了GDF15的效应。然而GDF15是否能够激活交感神经仍需更多证据支持。
除交感神经外,糖皮质激素也可能参与GDF15对脂肪的效应。最近,Cimino等[24]报道注射rGDF15或者药物诱导的内源性GDF15可快速激活下丘脑-腺垂体-肾上腺皮质轴,升高血浆糖皮质激素浓度。他们发现,给小鼠皮下注射rGDF15(0.03 mg·kg-1)使血浆GDF15浓度达到约7 μg·L-1,而血浆糖皮质激素浓度升高到约100 μg·L-1。在之前的研究中,rGDF15的剂量都远高于0.03 mg·kg-1。因此,注射rGDF15或用病毒表达GDF15在降低体质量的同时必然伴有血浆糖皮质激素浓度升高。考虑到糖皮质激素的促脂肪分解作用,有必要进一步研究其在GDF15降体质量效应的作用。
3.1.3.3 GDF15与中枢受体结合下丘脑是重要的摄食和体质量调节中枢,GDF15可能通过激活下丘脑的神经元影响摄食和体质量。Johnen等[14]给小鼠腹腔注射rGDF15,1 h后检测大脑神经元激活标志物c-fos表达,他们发现弓状核、室旁核、最后区(area postrema,AP)的神经元都有显著激活。2014年,Tsai等[25]也观察到注射rGDF15 1 h后小鼠的AP和孤束核(nucleus tractus solitarius,NTS)内侧部的c-fos表达最强。AP缺乏完整的血脑屏障,可直接感受血液中的激素分子,可能成为GDF15直接作用的脑区。的确,Tsai等[25]损毁小鼠的AP和其附近的NTS后,rGDF15抑制食欲和体质量的作用消失了。这些结果提示,AP和NTS的神经元介导了GDF15对摄食和体质量的效应。然而,此时尚不清楚是何种受体介导了GDF15的效应。
2017年,4家独立研究机构同时发文证实孤儿受体胶质细胞源性神经营养因子家族α样受体(glial cell-derived neurotrophic factors family receptor α-like,GFRAL)是GDF15的天然受体[15-16, 22, 26]。胶质细胞源性神经营养因子(glial cell-derived neurotrophic factors,GDNF)家族是TGF-β超家族的一个亚家族,包括4个成员:GDNF、neurturin、artemin和persephin。它们通过与4个GDNF受体家族成员(GDNF receptor α1~4,GFR-α1~4)结合发挥作用,主要功能是参与维持中枢和外周神经元的功能。GFR-α家族还包括2个远亲,分别是GFRAL和growth arrest specific-1 (GAS1),但GDNF家族的4个成员都不能与GFRAL和GAS1结合。除GFRAL外,GFR-α家族所有成员都通过糖基磷脂酰肌醇(glycosylphosphatidylinositol)固定在细胞膜上,GFRAL采用单次跨膜螺旋与细胞膜结合。与其它GFR-α家族成员一样,GFRAL同样需要辅助受体RET才能激活细胞内的信号通路,这可能与其胞内结构域过短,仅有23个氨基酸有关[15]。GDF15或GFRAL都不能单独激活RET,而RET缺失也不影响GDF15与GFRAL的结合。GDF15与GFRAL结合,促使GFRAL形成二聚体,进而招募RET以二聚体形式与GDF15-GFRAL复合物结合,RET发生自身磷酸化进而激活下游信号通路。在整体动物,GDF15可通过GFRAL-RET激活ERK[22],细胞实验证实AKT和磷脂酶C也是GFRAL-RET的下游通路[16]。
GFRAL的表达非常局限,最先报道的4个实验室都发现GFRAL仅在大脑AP和NTS表达,其他脑区和外周组织均不表达[15-16, 22, 26]。腹腔注射rGDF15,1 h后对AP和NTS进行免疫荧光双染,结果显示大部分GFRAL神经元表达c-fos,而敲除GFRAL完全消除c-fos表达。更重要的是,敲除GFRAL完全消除rGDF15产生的抑制摄食和降低体质量效应。上述结果表明,血浆中GDF15通过结合AP和NTS神经元上的GFRAL受体,激活这些神经元,进而产生抑制摄食和降低体质量效应。
3.2 GDF15与肿瘤恶液质恶液质是一种由癌症或其他慢性严重慢性疾病引起的一种复杂代谢紊乱综合征,主要表现为厌食、肌肉流失(伴有或不伴有脂肪减少)。约有15%~40%的肿瘤患者伴有恶液质,而在晚期癌症患者这个比例可高达80%。恶液质状态严重影响患者生活质量并缩短生存期,据估计约22%的肿瘤患者最终死于恶液质。因此,阐明肿瘤恶液质的机制对于改善患者生存质量、延长生存期有重要现实意义。
Johnen等[14]发现伴有恶液质的晚期前列腺癌患者血浆GDF15和IL-6显著高于无恶液质的患者,但只有GDF15与肿瘤导致的体质量减轻有相关性。动物实验亦表明GDF15参与肿瘤恶液质发生、发展过程。Lerner等[27]将7种能显著降低小鼠体质量的肿瘤细胞和3种不能降低体质量的肿瘤细胞种植到小鼠,随后检测了29种血浆蛋白,发现只有GDF15在前者呈现一致升高,而在后者的浓度极低或未检出。注射GDF15中和抗体完全逆转移植瘤引起的摄食减少、体质量下降。更重要的是,与单用抗肿瘤药物相比,联合应用抗肿瘤药物和GDF15中和抗体显著延长移植瘤小鼠的存活时间。
最近,Suriben等[23]开发了一种针对GFRAL的抗体:3P10。它抑制GDF15-GFRAL复合物与RET结合,阻断RET下游信号通路激活。他们发现移植瘤使小鼠体质量持续降低,在移植后d 13注射3P10逆转移植瘤导致的体质量降低。有趣的是,注射3P10后,小鼠的摄食量仅轻度增加,这难以解释体质量的大幅恢复。为了进一步明确摄食量的影响,他们在注射3P10后,把小鼠的摄食量限制在注射3P10前1 d的水平,使小鼠在注射3P10后无法增加摄食量,结果发现3P10组小鼠的体质量仍不断增加,治疗8 d后体质量恢复到接种移植瘤之前的水平。这表明摄食量减少并非移植瘤降低体质量的主要原因,激活GDF15-GFRAL信号通路对肿瘤恶液质的发生、发展至关重要,中和GDF15或阻断GRRAL可能成为治疗肿瘤恶液质的重要靶点。
3.3 GDF15与铂类化合物铂类化合物是临床治疗卵巢癌、睾丸癌、宫颈癌、肺癌、头颈部癌和膀胱癌的常用药[28],然而它们在抑制肿瘤生长的同时也产生许多副作用,其中恶心、呕吐、厌食是最为常见的副作用,严重影响患者的生活质量和治疗依从性。目前临床采用5-羟色胺受体3阻断剂、神经激肽-1受体阻断剂、地塞米松和奥氮平治疗铂类药物导致的恶心和呕吐,不过仍有约10%~30%的患者治疗无效。
Breen等[29]发现接受铂类药物治疗的非小细胞肺癌、结直肠癌和卵巢癌患者,其血浆GDF15水平高于非铂类药物治疗的患者。动物实验也表明,顺铂升高小鼠血浆GDF15浓度,减少摄食和体质量,且摄食和体质量的减少与血浆GDF15浓度呈正相关[30]。顺铂引起的体质量降低主要是脂肪组织减少,肌肉减少并不显著[29]。其他铂类化合物也表现出相似效应[29]。这些结果提示GDF15可能参与铂类化合物导致的厌食和体质量减轻。
敲除GDF15或其受体GFRAL抑制顺铂导致的摄食减少和体质量减轻[22, 29],针对GDF15或GFRAL的中和抗体也产生了同样的保护效应[29-30]。此外,在食蟹猴模型,GDF15中和抗体还减轻了顺铂导致的呕吐[29]。以上结果表明,GDF15参与铂类化合物导致的呕吐、厌食和体质量减轻,GDF15或GFRAL的中和抗体可能用于临床预防、治疗铂类化合物导致的此类副作用。
4 结语已有的动物实验都显示,GDF15能有效降低体质量,一些临床试验也提示GDF15与体质量下降显著相关,显示了其在治疗肥胖方面的巨大潜力。然而,GDF15在中枢的作用通路仍未完全明了,其是否能安全有效地治疗人类肥胖也有待临床试验证实。另一方面,拮抗GDF15/GFRAL已经在动物实验中展现了其在改善肿瘤恶液质以及铂类化疗药物导致的厌食、体质量减轻方面的良好前景,相关临床试验也已启动,期待GDF15/GFRAL拮抗药物成为未来治疗肿瘤恶液质及改善铂类化疗药物副作用的重要手段。
| [1] |
Pan X F, Wang L, Pan A. Epidemiology and determinants of obesity in China[J]. Lancet Diabetes Endocrinol, 2021, 9(6): 373-92. doi:10.1016/S2213-8587(21)00045-0 |
| [2] |
Wang Y, Zhao L, Gao L, et al. Health policy and public health implications of obesity in China[J]. Lancet Diabetes Endocrinol, 2021, 9(7): 446-61. doi:10.1016/S2213-8587(21)00118-2 |
| [3] |
Bootcov M R, Bauskin A R, Valenzuela S M, et al. MIC-1, a novel macrophage inhibitory cytokine, is a divergent member of the TGF-beta superfamily[J]. Proc Natl Acad Sci USA, 1997, 94(21): 11514-9. doi:10.1073/pnas.94.21.11514 |
| [4] |
Böttner M, Laaff M, Schechinger B, et al. Characterization of the rat, mouse, and human genes of growth/differentiation factor-15/macrophage inhibiting cytokine-1 (GDF-15/MIC-1)[J]. Gene, 1999, 237(1): 105-11. doi:10.1016/S0378-1119(99)00309-1 |
| [5] |
Li S, Wang Y, Cao B, et al. Maturation of growth differentiation factor 15 in human placental trophoblast cells depends on the interaction with matrix metalloproteinase-26[J]. J Clin Endocrinol Metab, 2014, 99(11): E2277-87. doi:10.1210/jc.2014-1598 |
| [6] |
Li J J, Liu J, Lupino K, et al. Growth differentiation factor 15 maturation requires proteolytic cleavage by PCSK3, -5, and -6[J]. Mol Cell Biol, 2018, 38(21): e00249-18. |
| [7] |
Böttner M, Suter-Crazzolara C, Schober A, et al. Expression of a novel member of the TGF-beta superfamily, growth/differentiation factor-15/macrophage-inhibiting cytokine-1 (GDF-15/MIC-1) in adult rat tissues[J]. Cell Tissue Res, 1999, 297(1): 103-10. doi:10.1007/s004410051337 |
| [8] |
Hromas R, Hufford M, Sutton J, et al. PLAB, a novel placental bone morphogenetic protein[J]. Biochim Biophys Acta, 1997, 1354(1): 40-4. doi:10.1016/S0167-4781(97)00122-X |
| [9] |
Paralkar V M, Vail A L, Grasser W A, et al. Cloning and characterization of a novel member of the transforming growth factor-beta/bone morphogenetic protein family[J]. J Biol Chem, 1998, 273(22): 13760-7. doi:10.1074/jbc.273.22.13760 |
| [10] |
Patel S, Alvarez-Guaita A, Melvin A, et al. GDF15 provides an endocrine signal of nutritional stress in mice and humans[J]. Cell Metab, 2019, 29(3): 707-18. doi:10.1016/j.cmet.2018.12.016 |
| [11] |
Dostálová I, Roubícek T, Bártlová M, et al. Increased serum concentrations of macrophage inhibitory cytokine-1 in patients with obesity and type 2 diabetes mellitus: The influence of very low calorie diet[J]. Eur J Endocrinol, 2009, 161(3): 397-404. doi:10.1530/EJE-09-0417 |
| [12] |
Xiong Y, Walker K, Min X, et al. Long-acting MIC-1/GDF15 molecules to treat obesity: Evidence from mice to monkeys[J]. Sci Transl Med, 2017, 9(412): eaan8732. doi:10.1126/scitranslmed.aan8732 |
| [13] |
Kim J, Kim S H, Kang H, et al. TFEB-GDF15 axis protects against obesity and insulin resistance as a lysosomal stress response[J]. Nat Metab, 2021, 3(3): 410-27. doi:10.1038/s42255-021-00368-w |
| [14] |
Johnen H, Lin S, Kuffner T, et al. Tumor-induced anorexia and weight loss are mediated by the TGF-beta superfamily cytokine MIC-1[J]. Nat Med, 2007, 13(11): 1333-40. doi:10.1038/nm1677 |
| [15] |
Yang L, Chang C C, Sun Z, et al. GFRAL is the receptor for GDF15 and is required for the anti-obesity effects of the ligand[J]. Nat Med, 2017, 23(10): 1158-66. doi:10.1038/nm.4394 |
| [16] |
Mullican S E, Lin-Schmidt X, Chin C N, et al. GFRAL is the receptor for GDF15 and the ligand promotes weight loss in mice and nonhuman primates[J]. Nat Med, 2017, 23(10): 1150-7. doi:10.1038/nm.4392 |
| [17] |
Tsai V W, Zhang H P, Manandhar R, et al. Treatment with the TGF-b superfamily cytokine MIC-1/GDF15 reduces the adiposity and corrects the metabolic dysfunction of mice with diet-induced obesity[J]. Int J Obes (Lond), 2018, 42(3): 561-71. doi:10.1038/ijo.2017.258 |
| [18] |
Borner T, Wald H S, Ghidewon M Y, et al. GDF15 induces an aversive visceral malaise state that drives anorexia and weight loss[J]. Cell Rep, 2020, 31(3): 107543. doi:10.1016/j.celrep.2020.107543 |
| [19] |
Chrysovergis K, Wang X, Kosak J, et al. NAG-1/GDF-15 prevents obesity by increasing thermogenesis, lipolysis and oxidative metabolism[J]. Int J Obes (Lond), 2014, 38(12): 1555-64. doi:10.1038/ijo.2014.27 |
| [20] |
Ellacott K L J, Morton G J, Woods S C, et al. Assessment of feeding behavior in laboratory mice[J]. Cell Metab, 2010, 12(1): 10-7. doi:10.1016/j.cmet.2010.06.001 |
| [21] |
Macia L, Tsai V W-W, Nguyen A D, et al. Macrophage inhibitory cytokine 1 (MIC-1/GDF15) decreases food intake, body weight and improves glucose tolerance in mice on normal & obesogenic diets[J]. PloS One, 2012, 7(4): e34868. doi:10.1371/journal.pone.0034868 |
| [22] |
Hsu J Y, Crawley S, Chen M, et al. Non-homeostatic body weight regulation through a brainstem-restricted receptor for GDF15[J]. Nature, 2017, 550(7675): 255-9. doi:10.1038/nature24042 |
| [23] |
Suriben R, Chen M, Higbee J, et al. Antibody-mediated inhibition of GDF15-GFRAL activity reverses cancer cachexia in mice[J]. Nat Med, 2020, 26(8): 1264-70. doi:10.1038/s41591-020-0945-x |
| [24] |
Cimino I, Kim H, Tung Y C L, et al. Activation of the hypothalamic-pituitary-adrenal axis by exogenous and endogenous GDF15[J]. Proc Natl Acad Sci USA, 2021, 118(27): e2106868118. doi:10.1073/pnas.2106868118 |
| [25] |
Tsai V W-W, Manandhar R, Jørgensen S B, et al. The anorectic actions of the TGFβ cytokine MIC-1/GDF15 require an intact brainstem area postrema and nucleus of the solitary tract[J]. PloS One, 2014, 9(6): e100370. doi:10.1371/journal.pone.0100370 |
| [26] |
Emmerson P J, Wang F, Du Y, et al. The metabolic effects of GDF15 are mediated by the orphan receptor GFRAL[J]. Nat Med, 2017, 23(10): 1215-9. doi:10.1038/nm.4393 |
| [27] |
Lerner L, Tao J, Liu Q, et al. MAP3K11/GDF15 axis is a critical driver of cancer cachexia[J]. J Cachexia Sarcopenia Muscle, 2016, 7(4): 467-82. doi:10.1002/jcsm.12077 |
| [28] |
尹连红, 张一萌, 彭金咏. 顺铂诱导肾毒性的分子机制及中药干预研究进展[J]. 中国药理学通报, 2020, 36(1): 13-8. Yin L H, Zhang Y M, Peng J Y. Molecular mechanism of cisplatin-induced nephrotoxicity and intervention of traditional Chinese medicine[J]. Chin Pharmacol Bull, 2020, 36(1): 13-8. doi:10.3969/j.issn.1001-1978.2020.01.004 |
| [29] |
Breen D M, Kim H, Bennett D, et al. GDF-15 neutralization alleviates platinum-based chemotherapy-induced emesis, anorexia, and weight loss in mice and nonhuman primates[J]. Cell Metab, 2020, 32(6): 938-50.e6. doi:10.1016/j.cmet.2020.10.023 |
| [30] |
Worth A A, Shoop R, Tye K, et al. The cytokine GDF15 signals through a population of brainstem cholecystokinin neurons to mediate anorectic signalling[J]. eLife, 2020, 9: e55164. doi:10.7554/eLife.55164 |

