

2. 贵州医科大学,省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550025;
3. 贵州省中国科学院天然产物化学重点实验室,贵州 贵阳 550014
 ,
ZHOU Fei3,
CHEN Fa-ju2,3,
PENG Mei2,3,
LUO Zhong-sheng2,3,
WANG Li2,3,
YANG Ke-ling1,2,3,
YANG Xiao-sheng2,3,
YANG Juan2,3
,
ZHOU Fei3,
CHEN Fa-ju2,3,
PENG Mei2,3,
LUO Zhong-sheng2,3,
WANG Li2,3,
YANG Ke-ling1,2,3,
YANG Xiao-sheng2,3,
YANG Juan2,3

2. State Key Laboratory of Functions and Applications of Medicinal Plants, Guizhou Medical University, Guiyang 550025, China;
3. The Key Laboratory of Chemistry for Natural Products of Guizhou Province and Chinese Academy of Sciences, Guiyang 550014, China
目前,血栓性疾病如冠心病、心肌梗死、缺血性脑卒中等许多栓塞性疾病,已经严重危害了人类身心健康[1]。据有关研究显示,全球约有20亿心脑血管疾病患者,且每年死于心脑血管疾病的人数占总死亡人数的一半以上[2],中国每年仅缺血性脑血管病患者就超过700万[3]。近年来,血栓性疾病发病率处于上升趋势,且越来越年轻化[4],给社会和家庭带来了极大的伤害。血栓性疾病发病机制复杂,受多种危险因素的影响,而血小板聚集是此类疾病的主要诱因,因此,寻找抗血小板聚集药物,研究其作用机制,寻找发病诱因对血栓性系列疾病的治疗及预防具有重大意义。课题组前期研究发现,高粱根水提醇沉上清液部位(WEAE)具有明显的扩张血小管和抗凝血作用[5]。WEAE部分进一步经MCI凝胶柱层析,0%、30%、60%、95%乙醇洗脱得到各流分。体外抗血小板聚集活性试验发现,30%乙醇洗脱流分(WEAE-M 30%)对胶原蛋白(collagen)、凝血酶(thrombin)、二磷酸腺苷(ADP)等激动剂诱导的血小板聚集有明显抑制作用[6]。在前期研究基础上,本研究对该流分抗血小板聚集作用机制进行初步探讨,为进一步开发抗血栓药物提供科学依据。
1 材料与方法 1.1 实验动物雄性SD大鼠(SPF级,体质量180~200 g),购于辽宁长生生物技术股份有限公司,许可证号:SCXK(辽)2020-0001。
1.2 药材高粱根于2018年10月采自贵州省遵义市桐梓县,为贵州茅台酒股份有限公司在桐梓地区种植的酒用高粱品种红缨子糯高粱的根,标本存放于贵州省中国科学院天然产物化学重点实验室。
1.3 试剂乳酸脱氢酶试剂盒(批号:20200805)、琼脂糖凝胶2B(批号:S8701)、钙离子荧光探针Fura-2/AM(批号:828C011)、EGTA(批号:623P053)、TritonX-100(批号:82910211)、凝血酶(批号:72F064)均购自Solarbio公司;胶原蛋白(批号:F19000122)HYPHEN BioMed公司;二磷酸腺苷(批号:SLCB5611)、阿司匹林(批号:SLBH0714V)购自Sigma公司;PLCγ2(批号:10)、phospho-PLCγ2(批号:5)购自Cell Signaling Technology公司;Syk(批号:GR267275-19)、phospho-Syk(批号:GR286096-16),Src(批号:GR3232598-8)、phospho-Src(批号:GR239935-26)、p38(批号:GR3215674-8)、phospho-p38(GR308415-23)、ERK(批号:GR3261666-6)、phospho-ERK(批号:GR3206456-3)均购自Abcam公司;β-actin(批号:303974)、Anti-rabbit secondary(批号:00018387)均购自Proteintech公司;PE anti-mouse/Rat CD62P(批号:B311813)购自Biolegend公司;Rat cAMP ELISA Kit(批号:GR2020-12)、Rat cGMP ELISA Kit(批号:GR2020-11)、Rat TXB2 ELISA Kit(批号:GR2021-02)、Rat 6-keto-PGF1α ELISA Kit(批号:GR2021-01)均购自武汉基因美生物有限公司。
1.4 仪器TDL-40C低速离心机(上海安亭科学仪器厂);LBY-NJ4血小板聚集仪(北京普利生仪器有限公司);IMS-50雪花制冰机(BIOBASE公司);NovoCyte 2040R流式细胞仪(ACEA Biosciences.Inc公司);F97Pro荧光分光光度计(上海棱光公司)
1.5 活性部位的制备按照文献[6]方法制备。高粱根经粉碎,加入去离子水浸泡24 h后,水煎煮提取2次,每次2 h。水煎液过滤,滤液合并浓缩后,浸膏加入适量95%乙醇,使乙醇溶液终浓度达60%,静置后上清液过滤。减压回收溶剂,将浓缩后的浸膏真空干燥,得水提醇沉上清液部位(WEAE)。WEAE部位再经MCI凝胶柱层析,分别采用0%、30%、60%、95%乙醇梯度洗脱,得到各洗脱流分。将30%乙醇洗脱流分(WEAE-M 30%)浓缩后真空干燥,备用。
1.6 大鼠血小板样品制备雄性SD大鼠经腹腔麻醉后,腹主动脉取血,枸橼酸钠1 ∶9抗凝,800 r·min-1离心10 min,取上层富血小板血浆(PRP)[7]。PRP经Sepharose 2B琼脂糖凝胶柱层析洗涤,得到凝胶过滤血小板(GFP)[8]。
1.7 血小板聚集功能测定根据文献方法[9]测定血小板聚集率。将GFP分为空白组,阳性组,低、中、高剂量组。在比色杯内加入搅拌转子,并加入270 μL GFP悬液与30 μL不同浓度WEAE-M 30%(终浓度为50、100、200 mg·L-1),以阿司匹林(aspirin,100 mg·L-1)为阳性对照,以含0.5% DMSO的生理盐水为空白对照,37 ℃孵育10 min。然后分别以ADP(20 μmol·L-1)、Thrombin(0.3 kU·L-1)、Collagen(2 mg·L-1)为激动剂,记录5 min内血小板聚集仪的曲线变化,并读取最大聚集率,按下列公式计算各受试药对血小板聚集的抑制率。
血小板聚集抑制率/% =(空白对照组的最大聚集率-给药组的最大聚集率)/空白对照组的最大聚集率×100 %[9]。
1.8 抗血小板聚集作用机制研究 1.8.1 Western blot检测GPVI、MAPK信号通路中蛋白表达分别取270 μL GFP,加入30 μL不同浓度WEAE-M 30%,空白对照组、阳性对照组,孵育10 min后,用Collagen刺激5 min,得到处理好的血小板悬液。取血小板悬液,加入150 μL蛋白酶,磷酸酶抑制剂的5×RIPA裂解血小板,冰上放置30 min后,4 ℃下12 000×g离心5 min,取上清液得血小板总蛋白样品。测定并调整血小板蛋白浓度,加入loading buffer,沸水浴5 min后,分装冻存于-80 ℃冰箱备用。将蛋白样品进行电泳、转膜、封闭后,加入对应的一抗(PLCγ2、phospho-PLCγ2,Syk、p-Syk,Src、phospho-Src,p38、p-p38,Erk、phospho-Erk,β-actin)4 ℃孵育过夜。用TBST洗膜30 min,然后与抗兔二抗在室温下孵育1 h。再次洗膜后,使用ECL发光液进行显色曝光,灰度分析。
1.8.2 ATP释放实验分别取270 μL GFP(含1 mmol·L-1的CaCl2),与30 μL不同浓度WEAE-M 30%,空白对照、阳性对照,孵育10 min,用Collagen刺激5 min后,用96孔UV板,在340 nm下,测定吸光度值。
1.8.3 环磷酸腺苷(cAMP)和环磷酸鸟苷(cGMP)含量测定按“1.8.1”操作处理好的血小板悬液,加入等体积80%冰乙醇终止反应,样品在3 000 r·min-1离心10 min,获取上清液,根据cAMP和cGMP含量测定试剂盒在450 nm下测定吸光度值,计算cAMP和cGMP的含量。
1.8.4 胞内血栓素(TXB2)和6-keto-PGF1α水平的测定按“1.8.1”操作处理好的血小板悬液,加入终浓度为2.5 mmol·L-1的冰EDTA和终浓度为100 μmol·L-1的吲哚美辛终止反应,悬液通过12 000×g离心3 min后[10],在4 ℃下收集上清液,根据TXB2和6-keto-PGF1α含量测定试剂盒,在450 nm下测定吸光度值,计算TXB2和6-keto-PGF1α的水平。
1.8.5 胞内钙离子浓度测定GFP加入5 μmol·L-1的Fura-2/AM,37 ℃孵育60 min,使Fura-2进入血小板内,并与Ca2+耦合,将Fura-2负载的血小板与WEAE-M 30%,或空白对照(含0.5 % DMSO生理盐水)、阳性对照(Aspirin),孵育10 min,加入Collagen刺激活化,随即用荧光分光光度计进行初次测定,之后依次记录加入Triton X-100后及加入EGTA后的荧光值,计算出胞内钙离子浓度[11]。
1.8.6 流式细胞术检测血小板表面CD62P的表达按“1.8.1”操作处理好的血小板悬液,按100 ∶1加入CD62P-PE染料,室温暗室放置40 min,混匀,加入1%多聚甲醛200 μL固定20 min,3 500 r·min-1离心5 min,弃上清,用PBS重悬,上流式细胞仪检测[12]。
1.9 统计数据处理各组数据均采用x±s表示,用SPSS 26.0对数据进行单因素方差分析以及2018 Origin软件作图。
2 结果 2.1 WEAE-M 30%对不同激动剂诱导大鼠血小板聚集的影响结果如Fig 1,与空白对照组比较,高(200 mg·L-1)、中(100 mg·L-1)、低(50 mg·L-1)浓度的WEAE-M 30%均能对Collagen、Thrombin、ADP诱导的血小板聚集有明显抑制作用,差异具有统计学意义(P < 0.01),其中以对Collagen诱导的血小板聚集抑制活性最为明显。因此后续其抗血小板聚集活性机制的探讨以Collagen为激动剂。
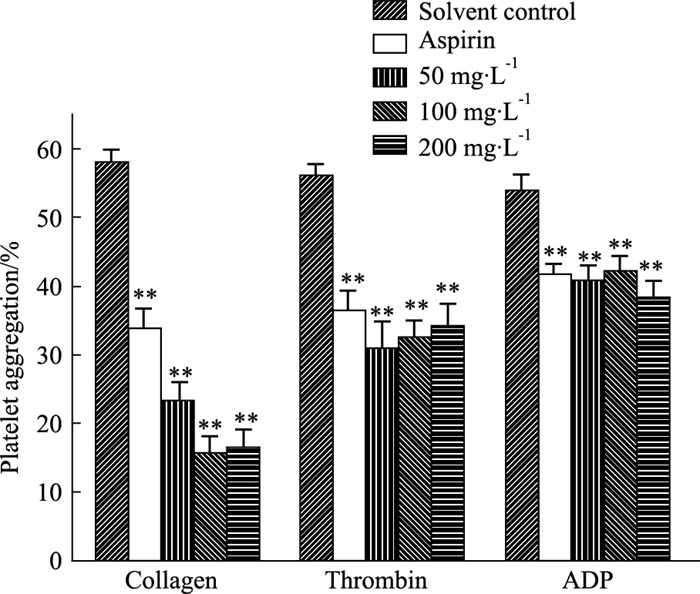
|
| Fig 1 Effect of WEAE-M 30% on platelet aggregation induced by different agonists (x±s, n=6) **P < 0.01 vs blank |
如Fig 2所示,在GPVI通路信号中,WEAE-M 30%对PLCγ2的磷酸化水平无明显抑制作用,但表现出促进趋势;对p-Syk水平抑制作用无明显影响,而对p-Src水平有明显抑制作用(P < 0.01)。在MAPK通路信号中,WEAE-M 30%低、高浓度对p-p38水平有明显抑制作用(P < 0.05或P < 0.01);中、高浓度对p-ERK水平有明显抑制作用(P < 0.01)。
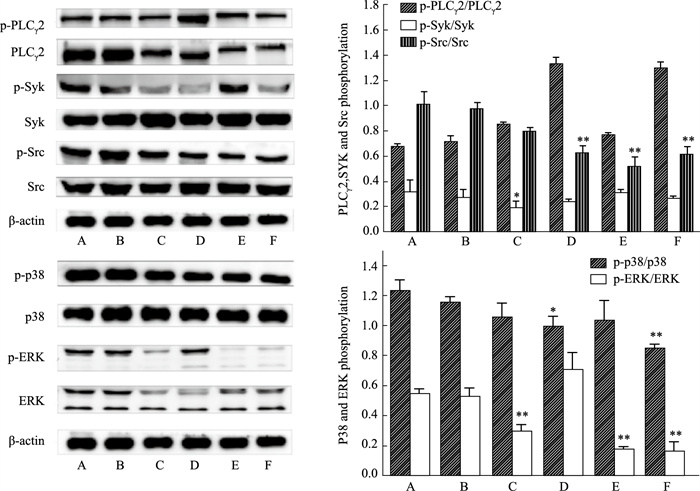
|
| Fig 2 Effect of WEAE-M 30% on protein expression of GPVI, MAPK pathways (x±s, n=3) A: Blank; B: Collagen; C: Collagen+Aspirin; D: Collagen+WEAE-M 30% (50 mg·L-1); E: Collagen+WEAE-M 30% (100 mg·L-1); F: Collagen+WEAE-M 30% (200 mg·L-1). *P < 0.05, **P < 0.01 vs blank |
如Fig 3所示,与空白组比较,不同浓度WEAE-M 30%对ATP释放具有明显抑制作用(P < 0.01),200 mg·L-1组效果最好,ATP释放量比空白组的减少了53.00%;而Aspirin对ATP的释放没有明显影响。
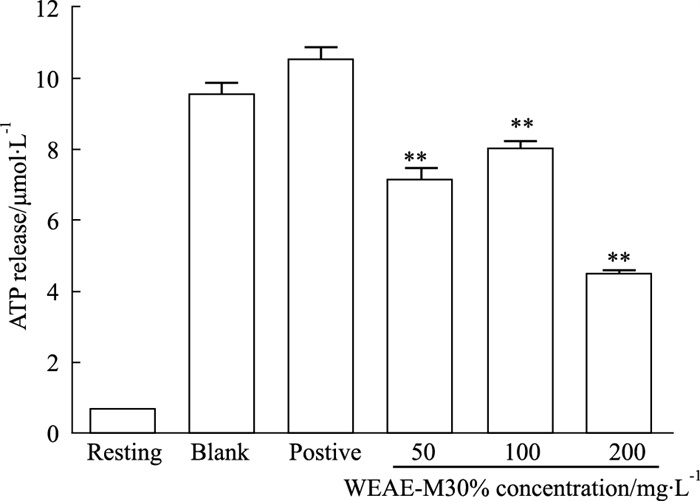
|
| Fig 3 Effect of WEAE-M 30% on platelet ATP release induced by collagen (x±s, n=6) **P < 0.01 vs blank |
如Fig 4所示,与空白组比较,100和200 mg·L-1的WEAE-M 30%对血小板内cAMP和cGMP的释放有促进作用,但差异无统计学意义(P>0.05);阳性药Aspirin能使血小板内cGMP含量明显升高(P < 0.01)。
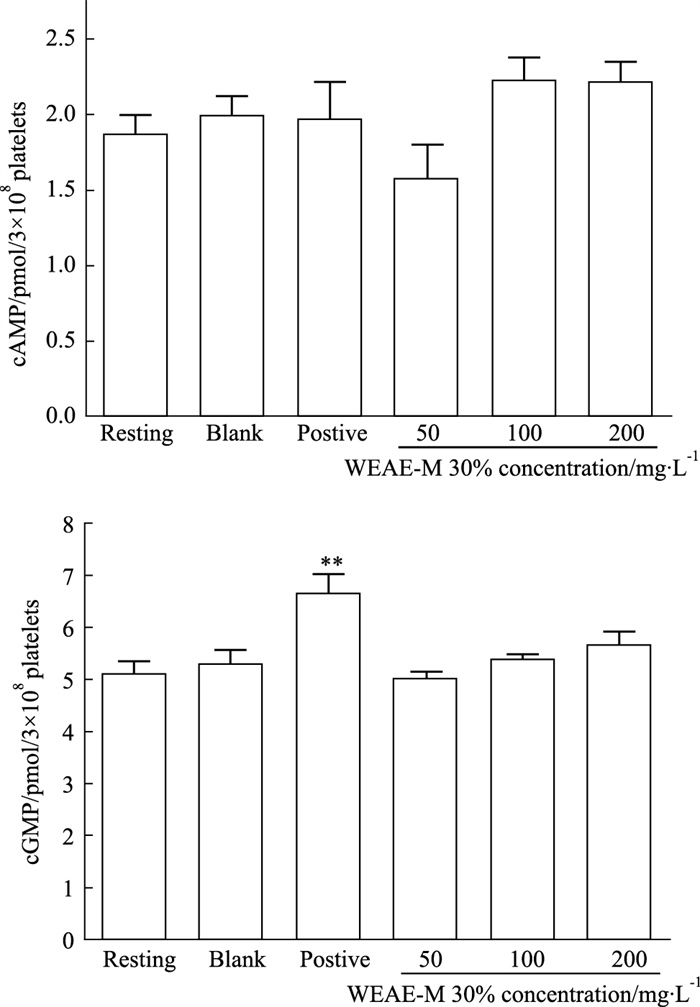
|
| Fig 4 Effect of WEAE- M 30% on platelet cAMP and cGMP release induced by collagen (x±s, n=6) **P < 0.01 vs blank |
如Fig 5所示,与空白组比较,不同浓度WEAE-M 30%对TXB2水平均有明显影响(P < 0.01),100、200 mg·L-1浓度对TXB2的水平影响相当;与阳性组比较,高、中、低剂量组均表现出明显优势。与空白组比较,不同浓度WEAE-M 30%对血小板6-keto-PGF1α的水平均有明显抑制作用(P < 0.01)。
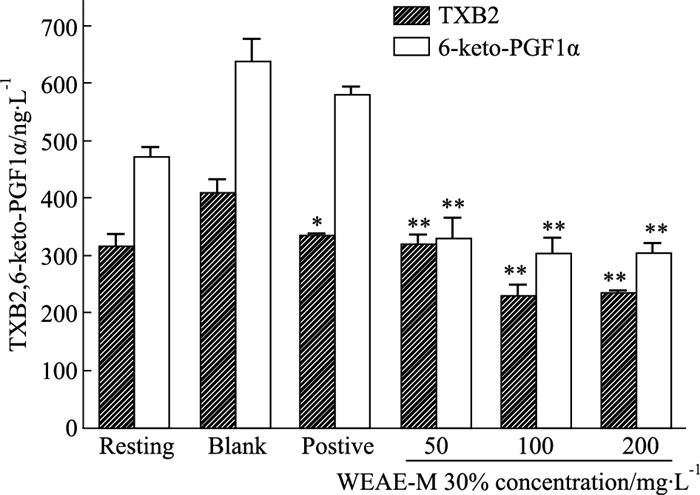
|
| Fig 5 Effect of WEAE-M 30% on contents of TXB2 and 6-Keto-PGF1α (x±s, n=6) *P < 0.05, **P < 0.01 vs blank |
与空白组比较(Fig 6),不同浓度WEAE-M 30%对血小板钙离子活化均有明显影响(P < 0.01),表现为抑制钙离子活化;在WEAE-M 30%浓度为200 mg·L-1时效果最好,钙离子浓度仅为(52.50±5.57) nmol·L-1,比阳性组减少了85%。
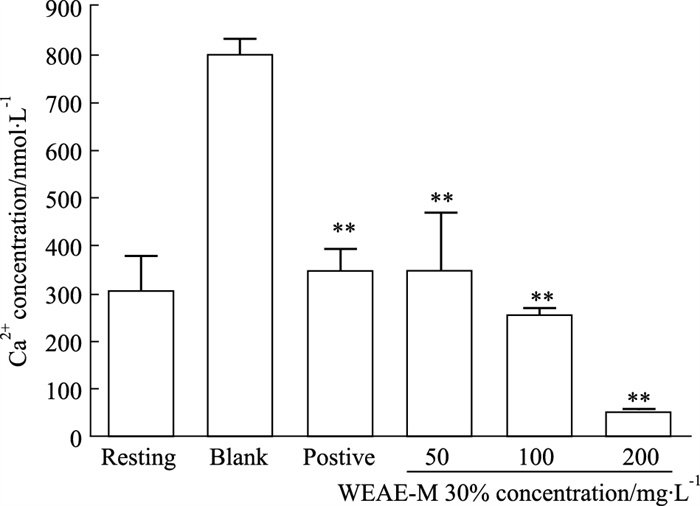
|
| Fig 6 Effect of WEAE-M 30% on intracellular calcium ion concentration of platelets induced by collagen (x±s, n=6) **P < 0.01 vs blank |
结果如Fig 7所示,与空白组比较,在WEAE-M 30%浓度为50、200 mg·L-1时,对血小板P-selection表达有明显抑制作用(P < 0.05),在浓度为100 mg·L-1,无明显影响;与阳性组比较,抑制活性较弱。说明WEAE-M 30%在Collagen诱导下对P-selection表达有一定的抑制作用,但抑制活性低于阳性组。
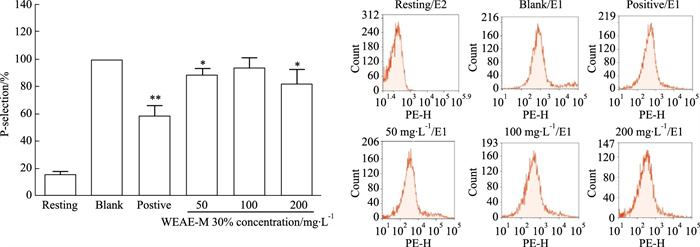
|
| Fig 7 Effect of WEAE-M 30% on CD62P expression in platelets induced by collagen (x±s, n=6) *P < 0.05, **P < 0.01 vs blank |
糖蛋白Ⅵ(GPⅥ)为血小板膜糖蛋白受体,仅在血小板和巨核细胞表达,GPⅥ可由胶原等激动剂诱导活化,继而引起颗粒内容物的释放和血小板内的信号转导[13]。在血小板中,Fc-受体-γ链与GPVI受体均可表达,当GPVI与胶原蛋白结合时,Src家族激酶被激活而引起Syk的酪氨酸磷酸化,此时两衔接蛋白将PLCγ2等连接在一起从而形成复合物,且活化PI3K、PLCγ2蛋白,激活其共同活化途径的整合素αIIbβ3。αIIbβ3进一步导致MAPK家族中JNK、ERK和p38磷酸化,最后引起血小板活化、聚集、释放等反应[14-15]。本研究中,WEAE-M 30%对Collagen介导的血小板GPVI信号通路蛋白Src,MAPK信号通路蛋白p38、ERK蛋白磷酸化水平的表达均有明显抑制作用。目前,已发现多种抗血小板聚集作用的相关机制,例如增加血小板细胞内cGMP与cAMP含量,抑制花生四烯酸(AA)的生成以及MAPK、NO、ATP酶的活性等[16]。cGMP和cAMP水平在正常情况下处于动态平衡,当血小板细胞内cGMP、cAMP水平稍有升高就会明显抑制血小板ATP释放、抑制血栓素合成、降低钙离子浓度以及抑制血小板活化[17]。当血小板被激活时,花生四烯酸(AA)会形成不稳定的过氧化物PGG2和PGH2,在血栓素合成酶(TXAS)和PGI2合成酶的催化作用下两者分别形成血栓烷素TXA2和PGI2。TXA2可引起血管收缩和血小板聚集,PGI2可增加cAMP的含量,从而抑制血小板聚集。由于TXA2和PGI2性质非常不稳定,迅速代谢难以被检测,因此人们常对二者相对稳定的代谢产物TXB2和6-Keto-PGF1α的浓度变化程度来反映血小板的活化状态。血小板颗粒的释放也是其活化过程的重要步骤,当血小板活化时,血小板需将原存储于血小板内的α-颗粒、致密颗粒和溶酶体中的成分释放到血小板外,其中从致密颗粒内释放出来的成分主要包括ATP、Ca2+、ADP以及5-HT等[6]。本研究中的WEAE-M 30%可明显抑制ATP、Ca2+、血栓素TXB2的释放水平。P-selection是存在于血小板α颗粒膜上的一种糖蛋白,血小板活化后,P-selection在细胞表面迅速表达,释放α粒子,导致白细胞黏附[18]。本研究中的WEAE-M 30%可明显抑制的P-selection释放水平。
综上所述,WEAE-M 30%抗血小板聚集作用可能是通过抑制血小板活化通路GPVI、MAPK蛋白Src、p38、ERK磷酸化表达水平,以及抑制血小板典型代表颗粒ATP、P-selection、Ca2+的释放而发挥其活性作用。
| [1] |
李园园. 冠心宁片抗血栓作用及其对MAPKs信号通路的影响[D]. 杭州: 浙江中医药大学, 2018. Li Y Y. Antithrombotic effect of Guanxinning tablet and its effect on MAPKs signaling pathway. [D]. Hangzhou: Zhejiang Chin Med Univ, 2018. |
| [2] |
Melissa S, Pena B, Rollins A. Environmental exposures and cardiovas-culardisease: A challenge for health and development in low-and middle-income countries[J]. Cardiol Clin, 2017, 1(35): 71-86. |
| [3] |
陈丹丹, 于楠. 新型抗血小板药物的研究进展[J]. 海峡药学, 2018, 30(1): 95-8. Chen D D, Yu N. Research progress of new antiplatelet drugs[J]. Strait Pharm J, 2018, 30(1): 95-8. |
| [4] |
Cosemans J M E M, Angelillo-Scherrer A, Mattheij N J A, et al. The effects of arterial flow on platelet activation, thrombus growth, and stabilization[J]. Cardiovasc Res, 2013, 2: 342-52. |
| [5] |
颜幻. 高粱根提取物抗凝血、止咳、抗炎镇痛作用的研究[D]. 贵阳: 贵州医科大学, 2016. Yuan H. Studies on the effect of extract of sorghum root on anti coagulation, cough and anti inflammation and analgesia[D]. Guiyang: Guizhou Med Univ, 2016. |
| [6] |
王山立. 高粱根抗凝血活性物质基础研究[D]. 贵阳: 贵州大学, 2020. Wang S L. Research on anticoagulant active ingredients from sorghum root[D]. Guiyang: Guizhou Univ, 2020. |
| [7] |
何小苏, 邹红群, 李启艳, 等. 替格瑞洛对大鼠全脑缺血/再灌注损伤的神经保护作用[J]. 中国药理学通报, 2019, 35(3): 413-8. He X S, Zhou H Q, Li Q Y, et al. Neuroprotective effect of ticagrelor against global cerebral ischemia/reperfusion injury in rats[J]. Chin Pharmacol Bull, 2019, 35(3): 413-8. |
| [8] |
程彦. 抗炎抗凝双效融合蛋白TAP-SSL5对血小板功能的影响[D]. 重庆: 第三军医大学, 2012. Cheng Y. Effects of anti-inflammatory and anticoagulant fusion protein TAP-SSLS on platelets function[D]. Chongqing: Army Med Univ, 2012 |
| [9] |
Li Y, Zhang Y R, Cao B, et al. Screening for the antiplatelet aggregation quality markers of Salvia yunnanensis based on an integrated approach[J]. J Pharmaceut Biomed, 2020, 188: 113383. doi:10.1016/j.jpba.2020.113383 |
| [10] |
Son E J, Kim S H, Yang W K. Antiplatelet mechanism of an herbal mixture prepared from the extracts of phyllostachys pubescens leaves and prunus mume fruits[J]. BMC Complem Altern M, 2017, 17(1): 541. doi:10.1186/s12906-017-2032-5 |
| [11] |
申栋帅. AEE在肺栓塞及血瘀动物模型中的抗血栓作用及其抗血小板聚集机制[D]. 北京: 中国农业科学院, 2018. Shen D S. Antithrombosis effect on pulmonary thromboembolism and blood stasis animal model of AEE and its anti-platelet aggregation mechanism. [D]. Beijing: Chin Acad Agri Sci, 2018 |
| [12] |
徐耑. SC99通过Syk/STAT3/PLCγ2信号通路抑制血小板聚集的实验研究[D]. 苏州: 苏州大学, 2017. Xu Z. SC99 Inhibits platelet aggregation via Syk/STAT3/PLCγ2 signaling pathway[D]. Suzhou: Soochow Univ, 2017. |
| [13] |
周雅君, 曹陶. 新的血小板活化诊断标志物sGPVI及其临床意义[J]. 广东医学, 2019, 40(20): 2970-3. Zhou Y J, Cao T. New diagnostic marker sGPVI for platelet activation and its clinical significance[J]. Guangdong Med J, 2019, 40(20): 2970-3. |
| [14] |
Kasahara K, Kaneda M, Miki T, et al. Clot retraction is mediated by factor XⅢ-dependent fibrin-aⅡbb3-myosin axis in platelet sphingomyelin-rich membrane rafts[J]. Blood, 2013, 122(19): 3340-8. |
| [15] |
Zhang Y, Hong Z C, Yuan Z X, et al. Extract from rostellularia procumbens (L.) nees inhibits thrombosis and platelet aggregation by regulating integrin β3and MAPK pathways[J]. ACS Omega, 2020, 5: 32123-30. |
| [16] |
Ruggeri Z M, Mendolicchio G L. Adhesion mechanisms in platelet function[J]. Circ Res, 2007, 100(12): 1673-85. |
| [17] |
Kapoor J. Platelet activation and atherothrombosis[J]. New Engl. J Med, 2008, 358(15): 1638-9. |
| [18] |
Kolaczkowska E., Kubes P. Neutrophil recruitment and function in health and inflammation[J]. Nat Rev Immunol, 2013, 13: 159-75. |