

慢性疼痛是骨关节炎(osteoarthritis,OA)的主要症状,也是临床治疗面临的棘手问题[1]。骨关节炎性痛(osteoarthritic pain)由组织损伤和神经病变共同引起,机械性痛觉超敏(mechanical allodynia)为其典型特征[2],包括静态痛觉超敏(static allodynia)和动态痛觉超敏(dynamic allodynia)。
实验动物的OA模型按诱发方式,可分为自发性、手术诱导和非手术诱导三类[1]。内侧半月板-胫骨韧带切断术(destabilization of the medial meniscus,DMM)是一种常用的手术诱导的骨关节炎模型,手术造成的小鼠膝关节不稳定会诱发软骨组织和神经病变,导致慢性病理性疼痛的形成,并且痛觉超敏症状与关节病变的发展程度存在明显的相关性[3-5]。
如意珍宝片是在藏药如意珍宝丸的基础上发展的一种新剂型,由珍珠母、沉香、石灰华等组成。如意珍宝片主要用于清热醒脑、舒筋通络、关节不利、治疗白脉病等神经系统疾病。我们先前的研究发现,在脊髓背角中,NMDA受体(N-methyl-D-aspartate receptors)功能亢进参与病理性疼痛的发生、发展,GABAA能去抑制可增加NMDA受体GluN1亚基第897位丝氨酸磷酸化(pS897-GluN1),提高GluN1亚基的突触分布,导致痛觉敏化[6]。本文旨在探究如意珍宝片缓解骨关节炎性痛的分子机制。
1 材料与方法 1.1 实验动物C57BL/6小鼠(♂),年龄8~12周,由兰州大学实验动物中心提供(动物合格证号:SCXK(甘) 2018-0002)。
1.2 主要材料如意珍宝片(甘肃奇正藏药有限公司;批准文号:国药准字Z20100061;生产批号:2003001)、多聚甲醛(Sigma-Aldrich,货号:158127)、正常山羊血清(Jackson ImmunoResearch,货号:138751)、山羊抗兔GluN1- pS897抗体(Millipore,货号:06-641)、Cy3偶联的山羊抗兔荧光二抗(Abcam,货号:ab6939)、AMPA受体阻断剂CNQX(Sigma-Aldrich,货号:C127)、NMDA受体阻断剂D-APV(Sigma-Aldrich,货号:A8054)、甘氨酸受体阻断剂strychnine (Sigma-Aldrich,货号:S450162)、钠通道阻断剂TTX(Sigma-Aldrich,货号:SML0378)、GABAA受体阻断剂bicuculline (Sigma-Aldrich,货号:B8398)、Von Frey纤维针(Stoehing,USA)、自制毛刷、BX51WIF荧光显微镜(Olympus,Japan)、Axon700B型膜片钳放大器(Axon Instrument,America)、冷冻切片机(Leica,Germany)、体式显微镜(上海蔡康光学仪器有限公司)、FV1200型激光共聚焦显微镜(Olympus Corporation,Japan)、ZQP-86型振动切片机(上海之信仪器有限公司)。
1.3 DMM模型在进行DMM手术之前,对小鼠进行痛觉筛选,连续3 d进行行为学测试,并剔除痛觉异常的小鼠(50%缩足反应阈值< 1 g,毛刷诱发的痛行为评分>0.5),对痛觉测试结果在正常范围内的小鼠造模。小鼠用戊巴比妥钠(90~120 mg·kg-1)腹腔注射麻醉。在体式显微镜下,无菌操作,行左侧膝关节髌骨内侧切口,暴露、并横断内侧半月板-胫骨韧带[3, 7]。右侧(假手术侧)仅做皮肤切口。逐层缝合伤口。
1.4 灌胃给药如意珍宝片研磨、粉碎,以每0.625、1.25、2.5 g·L-1比例溶解于蒸馏水。按照20 mL·kg-1的比例灌胃,即相当于每只小鼠给予如意珍宝片12.5、25、50 mg·kg-1,每天给药1次,连续给药6 d。
1.5 行为学测定 1.5.1 静态痛觉超敏将小鼠放在底部为金属铁丝网的测试笼里,适应30 min,在造模前、后的不同时间点,使用不同力度的von Frey纤维,垂直刺激小鼠的后足底掌心皮肤,观察小鼠的撤足和舔足反应,以up-down法[8-9],按照下列公式,计算50%缩足反应阈值(paw withdrawal thresholds,PWT):
50% PWT (g)=(10[Xf+K·δ])/10 000;Xf=最小von Frey力度值,K=常数,δ=0.26。
1.5.2 动态痛觉超敏将小鼠放在底部为金属铁丝网的测试笼里,适应30 min,在造模前、后的不同时间点,以特制的毛刷[10],从足跟向足尖方向轻刷小鼠的足底皮肤,以下列标准判定动物的疼痛分值[11]:
0:移步或简单的抬足;
1:持续抬足,时间超过2 s;
2:连续后足抖动;
3:舔足;
每只小鼠测试3次,每次间隔2 min,计算3次的平均值。
1.6 免疫组化染色小鼠用戊巴比妥钠(90~120 mg·kg-1)腹腔注射麻醉,左心室逆向灌注4 ℃的20 mL生理盐水和10 mL的多聚甲醛,分离腰膨大部脊髓,用30%的蔗糖溶液4 ℃脱水过夜;冰冻切片机切取厚16 μm组织片;在包含0.25% Triton X-100和10%正常山羊血清的PBS中4 ℃封闭过夜;加入一抗,4 ℃过夜;加入二抗,在暗处室温孵育2 h。封片。激光共聚焦显微镜拍片[8]。
1.7 电生理学记录小鼠用戊巴比妥钠(90~120 mg·kg-1)麻醉,脊髓转入4 ℃、充氧(95% O2+5% CO2) 的蔗糖溶液(mmol:50.0 sucrose,95.0 NaCl,1.8 KCl,0.5 CaCl2,7.0 MgSO4,1.2 KH2PO4,26.0 NaHCO3,15.0 D-glucose,pH 7.4),体式显微镜下,快速剥离脊膜,固定于琼脂槽,横向切取300 μm的脊髓片,转入记录槽,灌流(5 mL·min-1)充氧的ACSF至少1 h后,以BX51WIF荧光显微镜的40倍物镜,挑选Ⅱ板层的健康细胞,在电压钳模式下(钳制电压0 mV),以Axon700B型放大器记录mIPSCs,充灌电极内液(mmol:110.0 Cs2SO4,5.0 KCl,2.0 MgCl2,0.5 CaCl2,5.0 HEPES,5.0 EGTA,5.0 Mg-ATP,0.5 Na-GTP,pH 7.2,295~300 mOsm)的电极电阻为3~8 MΩ,细胞外液中加入AMPA受体阻断剂CNQX (10.0 μmol)、NMDA受体阻断剂D-APV(50.0 μmol)、甘氨酸受体阻断剂strychnine(2 μmol)和钠通道阻断剂TTX (0.5 μmol)。钳制电压在-70 mV,记录mEPSCs,电极内液为(mmol):115 CsMeSO4,20 CsCl,10 HEPES,2.5 MgCl2,4 Na-ATP,0.4 Na-GTP,0.6 EGTA,10 sodium phosphocreatine (pH 7.25,295-300 mOsm),细胞外液中加入GABAA受体阻断剂bicuculline(10 μmol)、strychnine (2 μmol)和TTX(0.5 μmol)。实时监测串联阻抗和输入阻抗的变化,任一阻抗的变化超过15%则细胞弃用。信号的过滤频率2 kHz,采样率为10 kHz[8]。
1.8 统计学分析所有数据以x±s表示。Mini-analysis软件分析mEPSCs和mIPSCs的幅值和频率。Image-Pro Plus 6.0软件分析单位面积下pS897-GluN1的光密度值。组间检验使用Kruskal-Wallis检验。
2 结果 2.1 如意珍宝片对DMM诱发的静态痛觉超敏的影响我们在测定小鼠的基础痛阈后,制备左侧DMM模型,连续监测痛阈的变化。结果显示:从造模后d 7开始,von Frey纤维诱发的左侧缩足反应阈值(PWT)显著下降(Fig 1A),而右侧(假手术侧)的痛阈却没有明显变化,在实验期内始终维持稳定(Fig 1A),说明DMM诱发出了静态痛觉超敏。随后,我们灌胃给予生理盐水、如意珍宝片小剂量(12.5 g·kg-1,Fig 1B)、中剂量(25 mg·kg-1,Fig 1C)和大剂量(50 mg·kg-1,Fig 1D),每天给药1次,连续给药6 d,发现:生理盐水不会对静态痛觉超敏产生明显的影响(Fig 1A)。灌胃给予如意珍宝片,能够剂量依赖性地升高左侧PWT值(Fig 1B-1D);在末次给药后,各组动物的左侧PWT值如Fig 1E所示,和DMM动物相比,25 mg·kg-1和50 mg·kg-1的如意珍宝片能够显著提高PWT值,有效缓解静态痛觉超敏。
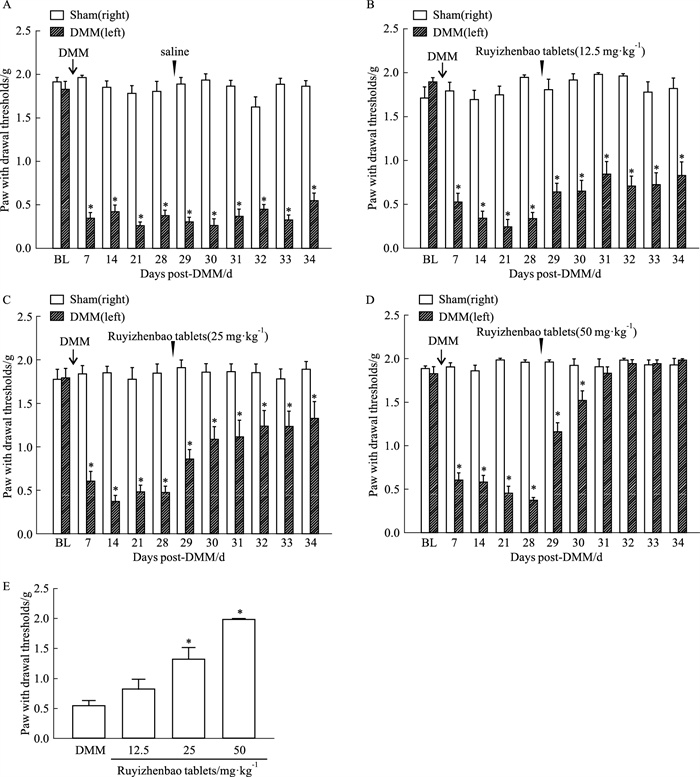
|
| Fig 1 Effect of Ruyizhenbao tablets on static allodynia induced by DMM(x±s, n=10~12) A: Changes of PWTs between DMM and sham groups after injection of saline. B: Changes of PWTs between DMM and sham groups after injection of Ruyizhenbao tablets (12.5 mg·kg-1). C: Changes of PWTs between DMM and sham groups after injection of Ruyizhenbao tablets (25 mg·kg-1). D: Changes of PWTs between DMM and sham groups after injection of Ruyizhenbao tablets (50 mg·kg-1). E: Effects of different doses of Ruyizhenbao tablets on static alladynia in DMM mice.BL: The baseline of pain threshold. The arrows showed the time point of the corresponding treatment. *P < 0.05 vs DMM group. |
相比于静态痛觉超敏,动态痛觉超敏的临床治疗更为困难。DMM会诱发明显的动态痛觉超敏(Fig 2A),表现为非伤害性的轻微毛刷刺激也会引起小鼠的撤足、舔足等痛行为;这些痛反应在DMM后7 d即出现,而右侧(假手术侧)则不会对毛刷刺激产生明显的反应(Fig 2A)。灌胃给予生理盐水不会对痛行为的评分值产生任何影响(Fig 2A)。但灌胃给予如意珍宝片,能够剂量依赖性地降低痛反应(Fig 2B-2D);在末次给药后,各组动物的左侧痛行为评分如Fig 2E所示,和DMM动物相比,50 mg·kg-1的如意珍宝片能够显著降低痛行为评分,有效缓解动态痛觉超敏。
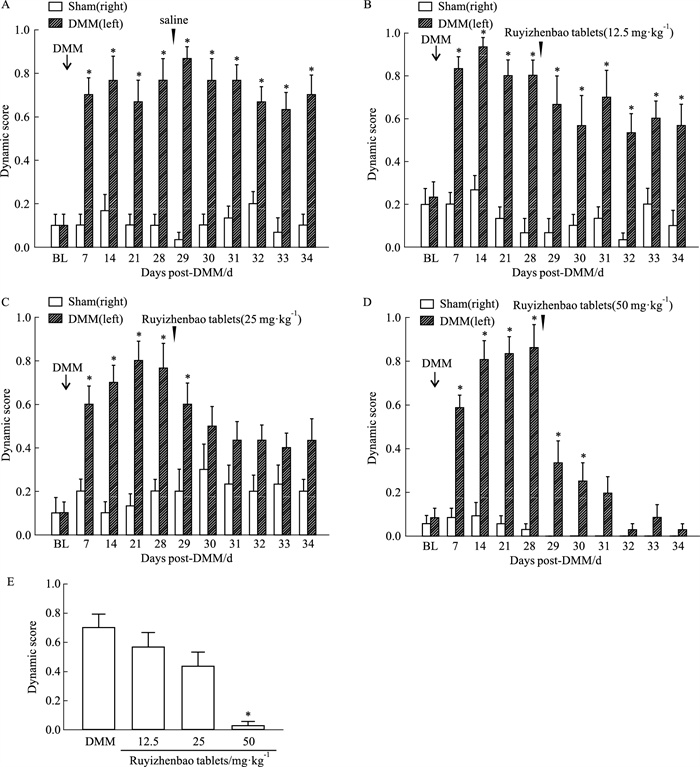
|
| Fig 2 Effect of Ruyizhenbao tablets on dynamic allodynia induced by DMM(x±s, n=10~12) A: Time-dependent changes of dynamic score between DMM and sham groups after injection of saline. B: Time-dependent changes of dynamic score between DMM and sham groups after injection of Ruyizhenbao tablets (12.5 mg·kg-1). C: Time-dependent changes of dynamic score between DMM and sham groups after injection of Ruyizhenbao tablets (25 mg·kg-1). D: Time-dependent changes of dynamic score between DMM and sham groups after injection of Ruyizhenbao tablets (50 mg·kg-1). E: Effects of different doses of Ruyizhenbao tablets on dynamic score in DMM mice.BL: The baseline of pain threshold. The arrows showed the time point of the corresponding treatment. *P < 0.05 vs sham group. |
在DMM诱发小鼠痛觉超敏后4周,灌胃给予不同剂量的如意珍宝片,每天给药1次,连续6 d;在末次给药后0.5~1 h,切取离体脊髓片,记录AMPA受体介导的微小兴奋性突触后电流(mEPSCs)。结果显示:DMM可显著提高mEPSCs的频率(Fig 3A),和假手术对照组相比,差异具有显著性(Fig 3B);灌胃给予如意珍宝片(12.5 mg·kg-1,25 mg·kg-1和50 mg·kg-1),能够剂量依赖性的降低mEPSCs的频率(Fig 3B)。然而,DMM后,mEPSCs的幅值没有明显的变化(Fig 3C),和对照组相比,差异无显著性;各剂量的如意珍宝片也不会对mEPSCs的幅值产生明显影响(Fig 3C),提示:如意珍宝片可能通过突触前机制,阻滞痛觉信息的传递。
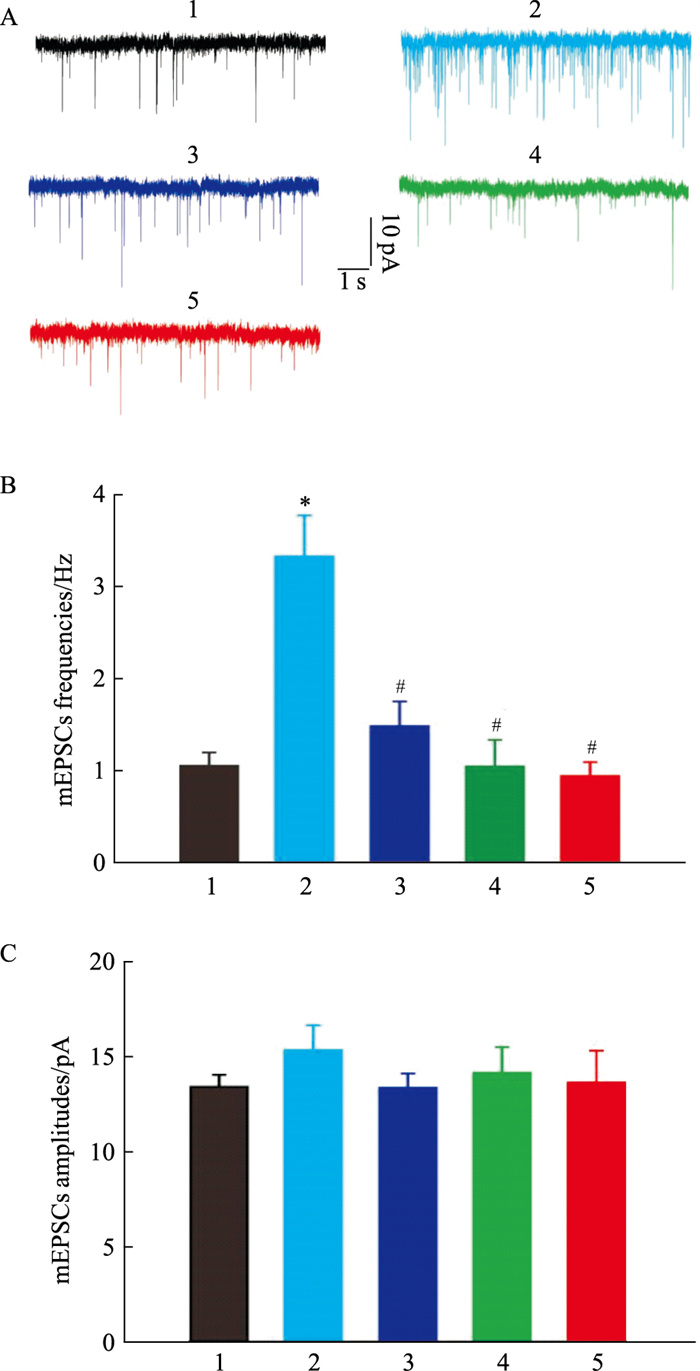
|
| Fig 3 Effect of Ruyizhenbao tablets on frequency (A, B) and amplitude (A, C) of mEPSCs in spinal cord dorsal horn of DMM mice (x±s, n=10-12) 1:Sham; 2:DMM; 3:Ruyizhenbao tablets/12.5 mg·kg-1; 4:Ruyizhenbao tablets/25 mg·kg-1; 5:Ruyizhenbao tablets/50 mg·kg-1.*P < 0.05 vs sham group (Kruskal-Wallis test), #P < 0.05 vs DMM group (Kruskal-Wallis test). |
在DMM诱发小鼠痛觉超敏后4周,灌胃给予不同剂量的如意珍宝片,每天给药1次,连续6 d;在末次给药后0.5~1 h,切取离体脊髓片,记录GABAA受体介导的微小抑制性突触后电流(mIPSCs)。结果显示:DMM可降低mIPSCs的频率和幅值(Fig 4A),和假手术对照组相比,差异具有显著性(Fig 4B-4C),提示:DMM诱发了脊髓去抑制。然而,灌胃给予如意珍宝片不会对mIPSCs的频率和幅值产生明显影响(Fig 4A),和模型组动物相比较,差异无统计学意义(Fig 4B-4C),提示:如意珍宝片不能逆转DMM诱发的脊髓去抑制。
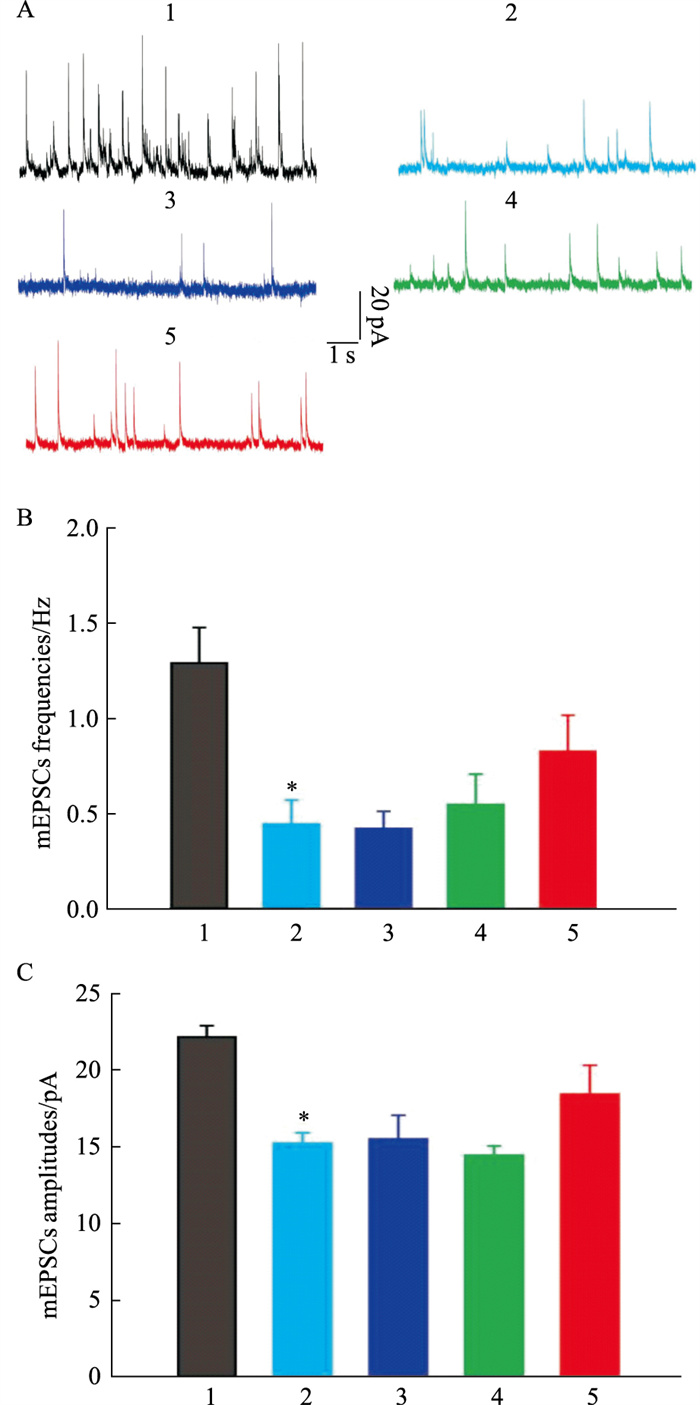
|
| Fig 4 Effect of Ruyizhenbao tablets on frequency (A, B) and amplitude (A, C) of mIPSCs in spinal cord dorsal horn of DMM mice(x±s, n=10-12) 1:Sham; 2:DMM; 3:Ruyizhenbao tablets/12.5 mg·kg-1; 4:Ruyizhenbao tablets/25 mg·kg-1; 5:Ruyizhenbao tablets/50 mg·kg-1.*P < 0.05 (Kruskal-Wallis test). |
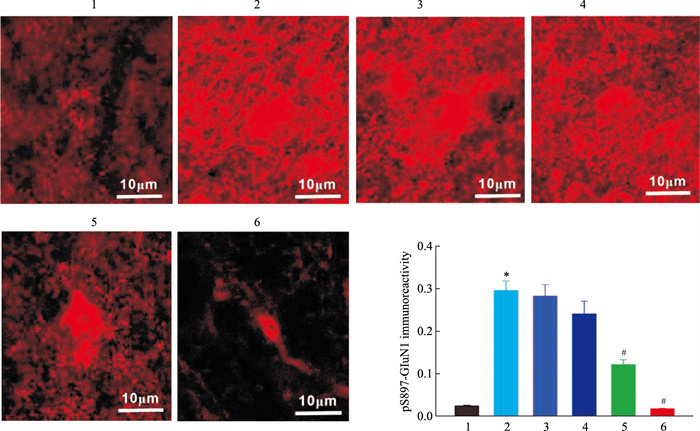
在DMM诱发小鼠痛觉超敏后4周,我们灌胃给予不同剂量的如意珍宝片,每天给药1次,连续6 d;在末次给药后0.5~1 h,在脊髓背角观察NMDA受体pS897-GluN1的变化。结果显示:和对照组相比,DMM小鼠的单位面积下pS897-GluN1的免疫反应强度明显升高(Fig 5),而如意珍宝片能够剂量依赖性地降低pS897-GluN1水平(Fig 5)。
|
| Fig 5 Effect of Ruyizhenbao tablets on pS897-GluN1 induced by DMM(x±s, n=8) 1: Sham; 2: DMM; 3: DMM/Saline; 4: DMM/12.5 mg·kg-1; 5: DMM/25 mg·kg-1; 6: DMM/50 mg·kg-1.*P < 0.05 vs sham group, #P < 0.05 vs DMM group. |
在骨关节炎疼痛状态下,关节软骨退化严重,滑膜及半月板中的血管生成增加,刺激关节处感觉神经生长,多种炎性细胞因子的表达增加,导致关节处炎症的发生。机械性痛觉超敏是骨关节炎患者的典型症状之一,严重影响患者的生活质量。本研究显示,灌胃给予如意珍宝片能够有效缓解DMM诱发的动态痛觉超敏和静态痛觉超敏,提示如意珍宝片对骨关节炎性痛的良好的治疗效果。
外周炎症及神经损伤之后,脊髓背角中兴奋性谷氨酸能突触传递的增强是诱发和维持慢性痛的重要机制。突触前膜递质的释放增加、和/或突触后膜谷氨酸受体的功能亢进,都有可能导致突触传递的增强。mEPSCs的频率和幅值变化,分别代表了突触前膜和突触后膜的功能改变。本研究发现DMM之后,mEPSCs的频率明显提高,但其幅值却没有明显变化,提示DMM可能通过促进突触前膜的递质释放,诱发骨关节炎性痛。我们的结果显示,如意珍宝片能够有效降低mEPSCs的频率,而对其幅值没有明显作用,说明如意珍宝片可能作用于突触前膜,抑制谷氨酸的释放,减弱痛觉信息的传递,从而产生良好的镇痛效果。
兴奋性NMDA型谷氨酸受体的功能亢进是增强痛觉信息传递、提高脊髓背角痛觉传递神经元的兴奋性、诱发和维持机械性痛觉超敏的重要原因。外周组织或神经损伤之后,脊髓背角NMDA受体的磷酸化水平会明显升高[12];磷酸化修饰是导致NMDA受体功能亢进的关键途径[13]。通过免疫组化实验,我们观察了如意珍宝片对NMDA受体GluN1亚基的影响,发现如意珍宝片呈剂量依赖性地降低了GluN1亚基S897位的磷酸化。众所周知,GluN1亚基的S897是cAMP依赖性蛋白激酶的磷酸化位点,我们先前研究发现,GluN1亚基的S897磷酸化水平降低能够减轻炎症疼痛[6]。S897磷酸化水平的降低提示:如意珍宝片可能通过对PKA的活性的抑制来缓解骨关节炎性痛。
我们先前研究表明,脊髓背角中抑制性突触传递的减弱是诱发病理性疼痛的又一关键因素[6]。提高GABA能抑制效率,可产生明显的镇痛效果[14]。我们的研究显示,DMM可降低mIPSCs的频率和幅值,提示脊髓去抑制参与DMM诱发的骨关节炎性痛。然而,各种剂量的如意珍宝片都不会对抑制性突触传递产生明显的影响。因此,我们的研究结果提示,如意珍宝片可能特异性干预兴奋性突触传递,有效缓解骨关节炎性痛。如意珍宝片含有多种成分,其靶向兴奋性突触传递的具体成分和特异性干预兴奋性突触传递的分子机制都不够明确,除此之外,我们尚未检测骨关节炎引起的关节滑液中炎性因子的变化情况,这些问题需要我们进一步的深入研究。
( 致谢: 本实验在兰州大学药学院分子药理学研究所完成,对本实验提供技术支持和实验帮助的老师同学表示感谢。)
| [1] |
Im H J, Kim J S, Li X, et al. Alteration of sensory neurons and spinal response to an experimental osteoarthritis pain model[J]. Arthritis Rheum, 2010, 62(10): 2995-3005. doi:10.1002/art.27608 |
| [2] |
Miller R E, Kim Y S, Tran P B, et al. Visualization of peripheral neuron sensitization in a surgical mouse model of osteoarthritis by in vivo calcium imaging[J]. Arthritis Rheumatol, 2018, 70(1): 88-97. doi:10.1002/art.40342 |
| [3] |
Li H, Ding X, Terkeltaub R, et al. Exploration of metformin as novel therapy for osteoarthritis: Preventing cartilage degeneration and reducing pain behavior[J]. Arthritis Res Ther, 2020, 22(1): 34. doi:10.1186/s13075-020-2129-y |
| [4] |
Gervais J A, Otis C, Lussier B, et al. Osteoarthritic pain model influences functional outcomes and spinal neuropeptidomics: A pilot study in female rats[J]. Can J Vet Res, 2019, 83(2): 133-41. |
| [5] |
Malfait A M, Ritchie J, Gil A S, et al. ADAMTS-5 deficient mice do not develop mechanical allodynia associated with osteoarthritis following medial meniscal destabilization[J]. Osteoarthritis Cartilage, 2010, 18(4): 572-80. doi:10.1016/j.joca.2009.11.013 |
| [6] |
Cao J, Yang X, Liu Y N, et al. GABAergic disinhibition induced pain hypersensitivity by upregulating NMDA receptor functions in spinal dorsal horn[J]. Neuropharmacology, 2011, 60(6): 921-9. doi:10.1016/j.neuropharm.2011.01.034 |
| [7] |
Hwang S M, Feigenson M, Begun D L, et al. Phlpp inhibitors block pain and cartilage degradation associated with osteoarthritis[J]. J Orthop Res, 2018, 36(5): 1487-97. doi:10.1002/jor.23781 |
| [8] |
Zhang Z Y, Bai H H, Guo Z, et al. Ubiquitination and functional modification of GluN2B subunit-containing NMDA receptors by Cbl-b in the spinal cord dorsal horn[J]. Sci Signal, 2020, 13(638): eaaw1519. doi:10.1126/scisignal.aaw1519 |
| [9] |
薛曼, 杨云惠, 索占伟, 等. 蛋白酪氨酸磷酸酶SHP-2在Ⅰ型代谢型谷氨酸受体诱发痛觉超敏中的作用[J]. 中国药理学通报, 2017, 33(2): 171-4. Xue M, Yang Y H, Suo Z W, et al. Role of protein tyrosine phosphatase SHP-2 in group I metabotropic glutamate receptors-induced allodynia[J]. Chin Pharmacol Bull, 2017, 33(2): 171-4. doi:10.3969/j.issn.1001-1978.2017.02.006 |
| [10] |
Duan B, Cheng L, Bourane S, et al. Identification of spinal circuits transmitting and gating mechanical pain[J]. Cell, 2014, 159(6): 1417-32. doi:10.1016/j.cell.2014.11.003 |
| [11] |
Cheng L, Duan B, Huang T, et al. Identification of spinal circuits involved in touch-evoked dynamic mechanical pain[J]. Nat Neurosci, 2017, 20(6): 804-14. doi:10.1038/nn.4549 |
| [12] |
Yang L, Bai H H, Zhang Z Y, et al. Disruption of SHP1/NMDA receptor signaling in spinal cord dorsal horn alleviated inflammatory pain[J]. Neuropharmacology, 2018, 137: 104-13. doi:10.1016/j.neuropharm.2018.04.029 |
| [13] |
Wang J Q, Guo M L, Jin D Z, et al. Roles of subunit phosphorylation in regulating glutamate receptor function[J]. Eur J Pharmacol, 2014, 728: 183-7. doi:10.1016/j.ejphar.2013.11.019 |
| [14] |
Du X, Hao H, Yang Y, et al. Local GABAergic signaling within sensory ganglia controls peripheral nociceptive transmission[J]. J Clin Invest, 2017, 127(5): 1741-56. doi:10.1172/JCI86812 |

