

2. 河北省中医药康养照护研究重点实验室,河北 石家庄 050200;
3. 河北中医学院中西医结合学院,河北 石家庄 050200
2. Hebei Key Laboratory of Traditional Chinese Medicine Health Care, Shijiazhuang 050200, China;
3. China College of Imtegrative Medicine, Hebei University of Chinese Medicine, Shijiazhuang 050200, China
乳腺癌(breast cancer,BC)是发生在乳腺腺上皮组织的一种恶性肿瘤。近年来发病率持续上升,并且呈年轻化趋势,是严重威胁我国乃至全世界女性健康的恶性肿瘤之一。乳腺癌中医称为“乳岩”、“乳石痈”,以乳房部肿块,质地坚硬,疼痛日增为主要表现[1]。
中草药抗肿瘤临床应用历史悠久,雷公藤(Tripterygium wilfordii Hook. f.)为卫矛科雷公藤属木质藤本植物,具有活血通络、消肿止痛等功效。始载于《神农本草经》,主治头风、痈肿、乳肿、疝瘕[2]。中医认为乳腺癌的治疗应活血化瘀、软坚散结。雷公藤活血通络,消肿散结止痛,切中病机,能对乳岩发挥很好的治疗作用。临床研究显示,在三阴性乳腺癌的辨证施治过程中,对照组给予柴胡疏肝散和补中益气汤,实验组在此基础上加用雷公藤治疗,可显著提高实验组患者的三年生存率[3]。现代药理学研究发现,雷公藤主要活性成分对乳腺癌、肺癌、前列腺癌、卵巢癌等多种肿瘤细胞具有抑制作用[4-5]。
为了进一步研究雷公藤的抗乳腺癌作用,从而更好的应用于临床。本研究利用网络药理学及分子对接技术筛选雷公藤活性成分,寻找其与乳腺癌靶点之间的关系。并利用细胞学实验进一步验证核心成分的抗乳腺癌活性。为雷公藤抗乳腺癌机制研究提供基础数据。
1 材料与方法 1.1 雷公藤活性成分获取利用中药系统药理学分析平台(TCMSP,http://www.tcmspw.com/tcmsp.php)收集雷公藤所有化学成分信息。由于成分较多,首先根据口服生物利用度(oral bioavailability,OB≥30%)和类药性(drug-likeness,DL≥0.18)初步筛选活性成分,并根据目前已报道的雷公藤抗肿瘤成分进行增补,最终确定药物活性成分。收集活性成分作用靶点,删除无靶点成分。
1.2 雷公藤抗乳腺潜在靶标筛选利用Uniprot数据库(http://www.uniprot.org/)将收集的雷公藤靶标蛋白转化为基因ID,物种来源限制为人(“Homo Sapiens”)。在人类基因数据库GeneCard(http://www.genecards.org)检索与乳腺癌相关的靶标基因,选取评分较高相关性较强的基因与雷公藤活性成分作用靶点取交集,作为雷公藤治疗乳腺癌的潜在靶标。
1.3 活性成分-靶点网络构建与分析利用Cytoscape3.6.0软件构建雷公藤治疗乳腺癌“活性成分-靶点”网络,同时对该网络进行核心成分分析。根据Degree值(连接度)最终认定雷公藤治疗乳腺癌的核心成分。
1.4 基因本体(gene ontology,GO)分子功能富集分析应用Metascape数据库(http://metascape.org/)对雷公藤治疗乳腺癌的潜在靶点进行GO分子功能富集分析。
1.5 京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析应用Metascape和DAVID数据库(http://david.ncifcrf.gov/)对雷公藤治疗乳腺癌潜在靶点进行KEGG通路富集分析,对相关性前20的通路进一步剖析。
1.6 蛋白质互作网络(protein-protein interaction,PPI)构建将筛选的潜在靶点导入蛋白互作网络分析平台String数据库,构建蛋白质互作网络。利用Cytoscape3.6.0软件,对该网络进行核心靶点分析,取degree值排名前3的靶点作为雷公藤治疗乳腺癌的核心靶点以备进一步分子对接。
1.7 雷公藤与乳腺癌治疗核心靶点的分子对接TCMSP数据库中下载核心成分的3D结构,保存为mol2格式。PDB网站(http://www.rcsb.org/)下载靶蛋白结构,利用AutoDock Vina软件进行分子对接。使用GraphPad Prism 8、Pymol和Maestro 11.9软件对上述对接结果进行分析并绘图。
1.8 CCK-8实验检测雷公藤核心成分雷公藤红素对乳腺癌细胞的抑制作用采用分子对接技术综合评价活性成分与靶点的结合程度,结果显示雷公藤红素与乳腺癌治疗核心靶点结合度较好。因此,实验进一步验证雷公藤红素对乳腺癌细胞的抑制作用。取对数生长期乳腺癌细胞MCF-7制备单细胞悬液,将细胞以5×104接种于3块96孔板,每孔接种100 μL。每组设6个复孔,加入不同浓度的雷公藤红素,以1 μmol·L-1盐酸阿霉素为阳性对照药,37 ℃、5%CO2及饱和湿度下孵育24、48、72 h,不同时间点后,每孔弃上清液终止培养,用PBS清洗后,每孔加入20 μL CCK-8,在酶标仪振荡混匀,选取波长450 nm测定吸收度(A)。以未加细胞孔为空白对照调零,重复3次。根据下列公式计算细胞抑制率,细胞抑制率/%=(1-实验组吸收度A值/对照组吸收度A值)×100%。根据细胞抑制率确定雷公藤红素对乳腺癌细胞活性的影响,并计算IC50。
1.9 克隆形成实验取对数生长期、状态良好的MCF-7细胞配制细胞悬液,以每孔800个细胞数接种于6孔板,培养过夜后分别加入含0.1、1、10 μmol·L-1不同浓度雷公藤红素的完全培养液,空白对照组加入完全培养液。细胞接受处理48 h后,弃去含雷公藤红素培养液,用无菌PBS洗去残留培养液,并加入新鲜培养液继续培养,隔天换1次培养液。培养箱内孵育14 d后,弃去培养液,用PBS清洗3次,加入甲醇固定15 min,弃去固定液,加入适量新鲜配制的吉姆萨染液染色10 min,流水缓慢洗去染色液,室温风干,在显微镜下计数≥50个细胞的克隆数。重复3次,计算克隆形成率/%=(克隆数/接种细胞数)×100%。
1.10 实时定量聚合酶链锁反应(real-time,PCR)将培养72 h的空白组细胞和给予1 μmol·L-1雷公藤红素的细胞分别加入TRIzol,室温放置10 min,使其充分裂解。加入氯仿,震荡混匀后室温放置15 min,4 ℃,12 000×g离心15 min。小心吸取上层水相,至另一离心管中,加入异丙醇混匀,室温放置10 min,4 ℃,12 000×g离心10 min。弃上清,RNA沉于管底,加入75%乙醇,温和震荡离心管,悬浮沉淀。4 ℃,8 000×g离心5 min,弃尽上清通风厨挥干5 min。25 μL DEPC水溶解,55 ℃,5 min,得到mRNA。选择纯度均在260/280=1.8~2.0之间的mRNA采用Themo逆转录合成试剂盒合成cDNA,再利用SYBR实时荧光定量PCR(real-time,PCR)试剂盒测定基因(引物序列详见表 1)的表达量,再用2-ΔΔCT法求算目的基因的表达量。ΔCT=CT目的基因-CTBeta-actin,ΔΔCT=ΔCT实验组-ΔCT对照组。用2-ΔΔCT表示的是实验组目的基因的表达相对于对照组的变化倍数,当2-ΔΔCT>1时,表明实验组目的基因表达上调,当2-ΔΔ△CT < 1时,表明实验组目的基因表达下降。
| Primer | Forward (5′-3′) | Reverse (5′-3′) |
| TP53 | TCACAGCACATGACGGAGGT | ATGAGCGCTGCTCAGATAGC |
| CCND1 | GCTGCGAAGTGGAAACCATC | CCTCCTTCTGCACACATTTGAA |
| c-MYC | TACAACACCCGAGCAAGGAC | GAGGCTGCTGGTTTTCCACT |
| ESR1 | GAAGTATGGCTATGGAATCTG | TGGCTGGACACATATAGTCGTT |
| Beta-actin | TGACGTGGACATCCGCAAAG | CTGGAAGGTGGACAGCGAGG |
采用GraghPad Prism 7.0软件进行统计分析,实验所有数据满足正态分布均以x±s表示。计量资料多组比较采用单因素方差分析,两组比较采用t检验。
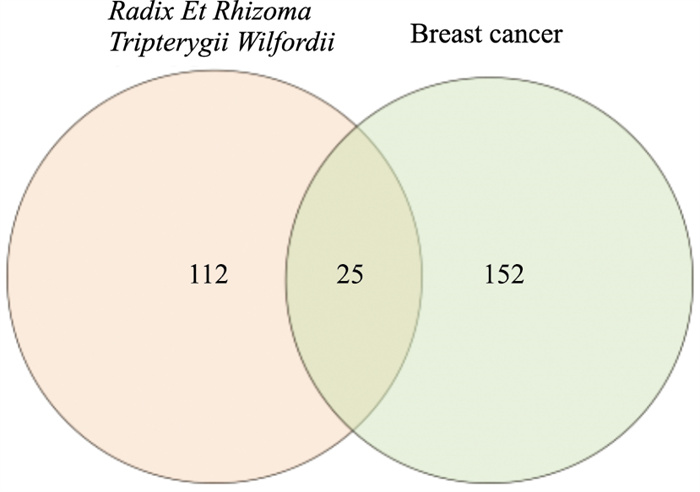
2 结果 2.1 雷公藤治疗乳腺癌的潜在靶点TCMSP平台收集雷公藤所有化学成分信息。根据OB≥30%,DL≥0.18初步筛选并进行增补后,最终确定雷公藤甲素、雷公藤红素、雷酚萜甲醚、异落叶松脂素、川陈皮素、山奈酚等共计52个药物活性成分(Tab 2)。检索GeneCard数据库筛选并删除重复项后共得到乳腺癌相关的靶点共177个,与雷公藤有效成分靶点基因对比后,筛选出雷公藤治疗乳腺癌的潜在靶标25个(Fig 1),具体靶点信息如Tab 3所示。
| Mol ID | Molecule name | OB/% | DL |
| MOL000296 | hederagenin | 36.91 | 0.75 |
| MOL003182 | (+)-Medioresinol di-O-beta-D-glucopyranoside_qt | 60.69 | 0.62 |
| MOL003184 | 81827-74-9 | 45.42 | 0.53 |
| MOL003185 | (1R,4aR,10aS)-5-hydroxy-1-(hydroxymethyl)-7-isopropyl-8-methoxy-1,4a-dimethyl-4,9,10,10a-tetrahydro-3H-phenanthren-2-one | 48.84 | 0.38 |
| MOL003187 | triptolide | 51.29 | 0.68 |
| MOL003188 | Tripchlorolide | 78.72 | 0.72 |
| MOL003189 | WILFORLIDE A | 35.66 | 0.72 |
| MOL003192 | Triptonide | 67.66 | 0.7 |
| MOL003196 | Tryptophenolide | 48.5 | 0.44 |
| MOL003198 | 5 alpha-Benzoyl-4 alpha-hydroxy-1 beta,8 alpha-dinicotinoyl-dihydro-agarofuran | 35.26 | 0.72 |
| MOL003199 | 5,8-Dihydroxy-7-(4-hydroxy-5-methyl- coumarin-3)-coumarin | 61.85 | 0.54 |
| MOL003206 | Canin | 77.41 | 0.33 |
| MOL003208 | Celafurine | 72.94 | 0.44 |
| MOL003209 | Celallocinnine | 83.47 | 0.59 |
| MOL003210 | Celapanine | 30.18 | 0.82 |
| MOL003211 | Celaxanthin | 47.37 | 0.58 |
| MOL003217 | Isoxanthohumol | 56.81 | 0.39 |
| MOL003222 | Salazinic acid | 36.34 | 0.76 |
| MOL003224 | Tripdiotolnide | 56.4 | 0.67 |
| MOL003225 | Hypodiolide A | 76.13 | 0.49 |
| MOL003229 | Triptinin B | 34.73 | 0.32 |
| MOL003231 | Triptoditerpenic acid B | 40.02 | 0.36 |
| MOL003232 | Triptofordin B1 | 39.55 | 0.84 |
| MOL003233 | Triptofordin B2 | 107.71 | 0.76 |
| MOL003234 | Triptofordin C2 | 30.16 | 0.76 |
| MOL003235 | Triptofordin D1 | 32 | 0.75 |
| MOL003236 | Triptofordin D2 | 30.38 | 0.69 |
| MOL003238 | Triptofordin F1 | 33.91 | 0.6 |
| MOL003239 | Triptofordin F2 | 33.62 | 0.67 |
| MOL003241 | Triptofordin F4 | 31.37 | 0.67 |
| MOL003242 | Triptofordinine A2 | 30.78 | 0.47 |
| MOL003244 | Triptonide | 68.45 | 0.68 |
| MOL003245 | Triptonoditerpenic acid | 42.56 | 0.39 |
| MOL003248 | Triptonoterpene | 48.57 | 0.28 |
| MOL003266 | 21-Hydroxy-30-norhopan-22-one | 34.11 | 0.77 |
| MOL003267 | Wilformine | 46.32 | 0.2 |
| MOL003278 | salaspermic acid | 32.19 | 0.63 |
| MOL003279 | 99694-86-7 | 75.23 | 0.66 |
| MOL003280 | TRIPTONOLIDE | 49.51 | 0.49 |
| MOL000358 | beta-sitosterol | 36.91 | 0.75 |
| MOL000211 | Mairin | 55.38 | 0.78 |
| MOL000422 | kaempferol | 41.88 | 0.24 |
| MOL000449 | Stigmasterol | 43.83 | 0.76 |
| MOL002058 | 40957-99-1 | 57.2 | 0.62 |
| MOL003283 | (2R,3R,4S)-4-(4-hydroxy-3-methoxy-phenyl)-7-methoxy-2,3-dimethylol-tetralin-6-ol | 66.51 | 0.39 |
| MOL004443 | Zhebeiresinol | 58.72 | 0.19 |
| MOL005828 | nobiletin | 61.67 | 0.52 |
| MOL007415 | [(2S)-2-[[(2S)-2-(benzoylamino)-3-phenylpropanoyl]amino]-3-phenylpropyl] acetate | 58.02 | 0.52 |
| MOL007535 | (5S,8S,9S,10R,13R,14S,17R)-17-[(1R,4R)-4-ethyl-1,5-dimethylhexyl]-10,13-dimethyl-2,4,5,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthrene-3,6-dione | 33.12 | 0.79 |
| MOL009386 | 3,3′-bis-(3,4-dihydro-4-hydroxy-6-methoxy)-2H-1-benzopyran | 52.11 | 0.54 |
| MOL011169 | Peroxyergosterol | 44.39 | 0.82 |
| MOL003186 | tripterine | 17.84 | 0.78 |
|
| Fig 1 Targets of Tripterygium wilfordii Hook. f. in treatment of breast cancer |
| No | Gene | No | Gene | No | Gene | No | Gene | No | Gene |
| 1 | RELA | 6 | TNF | 11 | BAX | 16 | ESR1 | 21 | ESR2 |
| 2 | STAT3 | 7 | TP53 | 12 | FLT1 | 17 | PGR | 22 | CHEK1 |
| 3 | STAT1 | 8 | TGFB1 | 13 | CASP8 | 18 | AR | 23 | BCL2 |
| 4 | VEGFA | 9 | Cxcr4 | 14 | MMP1 | 19 | PPARG | 24 | AKT1 |
| 5 | PLAU | 10 | CCND1 | 15 | MYC | 20 | TOP2A | 25 | CYP1B1 |
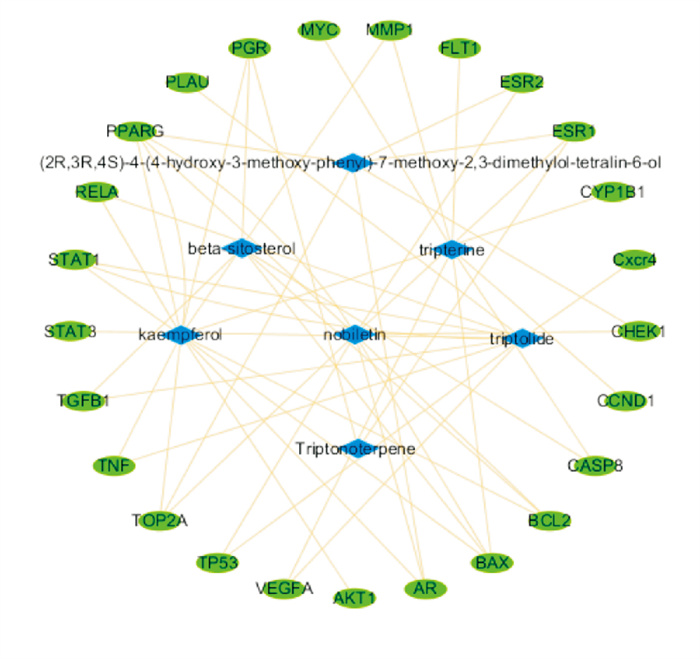
利用Cytoscape3.6.0软件绘制雷公藤治疗乳腺癌的“活性成分-靶点”网络图(Fig 2)。结果筛选出主要活性成分7个,连接度(degree)值前5的活性成分包括雷公藤甲素、雷公藤红素、雷酚萜甲醚、川陈皮素和山奈酚。其中,蓝色代表活性成分,绿色代表作用靶点,边则代表药物与靶点的相互作用。由图可知雷公藤治疗乳腺癌呈现多成分、多靶标的协同特点。
|
| Fig 2 Herb-active ingredient-target network of Tripterygium wilfordii Hook. f. in treatment of breast cancer |
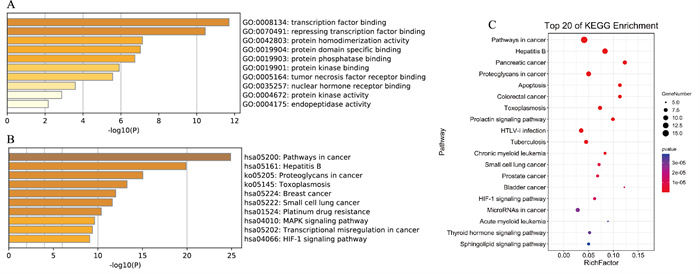
应用Metascape和DAVID数据库对雷公藤治疗乳腺癌的25个潜在靶点进行GO分子功能富集分析及KEGG通路富集分析(Fig 3)。
|
| Fig 3 GO enrichment and KEGG pathway enrichment in potential targets of Tripterygium wilfordii Hook. f. in treatment of breast cancer A: GO enrichment in Metascape Database; B: KEGG pathway enrichment in Metascape Database; C: KEGG pathway enrichment in DAVID Database |
GO分子功能富集结果显示,雷公藤治疗乳腺癌过程中所调节的分子主要涉及转录因子和抑制转录因子、核激素受体及肿瘤坏死因子受体等(Fig 3A)。KEGG信号通路分析结果显示,差异基因富集通路主要与肿瘤相关,包括乳腺癌、胰腺癌、结直肠癌,涉及细胞凋亡、miRNA和MAPK等信号通路过程(Fig 3B、C)。
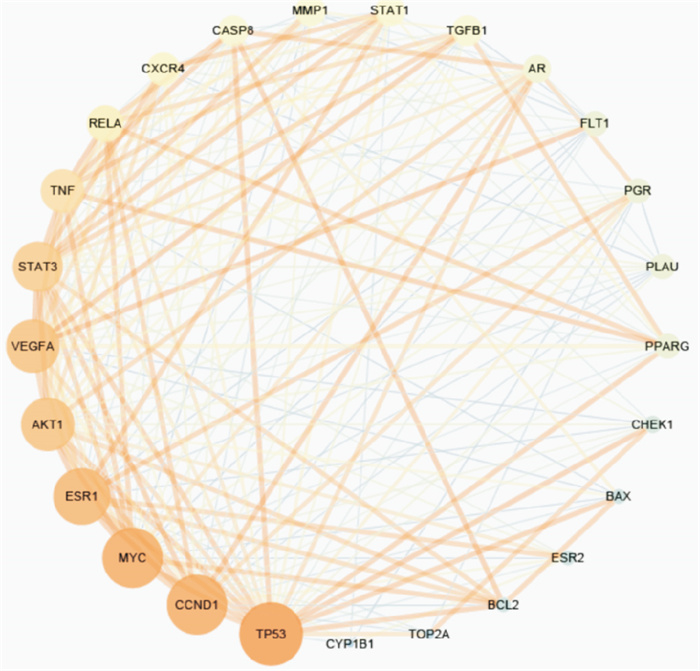
2.4 PPI构建在String数据库构建蛋白质互作网络,Cytoscape3.6.0软件对雷公藤治疗乳腺癌的25个靶点构建蛋白质互作网络图(Fig 4)。结果显示degree值排名前3的核心靶点分别是TP53、CCND1和MYC,ESR1、AKT1、VEGF及STAT3在其治疗过程中也起到重要作用。
|
| Fig 4 Interaction target network of Tripterygium wilfordii Hook. f. in treatment of breast cancer (Both the size and the color change in circles stand for degree value in descending order) |
将雷公藤治疗乳腺癌的3个核心成分雷公藤甲素、雷公藤红素和山奈酚与4个核心治疗靶点TP53、CCND1、MYC和ESR1的蛋白结构进行分子对接。结果显示,3种核心成分中雷公藤红素与乳腺癌治疗核心靶点结合度较好,其中与CCND1的相互作用最佳,自由结合能ΔG为-10.30 kca1·mol-1,其次为TP53蛋白(Fig 5A)。分子对接显示TP53蛋白可在LYS40、LEU48和TYR44位点与雷公藤红素通过疏水作用稳定结合(Fig 5B);CCND1蛋白在ARG126、LEU290、ARG26和PHE66位点与雷公藤红素通过疏水作用结合(Fig 5C)。
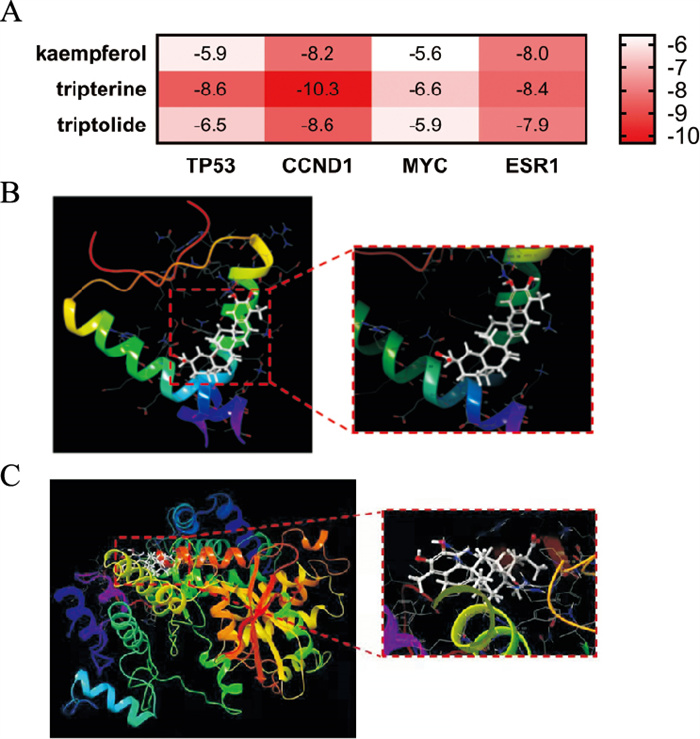
|
| Fig 5 Results of molecular docking A: Free binding energy between active ingredients and target; B: Diagram of interaction between TP53 protein and tripterine; C: Diagram of interaction between CCND1 protein and tripterine |
根据CCK-8实验的结果(Fig 6)可知,雷公藤红素抑制乳腺癌细胞的生长,并具有浓度和时间依赖性(与对照组相比P < 0.05),雷公藤红素对乳腺癌细胞的IC50,在24、48、72 h不同时间点分别为(22.68±1.46)μmol·L-1、(7.56±0.89)μmol·L-1和(0.89±0.067)μmol·L-1。
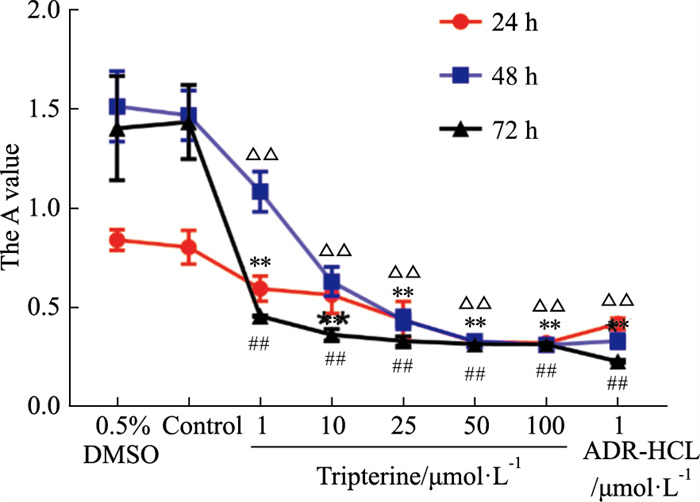
|
| Fig 6 Concentration-dependent effect of tripterine on MCF-7 viability Data are means±S.D. from three independent experiments. **P < 0.01 vs Control of 24 h, △△P < 0.01 vs Control of 48 h, ##P < 0.01 vs Control of 72 h |
根据平板克隆实验结果(Fig 7)可知,雷公藤红素抑制乳腺癌细胞克隆形成。MCF-7细胞的克隆形成率为(69.54±1.07)%,0.1、1、10 μmol·L-1的雷公藤红素处理组的克隆形成率分别降至(36.83±1.48)%、(24.67±0.05)%和(10.97±0.03)%(P < 0.05)。
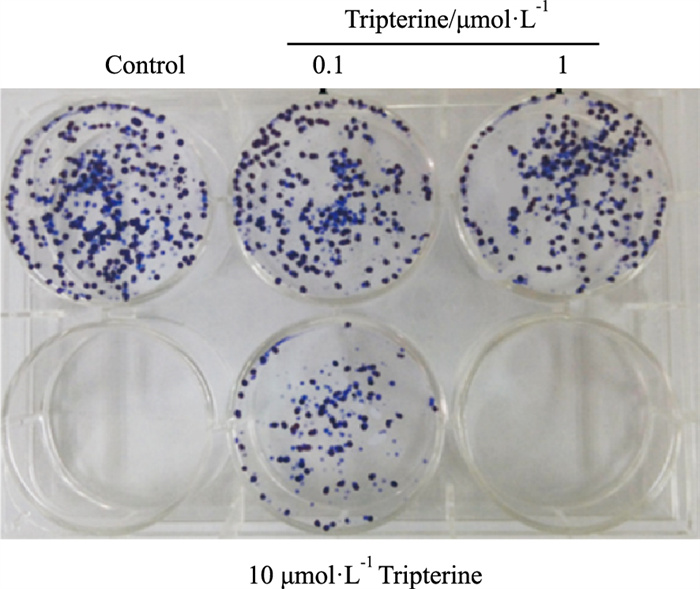
|
| Fig 7 Concentration-dependent effect of tripterine on clone of MCF-7 |
通过Real time qPCR的结果(Fig 8),可知给予1 μmol·L-1雷公藤红素后,TP53、CCND1、MYC和ESR1 mRNA的表达明显低于空白对照组。
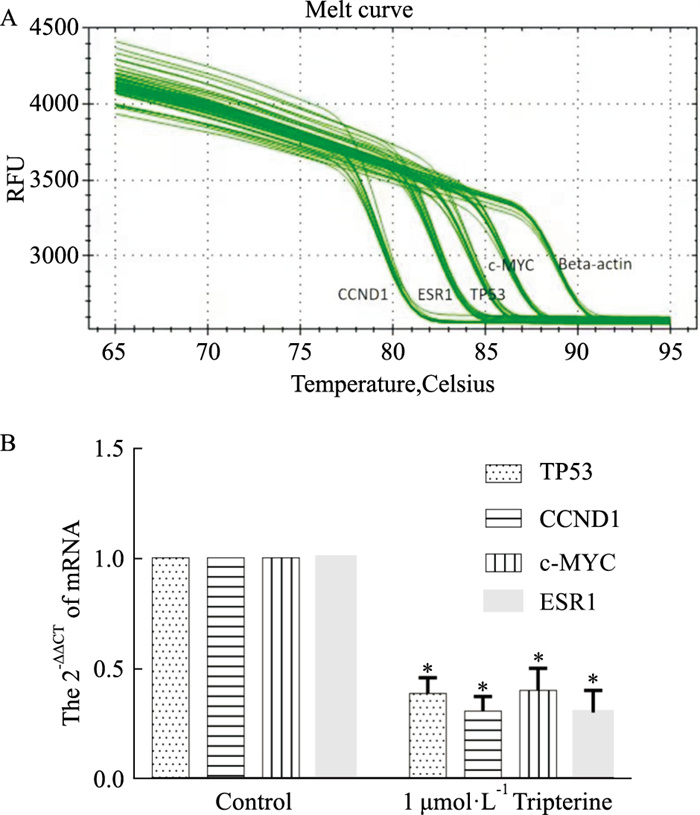
|
| Fig 8 Concentration-dependent effect of tripterine on mRNA of TP53, CCND1, MYC and ESR1 A: The melt curve of TP53, CCND1, MYC and ESR1 in the control group and the group of 1 μmol·L-1 tripterine; B: The quantitative representation of TP53, CCND1, MYC and ESR1 mRNA in the control group and the group of 1 μmol·L-1 tripterine on MCF-7 cells, *P < 0.05 vs control |
雷公藤是一种有悠久应用历史的中药,其多种活性成分已被证实具有抗肿瘤作用,雷公藤抗癌有效成分开发及机制研究近几年受到研究者的广泛关注。中医药具有多环节、多效应、多靶点的治疗特点,研究应用网络药理学和分子对接技术全面整合并评估雷公藤抗乳腺癌活性成分。通过数据库比对筛选出雷公藤治疗乳腺癌的7个活性成分和25个潜在治疗靶点。其中活性最强的抗乳腺癌成分包括雷公藤红素、雷公藤甲素和山奈酚,4个核心治疗靶点为TP53、CCND1、MYC和ESR1,AKT1、VEGF及STAT3也是其发挥作用的关键环节。CCK-8、克隆形成实验及Real-time qPCR初步验证了最优对接单体雷公藤红素对乳腺癌细胞及核心靶点的抑制作用。
雷公藤甲素作为中药雷公藤的主要活性成分,因其多途径、多靶点的高效抗肿瘤作用一直以来都是研究的热点。雷公藤甲素可通过干预肿瘤细胞转移、阻滞肿瘤细胞周期、影响肿瘤微环境等机制显著抑制乳腺癌细胞增殖,其乳腺癌治疗效果也得到广泛认可[6-7]。本研究KEGG信号通路分析结果显示,雷公藤治疗乳腺癌过程中差异基因富集通路主要涉及细胞凋亡、miRNA和MAPK等信号通路过程。雷公藤甲素诱导乳腺癌细胞凋亡可通过多种途径实现,包括MAKP信号转导通路、诱导p53依赖、抗ER活性[8-10]等。研究发现,MAPK在乳腺癌中可被显著激活,其持续活化过程促进乳腺癌细胞增殖。雷公藤甲素还可通过调节ERK1/2-HIF1-α-VEGFA轴,降低VEGFA水平,从而抑制乳腺癌细胞血管增殖,进而抑制乳腺癌侵袭与转移[11]。此外,雷公藤甲素对MDA-MB-468细胞的抗癌活性和对阿霉素增敏作用主要归因于MDM2介导的AKT激活,其抗肿瘤耐药作用的发挥与AKT信号通路密切相关[12]。
雷公藤红素属醌甲基型五环三萜类化合物,目前发现,雷公藤红素对肺癌、卵巢癌、肝癌、结肠癌、乳腺癌等多种癌细胞具有抑制作用,可在肿瘤细胞增殖、血管新生、癌细胞转移三个阶段对癌症发生发展进行干预,从而发挥其抗肿瘤作用[13-14]。雷公藤红素抗肿瘤作用研究虽起步较晚,但却极具发展潜力。本研究分子对接结果显示,雷公藤红素与乳腺癌治疗核心靶点结合度最佳,因此,我们利用细胞学实验进一步考察了雷公藤红素对乳腺癌治疗作用。经CCK-8实验验证,雷公藤红素能明显抑制乳腺癌细胞(MCF-7)的生长并具有浓度和时间依赖性,其对乳腺癌细胞的IC50值约在0.89~23 μmol·L-1之间。有研究显示,雷公藤红素可通过调节AKT信号通路诱导MDA-MB-231凋亡,其48 h的IC50值为0.93 μmol·L-1[15],以上结果均在一定程度上说明雷公藤红素是雷公藤治疗乳腺癌的重要抗癌活性成分。
在雷公藤治疗乳腺癌的核心靶点中,雷公藤红素与细胞周期蛋白D1(CCND1)的相互作用最佳,Real-time qPCR结果也显示,雷公藤红素降低乳腺癌细胞CCND1 mRNA的表达。CCND1的主要功能是促进细胞增殖,是一种公认的原癌基因,其过度表达可致细胞增殖失控[16],乳腺癌的发生发展与CCND1基因过表达和基因扩增有关。雷公藤红素与CCND1的高度结合表明雷公藤红素可能通过调节细胞周期抑制乳腺癌细胞的增殖。平板克隆实验的周期为14 d,期间经过多个细胞分裂周期,干预48 h后撤去雷公藤红素继续培养。既可评价雷公藤红素对肿瘤细胞生长的抑制能力,又能说明雷公藤红素对细胞周期的影响,间接验证雷公藤红素干扰了CCND1调控细胞周期的作用。另外平板克隆实验在一定程度上还可以看出雷公藤红素对细胞恢复能力的影响,克隆形成率与接种密度有一定关系,接种的细胞必须有增殖活力才能形成克隆,而形成克隆的细胞必为贴壁和有增殖活力的细胞。平板克隆形成实验结果可进一步验证雷公藤红素抑制乳腺癌细胞增殖,且雷公藤红素处理后的乳腺癌细胞生长恢复能力变差。据此推测,雷公藤红素对乳腺癌复发可能有一定抑制作用。此外,分子对接结果表明,TP53蛋白可在LYS40、LEU48和TYR44位点与雷公藤红素通过疏水作用稳定结合,Real-time qPCR结果可知雷公藤红素降低TP53的表达。TP53基因的突变(缺失)与多种肿瘤的发生发展密切相关,最新研究显示,TP53是诊断乳腺癌和评价预后的重要生物标志物[17]。目前关于TP53蛋白与雷公藤红素作用机制报道较少,雷公藤红素抑制乳腺癌细胞生长的具体分子机制尚需进一步深入研究。
网络药理学作为药理学新兴分支学科,可揭示比现代分子药理学更复杂的药理学规律,特别适用于以多靶标为基础的中药学理论及机制研究,但其严重受限于现有实验数据和数据库数据完整性的劣势也是不能忽视的[18]。充分利用现有数据,挖掘药物活性成分,预测作用靶点,并通过相应模型(动物或细胞)对药物作用进行实验验证,两者结合可在一定程度更好解析中草药网络药理学机制。
| [1] |
周仲瑛, 于文明. 中医古籍珍本集成(外伤科卷): 疮疡经验全书(上)[M]. 长沙: 湖南科学技术出版社, 2014: 12. Zhou Z Y, Yu W M. Ancient books of traditional Chinese medicine (Trauma volume): Book of Ulcer and Ulcer Experience (I)[M]. Changsha: Hunan Sci Tech Press, 2014: 12. |
| [2] |
顾观光. 神农本草经[M]. 北京: 学苑出版社, 2007: 274. Gu G G. Shennong herbal scripture[M]. Beijing: Academy Press, 2007: 274. |
| [3] |
刘敏, 王明武. 解毒破瘀法抑制三阴性乳腺癌复发与转移的临床研究[J]. 南京中医药大学学报, 2016, 32(2): 111-3. Liu M, Wang M W. Clinical research on the inhibition of recurrence and metastasis of triple negative breast cancer with the method of detoxification and blood stasis dissipating[J]. J Nanjing Univ Tradit Chin Med, 2016, 32(2): 111-3. |
| [4] |
Liu Q, Wang W, Li F Q, et al. Triptolide inhibits breast cancer cell metastasis through inducing the expression of miR-146a, a negative regulator of Rho GTPase[J]. Oncol Res, 2019, 27(9): 1043-50. doi:10.3727/096504019X15560124931900 |
| [5] |
Li X J, Wang H M, Ding J, et al. Celastrol strongly inhibits proliferation, migration and cancer stem cell properties through suppression of Pin1 in ovarian cancer cells[J]. Eur J Pharmacol, 2019, 842: 146-56. doi:10.1016/j.ejphar.2018.10.043 |
| [6] |
Shao H M, Ma J H, Guo T H, et al. Triptolide induces apoptosis of breast cancer cells via a mechanism associated with the Wnt/beta-catenin signaling pathway[J]. ExpTher Med, 2014, 8(2): 505-8. |
| [7] |
王娟, 李芳琼, 张枝倩, 等. 雷公藤甲素通过下调HCA66的表达抑制非小细胞肺癌[J]. 中国药理学通报, 2020, 36(7): 934-9. Wang J, Li F Q, Zhang Z Q, et al. Triptolide inhibits non-small cell lung cancer by down-regulating HCA66 expression[J]. Clin Pharmacol Bull, 2020, 36(7): 934-9. doi:10.3969/j.issn.1001-1978.2020.07.010 |
| [8] |
高欢, 曲晓宇, 张月明, 等. ERK信号传导通路在雷公藤甲素诱导人乳腺癌MCF-7细胞自噬与凋亡中的影响[J]. 中国医院药学杂志, 2018, 38(9): 930-3. Gao H, Qu X Y, Zhang Y M, et al. Effects of ERK signal transduction pathway in triptolide induced autophagy and apoptosis of human breast cancer M CF-7 cell[J]. Chin Hosp Pharm J, 2018, 38(9): 930-3. |
| [9] |
Liu J, Jiang Z Z, Xiao J W, et al. Effects of triptolide from Tripterygium wilfordii on ERalpha and p53 expression in two human breast cancer cell lines[J]. Phytomedicine, 2009, 16(11): 1006-13. doi:10.1016/j.phymed.2009.03.021 |
| [10] |
Tang Y, Wang J, Cheng J H, et al. Antiestrogenic activity of triptolide in human breast cancer cells MCF-7 and immature female mouse[J]. Drug Dev Res, 2017, 78(3-4): 164-9. doi:10.1002/ddr.21387 |
| [11] |
Liu H T, Tang L B, Li X Y, et al. Triptolide inhibits vascular endothelial growth factor-mediated angiogenesis in human breast cancer cells[J]. Exp Ther Med, 2018, 16(2): 830-6. |
| [12] |
Xiong J, Su T F, Qu Z L, et al. Triptolide has anticancer and chemosensitization effects by down-regulating Akt activation through the MDM2/REST pathway in human breast cancer[J]. Oncotarget, 2016, 7(17): 23933-46. doi:10.18632/oncotarget.8207 |
| [13] |
杨益, 唐文军, 卓曼云, 等. 雷公藤红素对骨肉瘤细胞增殖、凋亡的影响[J]. 中国临床药理杂志, 2019, 16: 1788-90. Yang Y, Tang W J, Zhuo M Y, et al. Effect of celastrol on the proliferation and apoptosis of osteosarcoma cells[J]. Chin J Clin Pharmacol, 2019, 16: 1788-90. |
| [14] |
徐资怡, 石金凤, 鲜静, 等. 雷公藤红素单用和联用抗肿瘤作用机制的研究进展[J]. 中草药, 2021, 52(14): 4372-85. Xu Z Y, Shi J F, Xian J, et al. Research progress on anti-tumor mechanism of celastrol alone and in combination[J]. Chin Tradi Herbal Drugs, 2021, 52(14): 4372-85. doi:10.7501/j.issn.0253-2670.2021.14.030 |
| [15] |
史晓娜, 徐霞, 谢闺娥. 雷公藤红素对人乳腺癌细胞系MDA-MB-231的抑制作用研究[J]. 中国医药导报, 2021, 18(1): 18-21, 198. Shi X N, Xu X, Xie G E. Inhibitory effect of tripterine on human breast cancer cell line MDA -MB-231[J]. China Medical Herald, 2021, 18(1): 18-21, 198. |
| [16] |
Packham S, Lin Y B, Zhao Z W, et al. The nucleus-localized epidermal growth factor receptor is SUMOylated[J]. Biochemistry, 2015, 54(33): 5157-66. doi:10.1021/acs.biochem.5b00640 |
| [17] |
Hameed Y, Ejaz S. Integrative analysis of multi-omics data highlighted TP53 as a potential diagnostic and prognostic biomarker of survival in breast invasive carcinoma patients[J]. Comput Biol Chem, 2021, 92: 107457. doi:10.1016/j.compbiolchem.2021.107457 |
| [18] |
段贤春, 黄石, 彭代银, 等. 网络药理学在中药复方研究中的应用[J]. 中国药理学通报, 2020, 36(3): 303-8. Duan X C, Huang S, Peng D Y, et al. Applicetion of network pharmacology in the study of traditional Chinese medicine formula[J]. Clin Pharmacol Bull, 2020, 36(3): 303-8. doi:10.3969/j.issn.1001-1978.2020.03.003 |

