


乳腺癌是全球女性常见的恶性肿瘤之一,其发病率在女性肿瘤中居首位,且呈逐年上升趋势。三阴性乳腺癌(triple-negative breast cancer,TNBC)是雌激素受体(ER)、孕酮受体(PR)和人表皮生长因子受体2(HER-2)表达均为阴性的乳腺癌,占所有乳腺癌的15%~20%[1],常规乳腺癌的内分泌治疗如芳香化酶抑制剂和靶向剂疗法对该类乳腺癌的疗效不佳。与其他乳腺癌亚型相比,TNBC有分化低、增殖快、复发率高、转移性强、整体生存率较低等特点[2],在临床上的治疗效果不理想。寻找TNBC的有效治疗药物,一直是乳腺癌基础研究的一个重要方向。
毛蕊异黄酮(calycosin,CA)是黄芪异黄酮类中的一种主要成分,也是黄芪的重要活性成分之一。CA已被证实在心血管疾病、肿瘤、细菌感染、神经疾病等方面的治疗中显示出良好的疗效[3]。近代药理学研究表明,CA对结肠癌[4]、鼻咽癌[5]、肝癌[6]等肿瘤的增殖、迁移侵袭有显著的抑制作用,也能促进凋亡和影响细胞周期,但对TNBC相关作用机制报道尚少。
Hippo信号通路是调节器官大小和维持组织稳态的最重要通路之一,肿瘤疾病中Hippo信号通路往往处于失调状态,能促进增殖和引起对化疗药物的抵抗,诱导肿瘤细胞发生EMT,增强其迁移侵袭能力[7],是肿瘤发生发展的机制之一。有报道在胃癌细胞中,高迁移率族盒蛋白9(SOX9)通过激活Hippo信号通路促进EMT,引起肿瘤细胞迁移侵袭,通过调控Hippo通路,可以抑制增殖、迁移,发挥抗肿瘤效果[8]。CA是否对TNBC具有相同或者相似的作用机制,尚未明确。本研究探讨了CA对人三阴性乳腺癌MDA-MB-231细胞增殖、迁移的影响及作用机制,为CA治疗TNBC的临床应用提供理论参考。
1 材料与方法 1.1 细胞MDA-MB-231细胞购自中国科学院上海细胞库。
1.2 试剂胎牛血清(批号42Q8497K)、L-15培养基(批号AG29798283)均购自美国Gibco公司;0.1%胰酶(批号21203504)、青霉素链霉素双抗(批号21203590)均购自Biosharp生物公司;毛蕊异黄酮(批号B20846)、碘化丙啶(批号L12J12G137439)购自上海源叶生物公司;BCA蛋白测定试剂盒(批号122120210621)购自上海碧云天生物技术有限公司;TRIzol® Plus RNA Purification Kit(批号12183-555)、SuperScriptTM Ⅲ First-Strand Synthesis SuperMix for qRT-PCR(批号11752-050)均购自美国Invitrogen公司;RNase-Free DNase Set(批号79254)购自德国Qiagen公司;E-cadherin抗体(批号3195S)、N-cadherin抗体(批号13116S)、vimentin抗体(批号5741S)、NF2抗体(批号6995S)、p-Mst1抗体(批号49332S)、p-Yap抗体(批号13008S)均购自美国CST公司;β-actin抗体(批号BK7018)购自杭州宝科生物科技有限公司;山羊抗兔Ig G H&L(批号ab6721)(购自美国abcam公司)。
1.3 仪器蛋白电泳转印设备(美国Bio-Rad公司);CFX384多重实时荧光定量PCR仪(美国Bio-Rad);ChemiScope Mini化学发光凝胶成像仪(上海勤翔科学仪器有限公司)。
1.4 方法 1.4.1 细胞培养MDA-MB-231细胞用含10%胎牛血清,青霉素、链霉素各100 mg·L-1的L-15培养基,置于37 ℃、100%空气,无CO2培养箱中培养。根据细胞生长状况,1~2 d更换新鲜培养基,待细胞生长铺至底部80%~90%时用0.1%胰酶消化液消化,以1∶2比例传代培养。
1.4.2 CCK-8法检测细胞存活率取对数生长期的MDA-MB-231细胞,以0.1%胰酶消化后制成细胞悬液,用2×107个·L-1细胞浓度接种于96孔培养板中,各孔200 μL,37 ℃下培养24 h,待细胞贴壁后加入药物,使CA终浓度为12.5、25、50、100、200、400、800 μmol·L-1,对照组加入含有等体积药物溶媒的培养基,每组设5个平行孔。加药后分别培养24 h,吸去各孔培养液,PBS清洗1次,加入10% CCK-8溶液200 μL,以无细胞的10% CCK-8溶液为空白组,37 ℃恒温放置30 min;用酶标仪在450 nm波长处测其吸光值并计算存活率。
细胞存活率/%=(OD毛蕊异黄酮组-OD空白组)/(OD对照组-OD空白组)×100%
1.4.3 流式细胞术检测细胞周期收集对数生长期的MDA-MB-231细胞,用0.1%胰酶消化后制成5×108个·L-1的细胞悬液种于6孔培养板中,待细胞生长至70%左右时加入药物,使CA终浓度为25、50、100 μmol·L-1,对照组加入含有等体积药物溶媒的培养基,每组设3个平行孔。培养24 h,0.1%胰酶消化收集细胞,1 000 r·min-1离心3 min弃去培养液,PBS洗1次,离心去除PBS,加入4 ℃预冷的70%乙醇固定,置于4 ℃环境,固定24 h。固定结束后离心弃去固定液,加入3 mL PBS重悬5 min;400目筛网过滤1次,1 000 r·min-1离心5 min,弃去PBS;加入200 μL PI染液,4 ℃避光孵育30 min。最后用流式细胞仪检测细胞周期情况。
1.4.4 流式细胞术检测细胞凋亡细胞分组及收集方法同“1.4.3”,用PBS轻轻重悬细胞并计数。取5×104个重悬的细胞,1 000 r·min-1离心5 min,吸去上清,加入195 μL Annexin V-FITC结合液轻轻重悬细胞,加入5 μL Annexin V-FITC,混匀,再加入10 μL碘化丙啶染色液,混匀。室温避光孵育20 min,随后置于冰浴中,用流式细胞仪检测细胞凋亡情况。
1.4.5 细胞划痕实验检测细胞迁移能力收集对数生长期细胞,用0.1%胰酶消化后制成5×108个·L-1的细胞悬液种于6孔培养板中,培养细胞待长满板底时,持移液器垂直板底均匀划痕,倒去培养液,用PBS轻轻洗去脱落细胞3次,加入药物,使CA终浓度为25、50、100 μmol·L-1,对照组加入含有等体积药物溶媒的培养基。在给药干预后0、12、24 h于显微镜下观察并记录细胞划痕的愈合情况。不同组细胞在各时间点的划痕面积用ImageJ软件分析,以各组0 h的划痕面积为基准,计算划痕愈合相对面积。
12 h或24 h愈合相对面积=(0 h划痕面积-12 h或24 h划痕面积)/0 h划痕面积。
1.4.6 RT-PCR实验检测EMT相关基因水平收集对数生长期细胞,用0.1%胰酶消化后制成5×108个·L-1的细胞悬液种于6孔培养板中,在37 ℃培养细胞,待生长至70%左右时,加入药物,使CA终浓度为25、50、100 μmol·L-1,对照组加入含有等体积药物溶媒的培养基,干预24 h。干预后加入TRIzol® Reagent和氯仿处理,提取总RNA,用紫外吸收光法测定RNA浓度。E-cadherin上游引物序列为5′-GATAGAGAACGCATTGCCACATAC-3′,下游为5′-CTCCATTGGATCCTCAACTGCATT-3′;N-cadherin上游引物序列为5′-CCCACAGCTCCACCATATGACTC-3′,下游为5′-CCTGCTCACCACCACTACTTGAG-3′;vimentin上游引物序列为5′-CTGGATTCACTCCCTCTGGTTG-3′,下游为5′-CATCGTGATGCTGAGAAGTTTCGTT-3′,β-actin上游引物序列为5′-GATGACCCAGATCATGTTTGAGAC-3′,下游为5′-GGAGTCCATCACGATGCCAGT-3′;反应体系:ddH2O 8 μL,上下游引物各0.5 μL,SYBR Green 10 μL,cDNA 1 μL,共20 μL。循环条件:95 ℃预变性1 min,95 ℃变性15 s,63 ℃变性25 s,共40个循环;扩增后输出目的基因以及内参基因β-actin的Ct值,以2-ΔΔCt法计算相对表达量。
1.4.7 Western blot实验检测EMT与Hippo通路相关蛋白水平收集对数生长期细胞,用0.1%胰酶消化后制成5×108个·L-1的细胞悬液种于6孔培养板中,在37 ℃培养细胞,待生长至70%左右时,加入药物,使CA终浓度为25、50、100 μmol·L-1,对照组加入含有等体积药物溶媒的培养基,干预24 h。用含PMSF的RIPA裂解液裂解细胞,提取细胞蛋白,BCA法测定蛋白浓度,加适量5×上样缓冲液,100 ℃处理5 min变性。以10% SDS-聚丙烯酰胺凝胶进行电泳分离蛋白,电泳完毕后蛋白经电转移到PVDF膜上,5%脱脂奶粉封闭2 h,按1∶1 000用TBST稀释一抗,4 ℃孵育过夜,次日TBST洗膜3次,孵育二抗,TBST洗膜3次,使用化学发光成像系统成像,采用ImageJ软件进行蛋白条带分析。
1.4.8 数据统计分析所有实验均进行≥3次的重复研究,采用SPSS 25.0软件处理数据,以x±s形式表示。组间差异分析采用单因素方差分析法(ANOVA),两组间比较采用LSD检验。
2 结果 2.1 CA对MDA-MB-231细胞存活率的影响与对照组相比,CA明显抑制MDA-MB-231细胞的增殖,且呈剂量相关性(Fig 1)。实验结果分析显示,CA作用于MDA-MB-231细胞24 h的半数抑制浓度(IC50)为363.2 μmol·L-1。为排除细胞毒性对实验的影响选用细胞存活率较高的药物浓度,因此后续实验选取低于IC50值浓度(25、50、100 μmol·L-1)的CA开展。
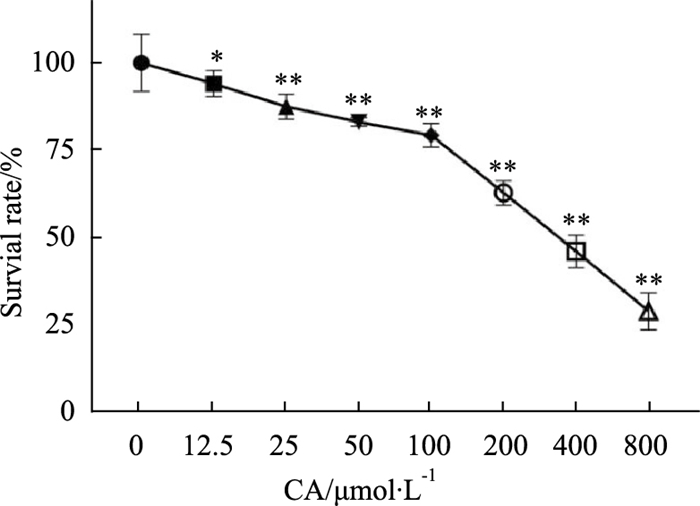
|
| Fig 1 Effect of calycosin on proliferation of MDA-MB-231 cells (x±s, n=6) *P < 0.05, **P < 0.01 vs Control group |
通过细胞流式法检测CA对MDA-MB-231细胞周期的影响,PI染色后经流式细胞仪检测各期细胞所占百分比,与对照组相比,CA 50、100 μmol·L-1能显著提高G0/G1期细胞所占百分比(P<0.01),阻滞效果呈现剂量相关性,表明CA组可能干预细胞周期,阻滞于G0/G1期,抑制MDA-MB-231细胞增殖(见Fig 2)。
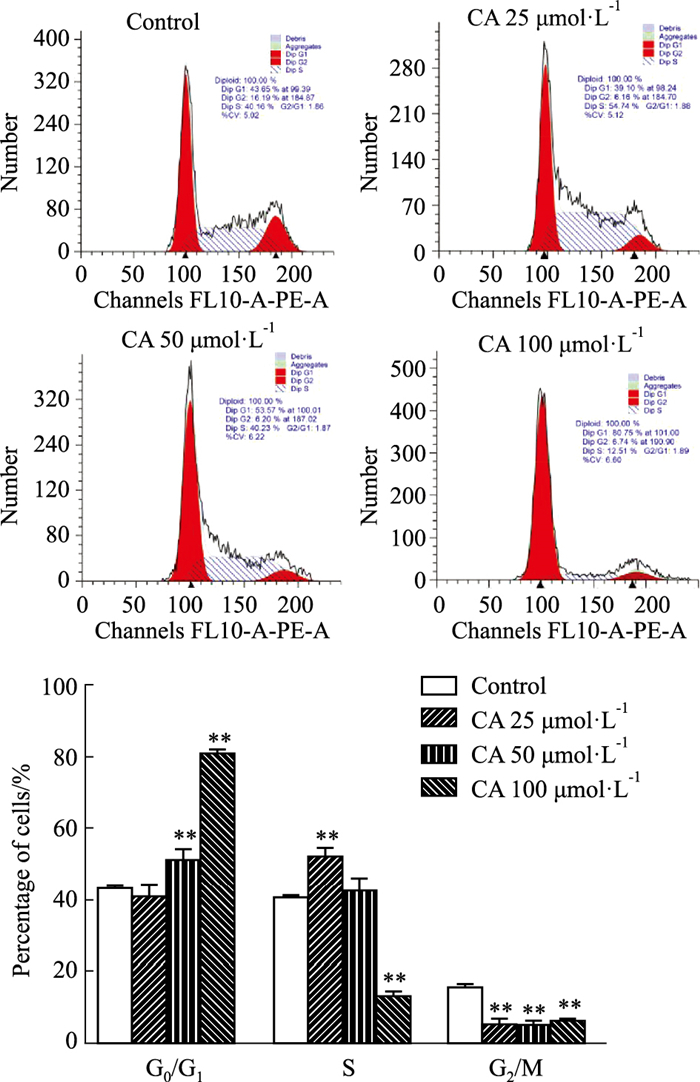
|
| Fig 2 Effect of calycosin on cell cycle of MDA-MB-231 cells (x±s, n=3) **P < 0.01 vs Control group |
Annexin V-FITC/PI染色后经流式细胞仪检测显示,与对照组相比,CA 50、100 μmol·L-1能明显提高细胞凋亡率(P<0.01),且效果呈现剂量相关性,表明CA促进MDA-MB-231细胞凋亡,见Fig 3。
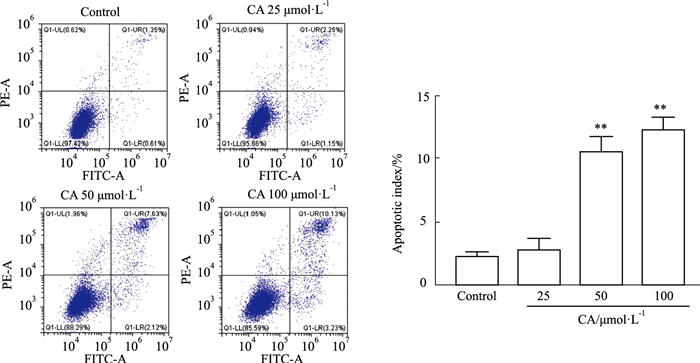
|
| Fig 3 Effect of calycosin on apoptosis of MDA-MB-231 cells (x±s, n=3) **P < 0.01 vs Control group |
细胞划痕实验检测CA对MDA-MB-231细胞迁移的影响,为避免CA的细胞增殖抑制作用对实验结果的干扰,细胞划痕实验时培养基的血清浓度为2%。在干预12 h和24 h时,与对照组相比,CA各浓度均能明显降低划痕的相对愈合面积(P<0.05、0.01),且抑制作用呈现时间、剂量相关,表明CA能对MDA-MB-231细胞的迁移能力有抑制作用,见Fig 4。
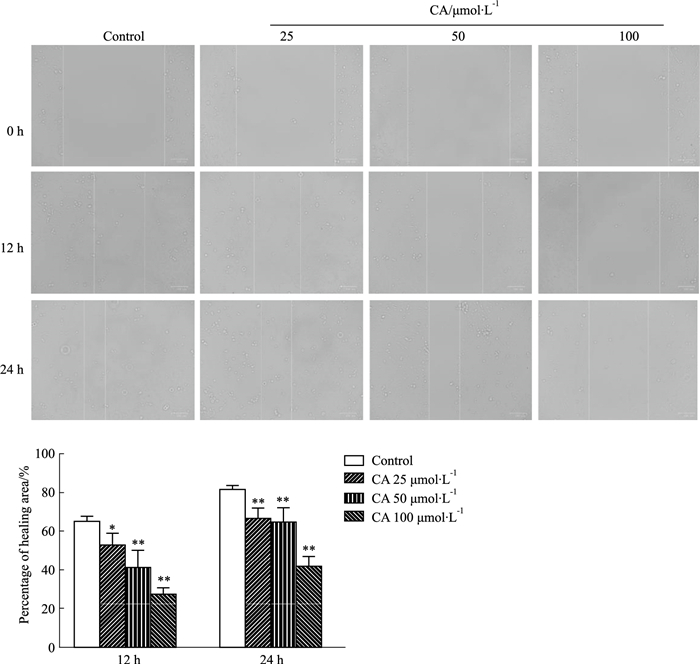
|
| Fig 4 Effect of calycosin on migration of MDA-MB-231 cells (x±s, n=3) *P < 0.05, **P < 0.01 vs Control group |
通过RT-PCR检测CA对MDA-MB-231细胞EMT相关基因mRNA表达的影响。结果显示,与对照组相比,CA各浓度均能显著提高E-cadherin基因mRNA表达和明显降低N-cadherin基因mRNA表达(P<0.01);CA 100 μmol·L-1明显下降vimentin基因mRNA表达(P<0.01),见Fig 5。
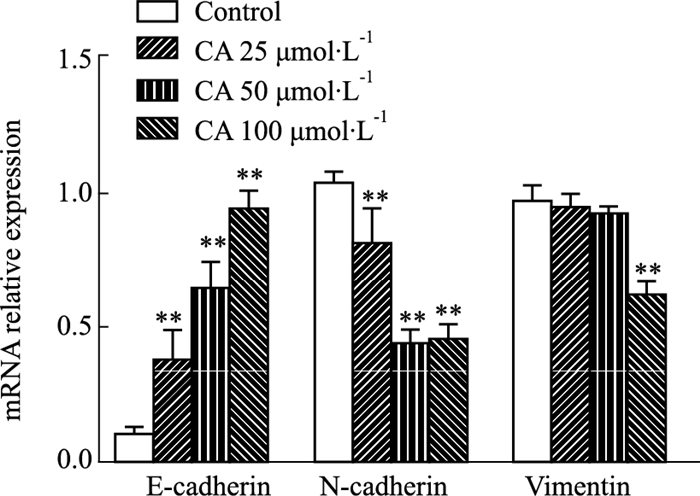
|
| Fig 5 Effect of calycosin on EMT-related mRNA expressions in MDA-MB-231 cells (x±s, n=3) **P < 0.01 vs Control group |
采用Western blot检测CA对MDA-MB-231细胞EMT相关蛋白表达的影响。检测结果显示,与对照组相比,CA各浓度均能显著提高E-cadherin表达量(P<0.05、0.01),CA 50、100 μmol·L-1能明显下降N-cadherin和vimentin表达量(P<0.01),且均呈现剂量相关性,见Fig 6。
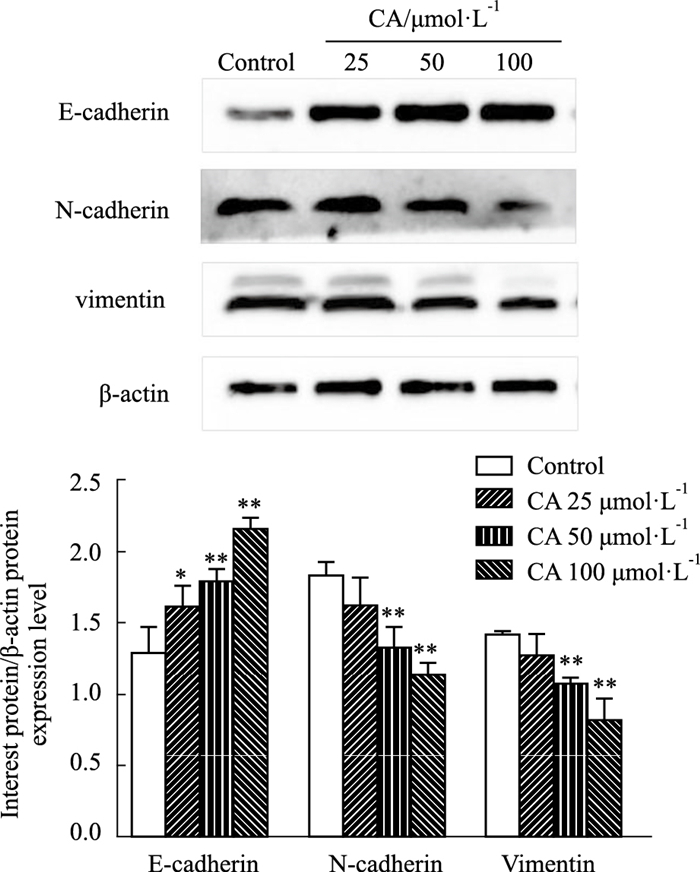
|
| Fig 6 Effect of calycosin on EMT-related proteins expressions in MDA-MB-231 cells (x±s, n=3) *P < 0.05, **P < 0.01 vs Control group |
RT-PCR与Western blot结果均显示CA能明显调控与EMT相关基因蛋白表达,表明CA可能通过抑制MDA-MB-231细胞的EMT实现其药效作用。
2.6 CA对MDA-MB-231细胞Hippo信号通路相关蛋白表达的影响通过Western blot检测CA对MDA-MB-231细胞Hippo信号通路相关蛋白NF2、p-Mst1、p-Yap表达的影响,与对照组相比,CA各浓度均能明显提高p-Mst1、p-Yap和NF2表达量(P<0.05、0.01),且呈现剂量相关性。表明CA能够抑制Hippo信号通路的激活,见Fig 7。
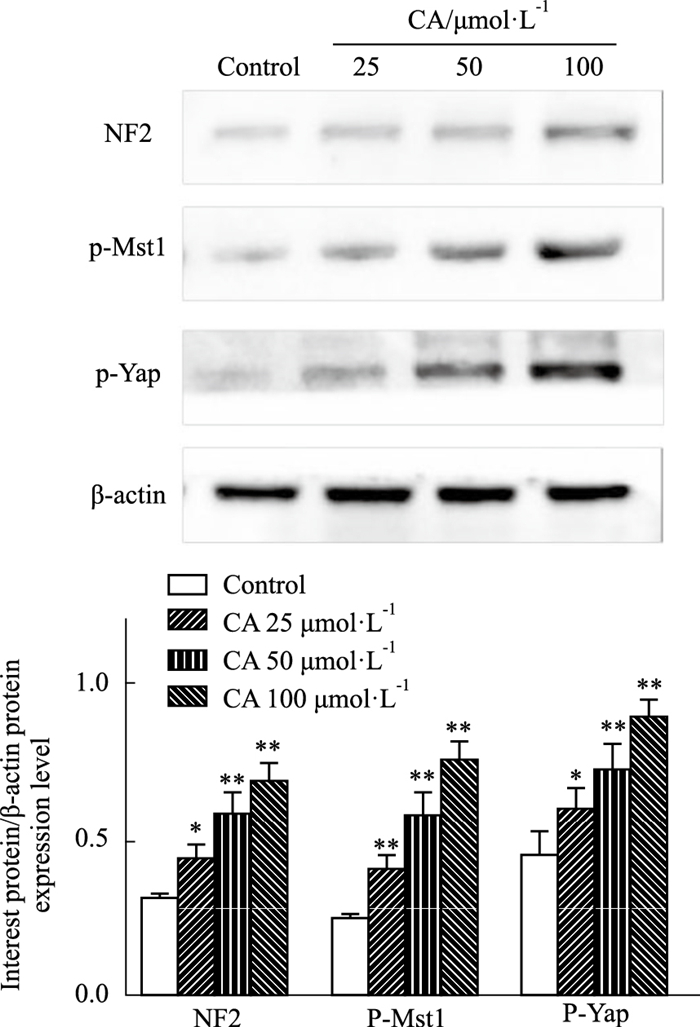
|
| Fig 7 Effect of calycosin on Hippo signaling pathway protein expressions in MDA-MB-231 cells (x±s, n=3) *P < 0.05, **P < 0.01 vs Control group |
乳腺癌在中医属于“积聚”,“阴毒”等范畴,黄芪具有升阳补气,补益扶正等功效,契合乳腺癌病理病机。CA作为黄芪中一种主要活性成分,在多种肿瘤的治疗中表现出较好的疗效。故本研究围绕CA对MDA-MB-231细胞的抑制作用,探讨其作用机制。有报道表明,CA阻滞胃腺癌AGS细胞于G0/G1期,提高了细胞凋亡率,抑制细胞增殖[9],本实验发现CA在TNBC细胞中展现出同样的效果,但其具体机制尚不明确。
迁移是导致乳腺癌发生转移恶化的主要原因。本实验发现,CA可抑制EMT途径抑制细胞迁移能力。EMT表现为上皮细胞失去连接和极性的过程,并出现间质细胞易迁移的特征,在肿瘤中会造成肿瘤细胞间黏附力的丧失,进而引起迁移和远处转移[10]。E-cadherin是细胞黏附的关键蛋白之一,用以维持细胞上皮表型和组织稳态,在肿瘤中其表达的缺失被认为是EMT发生的主要标志,往往会引起肿瘤组织局部浸润和转移侵袭[11]。N-cadherin是间充质细胞的标志物,介导细胞的黏附作用,在肿瘤中增强细胞的活力和迁移能力,其表达水平在EMT过程中提高[12]。vimentin是一种中间纤维蛋白,与微管、微丝一起构成细胞骨架,在调控细胞黏附能力和细胞迁移方面发挥重要作用,EMT过程中高表达的vimentin诱导细胞形态发生改变,细胞黏附力降低,提高细胞的迁移能力[13]。本研究发现,CA抑制了MDA-MB-231细胞中N-cadherin和vimentin蛋白表达,提高了E-cadherin蛋白的表达,提示CA可能通过抑制MDA-MB-231细胞的EMT途径来抑制细胞的迁移。
Hippo信号是由一系列激酶级联引起的信号调控,Hippo信号处于未被激活状态时,YAP与TAZ处于磷酸化状态,磷酸化Mst1/2的激活部位后激活Mst1/2,进一步激活肿瘤抑制激酶LATS1/2,活化的LATS1/2发生磷酸化,诱导生长转录共激活因子YAP/TAZ磷酸化,造成其胞质滞留或生物降解,阻止核积累[14]。当Hippo信号通路失调时,YAP/TAZ无法及时被磷酸化,会转移到细胞核中,与TEAD转录因子家族结合,并诱导与细胞增殖、细胞维稳和迁移侵袭相关基因的表达,调控细胞一系列活动[15]。肿瘤抑制基因NF2是Hippo信号通路的重要上游调控因子之一,通过激活MST1/2磷酸化和促进P-MST1/2激发LAT1/2磷酸化是Hippo信号传导重要激活因子[16]。干预Hippo信号通路,提高P-Yap蛋白表达,也可阻滞细胞于G0/G1期,抑制迁移侵袭活力[17]。本研究发现,CA通过提高NF2表达量,促进Mst1磷酸化进一步调控下游Yap磷酸化,提高P-Yap的水平,表明CA通过抑制Hippo信号通路抑制了MDA-MB-231细胞的增殖、迁移,阻滞细胞周期于G0/G1期,提高细胞凋亡水平。
本实验结果证明,CA对MDA-MB-231细胞具有良好的抑制作用,显著抑制细胞的增殖、迁移,阻滞细胞周期于G0/G1期,诱导细胞凋亡。其机制可能是通过抑制Hippo信号通路,抑制EMT途径,调控MDA-MB-231细胞的增殖、迁移、凋亡和周期水平。为CA进一步开发为乳腺癌药物提供了前期实验基础。
| [1] |
Liedtke C, Mazouni C, Hess K R, et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer[J]. J Clin Oncol, 2008, 26(8): 1275-81. doi:10.1200/JCO.2007.14.4147 |
| [2] |
郭亚瑞, 周伟强. Chidamide诱导的LncRNA ENST00000448869.1靶向作用Nestin抑制乳腺癌MDA-MB-231细胞的生长[J]. 中国药理学通报, 2021, 37(12): 1694-9. Guo Y R, Zhou W Q. Chidamide induced lncrna enst00000448 869.1 Targeting effect Nestin inhibits the growth of breast cancer MDA-MB-231 cells[J]. Chin Pharmacol Bull, 2021, 37(12): 1694-9. |
| [3] |
Deng M, Chen H, Long J, et al. Calycosin: A review of its pharmacological effects and application prospects[J]. Expert Rev Anti Infect Ther, 2021, 19(7): 911-25. doi:10.1080/14787210.2021.1863145 |
| [4] |
Wang Q, Lu W, Yin T, et al. Calycosin suppresses TGF-β-induced epithelial-to-mesenchymal transition and migration by upregulating BATF2 to target PAI-1 via the Wnt and PI3K/Akt signaling pathways in colorectal cancer cells[J]. J Exp Clin Cancer Res, 2019, 38(1): 240. doi:10.1186/s13046-019-1243-7 |
| [5] |
Liu F, Pan Q, Wang L, et al. Anticancer targets and mechanisms of calycosin to treat nasopharyngeal carcinoma[J]. Biofactors, 2020, 46(4): 675-84. doi:10.1002/biof.1639 |
| [6] |
Liu Y, Piao X J, Xu W T, et al. Calycosin induces mitochondrial-dependent apoptosis and cell cycle arrest, and inhibits cell migration through a ROS-mediated signaling pathway in HepG2 hepatocellular carcinoma cells[J]. Toxicol In Vitro, 2021, 70: 105052. doi:10.1016/j.tiv.2020.105052 |
| [7] |
Salem O, Hansen CG. The Hippo pathway in prostate cancer[J]. Cells, 2019, 8(4): 370. doi:10.3390/cells8040370 |
| [8] |
Zhou H, Li G, Huang S, et al. SOX9 promotes epithelial-mesenchymal transition via the Hippo-YAP signaling pathway in gastric carcinoma cells[J]. Oncol Lett, 2019, 18(1): 599-608. |
| [9] |
Zhang Y, Zhang J Q, Zhang T, et al. Calycosin induces gastric cancer cell apoptosis via the ROS-Mediated MAPK/STAT3/NF-κB pathway[J]. Onco Targets Ther, 2021, 14: 2505-17. doi:10.2147/OTT.S292388 |
| [10] |
Suarez-Carmona M, Lesage J, Cataldo D, et al. EMT and inflammation: Inseparable actors of cancer progression[J]. Mol Oncol, 2017, 11(7): 805-23. doi:10.1002/1878-0261.12095 |
| [11] |
Wong S H M, Fang C M, Chuah L H, et al. E-cadherin: Its dysregulation in carcinogenesis and clinical implications[J]. Crit Rev Oncol Hematol, 2018, 121: 11-22. doi:10.1016/j.critrevonc.2017.11.010 |
| [12] |
Kourtidis A, Lu R, Pence L J, et al. A central role for cadherin signaling in cancer[J]. Exp Cell Res, 2017, 358(1): 78-85. doi:10.1016/j.yexcr.2017.04.006 |
| [13] |
Wang W, Chen H, Gao W, et al. Girdin interaction with vimentin induces EMT and promotes the growth and metastasis of pancreatic ductal adenocarcinoma[J]. Oncol Rep, 2020, 44(2): 637-49. doi:10.3892/or.2020.7615 |
| [14] |
Ma S, Meng Z, Chen R, et al. The Hippo pathway: Biology and pathophysiology[J]. Annu Rev Biochem, 2019, 88: 577-604. doi:10.1146/annurev-biochem-013118-111829 |
| [15] |
Meng Z, Moroishi T, Guan K L. Mechanisms of Hippo pathway regulation[J]. Genes Dev, 2016, 30(1): 1-17. doi:10.1101/gad.274027.115 |
| [16] |
Wu J, Minikes A M, Gao M, et al. Intercellular interaction dictates cancer cell ferroptosis via NF2-YAP signalling[J]. Nature, 2019, 572(7769): 402-6. doi:10.1038/s41586-019-1426-6 |
| [17] |
Zhang C, Bao C, Zhang X, et al. Knockdown of lncRNA LEF1-AS1 inhibited the progression of oral squamous cell carcinoma (OSCC) via Hippo signaling pathway[J]. Cancer Biol Ther, 2019, 20(9): 1213-22. doi:10.1080/15384047.2019.1599671 |

