

高血压是全球死亡率升高的主要原因之一,有11.3亿人患有高血压[1]。随着生活水平的提高,饮食条件的改善,肥胖问题已成为影响公共健康的重要因素。肥胖是引起高血压的主要原因,大约75%的高血压发病率与肥胖(定义为体重指数≥ 30 kg/m2)直接相关[2-3]。肥胖患者伴随着糖脂代谢紊乱,引发血管内皮功能异常,有研究表明肥胖与收缩压升高呈正相关[4-5]。因此,单纯针对降低血压或降脂的治疗已不能适应当前的治疗,必须寻求既能改善心血管又能改善代谢指标的药物[6]。葛根是一种常见的中药材,具有抗心血管疾病、抗高血压、抗炎、抗心律不齐等药理学性质[7]。越来越多的证据表明,葛根素(puerarin,Pue)在高血压等心血管疾病治疗中有突出作用[8-9]。吴昀等[10]研究发现,葛根素可以通过内皮依赖性和非依赖性肠系膜动脉的舒张功能降压。玉从容等[11]研究发现,葛根素可明显降低高脂高糖饮食诱导的胰岛素抵抗小鼠的血脂和血压。最近的研究表明[12],高脂饮食诱导的C57 BL/6J雄性小鼠由于脂肪的积累易于发展为严重肥胖,使其成为研究人类肥胖的理想模型,但对主动脉在高脂饮食所诱导的肥胖小鼠所发挥的作用研究颇少,因而本研究拟探讨葛根素是否通过保护主动脉内皮功能而降低高脂饮食所诱导肥胖小鼠的血压,同时也为临床提供一定的参考价值。
1 材料与方法 1.1 实验动物8周龄SPF级♂ C57 BL/6J小鼠(上海斯莱克公司提供),饲养于江南大学医学院实验动物中心(伦理号:JN.No20201230c0600601[371]),进行12 h昼夜交替,小鼠饲养于通风良好的环境,温度在18~25 ℃,相对湿度40%~70%,适应性饲养7 d后开始正式实验。
1.2 主要试剂与药物生理盐水购自中国国药集团(货号:H34023609)、葛根素购自美国阿拉丁公司(货号:P111270-5 g)、甘油三脂(TG)测定试剂盒、总胆固醇(TC)测定试剂盒、低密度脂蛋白胆固醇(LDL-C)测定试剂盒、高密度脂蛋白胆固醇(HDL-C)测定试剂盒均购自于南京建成生物工程研究所(货号:A110-1-1、A111-1-1、A113-1-1、A112-1-1)、左旋硝精氨酸甲酯(NG-nitro-L-arginine methyl ester,L-NAME,货号:N109211)、乙酰胆碱(acetylcholine,ACh,货号:A2661)、HC-067047购自英国Tocris Bioscience公司(货号: SML0143)、甲基噻唑基四唑(methylthiazolyltetrazolium,MTT)比色法试剂盒购自中国碧云天生物科技(货号:C0009M)、Krebs溶液成分(mmol·L-1):NaCl 119、NaHCO3 25、MgCl2·6H2O 1、KCl 4.7、KH2PO4 1.2、CaCl2 2.5、D-glucose 11.1、60 mmol·L-1 KCl溶液成分(mmol):KCl 60、NaCl 63、NaHCO3 25、MgCl · 6H2O 1、KH2PO4 1.2、CaCl2 2.5、D-glucose 11.1。
1.3 仪器BP-2000大小鼠无创血压计(美国II TC生命科学仪器公司)、Wire myograph 620 M(丹麦DMT公司)、全功能微孔检测仪Synergy H4(美国伯腾仪器有限公司)、血糖仪(中国鱼跃生物科技公司)。
1.4 实验方法 1.4.1 模型建立及实验分组将C57 BL/6J小鼠分笼适应性饲养一周后,以45%高脂饲料喂养小鼠20周构建肥胖小鼠模型(diet-induced obesity,DIO),普通饲料喂养小鼠作为对照组,期间每周定时监测小鼠体重,模型组小鼠体重涨幅超过对照组20%。尾套法监测小鼠收缩压、舒张压变化情况,20周后模型组收缩压升至110~115 mmHg范围。模型组小鼠采取随机分组,分为肥胖小鼠模型组(DIO)、模型组+葛根素低剂量组Pue(L) 20 mg·kg-1·d-1、模型组+葛根素中剂量组Pue (M) 40 mg·kg-1·d-1、模型组+葛根素高剂量组Pue(H) 80 mg·kg-1·d-1,每组各6只小鼠,连续8周腹腔注射葛根素,在实验期间每周记录体重和血压。
1.4.2 原代内皮细胞分离与培养使用高浓度CO2将小鼠安乐死,打开胸腔,取出主动脉组织于无菌PBS中,在无菌超净台中将主动脉组织用剪刀剪碎后溶于含有胰酶(2 g·L-1)的PBS中,在37 ℃水浴震荡30 min后离心1 200 r·min-1,5 min;之后用ECM(Endothelial Cell Medium)培养基重悬细胞沉淀种于6孔板中,2 h后换液,此为第一代细胞,传代后的第二代细胞用于实验。
1.4.3 血清指标检测给药8周末将小鼠禁食过夜,采取眼眶静脉取血。将血样室温静置2 h后,4 ℃离心4 000 r·min-1,15 min。之后取上清,用试剂盒测定甘油三脂TG、总胆固醇TC、高密度脂蛋白胆固醇HDL-C、低密度脂蛋白胆固醇LDL-C,按照试剂盒法进行检测,最后于酶标仪上测定。
1.4.4 血压测定使用II TC无创血压计测量小鼠血压,先将恒温箱设为34 ℃,预热30 min后将小鼠放于小鼠固定同筒中固定,腹部朝下,尾巴穿过橡皮圈,适应30 min后进行测量,重复3次的平均值作为小鼠的血压值。给药期间每周测量小鼠血压。
1.4.5 小鼠离体主动脉环的制备与内皮功能检测取雄性小鼠装入可通CO2的泡沫塑料盒中,向其中通入CO2等待约1 min,待小鼠安乐死后,打开胸腔迅速取出主动脉组织,于4 ℃氧饱和的Krebs溶液中,小心分离出主动脉,剔除脂肪和结缔组织,操作过程中避免牵拉;主动脉制备成2~3 mm血管环,每只小鼠制备四个血管环进行平行实验,血管环用2根金属丝(40 μm)连于张力换能器上,浴槽中加入5 mL Krebs溶液温度为(37±0.5) ℃,持续通入5% CO2+95% O2,pH 7.4)。调节血管环的初张力,并稳定在0 mN,平衡约60 min,调至3 mN平衡约30 min,每15 min换液1次。待血管环稳定后,用60 mmol·L-1 KCl预收缩血管3次,待血管恢复血管活力后,向浴槽中加入Phe(1 μmol·L-1)刺激血管收缩,到达收缩平台后累积给药法依次加入ACh(1 nmol·L-1~10 μmol·L-1),注意在加入下一剂量时必须等上一剂量反应到达平台期。观察血管环对ACh的反应性,计算ACh引起的血管舒张率,舒张率%=(最大收缩张力值-ACh给药后张力值)/(最大收缩张力值-基础张力值) 100%,血管舒张85%以上表明内皮功能完好,此为内皮完整组(+Endo)
1.4.6 去内皮主动脉环的制备与内皮功能检测取已剔除结缔组织和脂肪的主动脉环,将粗细适当的大鼠胡须穿进血管环,并来回摩擦去除血管段中的内皮层,待血管稳定后,加入60 mmol·L-1 KCl刺激血管3次,待刺激达到坪值后,加入Phe(1 μmol·L-1)预收缩血管,稳定后加入梯度浓度ACh,舒张率低于10%视为内皮去除完全,此为去内皮组(-Endo)
1.4.7 L-NAME和HC-067047对葛根素舒张小鼠主动脉的测定内皮完整的主动脉环经内皮功能检测后,分别敷育一氧化氮合酶(nitric oxide synthase,NOS)抑制剂L-NAME(100 μmol·L-1)和TRPV4抑制剂HC-067047(1 μmol·L-1),30 min。对照组不敷育L-NAME和HC-067047。eNOS通路是促进大血管舒张的重要通路,加入其抑制剂以揭示在抑制eNOS活性后各组的反应性是否仍存在差异;已有研究证实葛根素为TRPV4激动剂,TRPV4也是血管舒张的重要通路之一[13]。在浴槽中加入其抑制剂以揭示抑制TRPV4活性后血管舒张差异。待血管恢复活力后,加入Phe(1 μmol·L-1)刺激血管收缩,收缩稳定后加入梯度浓度ACh,计算ACh引起的血管舒张率。
1.4.8 细胞Transwell实验将2 d内分离的DIO小鼠原代内皮细胞分别孵育25、50、100 μmol·L-1葛根素24 h,随后使用胰酶消化处理,将4万个细胞重悬至200 μL DMEM基础培养基后接种到小室中,24孔板中加入500 μL ECM培养基,在细胞培养箱中继续培养24 h之后,用PBS洗两次,再用4% PFA(多聚甲醛)固定,用PBS去除残留的PFA后,用1%结晶紫染色15 min,最后用PBS清洗3~5次后,擦掉上室残留细胞,使用正置显微镜拍摄小室的多个视野,使用Image J统计迁移率差异。
1.4.9 血糖检测于8周末将小鼠禁食过夜,更换垫料进行笼底清洁,小鼠进行正常饮水,分别采集小鼠尾尖血液于血糖试纸上,采用血糖仪测定血糖浓度。
1.4.10 MTT细胞增殖实验将可用于实验的DIO小鼠原代内皮细胞种于96孔板中,大约每孔5 000个细胞左右,并孵育25、50、100 μmol·L-1葛根素24 h,然后与MTT溶液(0.5 g·L-1)在37 ℃、5% CO2培养箱下共敷育4 h,然后加入DMSO以溶解甲臜晶体最后于570 nm处测定吸光度。
1.5 统计学方法使用GraphPad Prism 5.0处理数据,数据结果以平均数±标准差(x±s)表示,t检验用于比较两组之间的差异,单因素方差分析用于多组间比较。
2 结果 2.1 葛根素对DIO小鼠血压、体质量、血清中血脂、空腹血糖的影响 2.1.1 葛根素对DIO小鼠体质量、血清中血脂、空腹血糖的影响如Fig 1A所示,45%高脂饲料喂养小鼠后体重明显增加,与Con组相比体型肥胖;而低、中、高剂量葛根素处理8周后可明显降低小鼠体质量增加的幅度(P<0.0001)。如Fig 1B所示,DIO组空腹血糖与Con组相比明显增高(P<0.0001),与DIO相比高剂量组空腹血糖明显降低,(P<0.0001)。如Tab 1所示,DIO组TG、TC、LDL-C的水平明显高于对照组,HDL-C则明显低于其他各组,高剂量葛根素组可有效逆转高脂饮食所引发的TG、TC、LDL-C水平的升高以及HDL-C的降低。
| Group | N/mmol·L-1 | TG/mmol·L-1 | TC/mmol·L-1 | HDL-C/mmol·L-1 | LDL-C/mmol·L-1 |
| WT | 6 | 0.779±0.123 | 2.691±0.715 | 2.752±0.875 | 0.623±0.334 |
| DIO | 6 | 1.228±0.131* | 11.956±0.983* | 1.642±0.790* | 5.395±1.675* |
| Pue(L) | 6 | 1.318±0.311 | 9.661±0.923# | 1.967±1.166 | 2.797±0.409# |
| Pue(M) | 6 | 0.745±0.157# | 7.211±1.018# | 3.980±0.364# | 1.044±0.390# |
| Pue(H) | 6 | 1.030±0.138# | 6.687±1.900# | 4.448±0.305# | 0.977±0.441# |
| *P<0.05 vs WT;#P<0.05 vs DIO | |||||
如Tab 2-4所示,DIO组血压明显高于对照组,低剂量组SBP(systolic blood pressure)、DBP(diastolic blood pressure)、MAP(mean arterial blood pressure)与对照组无明显差异,中、高剂量组可明显降低DIO组的高血压(P<0.01)。
| Group | SBP(mmHg) | ||
| 0 wk | 4 wks | 8 wks | |
| Con | 94.667±2.066 | 95.667±1.751 | 94.500±2.258 |
| DIO | 114.833±2.137* | 122.333±6.408* | 121.000±2.828* |
| Pue(L) | 110.833±2.137* | 115.167±0.753# | 117.667±1.506# |
| Pue(M) | 112.333±3.077* | 105.000±6.542# | 103.667±1.506# |
| Pue(H) | 110.833±1.722* | 102.167±1.169# | 101.500±1.225# |
| *P<0.05 vs WT; #P<0.05 vs DIO | |||
| Group | DBP(mmHg) | ||
| 0 wk | 4 wks | 8 wks | |
| Con | 80.333±6.593 | 82.167±4.309 | 80.167±1.835 |
| DIO | 93.000±5.020* | 108.500±9.793* | 109.167±5.419* |
| Pue(L) | 90.833±5.913* | 90.000±6.986# | 88.833±2.927# |
| Pue(M) | 93.667±8.824* | 89.833±10.870# | 82.167±4.021# |
| Pue(H) | 94.833±2.317* | 89.500±4.764# | 80.333±4.761# |
| *P<0.05 vs WT; #P<0.05 vs DIO | |||
| Group | MAP(mmHg) | ||
| 0 wk | 4 wks | 8 wks | |
| Con | 85.111±4.801 | 86.667±2.921 | 84.944±1.255 |
| DIO | 100.278±3.329* | 113.11±7.512* | 113.111±3.781* |
| Pue(L) | 97.500±4.564* | 98.056±3.221# | 98.444±2.316# |
| Pue(M) | 99.889±6.33* | 94.889±8.063# | 89.333±2.633# |
| Pue(H) | 100.167±1.410* | 94.056±4.878# | 87.389±3.323# |
| *P<0.05 vs WT; #P<0.05 vs DIO | |||
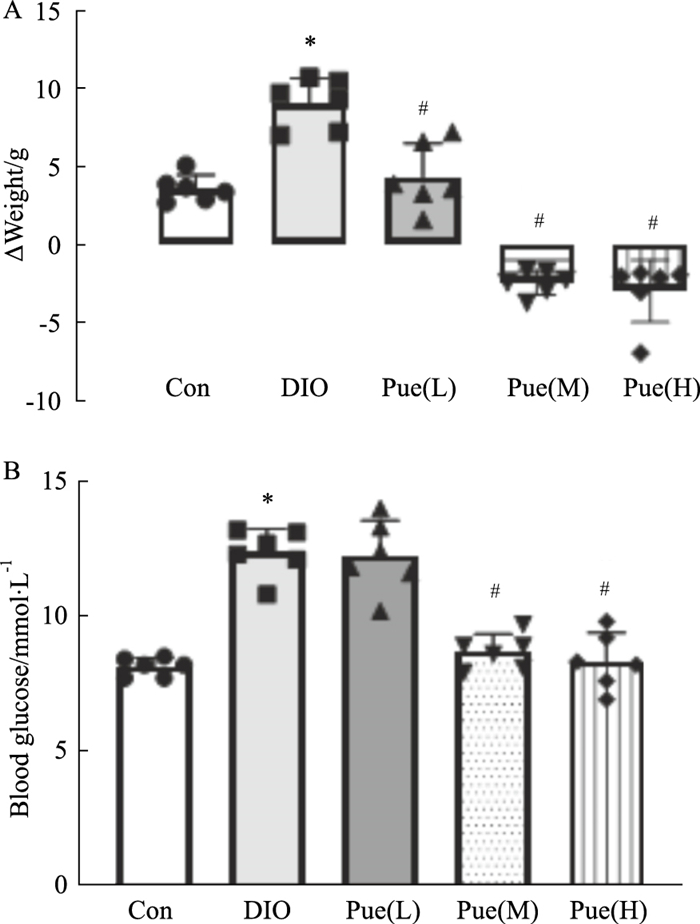
|
| Fig 1 Effects of puerarin on body weight (A), fasting blood glucose (B) (x±s, n=6) *P < 0.05 vs control; #P < 0.05 vs DIO |
血管张力结果如Fig 2A所示,与DIO组相比,葛根素组主动脉环对ACh引发的舒张明显降低。如Fig 2B所示,在ACh累积浓度为1 μmol·L-1时,对照组血管舒张率在50%左右,而葛根素组舒张率可达80%,与对照组相比差异具有统计学意义(P<0.01),表明高剂量葛根素干预可明显增强DIO小鼠主动脉对ACh的舒张作用,从而改善血管舒张功能。
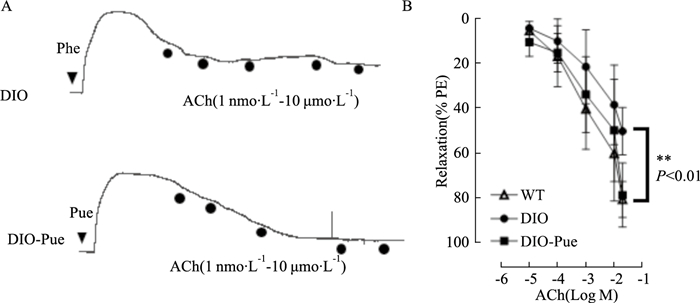
|
| Fig 2 Puerarin treatment improved aortic diastolic function of DIO mice Representative traces (A) and effects of ACh-induced vasodilation in aorticl rings (B), n=6, from three mice |
去内皮组血管舒张结果如Fig 3A所示,去内皮组(-Endo)主动脉环对ACh引起的舒张作用与对照组(+Endo)比较,差异具有统计学意义(P<0.01)。内皮完整组加入L-NAME处理后血管舒张结果如Fig 3B所示,L-NAME组主动脉对ACh引起血管舒张程度低于对照组,差异有统计学意义(P<0.01)。内皮完整组加入HC-067047处理后血管舒张结果如Fig 3C所示,HC-067047组主动脉与对照组相比,血管舒张明显减弱,差异具有统计学意义(P<0.01)。
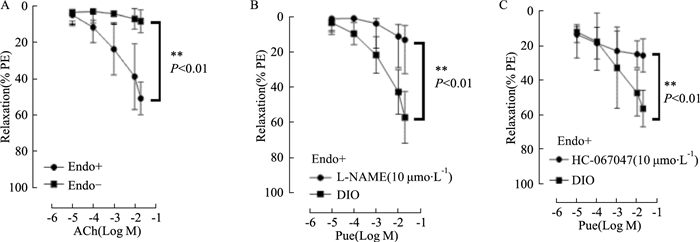
|
| Fig 3 Puerarin improved endothelium-dependent vasodilation of aorta Effects of ACh-induced relaxation in Phe(1 μmol·L-1) in aorta with endothelium (Endo+)or without endothelium(Endo-)(A). Effects of Pue-induced vasodilation in DIO mouse aorta of endothelium (Endo+) with or without L-NAME(100 μmol·L-1). (B) Effects of Pue-induced vasodilation in DIO mouse aorta of endothelium (Endo+) with or without HC-067047(1 μmol·L-1).(C) n=6, from three mice **P < 0.01 vs DIO |
MTT细胞增殖实验如Fig 4A所示,50 μmol·L-1葛根素组细胞活性明显高于DIO模型组(P<0.01), 100 μmol·L-1葛根素组也会显著增加细胞增殖能力,结果有统计学差异(P<0.01)。DIO小鼠内皮细胞Transwell细胞迁移实验结果如Fig 4B所示,与模型组比较,25 μmol·L-1葛根素组对细胞迁移率无影响,50、100 μmol·L-1葛根素组细胞迁移率明显增加(P<0.01)。
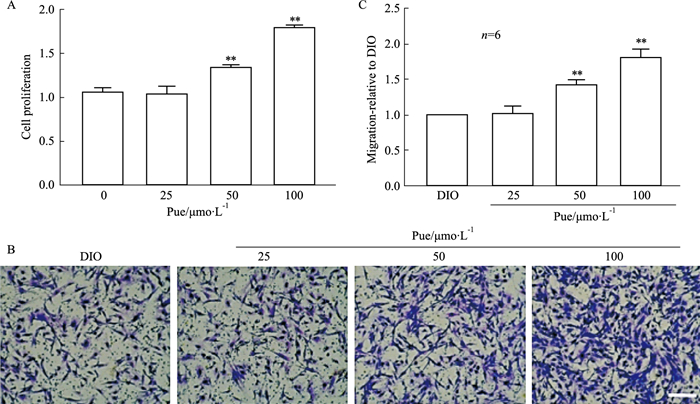
|
| Fig 4 Puerarin improved proliferation and migration of endothelial cell isolated from obese mice MAECs were cultured with Pue (25, 50, 100 μmol·L-1) for 24 h, and then the cell viability was detected by MTT assay.(A)MAECs were cultured with Pue (25, 50, 100 μmol·L-1) for 24 h, and then conducted the Transwell assay. Representative images of migration assays. (B-C) Scale bar, 20 μm **P < 0.01 vs DIO |
肥胖会引发血脂血糖代谢异常、高血压、高血脂且导致血管内皮功能改变。血管内皮细胞是血管壁的重要组成成分,内皮细胞的增殖迁移有助于维持血管壁内皮的完整性和细胞骨架的形成,从而改善血管内皮功能降低血压[14]。主动脉中内皮依赖性舒张主要由NO介导。TRPV4通道介导内皮依赖性引起的血管舒张,可促进内皮细胞产生NO,NO可以扩散到内皮细胞周围组织和平滑肌细胞中,然后通过平滑肌细胞介导主动脉血管舒张作用[15]。当TRPV4通道打开会引起细胞内Ca2+水平升高,激活eNOS引起血管舒张,TRPV4-eNOS信号传导在内皮功能中具有重要作用。葛根素是从葛根中提取的异黄酮类物质,在心脑血管疾病、糖尿病及高血压等临床疾病中广泛应用[16]。已报道的研究多聚焦于葛根素对高血压大鼠降压机制的研究,但对于高脂饮食诱导的肥胖小鼠的降压机制鲜有报道[17]。DIO小鼠随肥胖而血压升高其模型特点与因肥胖而造成的高血压人群更为接近。
本文研究发现葛根素治疗会降低肥胖小鼠的血压,主要通过改善主动脉血管功能。细胞水平的增殖和迁移实验结果表明葛根素能够促进内皮细胞的增殖与迁移;动物实验结果表明葛根素能够改善DIO小鼠的血管张力受损,并且内皮依赖性性的NO途径和TRPV4通道的激活参与上述调节。综上所述,本文的研究发现葛根素是能够增强主动脉内皮依赖性舒张和内皮细胞的迁移能力,降低肥胖小鼠的血压。本实验结果为探究葛根素治疗肥胖相关疾病包括血压升高提供了理论依据,极大地丰富了中药成分葛根素的在肥胖相关疾病的机制研究,说明中医药在临床中发挥的重要作用,同时也为未来中医药在肥胖相关性高血压的治疗及预防提供了更多的实践基础和有丰富的参考价值。
| [1] |
Valensi P. Autonomic nervous system activity changes in patients with hypertension and overweight: Role and therapeutic implications[J]. Cardiovasc Diabetol, 2021, 20(1): 170. doi:10.1186/s12933-021-01356-w |
| [2] |
Thorp A A, Schlaich M P. Relevance of sympathetic nervous system activation in obesity and metabolic syndrome[J]. J Diabetes Res, 2015, 2015: 341583. |
| [3] |
戴书伟, 蔡科. 论肥胖与高血压的关系[J]. 当代体育科技, 2019, 9(7): 9-11. Dai S W, Cai K. Discussion on the relationship between obesity and hypertension[J]. Contemporary Sports, 2019, 9(7): 9-11. |
| [4] |
Dua S, Bhuker M, Dhall M, et al. Body mass index relates to blood pressure among adults[J]. North Am J Med Sci, 2014, 6(2): 89-95. doi:10.4103/1947-2714.127751 |
| [5] |
Goel M, Pal P, Agrawal A, et al. Relationship of body mass index and other life style factors with hypertension in adolescents[J]. Annals Pediatric Cardiol, 2016, 9(1): 29-34. doi:10.4103/0974-2069.171393 |
| [6] |
Dominguez L J, Sayón-Orea C, Gea A. Increased adiposity appraised with CUN-BAE is highly predictive of incident hypertension. The SUN Project[J]. Nutrients, 2021, 13: 3309. doi:10.3390/nu13103309 |
| [7] |
Wang C K, Xu N G, Cui S. Comparative transcriptome analysis of roots, stems, and leaves of Pueraria lobata (Willd.) Ohwi: identification of genes involved in isoflavonoid biosynthesis[J]. PeerJ, 2021, 9: 10885. doi:10.7717/peerj.10885 |
| [8] |
Fang X X, Dong S, Zhang W J, et al. Ameliorated biomechanical properties of carotid arteries by puerarin in spontaneously hypertensive rats[J]. BMC Complement Med Ther, 2021, 21(1): 173. doi:10.1186/s12906-021-03345-8 |
| [9] |
刘剑, 段素萍, 乔着意, 等. 葛根素对肥胖型高血压大鼠血压和血管功能影响的实验研究[J]. 现代生物医学进展, 2012, 12(10): 1858-61. Liu J, Duan S P, Qiao Z Y, et al. Experimental study on the effect of Puerarin on blood pressure and vascular function in obese hypertensive rats[J]. Progr Modern Biomed, 2012, 12(10): 1858-61. |
| [10] |
吴昀, 许云飞, 贺细菊, 等. 葛根素对自发性高血压大鼠肠系膜动脉舒张功能的影响[J]. 中国临床解剖学杂志, 2019, 37(2): 142-7. Wu J, Xu Y F, He X J, et al. Effect of Puerarin on the diastolic function of mesenteric artery in spontaneously hypertensive rats[J]. Chin J Clin Anat, 2019, 37(2): 142-7. |
| [11] |
玉从容, 吕俊华, 王丹. 葛根素对胰岛素抵抗综合征大鼠血压、血脂及糖耐量的影响[J]. 山东中医杂志, 2005, 6: 367-9. Yu C R, LYU J H, Wang D. Effects of Puerarin on blood pressure, blood lipid and Glucose Tolerance in rats with insulin resistance syndrome[J]. Shangdong J Tradit Chin Med, 2005, 6: 367-9. doi:10.3969/j.issn.0257-358X.2005.06.024 |
| [12] |
Kleinert M, Clemmensen C, Hofmann S M, et al. Animal models of obesity and diabetes mellitus[J]. Nat Rev Endocrinol, 2018, 14(3): 140-62. doi:10.1038/nrendo.2017.161 |
| [13] |
Zhou T T, Wang Z W, Guo M T, et al. Puerarin induces mouse mesenteric vasodilation and ameliorates hypertension involving endothelial TRPV4 channels[J]. Food Funct, 2020, 11(11): 10137-48. doi:10.1039/D0FO02356F |
| [14] |
Taddei S, Virdis A, Salvetti A, et al. Defective L-arginine-nitric oxide pathway in offspring of essential hypertensive patients[J]. Circulation, 1996, 94(6): 1298-303. doi:10.1161/01.CIR.94.6.1298 |
| [15] |
曹盼, 张樱山, 魏学明, 等. 葛根素药理作用研究新进展[J]. 中成药, 2021, 43(8): 2130-4. Cao P, Zhang Y S, Wei X M, et al. New progress in pharmacological effects of puerarin[J]. Chin Tradit Patent Med, 2021, 43(8): 2130-4. doi:10.3969/j.issn.1001-1528.2021.08.028 |
| [16] |
李晓洁, 林宇涵, 刘彦彬, 等. 葛根素对高血压大鼠内皮功能障碍的影响[J]. 中国现代应用药学, 2016, 33(7): 841-4. Li X J, Lin Y H, Liu Y B, et al. Effect of Puerarin on endothelial dysfunction in hypertensive rats[J]. Chin J Mod Appl Pharm, 2016, 33(7): 841-4. |
| [17] |
吴文华, 张继业, 王宇, 等. 葛根素影响自发性高血压大鼠血压的机制[J]. 中医药学报, 2010, 38(4): 26-9. Wu W H, Zhang J Y, Wang Y, et al. The mechanism of puerarin affecting blood pressure in spontaneously hypertensive rats[J]. Acta Chin Med Pharm, 2010, 38(4): 26-9. |

