

2. 华中科技大学协和深圳医院疼痛科,广东 深圳 518052;
3. 南方科技大学医学院,广东 深圳 518055
2. Pain Management, Huazhong University of Science and Technology Union Shenzhen Hospital, Shenzhen 518052, China;
3. Dept of Medicine, Southern University of Science and Technology, Shenzhen 518055, China
吴茱萸俗称吴萸、米辣子,具有较高的药用价值,始载于《神农本草经》,列为中品。其味性辛热,有小毒。《中国药典》(2020年版)收载的吴茱萸来源芸香科植物吴茱萸、石虎及蔬毛吴茱萸的干燥近成熟的果实,具有散寒止痛、降逆止呕、寒疝脚气、助阳止泻及外治口舌生疮和湿疹等功效。
传承千年的中医药文化,底蕴丰富,集结了我国人民在长期的生产劳动、生活实践与医疗实践中的智慧。中药往往是配伍用药,药对是中药配伍的最小单位,遵循中药配伍的“七情合和”理论;用药中常常以相对固定的配伍形式进行使用,起到主次分明又相辅相成的作用。吴茱萸辛热,黄连苦寒;前者能温脾暖胃,后者黄连清热燥湿、泻火解毒,苦寒易伤脾胃。两者常常配伍使用,一方面中和吴茱萸的热性,另一方面中和黄连的苦寒之性。黄连和吴茱萸这一经典寒热药对,不同配伍,其功能主治各异,早在《丹溪心法·火六》中,以君药黄连与佐药吴茱萸6∶1的配伍比例组成左金丸(又称回命丸),主治肝火犯胃和消化性溃疡。随着黄连和吴茱萸配伍比例的变化还创造出运用于暑气证、寒痢证和胃寒证的甘露散(2∶1)、茱萸丸(1∶1)和反左金丸(1∶6)等方剂。仅在配伍比例上略有变化,却能产生完全不同的药效作用,可见中药配伍的神奇之处。
本草记载吴茱萸生品有小毒,且辛香走窜力量较强,因此,煎服多为炮制品。生吴茱萸温热苦燥,能祛寒燥湿,外用时可以经甘草制和水洗能降低毒性。黄连制能降逆止呕,醋制能疏肝镇痛,生姜制能散寒止呕,盐制能引药入肾,酒制能治心腹气滞作痛;说明古人对减轻毒性已经有宏观的认识。另外,以吴茱萸入药,还配制成了雪胆丸、华佗再造丸、戊己丸、四神丸、吴藿降压滴丸和萸黄连饮片等常用中药制剂。因此,进行中药的相互作用研究,对发挥中药协同增效作用、提高疾病治疗效率、逆转药物多药耐药和降低毒副作用等具有重要意义,为更有效临床用药提供依据。
1 吴茱萸碱概述通过成分分析属芸香科植物的吴茱萸的化学成分主要有:生物碱类、挥发油类、柠檬苦素类、萜类、香豆素等。其中生物碱类占主要部分,生物碱类主要又分吴茱萸碱和吴茱萸次碱等。《中国药典》记载两种碱类的总含量决定了吴茱萸药材质量的优劣。
吴茱萸碱(evodiamine,EVO)是吴茱萸次碱(rutecarpine)的衍生物,也是一种色胺吲哚类生物碱,其相对分子质量为303.36,分子式为C19H17N3O,溶点278 ℃,其性状为黄色片状结晶。EVO结构比较不稳定,温度超过60 ℃,pH<5或>9,即在过热、酸、碱等情况下结构立即发生变化。如Fig 1所示,对比EVO和吴茱萸次碱的结构不难发现,两者只有在14位置的N原子上一个甲基的差别。
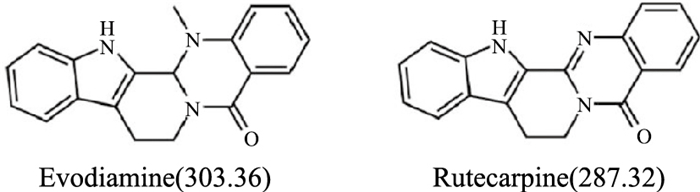
|
| Fig 1 Evodiamine and Rutecarpine chemical structural formula |
其次,EVO属生物药剂学分类系统(Biopharmaceutics Classification System,BCS)中的二类药物。并且是一种难溶性药物,不溶于水、乙醚和丙酮,能溶于氯仿、醋酸,微溶于酒精。一般来说,溶出速率是制约其生物利用度的关键因素,而EVO生物利用度低,使用时也面临这个难题。
近年来,尝试将EVO制备成EVO羟丙基-β-环糊精(HP-β-CD)分子包合物或者采用微乳液递送等[1],不但提高了水溶性和溶解度,还提升了它的生物利用度。另外,炮制后吴茱萸的辛散之力和毒性都大大减低,内服需选用炮制的吴茱萸,药典规定的最大用量为5 g。EVO具有抗炎、抗肿瘤、抗肥胖和抗心血管等多种药理活性。随着不断延展到分子生物学、药物化学和药物代谢等领域内进行深入研究,EVO现代药理作用的挖掘将会达到一个新的高度。
2 吴茱萸碱现代药理学活性 2.1 抗炎活性近年来,吴茱萸碱的抗炎作用备受关注,在细胞和分子水平上,抑制众多细胞相关的炎症因子的分泌,主要有以下四个方面:①抑制巨噬细胞(macrophage,Mφ)炎症因子的分泌:EVO通过抑制NF-κB及其介导的环氧合酶-2(cyclooxygenase-2,COX-2)的活性,进一步抑制LPS诱导的RAW 264.7细胞前列腺素E2(PGE2)分泌,影响巨噬细胞的迁移[2]。②抑制单核细胞(monocyte,MO)炎症因子的分泌:EVO可抑制淋巴毒素类似物(LIGHT)诱导的人MO分泌炎症因子及众多的CCR1、CCR2等趋化因子受体的表达以及人MO迁移[3]。③抑制中性粒细胞(neutrophile granulocyte,NE)中活性氧(reactive oxygen species,ROS)的产生:EVO通过抑制小鼠中NE中还原型辅酶Ⅱ(NADPH)氧化酶的活性,进而减少ROS和超氧阴离子的产生[4]。④抑制小胶质细胞(microglial cells,MC)中促炎因子的产生:LPS处理小鼠BV2细胞后,结果显示EVO可明显抑制诱导型一氧化氮合酶(iNOS)的合成,进而明显抑制MC中促炎因子的生成[5]。
EVO可以在多种炎症模型中发挥抗炎作用。例如,在酵母多糖(zymosan,ZYM)诱导的小鼠急性腹膜炎中,EVO能显著改善模型小鼠体内的“炎症风暴”,减少血清和腹腔中炎症因子(IL-6、TNF-α、IL-1β和角化细胞来源趋化因子等)的分泌、减轻腹腔液NE的浸润,并抑制NE中ROS的产生,此作用有可能是通过EVO抑制NF-κB的p65入核而起作用[6]。其次,发现EVO能减轻气管滴注LPS诱导的急性肺损伤大鼠和小鼠模型肺水肿症状,同样可以抑制肺组织细胞中NF-κB p65和p50的入核,从而减轻NE的浸润、降低炎症水平,发挥对急性肺损伤炎症模型的保护作用[6]。此外,在灌胃干预之后,吴茱萸明显改善动脉粥样硬化(atherosclerosis,AS)模型大鼠的血清胆固醇四项指标,能显著降低主动脉弓和肝脏组织中炎症性细胞的浸润,且当EVO(25 mg/kg/day)灌胃时效果最为明显[7]。同样EVO灌胃后后可以明显降低经典的小鼠溃疡性结肠炎模型结肠组织中炎症因子的水平。有趣的是,EVO还可以降低胞内的LPS含量以及重新平衡大肠杆菌和乳酸菌的数量。还有报道表明EVO不仅能减轻葡聚糖硫酸钠(Dextran sodium sulfate,DSS)诱导的炎症反应,且能维持肠道的完整性及肠道菌群的稳态,为临床治疗溃疡性结肠炎提供了新的方向[8]。
2.2 抗肿瘤活性研究证实,EVO通过诱导肿瘤细胞凋亡、遏制肿瘤细胞周期和迁移而起到抗肿瘤作用。其中,诱导凋亡主要经内源性途径、外源性途径及内质网途径实现,在这些途径中常常涉及众多重要的信号通路(NF-κB、mT0R/S6Kl、JNK等)[9]。目前有研究报道EVO对多种肿瘤细胞有积极的抗肿瘤作用,例如黑色素瘤A375、人胰腺癌细胞PANC-1、人宫颈癌细胞Hela、乳腺癌细胞MCF-7、胃癌细胞SGC-7901等。另外EVO除了自身的抗癌作用,在联合紫杉醇或黄连素等也能发挥较好的协同增益功能,降低化疗药物的使用量,进而减低对正常细胞的毒副作用,将为临床提供更好的治疗方案。
2.3 抗肥胖活性脂肪细胞的分化是研究肥胖症和糖尿病的关键点。Wang等[10]观察使用EVO处理脂肪细胞发现EVO可以抑制脂肪细胞分化的功能,其机制与EGFR-pKCa-ERK信号通路的激活密切相关;Kobayashi等[11]证实EVO发挥抗肥胖活性可能是通过增加棕色脂肪组织中β3肾上腺素的分泌来增强解偶联蛋白1(UCP-1)的产热作用;另有研究报道,黄连与吴茱萸(1∶1)的配伍,也能改善高脂血症模型大鼠血清四项指标的水平,同时激活JAK2/STAT3通路,调节脂质代谢,这也可能是黄连与吴茱萸的配伍后治疗高血脂症大鼠的机制之一[12];Shi等[13]在研究实验中发现,经过灌胃给药之后,EVO可以达到抑制肥胖的作用,机制可能是其抑制下丘脑弓状核内促食欲肽NPY的表达,这个机制值得进一步深入研究。
2.4 阿尔茨海默病阿尔茨海默病(Alzheimer’s disease,AD),由于大脑内β-淀粉样蛋白(amyloid β protein,Aβ)的产生和降解机制失衡而对大脑神经元造成极大性破坏,神经元内的神经纤维、皮层动脉和小动脉发生改变,引起大脑神经元数量减少,出现记忆学习功能障碍。通过微量注射器ICV(侧脑室)注射Aβ蛋白,诱导AD小鼠模型,EVO灌胃21 d后,发现灌胃EVO组较AD组能明显抑制小鼠海马体细胞的凋亡,且这种抑制作用有可能通过降低p53的表达和其磷酸化的水平实现的。研究发现,虽然EVO对Aβ的沉积无明显作用,但是它可以明显降低AD模型小鼠脑中炎性细胞因子的表达以及增加其脑部组织对葡萄糖的摄取而明显地改善AD的症状,说明EVO通过抗炎作用发挥抗老年痴呆的作用[14]。另外,通过Morris水迷宫实验中,发现EVO组能明显减少平均潜伏期,能显著改善AD小鼠的空间认知和学习能力,减少了测试中的逃避潜伏时间,保护脑组织[15]。这些研究说明EVO可能成为治疗及预防AD的候选天然药物。
2.5 抗菌活性吴茱萸提取物的体外抗菌实验中,发现对常见的幽门螺旋杆、菌金黄色葡萄球菌等有明显的抑制作用。然而,很多中药的成分在体外表现较为显著的抗菌抑菌作用,但是在进入体内后由于诸多因素的影响下效果却不佳,甚至作用消失。抗菌实验中,检测中药给药后的含药血清能准确反映中药的抗菌功效。Wu等[16]预先对家兔进行灌胃,连续给药3 d,3次/天,然后收集血清,发现收集的血清中EVO的含量最高;进一步用含EVO的血清处理各种细菌(伤寒杆菌、福氏志贺菌等),结果显示都有较好的抑菌作用,但是对于EVO的抗菌抑菌机制仍需进一步探索。
3 吴茱萸碱与蛋白之间的作用EVO分子靶点的确定为实现对其药理的深入研究提供了绝佳的时机。到目前为止,TRPV1和拓扑异构酶作用靶点的发现是EVO药理学的研究的阶段性成果。这两个药物作用靶点在炎症和癌症等发生发展过程中具有不可忽视的重要地位。众多研究致力于阐明EVO与其靶点相互作用的复合物结构,这些复合物结构将是研究多靶点药物的前提,注定是研究的焦点。
3.1 TRPV1众多周知,瞬时感受器电位香草酸受体l(transient receptor potential vanilloid 1,TRPV1)作为一种非选择性的配体门控的阳离子通道蛋白激活后主要引起细胞外的Ca2+向细胞内的流动。正因为TRPV1在炎症进程中有着举足轻重的作用,EVO通过激活TRPV1受体才能达到抑制炎症反应的作用[17]。其机制是通过抑制IL-4诱导的M2型巨噬细胞分泌产生的细胞因子TGF-β而抑制炎症。同样报道过吴茱萸和其提取物具有抗肥胖的作用,机制与辣椒素相似,通过不断消耗热量而降低脂肪的堆积。在结构水平上,通过分子对接,计算机模拟分析发现EVO的环1与TRPV1活性位点Tyr511发生疏水作用,环5与Tyr555形成π-π键相互作用。因此,EVO可以作为骨架结构研发作用于TRPV1新的药物或者配体[17]。
3.2 DNA拓扑异构酶研究发现,EVO可以抑制大肠杆菌中被拓扑异构酶Ⅰ(topoisomerase Ⅰ,TOPI)催化的超螺旋质粒DNA的松弛达到抗菌的作用,可以与TOPI的Arg161和Asp551残基相互作用[18]。另外,发现EVO对多药耐药的肺炎克雷伯菌(Klebsiella Pneumoniae)具有明显的杀菌作用[18]。EVO可能作为抗耐药菌的天然药物值得深入研究。有报道发现由于EVO可以抑制TOPI,与DNA形成共价复合物,并且与依立替康(Irinotecan)相似,能诱导DNA的损伤,但TOPI抑制剂Irinotecan等会抑制在S期。而在研究人前列腺癌、小鼠结肠癌的过程中发现,EVO处理后将细胞周期阻滞在G2/M期,这与以往的TOPI抑制剂的作用有所差别,因此有研究进一步发现EVO可以影响人乳腺癌细胞的微管解聚与聚合之间的平衡,抑制人乳腺癌细胞的增值,其中分子机制的发现丰富了EVO的抗癌机制。另外,根据EVO在TOPI结合口袋中的结合模式,采用苯甲酰基团替代EVO的吲哚氮原子,能够表现出更好的抗肿瘤活性。
3.3 微管蛋白研究证实,过表达的去乙酰化酶(histone deacetylases,HDACs)显著增加患者发生肿瘤的风险[19]。因此,HDACs是一个潜在的肿瘤治疗靶点。而EVO可抑制HDAC6的活性,激活MAPK信号通路,活化caspase-3,诱导人白血病细胞K562周期阻滞和凋亡[20]。同时,EVO可以明显抑制Burkitt淋巴瘤细胞系Raji和T淋巴系白血病细胞株Jurkat的增殖,可能为临床治疗淋巴瘤和白血病带来了新的希望[21]。
此外,EVO能够通过抑制HDAC6的活性参与微管的乙酰化调节过程。研究发现EVO浓度为4 μmol·L-1时可以促进体外微管蛋白的聚合,发现了EVO具有紫杉醇样活性[22],同时应用计算机析分析出EVO在β-tubulin蛋白内紫杉醇结合位点有较大的对接活性,并推测出EVO与β-tubulin蛋白的Thr276形成氢键,与Leu371和Ala233形成范德华力相互作用而到达与微管蛋白相互稳定结合的效应。提示了β-tubulin可能是EVO的作用靶点,且可能与紫杉醇有竞争结合的作用[23]。这些结果都表明,由于EVO参与微管的调节过程,可能作为新的微管抑制剂用于抗肿瘤治疗的探索。
另外,Liao等[22]和Huang等[24]的两个实验室都提到了EVO对微管蛋白的潜在活性,但是实验结果却恰恰相反。首先,两者都进行了通过in vivo微管聚合实验,Liao发现在体内EVO可以增加聚合型微管蛋白,然而Huang的实验结果却相反,因此,EVO对微管蛋白的潜在活性需要进一步论证。除了β-tubulin外,EVO处理肝癌细胞HepG-2后,通过共聚焦发现微管蛋白α-tubulin分布形态紊乱,由长条型变为不规则型或圆型;EVO浓度越高时,α-tubulin的排列方式改变就越显著。通过向细胞的一侧聚合,从原先的辐射状变换成束状分布,颜色呈亮绿色。表明EVO阻遏肿瘤细胞周期和增殖可能与改变细胞微管蛋白的聚合态密切相关。细胞骨架微管通过调控NLRP3炎症小体成分(ASC和NLRP3)的空间重排和转运,在调节NLRP3炎症小体活化过程中起着关键作用[25]。而Li等[23]研究发现EVO能够明显增强巨噬细胞中α-tubulin(K40)的乙酰化水平,且诱导线粒体的运输,最后乙酰化微管束紧靠微管组织中心(microtubule organizing centers,MTOCs),说明EVO通过诱导α-tubulin乙酰化,有利于线粒体上的ASC朝向MTOCs的运输,小鼠体内发生NLRP3炎症小体活化而发生细胞焦亡。而通过α-tubulin乙酰化的抑制剂白藜芦醇和NAD+或者siRNA敲低αTAT1(α-tubulin乙酰化关键酶)的表达,能够明显逆转EVO促进ATP或nigericin诱导的NLRP3炎症小体活化和细胞焦亡。因此,这些研究结果提示对微管蛋白的乙酰化修饰也是EVO的一个新的及重要的药理学活性。
3.4 mTOR蛋白哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路参与调节细胞增殖、分化、迁移,在卵巢癌、非小细胞肺癌、胃癌、结肠癌等肿瘤中高度活化。体内外实验表明,EVO可明显增加细胞内自噬体及ROS的产生,上调细胞内LC3、同时抑制p62等蛋白的表达,同时能上调AMPK/mTOR信号通路关键蛋白的表达,激活自噬,抑制结肠癌HCT-116细胞增殖[26]。研究发现EVO可以作用mTOR信号通路,抑制mTOR的磷酸化,促进胃癌SGC-7901细胞凋亡[27]。
3.5 毒性及安全性用药药典记载吴茱萸有小毒,EVO也具有潜在的毒性作用。例如,肝毒性、肾毒性、心脏毒性等。在研究EVO药理学活性和蛋白互作靶点时,也应更加重视对吴茱萸毒性的研究。例如,Cai等[28]研究发现EVO具有肝毒性可能与诱导线粒体肿胀、空泡化、MPT孔开放和线粒体电位显着降低,导致ATP耗竭和CytC释放,最终触发细胞死亡信号有关。Wu等[29]研究显示EVO-7和EVO-8,但不是EVO-1或EVO-6,可以诱导人肾细胞癌A498细胞中Bcl-2蛋白的聚合酶(PARP)切割和磷酸化,促进A498的凋亡。可见,EVO对肿瘤细胞具有毒性作用,也可以用于肿瘤的干预治疗。EVO对心血管疾病的治疗,但是也可能促进氧化应激介导心血管的损坏,在运用中注意监测其用量和剂型的使用。
4 结语综上,大量研究证实了EVO的抑瘤活性,可见抗肿瘤作用将是EVO发挥的主要药理作用之一,其抗肿瘤特性比较广泛,值得基础研究和临床试验进一步挖掘,它可能作为一种天然抗癌新药为患者的抗肿瘤治疗带来新的希望。最近研究发现使用诱导细胞凋亡的化疗药物处理后,能激活caspase-3进而切割GSDME的267-270位点产生GSDME-NT片段,并在膜上形成孔洞,诱导细胞二次坏死[30]。因此,探索EVO是否能影响GSDME的相关机制,将有待发现EVO又一新的抗癌机制。
EVO的毒性和用药安全也是在关注其药理学活性的同时更加关注的。一方面在临床合理用药中,减少不良反应,减少对患者的健康的危害;另一方面也要通过对其毒理机制的深入认识,扩展EVO在临床上应用范围,特别是EVO衍生物的开发和应用。
中医常将吴茱萸用于治疗喉舌口疮、痈疽发背和脚气等感染相关炎症性疾病,但其药理机制未明。对于这些慢性迁延性感染(如疮痈、脚气等)或其他慢性疾病(如肥胖等)而言,已活化的巨噬细胞会不断释放炎症因子,导致反复的慢性炎症性症状的发生,促使其快速焦亡可能是最好的策略,然而至今也没有找到明确的、可逆转已活化巨噬细胞的办法。因此,吴茱萸中的有效成分EVO可以促进NLRP3炎症小体活化,将可用于各种现代意义上的感染相关炎症性疾病(如消化性溃疡、痢疾等)的临床治疗,而在未来的研究中可能将中医术语与现代医学术语一一对应。
| [1] |
石明芯, 胡江波, 晏声蕾, 等. 微乳液递送吴茱萸碱的体外释放行为及在体吸收研究[J]. 中国药理学通报, 2018, 34(1): 87-90. Shi M X, Hu J B, Yan S L, et al. In vitro release behavior and in situ absorption of evodiamine loaded microemulsion[J]. Chin Pharmacol Bull, 2018, 34(1): 87-90. |
| [2] |
Choi Y H, Shin E M, Kim Y S, et al. Anti-inflammatory principles from the fruits of evodia rutaecarpa and their cellular action mechanisms[J]. Arch Pharm Res, 2006, 29(4): 293-7. doi:10.1007/BF02968573 |
| [3] |
Heo S K, Yun H J, Yi H S, et al. Evodiamine and rutaecarpine inhibit migration by light via suppression of NADPH oxidase activation[J]. J Cell Biochem, 2009, 107(1): 123-33. doi:10.1002/jcb.22109 |
| [4] |
Ko H C, Wang Y H, Liou K T, et al. Anti-inflammatory effects and mechanisms of the ethanol extract of evodia rutaecarpa and its bioactive components on neutrophils and microglial cells[J]. Eur J Pharmacol, 2007, 555(2-3): 211-7. doi:10.1016/j.ejphar.2006.10.002 |
| [5] |
Fan X, Zhu J Y, Sun Y, et al. Evodiamine inhibits zymosan-induced inflammation in vitro and in vivo: inactivation of NF-κB by inhibiting iκBα phosphorylation[J]. Inflammation, 2017, 40(3): 1012-27. doi:10.1007/s10753-017-0546-0 |
| [6] |
陈浩, 范霞, 孙宇, 等. 吴茱萸碱对酵母多糖诱导急性腹膜炎小鼠的保护作用[J]. 第三军医大学学报, 2017, 39(2): 163-8. Chen H, Fan X, Sun Y, et al. Protective effect of evodiamine on zymosan-induced acute peritonitis in mice[J]. J Third Military Med Univ, 2017, 39(2): 163-8. |
| [7] |
任妮娜, 杨奕樱, 潘春, 等. 吴茱萸碱对动脉粥样硬化大鼠抗炎抗氧化作用的研究[J]. 贵阳中医学院学报, 2018, 40(2): 21-6. Ren N N, Yang Y Y, Pan C, et al. A study on the effect of evodiamine on anti-oxidation and anti-inflammatory in rats with atherosclerosis[J]. J Guiyang Univ Chin Med, 2018, 40(2): 21-6. |
| [8] |
Shen P, Zhang Z C, Zhu K, et al. Evodiamine prevents dextran sulfate sodium-induced murine experimental colitis via the regulation of NF-κB and NLRP3 inflammasome[J]. Biomed Pharmacother, 2019, 110: 786-95. doi:10.1016/j.biopha.2018.12.033 |
| [9] |
Yang Y C, Ran X, Wang H F, et al. Evodiamine relieve LPS-induced mastitis by inhibiting AKT/NF-κB p65 and MAPK signaling pathways[J]. Inflammation, 2022, 45(1): 129-42. doi:10.1007/s10753-021-01533-9 |
| [10] |
Wang T, Wang Y X, Yamashita H. Evodiamine inhibits adipogenesis via the EGFR-PKCalpha-ERK signaling pathway[J]. FEBS Lett, 2009, 583(22): 3655-9. doi:10.1016/j.febslet.2009.10.046 |
| [11] |
Kobayashi Y, Nakano Y, Kizaki M, et al. Capsaicin-like anti-obese activities of evodiamine from fruits of evodia rutaecarpa, a vanilloid receptor agonist[J]. Planta Med, 2001, 67(7): 628-33. doi:10.1055/s-2001-17353 |
| [12] |
周昕, 魏宏, 沈涛, 等. 小檗碱与吴茱萸碱配伍对高胆固醇血症大鼠小肠ACAT2、ApoB48和NPC1L1表达的影响[J]. 中成药, 2017, 39(10): 1993-9. Zhou X, Wei H, Shen T, et al. Effects of berberine evodiamine compatibility on expressions of intestinal ACAT2, ApoB48 and NPC1L1 in hypercholesterolemic rat[J]. Chin Tradi Patent Med, 2017, 39(10): 1993-9. |
| [13] |
Shi J H, Yan J Q, Lei Q, et al. Intragastric administration of evodiamine suppresses NPY and AgRP gene expression in the hypothalamus and decreases food intake in rats[J]. Brain Res, 2009, 1247: 71-8. doi:10.1016/j.brainres.2008.09.091 |
| [14] |
Yuan S M, Gao K, Wang D M, et al. Evodiamine improves congnitive abilities in SAMP8 and APP(swe)/PS1(ΔE9) transgenic mouse models of alzheimer's disease[J]. Acta Pharmacol Sin, 2011, 32(3): 295-302. doi:10.1038/aps.2010.230 |
| [15] |
Zhang Y F, Wang J Q, Wang C Y, et al. Pharmacological basis for the use of evodiamine in alzheimer's disease: Antioxidation and antiapoptosis[J]. Int J Mol Sci, 2018, 19(5): 1527. doi:10.3390/ijms19051527 |
| [16] |
吴方评, 金苹, 蒲洪. 吴茱萸碱和吴茱萸次碱含药血清抑菌活性研究[J]. 中医药导报, 2016, 22(24): 47-9. Wu F P, Jin P, Pu H. Study on the antibacterial activity of the serum containing evodiamine and rutaecarpine[J]. Guid J Tradit Chin Med Pharmacy, 2016, 22(24): 47-9. |
| [17] |
Yu H, Jin H W, Gong W Z, et al. Pharmacological actions of multi-target-directed evodiamine[J]. Molecules, 2013, 18(2): 1826-43. |
| [18] |
Wu J Y, Chang M C, Chen C S, et al. Topoisomerase Ⅰ inhibitor evodiamine acts as an antibacterial agent against drug-resistant klebsiella pneumoniae[J]. Planta Med, 2013, 79(1): 27-9. |
| [19] |
Yang C, Croteau Stéphane, Hardy P. Histone deacetylase (HDAC) 9:versatile biological functions and emerging roles in human cancer[J]. Cell Oncol(Dordr), 2021, 44(5): 997-1017. |
| [20] |
袁龙, 陈益, 刘泽洪, 等. 吴茱萸碱抑制HDAC6促进人白血病K562细胞周期阻滞和凋亡的机制研究[J]. 中草药, 2016, 47(17): 3044-50. Yuan L, Chen Y, Liu Z H, et al. Mechanism of evodiamine inducing cell cycle arrest and apoptosis in human erythroleukemia K562 cells through inhibiting histone deacetylase 6[J]. Chin Tradit Herb Dr, 2016, 47(17): 3044-50. |
| [21] |
董瑞红, 陆志刚. 吴茱萸碱诱导不同起源的白血病细胞凋亡的研究[J]. 实用医学杂志, 2011, 27: 1722-4. Dong R H, Lu Z G. Evodiamine induces apoptosis of leukemia cells from different origins[J]. J Practical Med, 2011, 27: 1722-4. |
| [22] |
Liao C H, Pan S L, Guh J H, et al. Antitumor mechanism of evodiamine, a constituent from Chinese herb evodiae fructus, in human multiple-drug resistant breast cancer NCI/ADR-RES cells in vitro and in vivo[J]. Carcinogenesis, 2005, 26(5): 968-75. |
| [23] |
Li C G, Zeng Q Z, Chen M Y, et al. Evodiamine augments NLRP3 inflammasome activation and anti-bacterial responses through inducing α-tubulin acetylation[J]. Front Pharmacol, 2019, 10: 290. |
| [24] |
Huang D M, Guh J H, Huang Y T, et al. Induction of mitotic arrest and apoptosis in human prostate cancer pc-3 cells by evodiamine[J]. J Urol, 2005, 173(1): 256-61. |
| [25] |
Li X, Thome S, Ma X D, et al. MARK4 regulates NLRP3 positioning and inflammasome activation through a microtubule-dependent mechanism[J]. Nat Commun, 2017, 8: 15986. |
| [26] |
吕艳伟. 吴茱萸碱通过AMPK/mTOR信号通路激活自噬抑制结肠癌细胞增殖的研究[D]. 重庆: 重庆医科大学, 2019. LYU Y W. Inhibition of colon cancer cell proliferation by evodogine activation of autophagy through AMPK/mTOR signaling pathway[D]. Chongqing: Chongqing Med Univ, 2019. |
| [27] |
范春娇, 黄鹏, 黄贵华, 等. 吴茱萸碱抗消化系统肿瘤作用机制的研究进展[J]. 海南医学院学报, 2021, 27(10): 791-6. Fan C J, Huang P, Huang G H, et al. View from specialist: It is creative, and of certain scientific and educational value[J]. J Hainan Med Coll, 2021, 27(10): 791-6. |
| [28] |
Cai Q Y, Wei J J, Zhao W, et al. Toxicity of evodiae fructus on rat liver mitochondria: The role of oxidative stress and mitochondrial permeability transition[J]. Molecules, 2014, 19(12): 21168-82. |
| [29] |
Wu W S, Chien C C, Chen Y C, et al. Structure-activity relationship of evodiamine (EVO) and related chemicals on apoptotic events in human A498 renal cell carcinoma (RCC) cells[J]. PLoS ONE, 2016, 8(4): 17-21. |
| [30] |
Rogers C, Fernandes A T, Mayes L, et al. Cleavage of DFNA5 by caspase-3 during apoptosis mediates progression to secondary necrotic/pyroptotic cell death[J]. Nat Commun, 2017, 8: 14128. |

