

2. 安徽医科大学附属滁州医院(滁州市第一人民医院)神经外科,安徽 滁州 239000
吴华勋(1978-),男,博士,副教授,硕士生导师,研究方向:抗炎免疫药理学,通信作者,E-mail:wuhuaxun01@163.com
 ,
TIAN Qian-wen1,
HOU Shi-qiang2,
ZHOU Tong-tong1,
HUANG Lei1,
GU Fang1,
LIN Ning2,
WEI Wei1
,
TIAN Qian-wen1,
HOU Shi-qiang2,
ZHOU Tong-tong1,
HUANG Lei1,
GU Fang1,
LIN Ning2,
WEI Wei1
 ,
WU Hua-xun1
,
WU Hua-xun1

2. Dept of Neurosurgery, the Affiliated Chuzhou Hospital of Anhui Medical University, the First People′s Hospital of Chuzhou, Chuzhou Anhui 239000, China
干燥综合征(Sjogren′s syndrome,SS)是一种全身性自身免疫性疾病,主要影响外分泌腺,出现大量淋巴细胞浸润,导致黏膜表面严重干燥,临床表现为口干和眼干[1-2]; 也可累及肺、皮肤等其他器官[3]。目前,SS的具体发病机制尚不清楚,临床暂无理想的药物,以局部替代对症治疗为主,对SS的深入研究具有重要意义[4]。C57BL/6J小鼠是实验研究常用的小鼠,具有繁殖快和遗传稳定的特点,通过对其颌下腺匀浆作为抗原背部多点皮内注射,诱导成为SS动物模型[5]。SS动物模型的研究为SS的发病机制和治疗干预提供了重要实验方法,在SS的研究中较少涉及到对影响动物成模的因素的研究[6]。
SS具有明显的性别差异,男女比例约为1 ∶ 9[7],提示性别差异可能影响SS的发病过程。研究人员常采用雌性动物作为SS的动物模型,很少采用雄性动物,为探讨性别差异对抗原诱导型SS模型的影响,并比较雌、雄SS动物模型在SS样表现和病理表现的差异,选用雌性和雄性C57BL/6J小鼠,背部多点皮内注射自身抗原,诱导小鼠SS模型,成模后对雌性和雄性小鼠的SS模型小鼠造模成功率、全身表现、病理评分及脾脏T、B细胞的比例进行分析,对比雌性和雄性C57BL/6J小鼠对抗原诱导SS模型的成模过程以及成模效果的影响,为以后研究SS选取雌、雄动物提供参考。
1 材料与方法 1.1 实验动物C57BL/6J小鼠购买自斯贝福(北京)生物技术有限公司,生产许可证号为SCXK(京)2019-0010。选取60只SPF级,8周左右的雌、雄C57BL/6J小鼠,饲养于安徽医科大学临床药理研究所SPF动物实验室。动物实验计划由安徽医科大学临床药理研究所动物伦理委员会同意实施(伦理审查批号:LLSC20200667)。
1.2 试剂弗氏完全佐剂(Freund′s adjuvant complete,FCA)(批号:F5881),弗氏不完全佐剂(Freund′s incomplete adjuvant,FIA)(批号:F5506)购自美国Sigma-Aldrich公司,注射用盐酸替来他明盐酸唑拉西泮(Zoletil50)(2020外兽药证字06号)购自法国Virbac公司; 毛果芸香碱(pilocarpine hydrochloride)(批号:ab141301)购自英国Abcam公司; 流式抗体CD4(批号:553650)、IL-17(批号:560184)、RORγ(批号:562607)、CD25(批号:557192)、Foxp3(批号:560408)、CD19(批号:553785)、CD138(批号:558626)、CD27(批号:558754)购自美国BD公司。
1.3 动物分组将雌、雄小鼠各随机分为两组,即雌性和雄性小鼠造模组(每组各20只),雌性和雄性小鼠正常组(每组各10只),共计4组。
1.4 SS模型的建立另取雌、雄C57BL/6J小鼠各4只,处死小鼠后新洁尔灭浸泡10 min,超净工作台上解剖小鼠,取颌下腺组织,分离黏膜和结缔组织,用PBS洗净,置于高压灭菌后的纱布吸干多余液体,称质量,剪碎,每0.1 g加1 mL PBS,在冰上用研钵研磨,研磨约20 min至组织完全研碎。4 ℃离心机3 000 r·min-1离心15 min,弃上层脂质,吸取上清液,置15 mL无菌离心管。BCA法蛋白定量后用PBS将抗原稀释成5 g·L-1,加等量FCA,使抗原最终浓度调整为2.5 g·L-1[8]。以第一次注射抗原为d 0,d 0、7、14,模型组小鼠背部消毒后多点皮内注射同性别小鼠的抗原,注射剂量为0.1 mL·20 g-1。d 21用FIA注射加强小鼠免疫,注射抗原剂量和方式同前。
1.5 体质量和全身情况观察从造模开始d 0、d 7、d 14、d 21、d 28、d 35、d 42称取小鼠体质量,观察小鼠有无舔舌,抓挠口唇、全身皮肤破损等现象。
1.6 唾液量造模6周后,测量所有小鼠的唾液量。测量前麻醉,小鼠肌肉注射盐酸替来他明盐酸唑拉西泮(替来他明∶唑拉西泮=1 ∶ 1)(稀释10倍,浓度为5 g·L-1,以体重20 g的小鼠为例,肌肉注射60 μL),完全麻醉后立刻腹腔注射0.025 g·L-1毛果芸香碱溶液,注射剂量为0.1 mL·20 g-1[9],注射5 min后收集唾液,将已经称好质量(M1)的棉球放入小鼠口颊内,收集10 min(注意观察棉球是否掉落),取出棉球分析天平上称质量(M2)[唾液分泌量(mg)=M2-M1]。对造模组唾液量无显著变化的小鼠进行剔除,计算造模成功率。
1.7 颌下腺指数和颌下腺病理d 42处死小鼠,取颌下腺称质量计算颌下腺指数[颌下腺指数=颌下腺质量(mg)·小鼠体质量(g)-1],立即将颌下腺用4%多聚甲醛固定[10],固定24 h后,石蜡包埋切片制作病理切片,HE染色后,显微镜下观察拍照,对颌下腺组织进行病理评价。采用Chisholm和Mason评判标准分级,0级,无淋巴细胞浸润; 1级,轻度淋巴细胞浸润; 2级,中度浸润,即在每4 mm2内小于1个浸润灶(浸润灶是指有50个或更多的淋巴细胞); 3级,每4 mm2内有1~2个浸润灶; 4级每4 mm2内有2个或以上浸润灶[11]。
1.8 脾脏T淋巴细胞分析处死小鼠后,新洁尔灭浸泡5 min后无菌操作台取小鼠脾脏,淋巴细胞分离液提取小鼠脾脏淋巴细胞,铺板、刺激、洗细胞、表面抗体4 ℃孵育30 min、洗细胞、固定10 min、洗细胞、破膜10 min、洗细胞、胞内抗体4 ℃孵育30 min、洗细胞、过滤网上机,流式细胞术分析小鼠脾脏Treg细胞、Th17细胞的变化。
1.9 脾脏B淋巴细胞分析提取小鼠脾脏淋巴细胞,加入相应抗体4 ℃孵育30 min,清洗细胞过滤网上机,流式细胞术分析小鼠脾脏浆细胞、记忆B细胞的变化。
1.10 统计学处理数据分析使用GraphPad Prism 6.0软件,两组间比较采用独立样本t检验。
2 结果 2.1 雌性和雄性小鼠造模后体质量及全身情况变化在SS的造模过程中,雌、雄模型组小鼠体质量均低于同性别正常组,在d 28雌性小鼠模型组和正常组开始出现显著性差异,d 35、d 42雌、雄性模型组差异均有显著性。对比雌性模型组和雄性模型组小鼠体质量发现,与同性别正常小鼠相比,雌性SS小鼠体质量下降比雄性SS小鼠体质量下降更早更明显(Fig 1)。全身情况观察显示,从d 21起,模型组小鼠先后出现抓挠口唇、皮肤,舔舌等现象,随时间的进展这种现象越明显,而正常组并无明显异常,雌性SS模型组和雄性SS模型组之间差异无显著性。
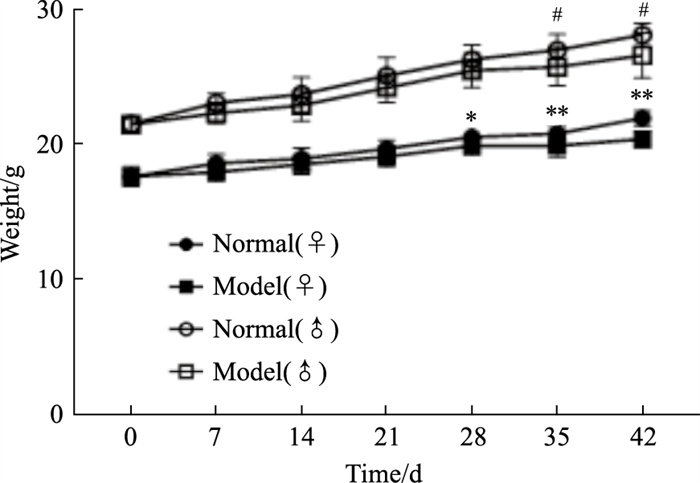
|
| Fig 1 Changes in body weight of female and male mice *P < 0.05, **P < 0.01 vs Model(♀); #P < 0.05 vs Model(♂) |
d 42测量所有小鼠唾液,模型组小鼠唾液量相比与同性别正常小鼠明显下降,提示SS模型建立成功。雌性SS模型组与雄性SS模型组唾液量差异无显著性(Fig 2)。剔除雌性和雄性模型组未成模动物,得出雌性造模成功率为75%,雄性造模成功率为60%,对比雌性和雄性C57BL/6J小鼠造模成功率发现,雌性C57BL/6J小鼠比雄性更易成模(Fig 2)。
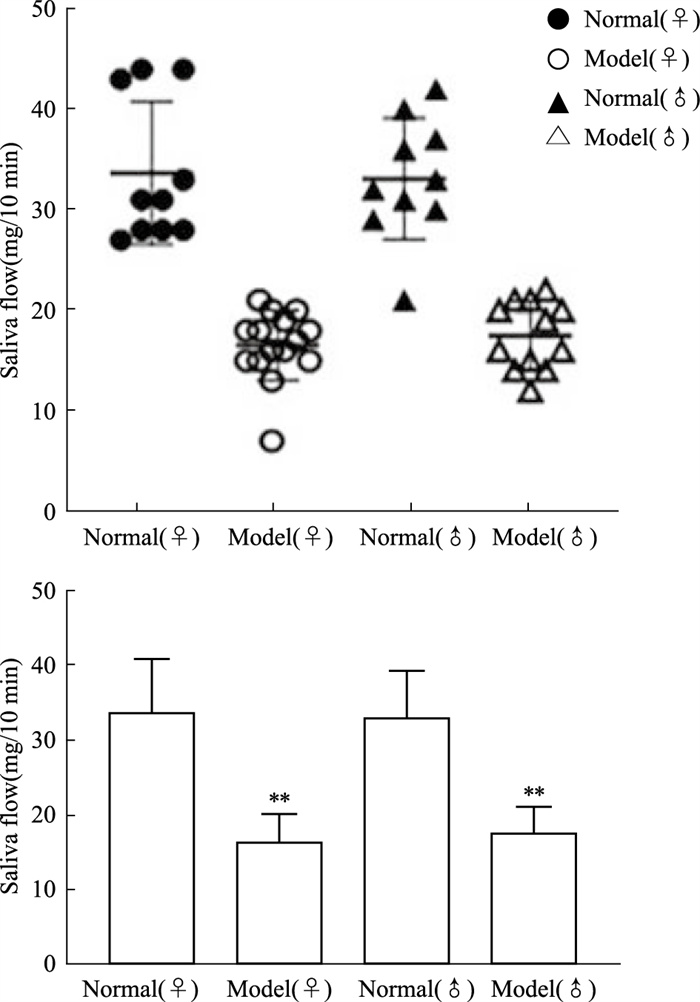
|
| Fig 2 Saliva flow of female and male mice (x±s, n=10) **P < 0.01 vs same sex normal group |
SS模型小鼠与同性别正常组小鼠颌下腺指数相比,SS模型小鼠颌下腺指数明显升高,对比雌性小鼠和雄性小鼠颌下腺指数发现,雄性SS模型小鼠颌下腺指数明显高于雌性SS模型小鼠,雄性正常组小鼠颌下腺指数也高于雌性正常组小鼠(Fig 3)。
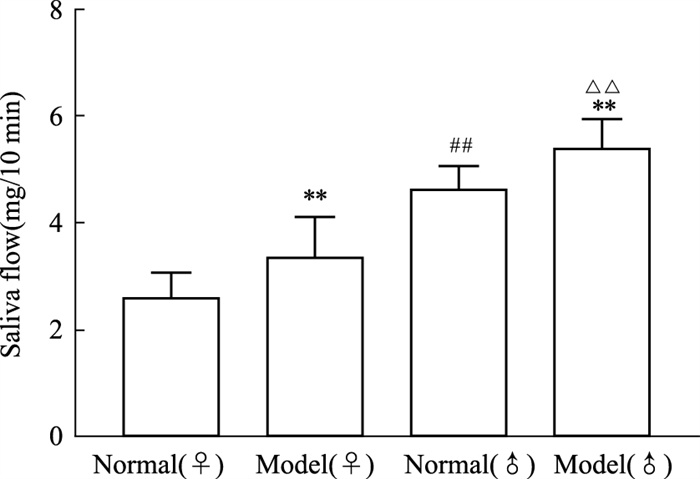
|
| Fig 3 Salivary gland indexes of female and male mice (x±s, n=10) **P < 0.01 vs same sex normal group; ##P < 0.01 vs female normal group, △△P < 0.01 vs female model group |
病理切片显示,SS模型小鼠颌下腺组织出现淋巴细胞浸润,浸润主要出现在颌下腺组织的导管附近(黑色箭头),雌、雄SS模型浸润程度差异无显著性,正常小鼠颌下腺中无淋巴细胞浸润(Fig 4)[12]。颌下腺病理评分结果显示,SS模型小鼠与同性别正常小鼠颌下腺病理评分对比差异具有显著性,雌性和雄性SS小鼠颌下腺病理评分差异无显著性(Fig 5)。
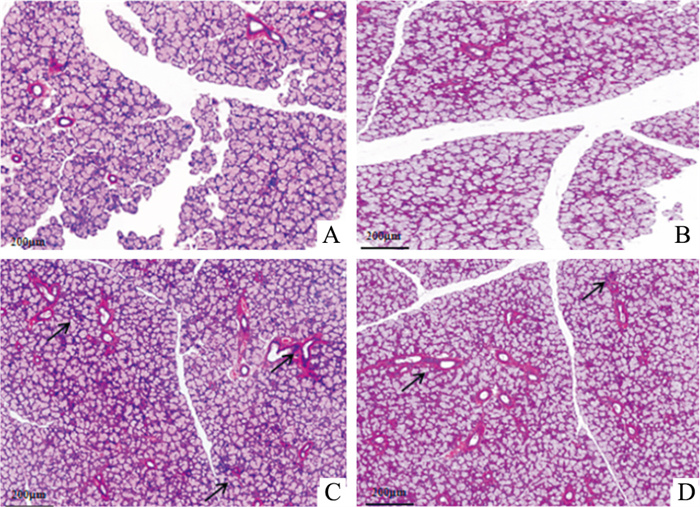
|
| Fig 4 Pathology of submandibular gland of female and male mice (×50) A: Female normal group mice (♀); B: Male normal group mice (♂); C: Female model group mice (♀); D: Male model group mice (♂). Black arrows represent lymphocyte infiltration |
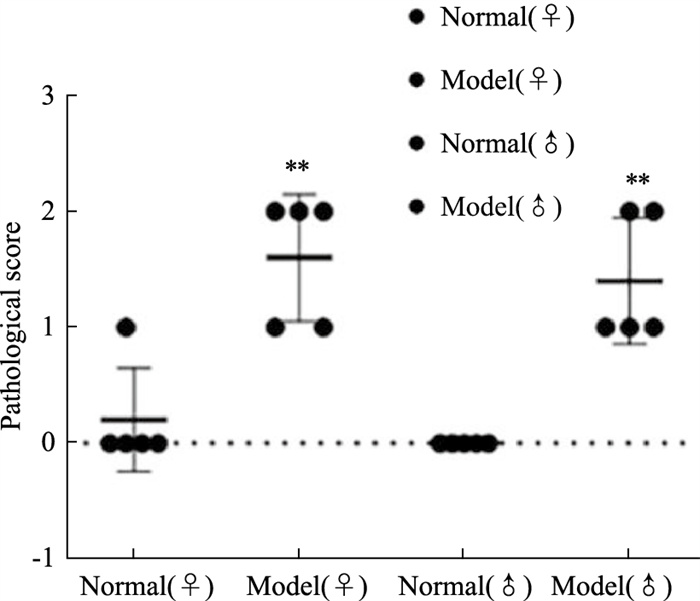
|
| Fig 5 Submandibular gland pathological score of female and male mice (x±s, n=5) **P < 0.01 vs same sex normal group |
小鼠脾脏流式细胞术结果表明,与同性别正常组相比,雌性SS小鼠Th17(CD4+IL-17+ RORγ+)细胞比例明显升高(差异具有高度显著性),雄性SS小鼠差异无显著性,雌性SS小鼠Treg(CD4+CD25+Foxp3+)细胞比例明显降低(差异具有高度显著性),雄性SS小鼠明显降低(Fig 6)。
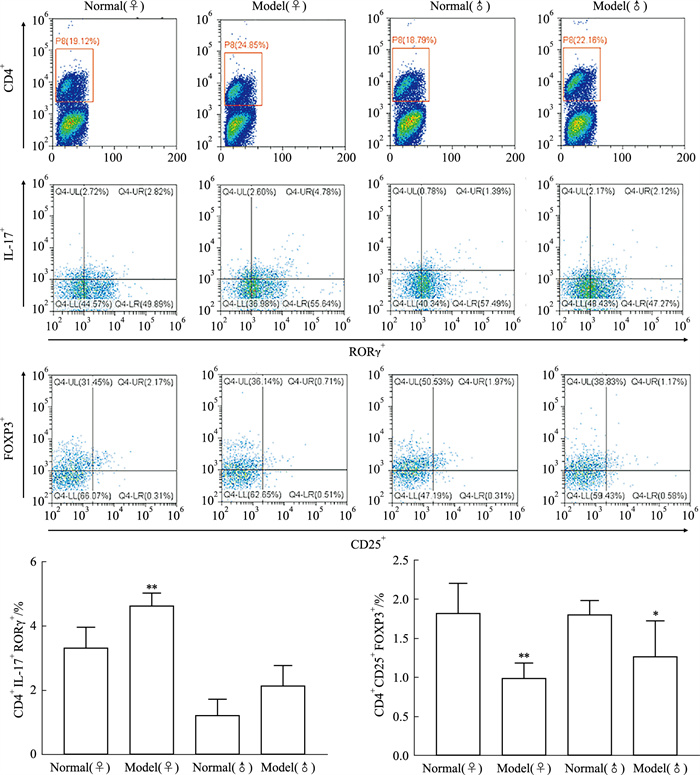
|
| Fig 6 Proportion of Th17 and Treg cells in spleen of female and male mice (x±s, n=5) **P < 0.01 vs same sex normal group |
脾脏流式细胞术结果表明,与正常小鼠相比,SS模型小鼠浆细胞(CD19+CD138+)比例明显升高,记忆B细胞(CD19+CD27+)比例明显降低; 与同性别正常小鼠比较,雌性SS模型小鼠浆细胞和记忆B细胞比例变化相比雄性SS小鼠差异无显著性(Fig 7)。
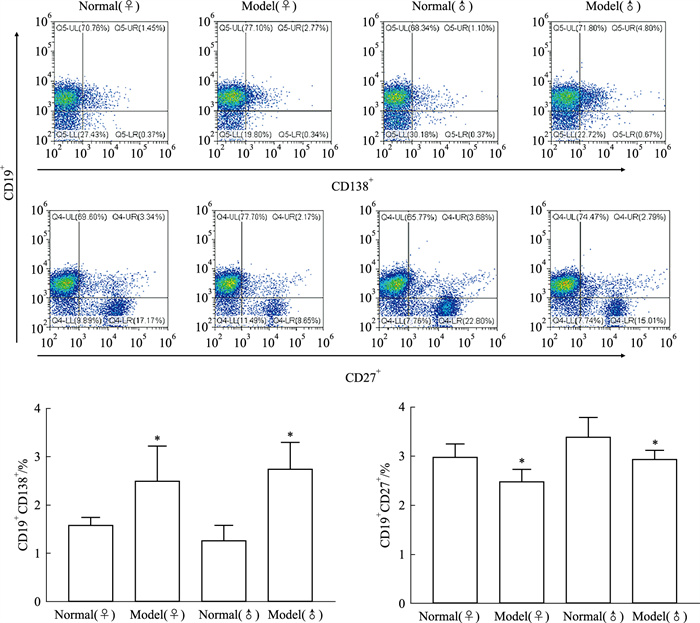
|
| Fig 7 Proportion of plasma cells and memory B cells in spleen of female and male mice (x±s, n=5) *P < 0.05 vs normal group |
SS是一种慢性全身性自身免疫性疾病,临床上尚无理想的治疗药物,可能与遗传、自身免疫、激素等多种因素有关,确切的发病机制尚不清楚[13]。SS发病机制的研究需要合适的动物模型,C57BL/6J小鼠SS模型与SS患者疾病状态相似,且具有模型制备简单、成模较快、可很好的模拟SS患者临床表现等优点[14],常用于研究SS的发病机制、药效学研究的动物模型。SS性别差异明显,临床患者多以中年女性为主,男女比例约为1 ∶ 9[7]。
为探讨动物性别差异对SS模型建立的影响,采用8周左右的雌、雄C57BL/6J小鼠,通过对其背部多点皮内注射同批同性别颌下腺蛋白制成的抗原,诱导建立SS动物模型,在第5周雌性SS模型组小鼠体质量与正常组差异有显著性,雄性SS模型组小鼠第6周差异出现显著性,与雄性SS模型小鼠比,雌性SS小鼠体质量下降更早,出现显著性差异,可能相比雄性小鼠,雌性小鼠对炎症反应更强烈,导致食欲减退; 造模后的第4周起,开始出现舔舌、抓挠口唇等现象; 第6周测量所有小鼠唾液量,SS模型组小鼠唾液量与正常组比差异有显著性,剔除未成模的小鼠,雌性和雄性SS模型小鼠唾液量差异无显著性,雌性SS模型造模成功率高于雄性,这与女性患者发病率高的研究结果相符合; 对小鼠脾脏淋巴细胞分析结果表明,与正常小鼠相比,SS模型小鼠Treg细胞和记忆B细胞比例明显降低,Th17细胞和浆细胞比例明显升高,提示细胞免疫和体液免疫的异常,T、B淋巴细胞的异常变化,可能与自身免疫系统的紊乱有关,导致过度自身免疫反应,与临床SS患者免疫系统异常变化结果相符合,提示SS模型的成功建立[15-17]; 雌性SS小鼠Th17和Treg细胞比例变化相比雄性SS小鼠更具有统计意义,提示雌性SS小鼠疾病情况更加严重,雌性激素可能加重SS的进展[18]; SS模型小鼠颌下腺指数明显高于同性别正常组,从另一方面提示模型的成功建立,雄性SS小鼠颌下腺指数明显高于雌性SS小鼠,这与性别本身差异有关,与SS病理严重程度无关。本实验所构建的SS小鼠模型,雌性与雄性小鼠之间的SS样表现与整体病理情况存在差异,雌性小鼠更早更易于诱导成模,且表现出更显著的SS样表现和病理情况。在大多数研究中,研究人员采用雌性动物作为SS的动物模型,很少采用雄性动物,在本实验中雄性小鼠可以诱导成为实验所需的SS动物模型,成模率偏低,严重程度较雌性低,可作为对男性SS发病机制、药效学研究的一种动物模型。期望本文能对研究SS雄性与雌性的小鼠选择提供新的参考依据,从而能更加全面的研究SS。
| [1] |
Brito-Zerón P, Baldini C, Bootsma H, et al. Sjögren syndrome[J]. Nat Rev Dis Primers, 2016, 2: 16047. doi:10.1038/nrdp.2016.47 |
| [2] |
Stefanski A L, Tomiak C, Pleyer U, et al. The diagnosis and treatment of Sjögren's syndrome[J]. Dtsch Arztebl Int, 2017, 114(20): 354-61. |
| [3] |
Katsiougiannis S, Tenta R, Skopouli F N. Endoplasmic reticulum stress causes autophagy and apoptosis leading to cellular redistribution of the autoantigens Ro/Sjögren's syndrome-related antigen A (SSA) and La/SSB in salivary gland epithelial cells[J]. Clin Exp Immunol, 2015, 181(2): 244-52. doi:10.1111/cei.12638 |
| [4] |
Burbelo P D, Ambatipudi K, Alevizos I. Genome-wide association studies in Sjögren's syndrome: What do the genes tell us about disease pathogenesis?[J]. Autoimmun Rev, 2014, 13(7): 756-61. doi:10.1016/j.autrev.2014.02.002 |
| [5] |
吴华勋, 陈晓芸, 刘琪, 等. 苯磺酸芍药苷通过调控颌下腺GRK2-JAK1-STAT1/2信号通路治疗抗原诱导型小鼠干燥综合征[J]. 中国药理学通报, 2021, 37(2): 245-50. Wu H X, Chen X Y, Liu Q, et al. Paeoniflorin besylate relieves mice with antigen-induced experimental Sjogren's syndrome by regulating GRK2-JAK1-STAT1/2 signaling pathway[J]. Chin Pharmacol Bull, 2021, 37(2): 245-50. doi:10.3969/j.issn.1001-1978.2021.02.018 |
| [6] |
Xiao F, Han M, Wang X, et al. Animal models of Sjogren's syndrome: An update[J]. Clin Exp Rheumatol, 2019, 37 Suppl 118(3): 209-16. |
| [7] |
Qin B, Wang J, Yang Z, et al. Epidemiology of primary Sjögren's syndrome: A systematic review and meta-analysis[J]. Ann Rheum Dis, 2015, 74(11): 1983-9. doi:10.1136/annrheumdis-2014-205375 |
| [8] |
Wu H, Chen X, Gu F, et al. CP-25 alleviates antigen-induced experimental Sjögren's syndrome in mice by inhibiting JAK1-STAT1/2-CXCL13 signaling and interfering with B-cell migration[J]. Lab Invest, 2021, 101(8): 1084-97. doi:10.1038/s41374-020-0453-0 |
| [9] |
Lin X, Rui K, Deng J, et al. Th17 cells play a critical role in the development of experimental Sjögren's syndrome[J]. Ann Rheum Dis, 2015, 74(6): 1302-10. doi:10.1136/annrheumdis-2013-204584 |
| [10] |
Rui K, Hong Y, Zhu Q, et al. Olfactory ecto-mesenchymal stem cell-derived exosomes ameliorate murine Sjogren's syndrome by modulating the function of myeloid-derived suppressor cells[J]. Cell Mol Immunol, 2021, 18(2): 440-51. doi:10.1038/s41423-020-00587-3 |
| [11] |
Bautista-Vargas M, Vivas A J, Tobón G J. Minor salivary gland biopsy: Its role in the classification and prognosis of Sjögren's syndrome[J]. Autoimmun Rev, 2020, 19(12): 102690. doi:10.1016/j.autrev.2020.102690 |
| [12] |
Wang Y, Yan T, Shen J, et al. Preventive effect of ophiopogon japonicus polysaccharides on an autoallergic mouse model for Sjogren's syndrome by regulating the Th1/Th2 cytokine imbalance[J]. J Ethnopharmacol, 2007, 114(2): 246-53. doi:10.1016/j.jep.2007.08.014 |
| [13] |
Tzioufas A G, Voulgarelis M. Pathogenetic mechanisms in the initiation and perpetuation of Sjögren's syndrome[J]. Nat Rev Rheumatol, 2010, 6(9): 529-37. doi:10.1038/nrrheum.2010.118 |
| [14] |
Peck A B, Nguyen C Q. What can Sjögren's syndrome-like disease in mice contribute to human Sjögren's syndrome?[J]. Clin Immunol, 2017, 182: 14-23. doi:10.1016/j.clim.2017.05.001 |
| [15] |
Lee G. The balance of Th17 versus treg cells in autoimmunity[J]. Int J Mol Sci, 2018, 19(3): 730. doi:10.3390/ijms19030730 |
| [16] |
Kiripolsky J, McCabe L G, Kramer J M. Innate immunity in Sjögren's syndrome[J]. Clin Immunol, 2017, 182: 4-13. doi:10.1016/j.clim.2017.04.003 |
| [17] |
Brokstad K A, Fredriksen M, Zhou F, et al. T follicular-like helper cells in the peripheral blood of patients with primary Sjögren's syndrome[J]. Scand J Immunol, 2018, 88(2): e12679. doi:10.1111/sji.12679 |
| [18] |
Lee T, Chiang B. Sex differences in spontaneous versus induced animal models of autoimmunity[J]. Autoimmun Rev, 2012, 11(6-7): A422-29. doi:10.1016/j.autrev.2011.11.020 |