

商陆为商陆科植物商陆(Phytolacca acinose Roxb.)或垂序商陆(Phytolacca amerrcana L.)的干燥根,主产于河南、安徽、陕西等全国大部分地区。性味苦,寒; 有毒。归肺、脾、肾、大肠经。功效为逐水消肿,通利二便; 外用解毒散结[1]。其在临床上有非常良好的利尿作用,常与其它利尿中药麻黄、泽泻等组成复方制剂,如商陆麻黄汤、商陆豆方、商陆散等,应用于治疗水肿、急性肾小球肾炎、肝硬化腹水等疾病[2-5]。三萜皂苷、酚酸、黄酮、多糖等成分是商陆的主要化学成分,其中以三萜皂苷为主,主要包括商陆皂苷甲(esculentoside A,EsA)、商陆皂苷乙(esculentoside B,EsB)、商陆皂苷C(esculentoside C,EsC)。EsA是药典规定的指标性成分,2020年版《中国药典》一部规定商陆药材中EsA含量不得少于0.15%。
本研究旨在探索商陆的利尿作用、利尿作用机制与药代动力学,明确商陆的“量-时-效”关系。主要包括三部分内容: 首先,大鼠造模水负荷模型后灌胃给予商陆水提物,探究商陆利尿作用; 其次,采用蛋白质免疫法(Western blot)测定大鼠的水通道蛋白以及肾素-血管紧张素度-醛固酮(RAAS)系统的蛋白表达,探索商陆的利尿作用机制; 最后,通过药代动力学研究,进行大鼠血浆内EsA的血药浓度测定并进行利尿药效相关性分析。
1 材料与方法 1.1 试剂商陆药材饮片购于上海市药材有限公司,产地为安徽省,批号180511; 商陆皂苷甲购于成都麦卡希化工有限公司,HPLC法含量≥98%,1 g; 氢氯噻嗪片购于上海上药信谊药厂有限公司,产品批号053180502,规格25 mg/片; 氯化钠注射液购于华裕(无锡)制药有限公司,产品批号20191202,规格100 mL ∶ 0.9 g。
Western blot试剂均购自毓秀生物科技(上海)有限公司。ELISA检测试剂购于南京建成生物工程研究所。
人参皂苷Rg 1标准品购于上海源叶科技生物有限公司,HPLC法含量≥98%,规格20 mg,批号G30N10Y104330; 乙腈(批号: JA076230)为色谱纯,甲醇为色谱纯,磷酸为分析纯。
1.2 仪器超纯水仪: Millipore Advantage A10超纯水仪; 超声波清洗器: 上海科导超声仪器有限公司; 分析天平: XS205DU电子天平; 高效液相色谱仪: Waters e2695; 液质联用仪: API5000 LC-MS/MS三重四级杆液质联用仪; 色谱柱: Waters ACQUITY UPLC CSH C18(1.7 μm,3.0×100 mm); 纯水仪: Millipore Elix 3纯水仪; 超纯水仪: Millipore Advantage A10超纯水仪; 分析天平: XS205DU电子天平、PL403-IC电子天平; 高速离心机: 3K30离心机。
1.3 实验动物SPF级雄性SD大鼠,180~200 g,购于浙江维通利华实验动物技术有限公司,生产许可证号为SCXK(浙)2019-0001。饲养温度为22 ℃~24 ℃,湿度为40%~70%,光照周期为12 h,自由饮食饮水。
1.4 试剂的制备与配制 1.4.1 商陆水提物的提取工艺取商陆药材饮片1 kg,加10倍量纯水浸泡90 min,于武火煮沸后,文火煎煮1 h,趁热过滤,收集滤液。6倍量纯水浸泡残余药渣,同法煎煮。合并2次滤液,然后以文火浓缩至1 kg/600mL浸膏[6]。
1.4.2 商陆水提物、阳性药物、商陆皂苷甲溶液的配制取商陆水提物浸膏适量,加纯水稀释至0.045 kg·L-1作为低剂量组,加纯水稀释至0.09 kg·L-1作为中剂量组,加纯水稀释至0.18 kg·L-1作为高剂量组。
取氢氯噻嗪片一片(25 mg)研磨为粉末,加入50 mL纯水中混匀得0.5 g·L-1的氢氯噻嗪溶液作为阳性对照品溶液。
取商陆皂苷甲标准品粉末12.5 mg,加入50 mL容量瓶中定容,置于超声器中超声溶解混匀,得0.25 g·L-1的商陆皂苷甲溶液。
1.5 实验动物的筛选、分组、造模与给药 1.5.1 实验动物的筛选与分组实验大鼠适应性饲养3 d,实验前禁食不禁水,按25 mL·kg-1灌胃生理盐水,收集6 h尿液,每2 h收集一次,挑选出2 h内收集到的尿量大于40%的生理盐水灌胃量的大鼠作为合格大鼠,记录6 h总尿量作为基础尿量值[7]。
将合格大鼠按体质量与基础尿量值分组,分别为空白对照组、模型组、阳性对照组、商陆低、中、高剂量组、商陆皂苷甲组,每组7只。同步设置TK卫星组,每组3只,用于PK采血。
1.5.2 造模与给药空白对照组与模型组给与纯水,阳性对照组给与氢氯噻嗪溶液(剂量为10 mg·kg-1),商陆各剂量组依次灌胃商陆水提物(剂量依次为0.9、1.8、3.6 g生药·kg-1),商陆皂苷甲组灌胃商陆皂苷甲溶液(剂量为5 mg·kg-1),各组给药体积均为20 mL·kg-1,连续给药3 d。
d 3给药前,需要造模水负荷模型: 提前18 h禁食,自由饮水,除空白对照组外各组分别灌胃30 mL·kg-1生理盐水,轻按大鼠下腹部,促其排尽余尿,造模水负荷状态大鼠[8]。造模30 min后,即可按上述方式灌胃给药。
给药后将大鼠放入代谢笼,每2 h收集一次,收集0~6 h尿液,测量尿量。试验结束后,乌拉坦腹腔注射麻醉,取左肾于-80 ℃冷冻保存,用于利尿机制探索; 卫星组大鼠于给药前、给药后15 min、30 min、1 h、2 h、4 h、8 h、24 h采血点取血0.3 mL,加入EDTA-2K抗凝EP管中,3 000 r·min-1、15 min离心取上清得血浆,置于-80 ℃冰箱保存待测。
1.5.3 利尿作用机制探索分别选取空白对照组、阳性对照组、商陆低剂量组、商陆皂苷甲组各3只大鼠的肾脏。剪碎组织、冰浴裂解并于12 000 r·min-1、4 ℃、离心10 min,取上清,为总蛋白溶液。总蛋白溶液与5×还原型蛋白上样缓冲液按照4 ∶ 1混合,置于沸水中15 min,完成变性,置于-20 ℃保存。
分别配制不同浓度(8%、10%、12%、15%、18%、20%)的分离胶与5%的浓缩胶; 设置分离胶电压为120 V,浓缩胶电压为75 V。溴酚蓝里最底部仅1 cm时应停止电泳并转膜。选用脱脂牛奶,置于脱色摇床上,室温下封闭30 min。将稀释好的一抗倒入,4 ℃于摇床上慢摇过夜并洗脱。二抗加入孵育槽,室温下置于摇床上慢摇30 min。先后进行胶片的显影与定影,调节曝光条件实现化学发光,使用PhotoShop软件整理去色、Alpha软件处理系统分析目标带的光密度值。
1.6 药代动力学研究 1.6.1 标准溶液、随行质控样品(QC)及内标溶液的配制与前处理配制1 g·L-1的商陆皂苷甲储备液并稀释该储备液配制浓度为10、4、2、1、0.4、0.2、0.1 mg·L-1的标准工作溶液。质控工作溶液的配制同标准工作溶液的配制,质控工作溶液的质量浓度为8、2、0.2 mg·L-1。同方法以1 g·L-1的人参皂苷Rg1储备液配制浓度10、2、1 mg·L-1的内标工作溶液。
取95 μL空白血浆加5 μL的标准工作溶液,配制为标准曲线样品,质量浓度依次为500、200、100、50、20、10、5 μg·L-1; 随行质控样品溶液配制同标准曲线样品溶液的配制,质量浓度为400、100、10 μg·L-1。
取配制好的标准曲线样品溶液与随行质控样品溶液,加入10 μL内标工作溶液(1 mg·L-1)涡旋30 s充分混匀; 加入300 μL乙腈,涡旋3 min,15 000 r·min-1、10 min离心2次,取上清,加入放内衬管的进样瓶中用于下一步分析。
取100 μL空白血浆,加入300 μL乙腈后同样涡旋与离心取上清。单空白溶液: 取100 μL空白血浆,加入10 μL内标工作溶液后涡旋,再加入乙腈,然后同步骤操作。
将采集到的待测血浆样品,按蛋白沉淀法进行前处理。取待测血浆样品100 μL,加入10 μL内标工作溶液(1 mg·L-1)涡旋30 s充分混匀; 加入300 μL乙腈,涡旋3 min,15 000 r·min-1、10 min离心两次,取上清,加入放内衬管的进样瓶中用于分析。
1.6.2 液质分析条件色谱分析条件: 采用Waters ACQUITY UPLC CSH C18色谱柱(1.7 μm,3.0×100 mm); 流动相0.1%甲酸溶液(A)-乙腈(B),梯度洗脱,0~1 min,90%(A)- 10%(B),1~3 min,10%(A)-90%(B),3~4 min,90%(A)-10%(B); 流速0.2 mL·min-1,柱温30 ℃,样品室温度10 ℃,进样量2 μL。
质谱分析条件: 采用电喷雾离子源(ESI),正离子方式监测。离子源喷雾电压(IS): 5 500 V; 温度: 400 ℃; 源内气体1(GS1,N2)压力: 30 psi; 气体2(GS2,N2)压力: 45 psi; 气帘气体(N2)压力: 30 psi; 碰撞气(CAD,N2)压力: 30 psi; 扫描方式为多反应监测(MRM); 用于定量分析的离子反应分别为m/z 849.5→m/z 805.6(商陆皂苷甲)和m/z 823.7→m/z 643.8(内标),去簇电压(DP)为100 V,射入电压(EP)为8 V,碰撞能量(CE)分别为67 eV,碰撞室射出电压(CXP)为33 V[9-10]。
1.7 统计学分析采用统计软件SPSS20.0和Graph Pad Prism 8.01软件进行数据处理,数据均以x±s表示,首先进行Levene’s检验,当P>0.05,采用单因素ANOVA进行检验; 当P ≤0.05,采用Kruskal-wallis检验。检验水准α=0.05。数据分析采用DAS2.1.1软件,药代动力学项下成批数据分析,计算各组药动学参数,绘制药时曲线。
2 结果 2.1 商陆利尿作用与空白对照组相比,模型组尿量在0~4 h与0~6 h均明显升高(P < 0.01),说明水负荷模型造模成功; 与模型组相比,阳性对照组尿量在0~2 h、0~4 h、0~6 h均明显增加(P < 0.01),商陆低剂量组(0.9 g生药·kg-1)尿量在0~2 h、0~4 h、0~6 h均显著升高(P < 0.01),商陆中剂量组(1.8 g生药·kg-1)尿量在0~6 h明显增加(P < 0.01),商陆高剂量组(3.6 g生药·kg-1)尿量在4~6 h(P < 0.05)、0~6 h(P < 0.01)明显增加,商陆皂苷甲组尿量在0~6 h明显升高(P < 0.05)。因此,商陆低、中、高剂量组以及商陆皂苷甲均有明显的利尿作用。每组大鼠各时间段的尿量值见Fig 1。
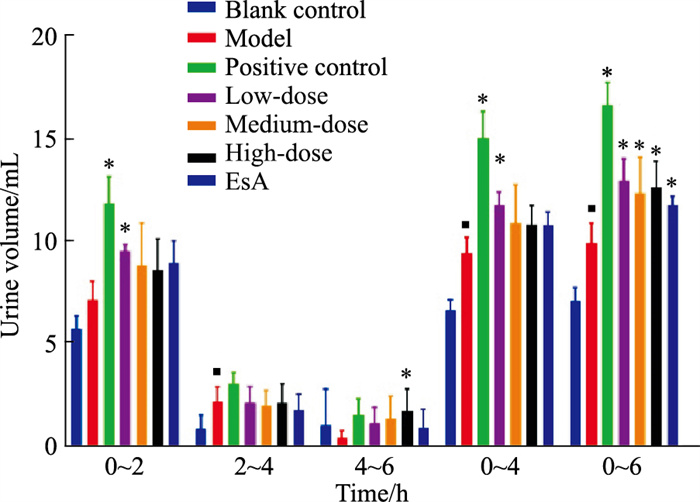
|
| Fig 1 Urine volume value of each group of rats in each time period (x±s, n=3) *P < 0.05 vs model; ■P < 0.05 vs Blank |
Western blot结果以及相对灰度值统计显示,与空白对照组相比,阳性对照组大鼠肾脏组织中水通道蛋白AQP2、AQP4的蛋白表达明显被抑制(P < 0.01),血管紧张素Ⅱ1型受体(ATGR1)、血管紧张素Ⅱ2型受体(ATGR2)、肾素(Renin)的蛋白表达无明显改变; 与空白对照组相比,商陆(0.9 g生药·kg-1)组大鼠肾脏组织中水通道蛋白AQP2、AQP4的蛋白表达明显被下调(P < 0.01),ATGR1、Renin的蛋白表达明显降低(P < 0.01),ATGR2蛋白的表达无明显改变; 与空白对照组相比,商陆皂苷甲(EsA)组大鼠肾脏组织中水通道蛋白AQP2、AQP4的蛋白表达明显下调(P < 0.01),ATGR1(P < 0.05)、Renin(P < 0.01)蛋白的表达明显降低,ATGR2蛋白的表达无明显改变。见Fig 2。
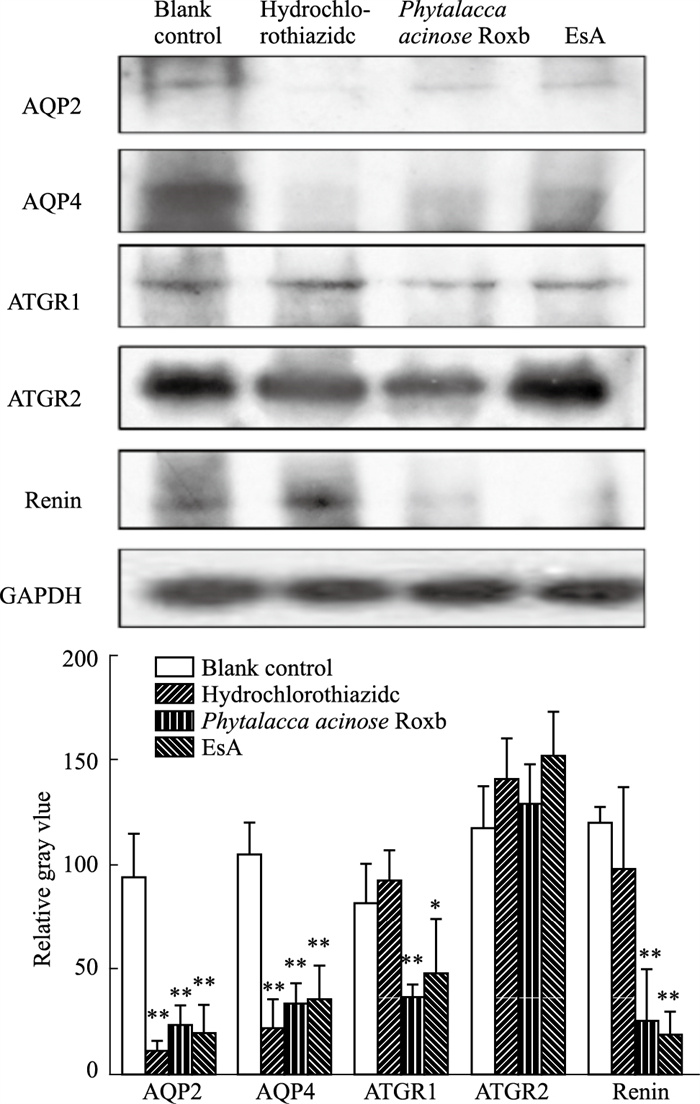
|
| Fig 2 Protein expression of aquaporin and RAAS system and relative gray value (x±s, n=3) *P < 0.05, **P < 0.01 vs Blank |
应用建立的LC-MS/MS方法,商陆低、中、高剂量组的药代动力学参数见Tab 1。商陆低剂量组大鼠血浆中EsA的Cmax为(23.2±8.32) μg·L-1、AUC0-t为(147.56±30.82) h·ng·mL-1,商陆中剂量组大鼠血浆中EsA的Cmax为(61.13±6.96) μg·L-1、AUC0-t为(152.00±51.00) h·ng·mL-1,商陆高剂量组Cmax大鼠血浆中EsA的为(75.67±14.08) μg·L-1、AUC0-t为(179.3±36.96) h·ng·mL-1。商陆皂苷甲(5 mg·kg-1)组组大鼠血浆中EsA的Cmax为(46.70±23.98) μg·L-1、AUC0-t为(130.18±31.76) h·ng·mL-1。EsA在SD大鼠体内吸收迅速,0.5~1 h内即可达到血药浓度峰值。商陆低、中、高剂量组与商陆皂苷甲组的药-时曲线见Fig 3。
| Group | Dose | Cmax/μg·L-1 | Tmax/h | t1/2z/h | AUC0-t/h·μg·L-1 |
| Low dose | (0.9 g·kg-1) | 23.2 ± 8.32 | 0.33 ± 0.14 | 12.81 ± 13.56 | 112.63 ± 29.03 |
| Medium dose | (1.8 g·kg-1) | 61.13 ± 6.96 | 0.67 ± 0.29 | 2.46 ± 0.63 | 152.00 ± 51.00 |
| High dose | (3.6 g·kg-1) | 75.67 ± 14.08 | 0.42 ± 0.14 | 2.57 ± 1.23 | 179.3 ± 36.96 |
| EsA | (5 mg·kg-1) | 46.70 ± 23.98 | 0.33 ± 0.14 | 4.21 ± 1.95 | 130.18 ± 31.76 |
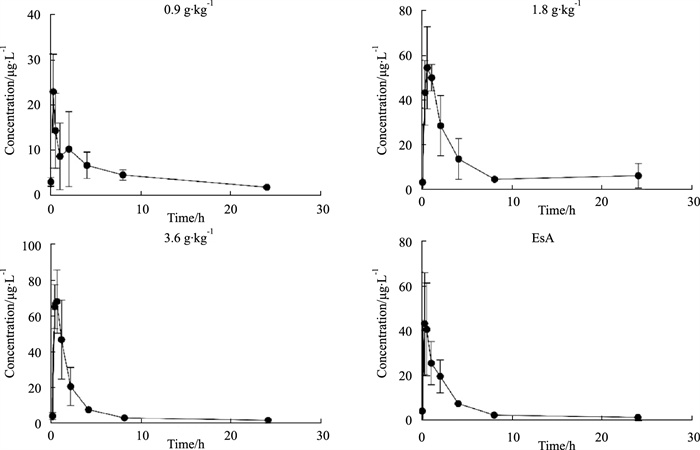
|
| Fig 3 The drug-time curve of EsA in rat plasma after administration |
本研究结果显示,商陆0.9 g生药/kg利尿作用最为显著。药典记载商陆的人临床用量为3~9 g/60 kg(即0.05~0.15 g·kg-1),大鼠等效剂量为0.3~0.9 g·kg-1,大鼠药效剂量与药典中人临床用量9 g/60 kg等效剂量相同,确证药典中商陆的人临床使用量有效,同时EsA也具有利尿作用,EsA为商陆利尿作用的主要成分之一。商陆中、高剂量组(1.8、3.6 g生药·kg-1)的利尿效果并未随剂量的升高而升高,反而低剂量利尿作用最好,具体原因还有待进一步研究。
根据Western blot结果,氢氯噻嗪可以下调AQP2、AQP4蛋白的表达,但没有影响ATGR1、ATGR2、Renin、ALD的蛋白表达,说明氢氯噻嗪可以通过抑制水通道蛋白的表达而发挥利尿作用,其利尿机制与RAAS系统无关。
文献中报道,商陆的利尿机制为抑制水通道蛋白的表达以及调节血液内体液代谢相关激素的水平[11-12]。本研究表明商陆可以明显下调AQP2、AQP4、蛋白的表达,验证了文献中商陆抑制水通道蛋白表达的利尿机制。
文献报道,其他利尿中药的利尿机制与肾素-血管紧张素-醛固酮系统相关[13-14],说明中药的利尿机制可能涉及肾素-血管紧张素-醛固酮系统。本文检测肾脏中RAAS系统中相关蛋白的表达情况,结果显示商陆明显下调ATGR1、Renin蛋白的表达,ATGR2与ALD的表达无明显改变,说明商陆可以抑制血管紧张素Ⅱ1型受体与肾素的表达,进而减少血管紧张素Ⅱ的产生,从而减少醛固酮与抗利尿激素的产生,降低肾小管与集合管的重吸收,从而加大尿量,发挥利尿作用。
药效试验中商陆水提物浓度较低(0.9、1.8、3.6 g生药·kg-1),本批次商陆药材中药效成分商陆皂苷甲的含量在我们课题组其它试验中经测量为0.27%,因此大鼠血浆中检测到的EsA的含量也较低。从检测结果看,体内暴露量与给药剂量存在一定的量效关系,商陆皂苷甲体内暴露量与商陆水提物低剂量组接近,进一步提示商陆皂苷甲为商陆药效的主要成分之一。
综上所述,0.9、1.8、3.6 g生药·kg-1的商陆水提物皆有显著利尿作用,0.9 g生药·kg-1的商陆水提物的利尿作用最为显著,商陆皂苷甲(5 mg·kg-1)也显示利尿作用,为商陆利尿药效的主要成分之一。商陆的利尿作用机制为: 一为抑制水通道蛋白AQP2、AQP4蛋白的表达,二为抑制肾素与血管紧张素Ⅱ1型受体蛋白的表达,从而抑制肾小管与集合管的重吸收,达到利尿作用。商陆皂苷甲的利尿机制与商陆利尿机制相同,提示EsA为商陆的药效成分。商陆“量-时-效”关系研究表明商陆水提物低、中、高剂量组的Cmax与AUC0-t随剂量升高而升高,但非线性关系。
| [1] |
国家药典委员会. 中华人民共和国药典: 一部[S]. 北京: 中国医药科技出版社, 2020: 324. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China, Volume 1[S]. Beijing: Chin Med Sci Press, 2020: 324. |
| [2] |
李春深. 百草良方[M]. 天津: 天津科学技术出版社, 2018: 167. Li C S. Hundreds of herbs and good prescription[M]. Tianjin: Tianjin Science and Technology Press, 2018: 167. |
| [3] |
苑振亭, 焦万田. 北京名医世纪传媒新编中药400味速查手册第2版[M]. 郑州: 河南科学技术出版社, 2018: 378-9. Yuan Z T, Jiao W T. Beijing famous doctor century media newly compiled quick check manual of 400 flavor of traditional chinese medicine 2nd edition[M]. Zhengzhou: Henan Science and Technology Press, 2018: 378-9. |
| [4] |
田燕. 北京名医世纪传媒一味中药治顽疾第2版[M]. 郑州: 河南科学技术出版社, 2018: 289-90. Tian Y. Beijing famous doctor century media traditional chinese medicine for treating intractable diseases 2nd edition[M]. Zhengzhou: Henan Science and Technology Press, 2018: 289-90. |
| [5] |
李葆莉. 本草纲目彩色图鉴上[M]. 北京: 中医古籍出版社, 2018: 171. Li B L. Compendium of materia medica color map the first part[M]. Beijing: Traditional Chinese Medicine Classics Publishing House, 2018: 171. |
| [6] |
徐婷婷, 李一飞, 金若敏, 等. 商陆水煎液致大鼠肾损伤的初步研究[J]. 中国药学杂志, 2015, 50(5): 403-7. Xu T T, Li Y F, Jin R M, et al. Preliminary research of radix phytolaccae decoction on the renal injury in rats[J]. Chin Pharm J, 2015, 50(5): 403-7. |
| [7] |
Aston A. A rat diuretic screening procedure[J]. Toxicol Appl Pharmacol, 1959, 1(3): 277-82. doi:10.1016/0041-008X(59)90112-7 |
| [8] |
Allegretti A S, Solà E, Ginè S P. Clinical application of kidney biomarkers in cirrhosis[J]. Am J Kidney Dis, 2020, 76(5): 710-9. doi:10.1053/j.ajkd.2020.03.016 |
| [9] |
Guan X, Chang H, Sun F, et al. Determination of esculentoside A in dog plasma by LC-MS/MS method: Application to pre-clinical pharmacokinetics[J]. J Pharm Biomed Anal, 2013, 72: 261-6. doi:10.1016/j.jpba.2012.09.002 |
| [10] |
Wei F, Singh R S P, Fueth M, et al. Development and validation of a HPLC-MS/MS method for the determination of phytolaccagenin in rat plasma and application to a pharmacokinetic study[J]. J Pharm Biomed Anal, 2015, 107: 82-8. doi:10.1016/j.jpba.2014.12.025 |
| [11] |
李坤, 崔楠楠, 孟祥龙, 等. 商陆皂苷甲对水负荷大鼠肾脏AQP2及AQP4表达的影响[J]. 中药材, 2015, 38(8): 1685-9. Li K, Cui N N, Meng X L, et al. Effect of esculentoside A on expression of AQP2 and AQP4 protein of kidney in water-loaded rats[J]. J Chin Mater Med, 2015, 38(8): 1685-9. |
| [12] |
程梓烨, 郁红礼, 吴皓, 等. 醋制对商陆促利尿作用的影响及其机制研究[J]. 南京中医药大学学报, 2019, 35(2): 156-9. Cheng Z Y, Yu H L, Wu H, et al. Study on diuretic effects and its mechanism of phytolaccae radix before and after vinegar processing[J]. J Nanjing Univ Tradit Chin Med, 2019, 35(2): 156-9. |
| [13] |
张璐. 不同时间灌服螺内酯对高血压大鼠尿RAAS活性物质昼夜节律的影响[D]. 石家庄: 河北医科大学, 2017. Zhang L. The effect of different dosing schedule of spironolactone on circadian rhythm of urine reninan giotensin-aldosterone system in spontaneously hypertensive in rats[D]. Shijiazhuang: Hebei Med Univ, 2017. |
| [14] |
凌冰, 哈木拉提, 刘晓燕, 等. 金鸡菊提取物对肾性高血压大鼠肾素-血管紧张素-醛固酮系统的影响[J]. 中国药理学通报, 2013, 29(10): 1448-52. Ling B, Hamulati, Liu X Y, et al. Effects of coreopsis tinctoria extract on renin angiotensin-aldoster system in renal hypertensive rats[J]. Chin Pharmacol Bull, 2013, 29(10): 1448-52. |

