

吴艳玲(1977-),女,博士,教授,博士生导师,研究方向: 中药药理学,通信作者,E-mail: ylwu@ybu.edu.cn
痛风性关节炎(gouty arthritis)是一种典型与多种因素交叉的代谢性疾病,主要临床特征是尿酸盐结晶沉积和高尿酸血症。根据不同的类型和严重程度分为急性痛风性关节炎、痛风石关节炎和慢性痛风石关节炎。严重的患者可能出现尿路结石、关节功能障碍、肾功能衰竭等并发症[1-2]。目前临床上治疗痛风性关节炎的常规药物主要包括秋水仙碱、非甾体抗炎药等,这些药物在使用过程中常常伴有不良反应而限制了在临床上的应用[3]。因此,研究效果好、毒性低的抗痛风药物是目前药学研究的重要方向之一。
白芷为伞形科植物白芷[Angelica dahurica (Fisch. ex Hoffm.)Benth. et Hook. f. ex Franch. et Sav,AD]的干燥根,主要含有香豆素类、挥发油类、苷类、生物碱类等多种化学成分,现代药理学研究表明,白芷具有抗菌、抗氧化、抗炎、保护神经和镇痛效果[4-5]。临床广泛应用于头痛、牙痛、风湿痹痛、疮疡肿痛等病症。有许多治疗痛风性关节炎的外用中药制剂配方中都含有白芷[6]。说明白芷具有治疗痛风的作用,但未见单一用药治疗痛风的相关报道。欧前胡素(imperatorin,IM)是白芷中一种主要的香豆素类化合物,其药理作用与白芷相似,具有抗癌、神经保护、抗炎、抗高血压和抗菌的作用[7]。有研究发现,欧前胡素可以减轻胶原诱导的大鼠类风湿性关节炎[8]。本文采用尿酸钠(monosodium urate,MSU)晶体诱导痛风性关节炎动物模型,观察AD和IM对MSU诱导的痛风性关节炎大鼠左踝关节肿胀度和滑膜组织中炎性浸润情况,以及滑膜组织中NLRP3、IL-1β、caspase-1、IL-1R1、IL-6、TNF-α含量的影响。
1 材料与方法 1.1 实验药物及试剂本实验所用白芷购于延边叶琳参茸药品有限公司,产地为四川。欧前胡素购于成都德锐可生物科技有限公司(批号: drk-1184-940126)。秋水仙碱购于成都德锐可生物科技有限公司(批号: drk-1161-950118)。尿酸钠购于SIGMA公司(批号: BCBS7438)。Anti-GAPDH(ab8245)、Anti-NLRP3(ab181389)购自Abcam; Anti-IL-1R1(sc-393998)、Anti-IL-1β(sc-32294)、Anti-IL-6(sc-28343)、Anti-caspase-1(sc-622)购自Santa Cruz; BCA试剂盒(Beyotime); RNA总提取试剂盒(Promega); 中性树胶(国药集团化学试剂)。
1.2 实验仪器化学成像发光显色仪(Tanon); 全自动倒置电泳仪、转印电泳槽、电泳仪、转印电泳槽(BIO-RAD); 水平摇床、低温超速离心机、酶标仪(Bio Tek); Mastercycler PCR仪(Eppendorf); 凝胶成像分析仪(BIO-RAD); Mini离心机、磁力加热搅拌器(IKA); 高速冷冻离心机(HITACHI); 石蜡包埋机、转轮切片机(Leica)。
1.3 动物SD大鼠,♂,体质量(200~220) g,SPF级,由延边大学实验动物中心提供,动物许可证号SYXK(吉)2020-0010,适应性喂养1周后开始实验。
1.4 白芷提取物的制备取白芷药材50 g,加入75%乙醇500 mL,浸泡24 h,在80 ℃水浴中回流提取3 h,过滤,回流提取2次,收集滤液,60 ℃旋转蒸发浓缩至浸膏,冷冻干燥成冻干粉,即为白芷提取物。
1.5 尿酸钠晶体(MSU)的制备将800 mg尿酸钠和5 mL NaOH(1 mol·L-1)加入155 mL去离子水煮沸,完全溶解,搅拌降至室温,用1 mol·L-1 HCl调pH至7.0,3 000 r·min-1离心2 min,4 ℃冷却1 h后离心,d 2抽滤,收集晶体,4 ℃保存。
1.6 实验动物分组与造模SD大鼠随机分为7组,每组5只,即为正常组、模型组、AD低、高剂量组(800、1 200 mg·kg-1)、IM低、高剂量组(20、40 mg·kg-1)、秋水仙碱组(0.8 mg·kg-1 Colchicine,COL)。AD和IM各组连续灌胃给药7 d。d 7秋水仙碱组灌胃给药一次。d 8除正常组外,其余各组均用乙醚麻醉,将0.2 mL MSU溶液(取0.5 g MSU溶于9 mL生理盐水加入适量吐温充分溶解)注射到左踝关节腔内造模。24 h后,大鼠进行安乐死,收集滑膜组织。
1.7 大鼠左踝关节肿胀度的测量每组大鼠分别在造模前(0 h)和造模后2~24 h,测量大鼠左踝关节同一部位的周长,测量3次,取平均值。
1.8 Western bolt检测滑膜组织中炎性因子的蛋白含量取滑膜组织,加入RIPA裂解液(含蛋白酶抑制剂)匀浆机匀浆10 min,5 000 r·min-1离心10 min,BCA法测定蛋白含量,以GAPDH为内参,进行western blot检测,测定蛋白相对含量。
1.9 RT-PCR检测滑膜组织中炎性因子mRNA的表达用RNA提取试剂盒从滑膜组织提取总RNA,用所需的基因引物进行RT-PCR过程,通过凝胶成像分析仪不同曝光时间进行拍照分析。引物序列见Tab 1。
| Gene | Primer sequences |
| GAPDH | 5′-CTTGTGCAGTGCCAGCC-3′ |
| 5′-GCCCAATACGGCCAAATCC-3′ | |
| TNF-α | 5′-TCACACTCAGATCATCTTCTC-3′ |
| 5′-AGACTCCTCCCAGGTATATG-3′ | |
| IL-1R1 | 5′-CTTGAGTCGGCAAAGAAATC-3′ |
| 5′-GAGATGGTCAATGGCAGAAC-3′ | |
| IL-6 | 5′-GGTGTTGGAATTAGACAACTGC-3′ |
| 5′-TCAAAGACGACGGTCAGCTC-3′ | |
| NLRP3 | 5′-ACATCCTTCATCCTCAGAAAC-3′ |
| 5′-ATCCTCCAGCAGCAACTTC-3′ | |
| caspase-1 | 5′-ACATCCTTCATCCTCAGAAAC-3′ |
| 5′-ATCCTCCAGCAGCAACTTC-3′ | |
| IL-1β | 5′-TCTTTGAAGAAGAGCCCATCC-3′ |
| 5′-CTAATGGGAACGTCACACAC-3′ |
将滑膜组织多聚甲醛固定后,3%硝酸脱钙8 d,用0.1%氨水中和1 h,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片后,用苏木素和伊红对切片进行染色,最后在显微镜下观察并采图。
1.11 统计学分析实验数值以x±s表示。使用GraphPad Prism程序通过单因素方差分析(ANOVA)和Tukey的多重比较检验来评价结果的比较。
2 结果 2.1 AD和IM对MSU诱导的痛风性关节炎大鼠左踝关节肿胀度的影响与正常组相比,大鼠左踝关节出现明显肿胀(Fig 1),造模2 h肿胀达到高峰(P < 0.05)。与模型组相比,AD、IM和COL组的大鼠左踝关节肿胀逐渐得到缓解,见Tab 2。
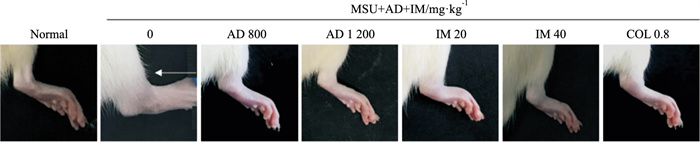
|
| Fig 1 Left ankle joints of each group after injection of MSU 24 h |
| 0 h | 2 h | 4 h | 8 h | 12 h | 24 h | |
| Normal | 2.52±0.13 | 2.46±0.05 | 2.48±0.04 | 2.48±0.08 | 2.54±0.11 | 2.52±0.13 |
| Model | 2.44±0.05 | 3.08±0.15# | 3.06±0.11# | 2.86±0.13# | 2.86±0.13# | 3.00±0.17# |
| AD 800 mg·kg-1 | 2.48±0.04 | 2.86±0.11 | 2.80±0.17* | 2.92±0.08 | 2.84±0.15 | 2.86±0.15 |
| AD 1 200 mg·kg-1 | 2.48±0.08 | 2.98±0.19 | 2.82±0.11* | 2.82±0.08 | 2.84±0.05 | 2.75±0.06* |
| IM 20 mg·kg-1 | 2.54±0.09 | 3.00±0.21 | 2.80±0.12* | 2.76±0.09 | 2.88±0.13 | 2.84±0.05 |
| IM 40 mg·kg-1 | 2.46±0.09 | 3.06±0.17 | 2.84±0.11 | 2.82±0.08 | 2.84±0.11 | 2.82±0.13 |
| COL | 2.50±0.08 | 3.00±0.16 | 2.86±0.09 | 2.82±0.13 | 2.75±0.17 | 2.78±0.04 |
| #P < 0.05 vs normal; *P < 0.05 vs model | ||||||
正常组滑膜组织中滑膜细胞排列整齐,没有炎性细胞浸润; 模型组滑膜组织中炎性细胞浸润明显,并伴有纤维蛋白渗出,滑膜组织增生,滑膜层增厚; AD、IM和COL组滑膜细胞的炎性细胞浸润和滑膜组织增生均有不同程度的减轻,见Fig 2。

|
| Fig 2 Effect of AD and IM on synovial histopathology of MSU induced gouty arthritis |
如Fig 3,4所示,与正常组相比,MSU诱导痛风性关节炎大鼠的滑膜组织中NLRP3、IL-1β、caspase-1的蛋白和mRNA表达均明显高(P < 0.01)。同时促进IL-1R1、IL-6、TNF-α蛋白或mRNA表达(P < 0.01)。给予AD、IM和COL后NLRP3、IL-1β、caspase-1的蛋白和mRNA表达水平降低(P < 0.01,P < 0.01),且可以降低炎性因子IL-1R1、IL-6、TNF-α的蛋白或mRNA的表达(P < 0.01)。

|
| Fig 3 Effect of AD and IM on content of NLRP3, caspase-1, IL-1β, IL-6, IL-1R1 protein in synovial tissues of MSU induced gouty arthritis (x±s, n=3) ##P < 0.01 vs normal, **P < 0.01 vs model |

|
| Fig 4 Effect of AD and IM on content of NLRP3, caspase-1, IL-1β, IL-6, IL-1R1, TNF-α mRNA in synovial tissues of MSU induced gouty arthritis (x±s, n=3) ##P < 0.01 vs normal, **P < 0.01 vs model |
痛风性关节炎在临床上以关节剧痛伴肿胀发热暗红为主要表现。白芷始载于《神农本草经》,被列为中品,在我国有着悠久的药食两用的历史。白芷中主要含有的有效成分为香豆素类和挥发油类,除此之外,还含有香豆素苷类、微量元素、多糖等多种有效成分[5]。白芷因其消肿止痛、祛风除湿的作用,常与其他清热解毒、消肿止痛的药物配伍应用与治疗痛风性关节炎的外用制剂。临床研究证实了白芷与清热解毒、活血通络药物配伍治疗痛风性关节炎可起到一定的作用,有其独特的配伍特点[6]。临床及科研中单独用白芷治疗痛风性关节炎的研究少见。现代药理学研究中白芷的镇痛抗炎主要成分与总香豆素和挥发油类有关,欧前胡素是香豆素中主要的活性成分。有研究显示,欧前胡素和β-谷甾醇联合应用可协同缓解胶原诱导大鼠类风湿性关节炎的严重程度,其机制与靶向LTA、CD83和SREBF1密切相关[8]。西药长期服用不良反应发生率高,目前还没有解决尿酸盐沉积这个问题的有效治疗手段。中医学在防治痛风方面有着长期的临床实践和大量的临床经验,疗效独特,但其药理机制尚不明确,限制了临床应用和推广。目前临床上治疗痛风的有效药物分为两类,一是促进尿酸排泄的药物,如苯溴马隆、丙磺舒等; 二是抑制尿酸产生的药物,如秋水仙碱、非甾体抗炎药、促肾上腺素皮质激素、糖皮质激素等。但这些药物常常伴有消化系统损害和肝肾毒性等不良反应[9]。本研究中选取秋水仙碱为阳性对照药物。结果显示,AD和IM可以减轻MSU诱导大鼠痛风性关节炎左踝关节肿胀程度; 降低滑膜组织中炎性物质的渗出,抑制滑膜层增厚。综上所述,AD和IM可以有效治疗MSU诱导的痛风性关节炎。
痛风性关节炎由尿酸钠结晶沉积在关节及关节周围组织,并与滑膜中免疫球蛋白结合,炎症细胞聚集引起的炎症反应,进而促使单核细胞产生IL-6、IL-1β等多种炎性因子。尿酸钠晶体注射踝关节腔后可导致受试关节周径明显增大,肿胀严重[10-11]。IL-1β被认为是尿酸钠结晶诱导炎症的关键因子,在痛风性关节炎的滑膜,滑液软骨等关节组织中大量存在[12]。IL-6主要由巨噬细胞、T细胞等多种细胞产生,痛风性关节炎期间IL-6水平升高,可作为判断痛风性关节炎严重程度的指标[13]。TNF-α可增加中性粒细胞的募集,上调内皮细胞选择素活性,使中性粒细胞和内皮细胞表面的黏附分子结合,为促炎症介质,可对局部产生浸润,导致炎性介质释放,引起关节局部出现红肿热痛等炎症反应[14]。NLRP3是NLRs受体家族中的重要亚族之一,主要由B淋巴细胞和T淋巴细胞等产生。NLRP3作为胞内模式识别受体,识别病原相关分子模式和危险相关分子模式。如MSU、SiO2、CPPD、胞外ATP等危险信号分子,可作为配体被NLRP3识别,使NLRP3发生蛋白寡聚化,并招募衔接蛋白凋亡相关斑点样蛋白和caspase-1,组装成NLRP3炎性体,最终活化效应蛋白caspase-1[15]。由此可见,上述炎症因子在痛风性关节炎中发挥着至关重要的作用,因此抑制它们的产生并阻断炎症反应的发生,对缓解痛风性关节炎有重要意义。本研究结果表明,AD和IM可以显著抑制MSU导致的炎症反应,进而缓解痛风性关节炎。综上所述,白芷提取物和欧前胡素在抗痛风性关节炎方面有明显的缓解作用,可以作为治疗MSU诱导的痛风性关节炎的有效药物,但作用机制还需进一步研究。
| [1] |
Li X, Xu D Q, Sun D Y, et al. Curcumin ameliorates monosodium urate-induced gouty arthritis through Nod-like receptor 3 inflammasome mediation via inhibiting nuclear factor-kappa B signaling[J]. J Cell Biochem, 2019, 120(4): 6718-28. doi:10.1002/jcb.27969 |
| [2] |
Chen X, Gao Q, Zhou L, et al. MiR-146a alleviates inflammation of acute gouty arthritis rats through TLR4/MyD88 signal transduction pathway[J]. Eur Rev Med Pharmaco, 2019, 23(21): 9230-7. |
| [3] |
单佳铃, 欧阳香, 杨海艳, 等. 藏药短穗兔耳草不同部位对急性痛风性关节炎模型大鼠的作用及其机制研究[J]. 中药新药与临床药理, 2021, 32(4): 492-8. Shan J L, Ouyang X, Yang H Y, et al. Study on the effective Parts of Lagotis brachystachys maxim against acute gout arthritis in rats[J]. Tradit Chin Drug Res. Clin Pharmacol, 2021, 32(4): 492-8. |
| [4] |
卫若楠, 翟艳会, 朱向东. 白芷的临床应用及其用量探究[J]. 吉林中医药, 2021, 41(3): 384-7. Wei R N, Zhai Y H, Zhu X D. Exploration on the clinical application and dosage of dahurian angelica root[J]. Jilin J Chin Med, 2021, 41(3): 384-7. |
| [5] |
Lu X, Yuan Z Y, Yan X J, et al. Effects of Angelica dahurica on obesity and fatty liver in mice[J]. Chin J Nat Med, 2016, 14(9): 641-52. |
| [6] |
林双杰. 白芷外敷联合常规药物治疗急性痛风性关节炎的临床观察[D]. 福州: 福建中医药大学, 2018. Lin S J. The clinical research of radix angelicae dahurica connection joint of conventional drugs in the treatment of damp-heat[D]. Fuzhou, Fujian Univer Tradit Chin Med, 2018. |
| [7] |
Deng M, Xie L, Zhong L, et al. Imperatorin: A review of its pharmacology, toxicity and pharmacokinetics[J]. Eur J Pharmacol, 2020, 879: 173124. doi:10.1016/j.ejphar.2020.173124 |
| [8] |
Guo Q, Li L, Zheng K, et al. Imperatorin and β-sitosterol have synergistic activities in alleviating collagen‐induced arthritis[J]. J Leukocyte Biol, 2020, 108(2): 509-17. doi:10.1002/JLB.3MA0320-440RR |
| [9] |
梁晓萍, 梁琼麟, 胡坪, 等. 高尿酸血症与痛风研究进展[J]. 中国药理学通报, 2008, 24(10): 1265-8. Liang X P, Liang Q L, Hu P, et al. Advances in the study of hyperuricemia and gout[J]. Chin Pharmacol Bull, 2008, 24(10): 1265-8. doi:10.3321/j.issn:1001-1978.2008.10.002 |
| [10] |
党荣敏, 李宁怡, 谢洪书, 等. 黑骨藤醇提取物调控急性痛风性关节炎模型大鼠血清炎性因子及滑膜功能[J]. 中国组织工程研究, 2021, 25(17): 2681-6. Dang R M, Li N Y, Xei H S, et al. Regulating serum inflammatory factors and synovial cell function of gout arthritis model rats by alcohol extract of gardneria angustifolia[J]. Chin J Tissue Eng Res, 2021, 25(17): 2681-6. doi:10.3969/j.issn.2095-4344.3193 |
| [11] |
Liu Y, Zhu H, Zhou W, et al. Anti-inflammatory and anti-gouty-arthritic effect of free Ginsenoside Rb1 and nano Ginsenoside Rb1 against MSU induced gouty arthritis in experimental animals[J]. Chem-Biol Interact, 2020, 332: 109285. doi:10.1016/j.cbi.2020.109285 |
| [12] |
党荣敏, 刘元忠, 谢洪书, 等. 黑骨藤抗急性痛风性关节炎的实验研究[J]. 中国免疫学杂志, 2016, 32(9): 1295-8. Dang R M, Liu Y Z, Xei H S, et al. Experimental study on treatment of acute gout arthritis with periploca forrestii schltr[J]. Chin J Immunol, 2016, 32(9): 1295-8. doi:10.3969/j.issn.1000-484X.2016.09.011 |
| [13] |
李利生, 史源泉, 龚其海. 淫羊藿苷抗尿酸钠诱导的大鼠急性痛风性关节炎作用[J]. 中国实验方剂学杂志, 2017, 23(11): 134-8. Li L S, Shi Y Q, Gong Q H. Icariin attenuates acute gout arthritis induced by sodium urate in rats[J]. Chin J Exp Tradit Med Formulae, 2017, 23(11): 134-8. |
| [14] |
赵用, 刘佳, 马宝东, 等. 苓泽合剂对急性痛风性关节炎大鼠血清IL-6、TNF-α含量的影响[J]. 湖南中医药大学学报, 2019, 39(1): 28-31. Zhao Y, Liu J, Ma B D, et al. Effect of lingze mixture on serum levels of IL-6 and TNF-α in rats with acute gout arthritis[J]. J Hunan Univ of ChinMed, 2019, 39(1): 28-31. doi:10.3969/j.issn.1674-070X.2019.01.007 |
| [15] |
王璐, 那莎, 陈光亮, 等. 萆薢总皂苷对大鼠急性痛风性关节炎NALP3炎性体信号通路的影响[J]. 中国药理学通报, 2017, 33(3): 63-9. Wang L, Na S, Chen G L, et al. Effect of total saponin of Dioscorea on NALP3 inflammasome signaling pathway with acute gouty in rats[J]. Chin Pharmacol Bull, 2017, 33(3): 63-9. |

